GCN5调控sublytic C5b⁃9诱导大鼠肾小球系膜细胞表达Cyclin D1及致SOX9的乙酰化修饰
2021-03-22郭苗苗刘龙飞谢梦晓吴志皎彭明玉王迎伟
郭苗苗,刘龙飞,谢梦晓,吴志皎,罗 灿,彭明玉,赵 聃,张 婧,邱 文,王迎伟
南京医科大学免疫学系,江苏 南京 211166
系膜增生性肾炎(mesangial proliferative glomer⁃ulonephritis,MsPGN)是人类常见的肾小球疾病,其病变特征是肾小球系膜细胞(glomerular mesangial cell,GMC)的异常增生和细胞外基质(extracellular matrix,ECM)的过量堆积,最终可致肾纤维化和硬化[1]。大鼠Thy⁃1N 是一种普遍用于MsPGN 研究的动物模型[2]。本课题组以往研究已表明,Thy⁃1N 发病具有亚溶解C5b⁃9(sublytic C5b⁃9)的依赖性。体外用sublytic C5b⁃9 刺激GMC 后可引起细胞增生和产生促炎因子等[3-4],但截至目前,有关sublytic C5b⁃9促进GMC增生的分子机制并不十分清楚。
本课题组前期研究发现,在Thy⁃1N大鼠发病早期的肾组织和受sublytic C5b⁃9 刺激的GMC 中,具有组蛋白乙酰基转移酶(histone acetyltransferase,HAT)活性的GCN5和转录因子SOX9以及Cyclin D1的表达均同期上调。已知GCN5既可乙酰化修饰组蛋白和非组蛋白(如转录因子),又能作为辅助激活因子促进靶基因的转录[5]。再者,SOX9也可促进肿瘤细胞的增殖[6-7],而Cyclin D1 的表达升高则能诱导细胞从G1期进入S期[8]。提示这3种基因的表达上调均是细胞增殖重要的调控因子。鉴于GCN5和SOX9分别是一种兼有HAT的转录辅激活因子和含锌指结构的转录因子,而Cyclin D1又是细胞周期家族的一个成员,故在sublytic C5b⁃9刺激的GMC中升高的GCN5 对Cyclin D1 基因表达有何影响,以及GCN5可否乙酰化修饰SOX9目前并不知晓,本研究对此进行了探讨。
1 材料和方法
1.1 材料
大鼠GMC细胞株(HBZY⁃1)购自武汉大学中国典型培养物保藏中心。pIRES2/GCN5(带Flag标签)和pcDNA3.1⁃SOX9(带HA 标签)过表达质粒、GCN5酶活性失活突变质粒(570 位谷氨酸突变为丙氨酸,简称ΔGCN5)均由本课题组刘龙飞博士构建并惠赠。此外,pGL3⁃Cyclin D1 启动子全长(+105~+130 nt)质粒由本课题组谢梦晓博士构建并惠赠。
多克隆兔抗Thy⁃1 Ab由本实验室制备保存[3-4]。补体来自健康志愿者新鲜血清(normal human se⁃rum,NHS)。人补体C6 缺陷血清(C6DS,Comple⁃ment Technology 公司,美国)。补体热灭活血清(heat inactive serum,HIS)是指56 ℃30 min 灭活的正常人血清。重组人C6(北京义翘神州生物技术有限公司)。单克隆GCN5 抗体(C26A10)、乙酰化抗体(Ac⁃K⁃103)(CST公司,美国)。单克隆SOX9抗体(sc⁃166505,Santa Cruz 公司,美国)。多克隆Cyclin D1抗体(Abcam公司,美国)。
1.2 方法
1.2.1 大鼠GMC的培养
将大鼠GMC 细胞株接种于含有MEM 完全培养液(10%胎牛血清)中培养48 h。当细胞融合度达到80%~90%时,行细胞传代并继续培养。
1.2.2 Sublytic C5b⁃9刺激GMC最佳剂量的确定
将GMC 种于MEM 完全培养液中,当融合达60%时,用不同浓度的Thy1Ab 致敏30 min,再用不同浓度的NHS(含补体)进行孵育。然后,采用乳酸脱氢酶(lactate dehydrogenase,LDH)法检查GMC 溶解的百分率。GMC 溶解率小于5%称为亚溶解(sublytic)剂量[3-4]。本研究最终确定以5%Thy1Ab与3%NHS作为形成sublytic C5b⁃9的最佳剂量。
1.2.3 GMC中GCN5、SOX9和Cyclin D1表达水平的测定
GMC 分组处理:将GMC 分为6 组(n=3),即①MEM 组:仅用MEM 培养;②Thy⁃1Ab 组:给Thy⁃1 Ab(50 μL/mL)致敏30 min,缓冲液洗涤后加MEM培养;③Thy⁃1 Ab+HIS 组:用同量Thy⁃1 Ab 致敏30 min,洗涤后加HIS(30 μL/mL)继续培养;④Thy⁃1 Ab+C6DS 组:同量Thy⁃1 Ab 致敏30 min,洗涤后加C6DS(30 μL/mL)继续培养;⑤Thy⁃1 Ab+C6DS+C6组:同上Thy⁃ Ab 致敏30 min,洗涤后加入C6DS(30 μL/mL)及C6 蛋白(2 mg/L)再培养;⑥Sublytic C5b⁃9 组:加同量Thy⁃1 Ab 致敏30 min,洗涤后加NHS(30 μL/ml,提供补体)继续培养。
Western blot 实验:上述分组GMC 在实验3 h 时提取蛋白,用Western blot 检测GCN5、SOX9 和Cy⁃clin D1的表达。将GMC裂解物离心10 min,取20 μg蛋白行SDS⁃PAGE 胶电泳,先45 V恒压浓缩再120 V电泳2 h,接着用0.3 A 恒流湿转120 min,将蛋白转印到PVDF 膜上。之后分别加入GCN5、SOX9、Cy⁃clin D1一抗,4 ℃过夜。漂洗后用HRP 标记的二抗孵育1 h,最后用ECL化学发光试剂检测[3-4]。
1.2.4 过表达或沉默GCN5对Cyclin D1基因启动子活性的影响
GMC 分组处理:将GMC 转染不同质粒进行分组(n=3):①pIRES2 组;②pIRES2⁃GCN5 组;③shC⁃TR 组;④shCTR+sublytic C5b⁃9 组;⑤shGCN5+sub⁃lytic C5b⁃9 组。①、②组用Lipofectamine 2000 将pIRES2 或pIRES2⁃GCN5 质粒单独或分别与含有Cyclin D1 启动子序列的荧光素酶报告基因质粒共转染GMC后48 h,而③、④、⑤组则同法将shCTR 或shGCN5质粒单独或分别与含有Cyclin D1启动子序列的荧光素酶报告基因质粒共转染GMC 48 h,再行sublytic C5b⁃9 刺激3 h(过表达和小干扰质粒的转染效率验证以检查GCN5的表达水平确定)。
荧光素酶报告实验:用1×被动裂解缓冲液(PLB)裂解处理后的GMC,行荧光素酶报告实验测定Cyclin D1 启动子活性。步骤:先在检测管中加入25 μL 荧光素酶检测试剂Ⅱ,放入荧光发光仪中,接着转移2.5 μL PLB 裂解的细胞液到检测管中,混合后检测萤火虫荧光素酶的活性,最后加入25 μL Stop&Glo®Reagent 检测海肾荧光素酶的活性。萤火虫荧光值/海肾荧光值的比值即为最终结果[3-4]。
1.2.5 过表达或沉默GCN5对Cyclin D1基因转录与表达的检查
Cyclin D1 mRNA水平的测定:质粒转染GMC的分组同1.2.4。用Primer Premier 5 软件设计大鼠Cy⁃clin D1和β⁃actin qPCR引物。引物序列如下:Cyclin D1上游5′⁃AGAGGGAGATTGTGCCATCC⁃3′,下游5′⁃ACAAGA⁃ACCGGTCCAGGTA G⁃3′;β⁃actin 上游5′⁃TCACCCACACTGTGCCCATCTATGA⁃3′,下游5′⁃CATCGGAA⁃CCGCTCATTGCCGATAG⁃3′。提取GMC总RNA,取500 ng 总RNA 作模板,行逆转录制备cDNA。Real⁃time PCR反应参数为:95 ℃,10 s预变性;95 ℃,5 s,60 ℃,31 s,共40 个循环。用β⁃actin作内参基因,计算公式为:2-ΔΔCT。Cyclin D1 蛋白表达的测定同1.2.3所述。
1.2.6 Sublytic C5⁃9 刺激的GMC 中SOX9 乙酰化水平的鉴定
GMC分组处理同前1.2.3。SOX9乙酰化水平用免疫共沉淀(Co⁃IP)和Western blot 实验检测。按说明书操作,每6孔板GMC加入200 μL IP 裂解液(含PMSF 和磷酸酶抑制剂),提取蛋白后行Western blot检测,一抗为乙酰化抗体(Ac⁃K⁃103),实验步骤见1.2.3描述。
1.2.7 过表达GCN5和酶活性突变质粒(ΔGCN5)或沉默GCN5基因影响SOX9乙酰化的检查
GMC 分组处理:过表达GCN5 和ΔGCN5 的分组是:①HA⁃SOX9+pIRES2组,②HA⁃SOX9+Flag⁃GCN5组,③HA⁃SOX9+ΔGCN5组。分别转染相应质粒于GMC中48 h。另沉默GCN5基因的分组是:①shCTR组;②shCTR+sublytic C5b⁃9组;③shGCN5+sublytic C5b⁃9 组。将shCTR 或shGCN5 质粒单独转染GMC后48 h,②和③组再行sublytic C5b⁃9 刺激3 h(所有分组n=3)。SOX9乙酰化水平的测定同1.2.6所述。
1.3 统计学方法
所有实验均独立重复3 次,所得定量数据以均数±标准误()表示,组间比较则采用单因素方差分析,两两比较采用SNK法。应用GraphPad⁃prism软件(版本5.01)进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 Thy⁃1N 大鼠肾组织中GCN5、SOX9 和Cyclin D1基因的表达
取Thy⁃1N大鼠发病3 h和正常兔血清(NRS)对照鼠3 h 的肾组织进行检查显示,Thy⁃1N 组的GCN5、SOX9 和Cyclin D1 表达明显升高(P<0.05,图1)。
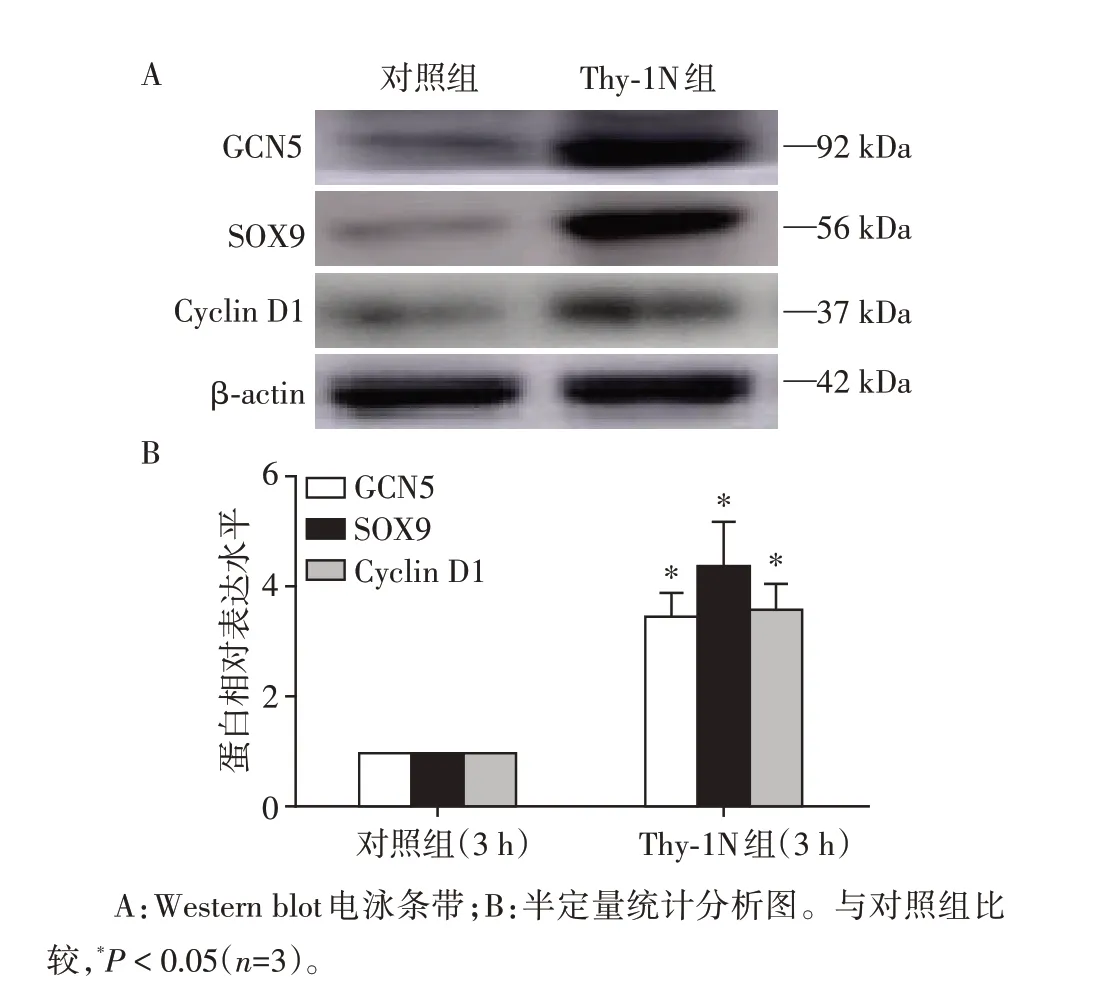
图1 Thy⁃1N大鼠肾组织中GCN5、SOX9和Cyclin D1蛋白的表达Figure 1 GCN5,SOX9 and Cyclin D1 expression in the renal tissues of Thy⁃1N rat
2.2 Sublytic C5b⁃9 刺激的GMC 中GCN5、SOX9 和Cyclin D1蛋白的表达
将GMC 分为MEM、Thy⁃1 Ab、Thy⁃1 Ab+HIS、Thy⁃1 Ab+C6DS、Thy⁃1 Ab+C6DS+C6和sublytic C5b⁃9 组。Western blot 检测发现,3 h 时,sublytic C5b⁃9组和Thy⁃1 Ab+C6DS+C6组的GCN5、SOX9和Cyclin D1表达明显增加(P<0.05或P<0.01,图2)。
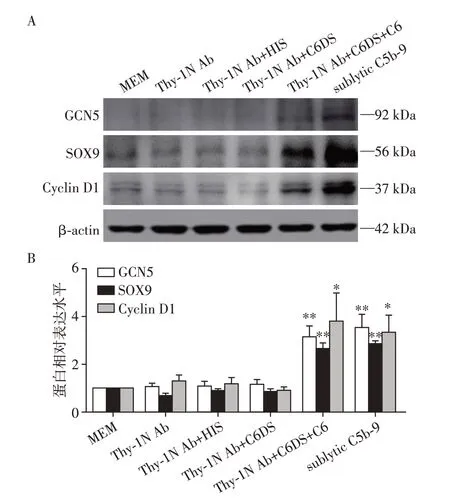
图2 不同处理3 h的GMC中GCN5、SOX9和Cyclin D1蛋白的表达Figure 2 GCN5,SOX9 and Cyclin D1 protein expression at 3 h in the GMC by different treatment
2.3 过表达或沉默GCN5对Cyclin D1基因启动、转录和表达的影响
将pGL3⁃Cyclin D1 启动子质粒分别与pIRES2/GCN5 或shGCN5 共转染GMC。在转染后48 h,pIRES2/GCN5 组不予刺激,而转染shGCN5 质粒的GMC 培养36 h,用无血清饥饿12 h,再给予sublytic C5b⁃9 刺激3 h。结果显示,过表达GCN5 基因明显上调Cyclin D1 的启动子活性,而沉默GCN5 基因后由sublytic C5b⁃9 上调的Cyclin D1 启动子活性显著下降(P<0.05或P<0.01,图3)。
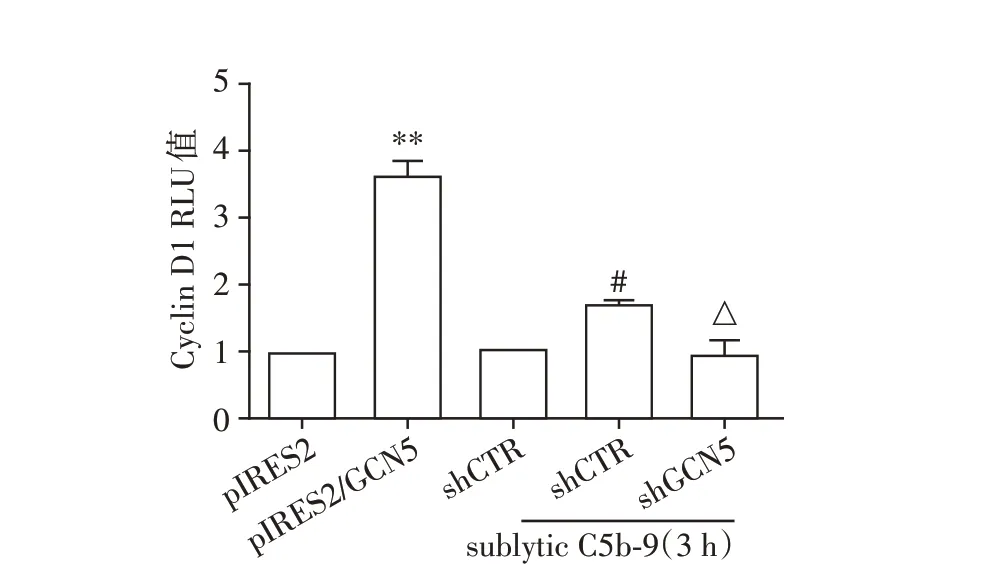
图3 过表达或沉默GCN5 对GMC 中Cyclin D1 基因启动子活性的影响Figure 3 Effects of GCN5 overexpression or knockdown on the activity of Cyclin D1 promoter in GMC
GMC 处理后提取总RNA 和蛋白,real⁃time PCR和Western blot 检测显示,过表达GCN5 可显著增加Cyclin D1 的mRNA 和蛋白水平,而沉默GCN5 基因则可抑制sublytic C5b⁃9 诱导的Cyclin D1 表达(P<0.05或P<0.01,图4)。
2.4 Sublytic C5b⁃9 刺激大鼠GMC 后SOX9 乙酰化的修饰
实验证实,sublytic C5b⁃9和Thy⁃1 Ab+C6DS+C6组,SOX9 的乙酰化水平显著增加,且SOX9 的蛋白表达也明显升高(图5)。
过表达GCN5基因对SOX9乙酰化修饰的影响:为了证明GCN5 可对SOX9 进行乙酰化修饰,将pIRES2、Flag⁃GCN5 过表达质粒及ΔGCN5 分别与HA⁃SOX9 过表达质粒共转染GMC 48 h,行Co⁃IP/Western blot 检测证实,过表达GCN5可增强SOX9的乙酰化,而过表达ΔGCN5则对SOX9乙酰化水平无明显影响(图6)。
沉默GCN5 基因对sublytic C5b⁃9 诱导SOX9 乙酰化修饰的影响:为了进一步明确GCN5 能乙酰化修饰SOX9,将shGCN5及对照质粒分别转染GMC再行sublytic C5b⁃9刺激3 h,用Co⁃IP/Western blot实验发现,沉默GCN5基因后确能明显降低sublytic C5b⁃9诱导SOX9的乙酰化修饰(图7)。
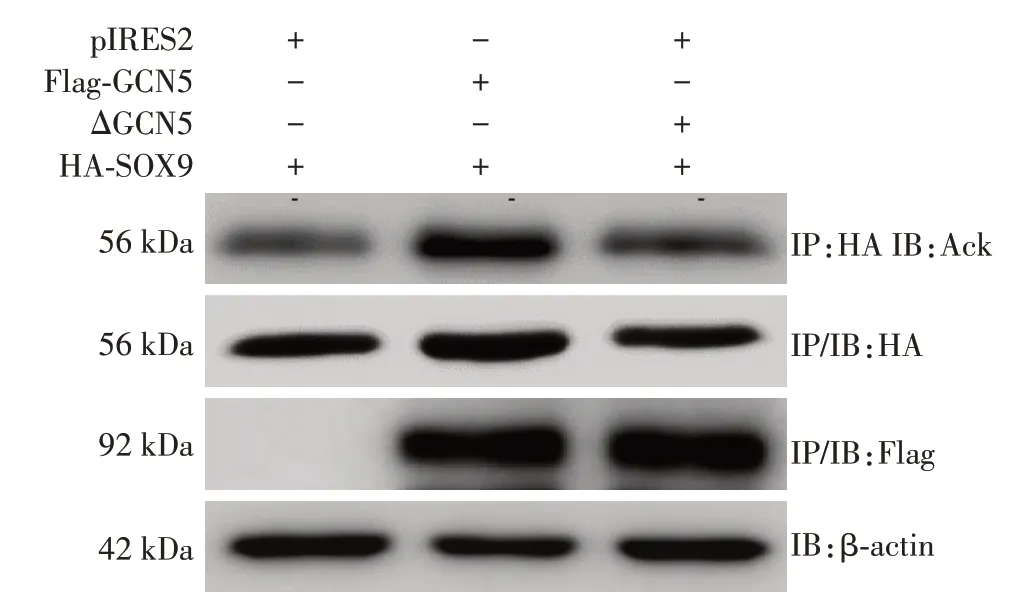
图6 过表达GCN5或ΔGCN5影响SOX9乙酰化修饰的作用Figure 6 Effects of GCN5 or ΔGCN5 overexpression on SOX9 acetylation
3 讨论
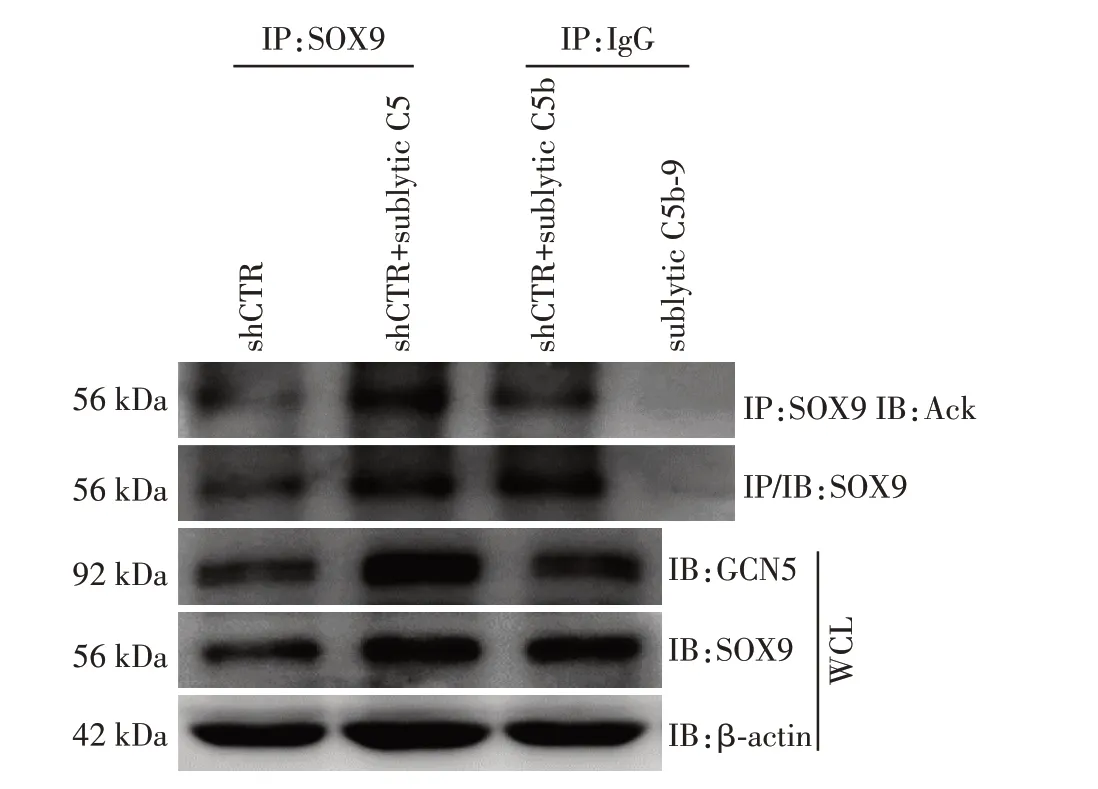
图7 沉默GCN5 基因后影响sublytic C5b⁃9 诱导SOX9 乙酰化的修饰Figure 7 Effects of GCN5 gene silencing on SOX9 acetyla⁃tion induced by sublytic C5b⁃9
人类MsPGN 发病率约占临床肾病综合征的30%,其组织病变的主要特征是,GMC 的过度增生和ECM 的大量积聚,最终可致肾小球纤维化,引起患者肾功能衰竭而死亡[1]。大鼠Thy⁃1N 是当今研究MsPGN 公认的动物模型[2]。以往实验已表明,Thy⁃1N的发病具有sublytic C5b⁃9的依赖性,即当其GMC膜表面形成sublytic C5b⁃9后,它可作为细胞的刺激原激活某些信号通路及上调多种转录因子和转录辅激活因子,进而促使相应基因的转录与表达,最终引起GMC的凋亡、炎症或增生反应[3-4,9]。
就Thy⁃1N大鼠GMC的增生而言,不仅需要sub⁃lytic C5b⁃9的插膜刺激,也需要转录因子、转录辅激活因子和促增生基因的共同参与[10-12]。本课题前期实验已确证,无论是Thy⁃1N 大鼠发病3 h 的肾组织(体内),还是在受sublytic C5b⁃9 刺激3 h 的GMC 中(体外),GCN5、SOX9 和Cyclin D1 的表达均明显上调。此外,本课题组还发现,Cyclin D1 表达的高峰时相稍晚于GCN5和SOX9,且GCN5与SOX9的表达峰值基本同步,加之SOX9 的上调能促进Cyclin D1基因转录,故这些结果提示,GCN5、SOX9 和Cyclin D1之间可能存在着密切的关系。
由于本课题组过去的实验已发现,SOX9 对Cyclin D1的表达有调控效应(待发表)。因此,本研究着重探讨了在GMC 中过表达或沉默GCN5 对Cyclin D1 基因激活的影响。结果发现,过表达GCN5 能提高Cyclin D1 的启动子活性、mRNA 和蛋白水平,而沉默GCN5基因则能降低由sublytic C5b⁃9 刺激导致的Cyclin D1 基因的启动与表达。提示,GCN5确能促进Cyclin D1基因的表达。
文献报道,GCN5 作为一个兼有HAT 活性的转录辅激活因子,其表达升高时既能乙酰化修饰组蛋白,又能乙酰化修饰非组蛋白(如转录因子),以增强其自身的活性,最终有利于靶基因的转录[5,13-15]。本研究为了观察受sublytic C5b⁃9刺激的GMC中SOX9能否与GCN5结合并被GCN5乙酰化修饰,在体外进行了Co⁃IP/Western blot 实验。结果发现,用sublytic C5b⁃9 刺激GMC 后,其SOX9 确可与GCN5 结合,且其乙酰化水平明显增加。另外,在GMC 中过表达GCN5 能明显提高SOX9 的乙酰化水平,而在GMC中转染酶活性缺失的ΔGCN5 质粒后,SOX9 的乙酰化水平则无明显变化。再者,沉默GCN5 基因也可下调sublytic C5b⁃9诱导的SOX9乙酰化的升高。提示,sublytic C5b⁃9刺激细胞后,GCN5确能乙酰化修饰SOX9,且其作用依赖于GCN5的HAT活性。
综上所述,本研究在确证了Thy⁃1N大鼠的肾组织和受sublytic C5b⁃9 刺激的GMC 中GCN5、SOX9、Cyclin D1蛋白表达均已增加的基础上,进一步探讨了GCN5 对Cyclin D1 表达的影响,以及GCN5 对SOX9的乙酰化修饰作用。研究揭示,GCN5既能促进Cyclin D1 基因的表达,又能乙酰化修饰SOX9。本研究结果为今后深入研究Thy⁃1N 的发病机制提供了有用的实验依据。
