Bacillus sphaericus DS11蛋白酶基因osp在Bacillus subtilis的异源表达及酶学性质研究
2020-06-05柴金龙胡晟源陈丽王淑军焦豫良杨杰刘姝房耀维
柴金龙,胡晟源,陈丽,王淑军,焦豫良,杨杰,刘姝,*,房耀维
(1.江苏海洋大学海洋生命与水产学院,江苏连云港222005;2.江苏省海洋资源开发研究院,江苏连云港222005;3.江苏海洋大学海洋资源与环境学院,江苏连云港222005)
蛋白酶是一类水解蛋白质肽键并将其分解为蛋白胨、多肽、游离氨基酸的一类酶的总称[2]。蛋白酶具有催化活性高、条件温和、专一性强、选择性高等优点,广泛应用于蛋白质加工、洗涤剂添加、制药、污水处理等多种工业领域[2-5]。更值得关注的是蛋白酶在有机溶剂介质中可以催化广泛应用于食品和医药的短肽的合成[6]。但是,有机溶剂对大多数天然蛋白酶具有毒性,极大地限制了其在有机合成领域的应用。通过生物催化工程[7-9]和溶剂工程[10-11]可提高酶类有机溶剂耐受性,但这些方法操作复杂且成本极高。获得天然耐受有机溶剂的蛋白酶可节约成本、提高效率[12]。另外,已报道的耐有机溶剂蛋白酶种类有限,难以满足工业催化需要。明确蛋白酶耐受有机溶剂的分子机制,通过理性设计提高蛋白酶有机溶剂耐受性提供了解决该问题的有效途径。
目前,蛋白酶有机溶剂耐受性的分子机制尚不完善。通过酶基因的异源表达利于酶的纯化,也为酶的理性设计奠定基础。Rahman等[13]从P.aeruginosa strainK中克隆得到一段由479个氨基酸耐有机溶剂碱性蛋白酶的序列。该酶在E.coli BL21(DE3)中进行表达。承龙飞等[14]从Bacillus cereus WQ-2中克隆获得了566个氨基酸的耐有机溶剂中性蛋白酶序列,并将其在枯草芽孢杆菌WB600中表达,重组菌的蛋白酶活力比野生菌提高了约4倍,达到17 400 U/mL。何小丹等[15]从B.licheniformis YP1A中克隆得到了一段1 264 bp的耐有机溶剂蛋白酶基因,用两种不同启动子的载体将其在枯草芽孢杆菌WB800中表达,最后得到的重组菌的发酵产酶水平达到395 U/mL。
本研究组前期筛选的菌株Bacillus sphaericus DS11分泌耐有机溶剂蛋白酶,将其在25%的正己醇、苯、二甲苯等有机溶剂中孵育14 d后仍然保持80%以上的蛋白酶活力[16-17]。扩增该蛋白酶基因序列,BLAST发现该序列同B.sphaericus 2297蛋白酶基因(GenBank登录号:AJ238598.1)的氨基酸序列与其相似度达到88%。本研究全构建了重组枯草芽孢杆菌B.subtilis WB800-pMA0911-sph,实现蛋白酶卵巢特异性启动子(ovarian-specific promoter,OSP)的胞外表达,并研究了重组酶进行酶学性质和其对有机溶剂的耐受特性,为以后进一步探索B.sphaericus DS11蛋白酶有机溶剂耐受性分子机制的研究奠定基础。
1 材料与方法
1.1 材料和试剂
E.coli DH5α感受态细胞、B.subtilis WB800感受态细胞:杭州宝赛生物科技有限公司;大肠杆菌-枯草芽孢杆菌穿梭质粒pMA0911-H3:江南大学;环己烷、正丁醇、二甲苯:阿拉丁试剂有限公司;DNA Marker、T4 DNA 连接酶、限制性内切酶 BamH I、ECOR I、质粒小抽试剂盒、Lysis Buffer for Microorganism to Direct PCR、镍离子金属亲和层析柱:宝生物工程有限公司(TaKaRa)。试验所用试剂均为分析纯试剂。
1.2 仪器与设备
Q5000微量核酸蛋白检测仪:美国Quawell公司;T100TMThermal Cycler PCR仪、Sub-Cell GT1704481凝胶电泳槽、Gel DocTMEZ凝胶成像仪:美国Bio-RAD公司;Thermo多功能酶标仪:南京宝诚生物技术有限公司。
1.3 试验方法
1.3.1 培养基
LB 培养基(L):蛋白胨10g,酵母粉5g,NaCl 10g。
LB奶粉固体培养基(L):蛋白胨10 g,酵母粉5 g,NaCl 10 g,奶粉 5 g,琼脂 20 g。
脱脂奶粉等培养基其余成分121℃,20 min灭菌后,直接加入未凝固的培养基中,摇匀后倒平板(注意不要产生气泡和块状沉淀)。
1.3.2 引物的设计与合成
设计扩增osp上下游引物,分别在上下游引物添加BamH I、ECOR I酶切位点,在下游引物添加His标签。
PpMa09-F1 CCGGAATCCATGGATAGCGAAGATAGCTTAGG 和 PpMa09-R1 CGCGGATCCTAATGATGATGATGATGATGTTGAACACGAGCGAAG,由南京思普金生物科技公司合成。
1.3.3 重组表达菌株的构建
将斜面4℃保藏的B.sphaericus DS11在LB固体平板三区划线,37℃倒置过夜培养。在1.5 mL EP管中加入 50 μL Lysis Buffer for Microorganism to Direct PCR,挑取单菌落加入EP管中,80℃水浴15 min,4 000 r/min离心后上清液作为模板,添加引物扩增蛋白酶基因osp。将osp和载体质粒pMA0911-H3分别用ECOR I、BamH I两种限制性内切酶进行双酶切,琼脂糖凝胶电泳回收目的基因sph片段和载体质粒,T4 DNA连接酶16℃过夜连接,转化到克隆载体E.coil DH5α感受态细胞,并涂布于Amp抗性(100 μg/mL)的 LB平板,37℃倒置过夜培养,挑取单菌落转接到含有Amp抗性(100 μg/mL)液体培养基中,37℃,180 r/min摇床培养后抽提质进行双酶切验证。利用质粒提取试剂盒提取阳性重组质粒pMA0911-sph,然后转化到感受态B.subtilis WB800,涂布于卡那抗性(50 μg/mL)的 LB奶粉平板上,37℃倒置过夜培养。挑取周围有明显透明圈的转化子单菌落进行菌落聚合酶链式反应(polymerase chain reaction,PCR)验证并进行基因测序。
1.3.4 osp的表达、纯化及电泳分析
将重组菌和含有空质粒pMA0911的WB800菌株分别挑取单菌落接入到含有50 μg/mL卡那霉素的LB液体培养基中,180 r/min、37℃振荡过夜培养。将菌液于4℃下,8 000 r/min离心30 min,得到的上清液即为粗酶液。利用镍柱根据说明书方法对粗酶液进行纯化,并进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测[18]。
1.3.5 蛋白酶活性测定
利用福林酚法测定蛋白酶活力[19]。在试管中加入的1 mL的酶液、1 mL 2%pH 8.0的酪蛋白底物(需要在40℃先预热),于40℃水浴锅中水浴反应10 min,加入2 mL 0.4 mol/L的三氯乙酸(trichloroacetic acid,TCA),充分振荡混匀,静置10 min(终止反应)后,用滤膜过滤,取1 mL滤液,加入5 mL 0.4 mol/L的碳酸钠溶液和1 mL的福林酚试剂摇匀后,置于40℃水浴锅中显色20 min,测定上清液的吸光度(A680)。酶活测定时需要设置一个对照组,对照组需要直接先在酶液中加入TCA,反应10 min后,再加入底物静止10 min后过滤后取1 mL滤液,后续操作同试验组。酶活单位(U/mL):在40℃条件下,每分钟水解酪蛋白底物产生1 μg酪氨酸所需的酶量定义为1个酶活单位。
1.3.6 重组OSP酶学性质研究
1.3.6.1 温度对重组OSP酶活性和稳定性的影响
用2%pH 8.0的酪蛋白溶液作为底物,与酶液混匀后,置于 20、30、40、50、60、70 ℃下水解反应 10 min,TCA终止反应,测定酶活力。将酶液分别在20、30、40、50、60 ℃下保温 2、4、6、7、10 h后,测定其剩余酶活力。
1.3.6.2 pH值对重组OSP酶活性和稳定性的影响
以2%的酪蛋白为底物,分别在pH 5.0~6.0的柠檬酸-柠檬酸钠缓冲液、pH 6.0~8.0的磷酸盐缓冲液、pH 8.0~9.0的Tris-HCl缓冲液、pH 9.0~10.0的甘氨酸-NaOH缓冲液中,在最适温度下水解反应10 min,测定酶活力。将酶液于pH 5.0~10.0的不同缓冲体系中孵育24 h后,测定其剩余酶活力。
1.3.6.3 金属离子对重组蛋白酶活力的影响
乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)终浓度为1 mmol/L,各种金属离子溶液与酶液混至终浓度分别为1 mmol/L和2.5 mmol/L,并且设置对照组不添加金属离子,在最适条件和pH值条件下反应10 min后测定剩余酶活力。
1.3.6.4 重组OSP的有机溶剂稳定性
将酶液与终浓度为25%正丁醇、环己烷、二甲苯、乙醇混匀,30 ℃、180 r/min 分别孵育 30 min、1、2、24 h、6 d,按最适反应条件测定剩余酶活力。
2 结果与分析
2.1 重组表达菌株的构建和验证
将蛋白酶基因sph连接到载体pMA0911-H3,得到重组质粒pMA0911-osp。将重组质粒pMA0911-osp转化E.coil DH5α感受态细胞,挑取阳性克隆,摇菌后用质粒小抽试剂盒抽提质粒并双酶切验证,重组质粒pMA0911-osp双酶切结果见图1。
将验证正确的重组质粒pMA0911-osp转化B.subtilis WB800感受态细胞中,转化后涂布于卡那抗性(50 μg/mL)LB奶粉平板。挑取有透明圈的单菌落PCR扩增验证,重组枯草芽孢杆菌B.subtilis WB800-pMA0911-osp菌落PCR鉴定结果见图2。进一步序列测定表明序列准确,表明重组枯草芽孢杆菌工程菌B.subtilis WB800-pMA0911-osp构建成功。
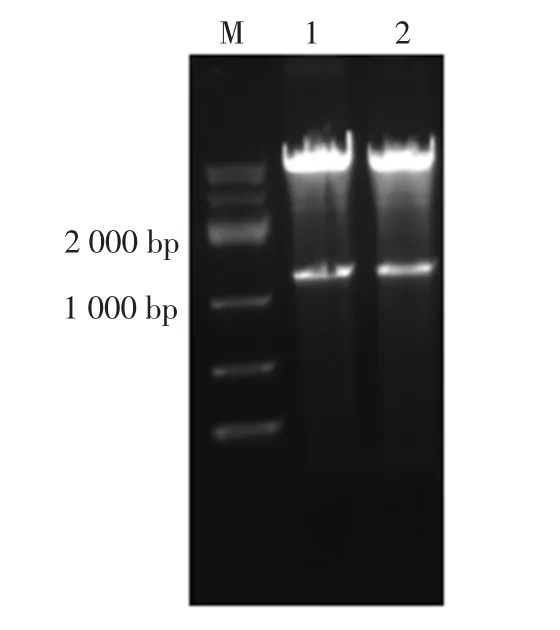
图1 重组质粒pMA0911-osp双酶切结果Fig.1 Recombinant plasmid pMA0911-osp Double digestion results

图2 重组枯草芽孢杆菌B.subtilis WB800-pMA0911-osp菌落PCR鉴定结果Fig.2 Results of PCR identification of recombinant B.subtilis WB800-pMA0911-osp colonies
2.2 SDS-PAGE分析
将B.subtilis WB800-pMA0911-osp发酵粗酶液用镍柱进行蛋白纯化,并进行SDS-PAGE电泳检测,重组菌B.subtilis WB800-pMA0911-His6-osp发酵上清SDS-PAGE电泳结果见图3。表达的蛋白酶大小约为33 kDa。
2.3 重组OSP酶学性质分析
2.3.1 重组蛋白酶的最适温度及热稳定性
温度对蛋白酶活力的影响见图4,温度对蛋白酶稳定性的影响见图5。

图3 重组菌B.subtilis WB800-pMA0911-His6-osp发酵上清SDS-PAGE电泳结果Fig.3 SDS-PAGE analysis of the recombinant B.subtilis WB800-pMA0911-sph fermentation supernatant
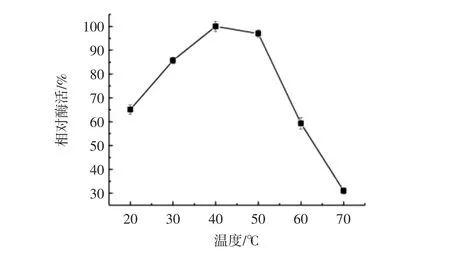
图4 温度对蛋白酶活力的影响Fig.4 Effects of temperature on protease activity

图5 温度对蛋白酶稳定性的影响Fig.5 Effects of temperature on protease stability
重组OSP的最适反应温度为40℃,在20℃~40℃范围内,蛋白酶OSP的活性随温度的升高而上升,40℃时,酶活力达到最高,当温度从40℃升高到70℃时,酶活力逐渐降低,70℃时,酶活下降约70%。蛋白酶OSP在低温条件下(20℃~30℃)有较好的稳定性,可以保持较高的酶活性。温度高于30℃后,酶稳定性迅速下降,当保温温度为60℃时,仅2h,酶活下降约70%。
2.3.2 重组蛋白酶的最适pH值及pH值稳定性
pH值对蛋白酶活力的影响见图6,pH值对蛋白酶稳定性的影响见图7。
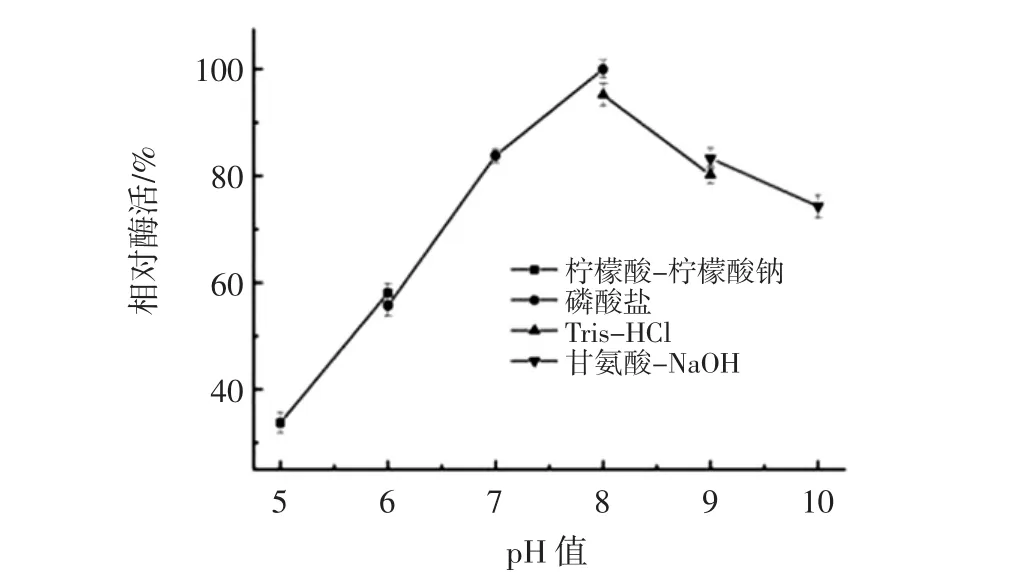
图6 pH值对蛋白酶活力的影响Fig.6 Effects of pH value on protease activity

图7 pH值对蛋白酶稳定性的影响Fig.7 Effects of pH value on protease stability
由图6可知,重组蛋白酶OSP的最适反应pH值为8.0。pH值为5.0~8.0时,蛋白酶OSP的酶活随着pH值的升高而增加,pH值为8.0时,酶活力达到最高;当pH值从8.0升到10.0时,酶活力逐渐下降;且由图6可知,酸性条件下,酶活下降较快,而pH值为10.0时,仍能保持75%左右的酶活,说明蛋白酶OSP为弱碱性蛋白酶。
由图7可知,当重组酶在其最适反应pH值的缓冲液中有较高的稳定性,用pH8.0的缓冲液处理酶液24h,仍能保持98%左右的酶活。用pH 5.0的缓冲液处理酶液24 h后,蛋白酶活性下降超过90%,而碱性条件对酶活影响相对较弱,用pH 10.0的缓冲液处理酶液24 h后,剩余蛋白酶活力约为30%左右。
2.3.3 金属离子对重组蛋白酶活力的影响
金属离子重组蛋白酶OSP的酶活力影响如图8所示。
Sr2+、K+、Mg2+对酶活有促进作用,其中 K+的促进作用最强,能使酶活提高约1.5倍;低浓度的Co2+对酶活有促经作用,而高浓度的Co2+则会抑制蛋白酶活性;Fe3+、Ba2+、Ca2+对酶活有抑制作用;Cd2+、Na+对蛋白酶酶活影响很小。Gupta等[20]报道Ca2+对Pseudomonasaeruginosa PseA所产的耐有机溶剂蛋白酶有抑制作用,试验结果与本研究结果一致;Sasithorn Uttatree等[21]筛选出一株耐有机溶剂蛋白酶的菌株Bacillus megaterium,试验结果显示Mg2+对酶活有促进作用,而本研究结果表明Mg2+对蛋白酶OSP酶活同样显示出促进作用。
2.3.4 重组OSP有机溶剂稳定性
用log POW值不同的4种有机溶剂处理蛋白酶OSP后,酶活力剩余情况如表1所示。

表1 有机溶剂对蛋白酶活力的影响Table 1 Effects of different organic solvents on protease activity
由表中可以看出蛋白酶OSP在不同极性常数的 有机溶剂中,耐受性差异很大。其在log POW值为0.8~3.1的3种有机溶剂中孵育6 d后,仍能保持53%以上的酶活性,但log POW值小于0.8后,酶活下降较快,其在log POW值为-0.24的乙醇溶液中孵育6 d后,酶活下降约70%。且有机溶剂孵育时间不同,对酶活性的影响也很大。当孵育时间为30 min时,4种有机溶剂孵育的蛋白酶剩余酶活力均显著性差异;当孵育时间为1 h~2 h时,用环己烷和正丁醇孵育的两组蛋白酶的剩余酶活力无显著性差异,但其结果与另外两组的结果存在显著性差异;当孵育时间为24 h~6 d时,4种有机溶剂孵育的蛋白酶剩余酶活力均有显著性差异。Divakar等[22]研究发现,菌株Aeromonas veronii PG01所产的耐有机溶剂蛋白酶用极性常数较小的乙醇中(log POW-0.24)孵育5 h后,剩余酶活力仅剩25.3%左右,而蛋白酶OSP用乙醇孵育6 d后,剩余酶活力仍能达到33%,说明蛋白酶OSP对亲水性有机溶剂有着更好的耐受性。
3 结论
将源于B.sphaericus DS11蛋白酶osp在B.subtilis WB800中胞外分泌表达,并对其酶学性质和有机溶剂耐受特性进行研究。重组酶的最适反应温度为40℃,最适反应pH值为8.0,且其在中低温(20℃~30℃)、弱碱性(pH 7.0~9.0)。蛋白酶OSP为耐有机溶剂蛋白酶,且其对log POW值在0.8~3.1范围的有机溶剂有较好的耐受性。
