麦麸阿拉伯木聚糖-牛血清白蛋白酶促共聚物制备及其乳化性能研究
2020-06-05吕丁阳殷丽君陈复生段晓杰
吕丁阳,殷丽君,陈复生,*,段晓杰
(1.河南工业大学粮油食品学院,河南郑州450001;2.中国农业大学食品科学与营养工程学院,北京100083)
乳化剂是一种通过降低两个不混溶相间界面张力进而促进乳状液形成的表面活性剂[1]。食品乳化剂是食品工业中用量较多的添加剂之一,按照来源可分为天然型和人工合成型[2],目前热点集中于利用天然乳化剂代替合成型乳化剂[3]。天然乳化剂多从植物中提取,如多糖类[4]、蛋白质类[5]。多糖类乳化剂通常缺少与其亲水基团相匹配的疏水性基团[6],蛋白质类乳化剂易受环境影响[7],为了改善多糖与蛋白质的乳化特性,研究人员利用物理化学方法使多糖与蛋白质交联从而制得多糖-蛋白质共聚物,聚合物能够集合两者的优良特性[8]。近些年多糖与蛋白质之间的酶促交联反应因反应条件温和、反应时间较短且结合产物无毒性逐渐成为研究热点[9]。
多糖与蛋白质的酶促交联反应通常通过过氧化物酶(horseradish peroxidase,HRP)、转谷氨酰胺酶、漆酶等实现。HRP与漆酶主要作用于多糖中的阿魏酸与蛋白质中的酪氨酸,使二者交联进而使多糖与蛋白质形成共聚物[10]。在H2O2、蛋白质存在条件下,HRP催化多糖氧化交联反应的机理为HRP将蛋白质中的酚氧化成邻醌,醌在多糖的分子内交联副反应中形成二聚体,或与多肽的氨基或巯基侧链反应形成共价C-N或C-S键,并再次形成酚羟基结构,后者可以再次被氧化并结合从而形成交联化合物。所以在HRP的催化下,多糖和蛋白质也会通过阿魏酸及酪氨酸的自身交联形成多糖-多糖及蛋白质-蛋白质酶促共聚物[11-12]。
我国是小麦生产大国,每年因小麦制粉产生约2 000万t麦麸,大部分麦麸均用作饲料,造成极大的资源浪费[13]。近些年来,国内外研究人员对麦麸中含有的膳食纤维、蛋白等进行深入研究,表明从麦麸中提取的阿拉伯木聚糖在食品乳化剂、化妆品等行业具有应用前景[14]。阿拉伯木聚糖由一系列β-D-吡喃木糖残基通过β-1,4-糖苷键连接成主链,α-L-阿拉伯呋喃糖在α-L-阿拉伯呋喃糖上不取代、C2(C3)位置单取代或C2和C3位置上双取代[15-16]。阿拉伯木聚糖还存在羟基氨基酸残基,主要是阿魏酸和一些对香豆酸,酯化在α-L-阿拉伯呋喃糖残基的C(O)-5上[17]。阿拉伯木聚糖分子量大,且富含羟基,通常通过改善乳状液的流变学特性进而改善乳状液稳定性,但是阿拉伯木聚糖通常缺少与亲水基团相对应的疏水性基团,应用在乳状液中时乳化活性较差[18]。
本文利用HRP催化麦麸阿拉伯木聚糖(wheat bran arabinoxylan,WBAX) 与牛血清白蛋白(bovine serum albumin,BSA)第五组分交联,通过紫外分光光度法采用单因素试验确定交联反应的最适HRP酶添加量、H2O2浓度、WBAX与BSA质量比,并利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)及高效尺寸排阻色谱(high performance size exclusion chromatography,HPSEC)对WBAX-BSA酶促共聚物进行定性分析,并研究了在3个因素下WBAX-BSA酶促共聚物乳化活性及乳化稳定性变化规律。
1 材料与方法
1.1 材料与仪器
WBAX(其中阿拉伯木聚糖含量为71%):河南工业大学粮油食品学院8351实验室自提;BSA第五组分、HRP(200 U/mg):北京索莱宝科技有限公司;H2O2(30%):天津科密欧化学试剂有限公司;叠氮化钠:天津化工试剂三厂;无水乙醇(色谱级):天津市津科精细化工;其他试剂均为分析级。
UV-1901紫外分光光度计:北京普析通用仪器有限公司;DYY-6D电泳设备:北京市六一仪器厂;BS210S分析天平:德国Sartorius公司;LGL-25C冷冻干燥机:北京四环科学仪器厂;GL-20C高速离心机:上海安亭科学仪器有限公司;FLUKO高速剪切均质机:上海弗鲁克流体机械制造有限公司;dRI-rEX-495示差检测器:美国Wyatt科技公司。
1.2 WBAX-BSA酶促共聚物制备
分别利用0.1 mol/L磷酸盐缓冲溶液(pH 6.5)配置浓度分别为 0.05、0.1、0.2、0.4、1.0%的 WBAX、0.4%BSA,100 U/mL HRP 溶液,浓度为 0.05、0.5、1.0、5.0、10.0 mol/L的H2O2。取适宜体积的上述HRP溶液、50 μL适宜浓度的H2O2、1mL BSA混合,然后将4 mL各浓度的WBAX分成体积相同的10份,每隔5 min以400 μL体积添加到上述混合溶液中,配置成不同WBAX 与 BSA质量比(1∶2、1∶1、2∶1、4∶1、10∶1、15 ∶1)的溶液。对照组为单独的WBAX、BSA溶液及不含有HRP的WBAX/BSA复合物及HRP催化的WBAX(1.0%)或BSA(0.4%),分别记作 WBAX、BSA、WBAX/BSA 复合物、WBAX(HRP)、BSA(HRP)。试验组及对照组放置于35℃恒温振荡水浴锅中反应4 h,然后利用20 μL 1.0%叠氮化钠终止反应。
1.3 紫外-可见光吸收光谱分析
当WBAX与BSA在HRP的作用下发生反应时,WBAX结构中含有的阿魏酸及BSA含有的酪氨酸含量会降低,据Oudgenoeg G等报道[19],阿魏酸及酪氨酸分别在325、280 nm处具有最大紫外吸收光值。可以通过监测各样品在325、280 nm处紫外吸收光度值的变化监测酶促反应进程。取1.2制备的样品利用0.1 mol/L pH 6.5的磷酸盐缓冲溶液稀释一倍,以磷酸盐缓冲溶液为标定液,测定各样品在325 nm(阿魏酸)及280 nm(酪氨酸)处的吸光度值[20]。
1.4 乳化性测定
取30 mL制备好的样品溶液于平底小烧杯中,加入10 mL大豆油,在10 000 r/min下均质1 min,分别于0、10 min从烧杯底部0.5 cm处取50 μL匀浆液稀释在5 mL 0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液中,混匀后在500 nm波长处测定吸光值分别记作A0和A10。用0.1%SDS溶液作为空白对照。根据公式(1)、(2)计算乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)[21]。
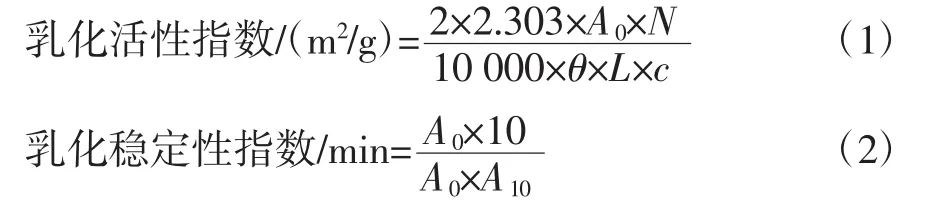
式中:N为稀释倍数,100;θ为油相体积比,0.25;L 为比色杯厚度,1 cm;C 为蛋白质浓度;A0、A10分别为0 min和10 min的吸光值;10为两次测定的时间间隔,min。
1.5 SDS-PAGE分析
分别将 10 μL 样品溶液 [WBAX、BSA、WBAX(HRP)、BSA(HRP)、WBAX/BSA 酶促共聚物、WBAX/BSA复合物]与10 μL样品缓冲液混合,样品缓冲液由 25%甘油、60 mmol/L Tris-HCl(pH 6.8)、2%SDS、14.4 mmol/L β-巯基乙醇、0.1%溴酚蓝和50 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)组成。样品缓冲液混合物煮沸3 min,取10 μL上样,电泳凝胶由5%浓缩胶和12%分离胶组成,在恒流条件下进行,其中浓缩胶电流为20 mA,分离胶电流为40 mA。凝胶电泳结束后进行振荡染色1 h,脱色处理1 h,蛋白质染色液配方为1.0 g考马斯亮蓝R250、45%甲醇、45%蒸馏水、10%甲酸;脱色液配方10%甲醇、80%蒸馏水、10%甲酸。
1.6 HPSEC分析
在25℃条件下,将待测样品溶液利用0.45 μm微滤膜过滤。采用1200 HPLC液相系统,配置体积排阻色谱柱TSK Gel 5000 PWXL,柱温35℃,检测器为示差检测器,流动相为0.2 mol/L NaCl溶液,流速0.5 mL/min。样品溶液上样量为20μL,等度洗脱,洗脱时间为40min,每个样品测定3次取平均值。
2 结果与讨论
2.1 各因素对WBAX-BSA酶促共聚物吸光度及乳化特性影响研究
2.1.1 酶添加量对性质的影响结果
当H2O2浓度为0.5 mol/L,WBAX与BSA质量比为10∶1时,测定反应体系中不同酶添加量(0、0.1、0.2、0.3、0.4、0.5 U/g) 对 WBAX-BSA 酶促共聚物 Abs及乳化特性影响。其中酶添加量是指每克底物中添加的酶活力,试验结果见图1及图2。
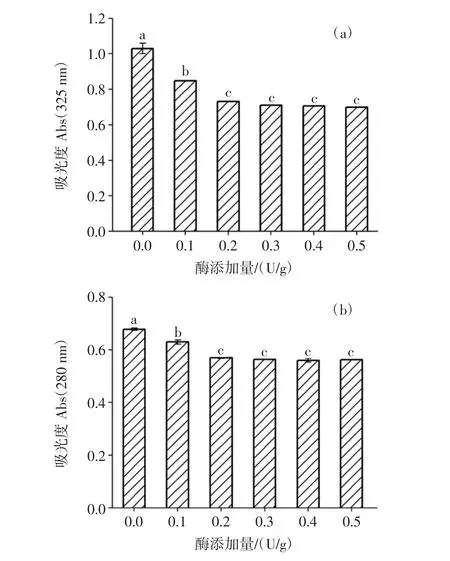
图1 酶添加量对WBAX-BSA酶促共聚物Abs变化影响Fig.1 Effect of enzyme addition on the Abs change of WBAX-BSA conjugates

图2 酶添加量对WBAX-BSA的ESI/EAI的影响Fig.2 Effect of enzyme addition on the ESI/EAI of WBAX-BSA conjugates
当WBAX中含有的阿魏酸或BSA中含有的酪氨酸在HRP的催化下发生反应时,反应体系中阿魏酸或酪氨酸的含量会降低,相对应的Abs325nm、Abs280nm会减小[22]。由图1可知,酶添加量为0.1 U/g~0.5 U/g均可以催化WBAX与BSA交联。与未添加HRP的WBAX/BSA复合物体系相比,HRP添加量为0.2 U/g时,Abs325nm、Abs280nm变化最显著,其中Abs325nm下降了28.6%,Abs280nm下降16.6%,随后提高HRP浓度,Abs325nm及Abs280nm没有显著降低,表明当酶添加量为0.2 U/g时足以促进WBAX与BSA发生反应。
从图2可以看出,随着酶添加量的增加,WBAXBSA的EAI及ESI呈现先增加后趋于平缓的趋势,当WBAX与BSA体系中加入0.2 U/g的HRP时,EAI由161.4 m2/g提升至211.4 m2/g,提升了30.9%;ESI由18.7 min提升至32.4 min,提升了73.2%。且随着酶添加量的增加,EAI及ESI趋于平稳。这是因为当WBAX与BSA通过HRP交联后运用到乳状液中时,WBAXBSA酶促共聚物能够迁移到油水界面处,WBAX能够增加乳状液黏度,BSA具有分子两亲性,能够吸附在油水界面,降低油水界面张力,从而提升乳状液EAI及ESI[23],随着酶添加量增加,EAI及ESI趋于平稳,这与WBAX、BSA的Abs325nm及 Abs280nm变化呈现一致性,说明反应体系中酶添加量为0.2 U/g时,WBAX与BSA交联度较好、乳化稳定性及乳化活性较高,且酶添加量的继续增加不会显著增加WBAX与BSA的交联度及乳化特性。
2.1.2 H2O2浓度对性质的影响结果
HRP需要在H2O2的作用下释放酶活力催化WBAX与BSA反应,且H2O2浓度会影响HRP的催化能力[24]。当体系中的H2O2浓度过低时,HRP活力释放力较低,酶促反应速率低。H2O2浓度对WBAX-BSA酶促共聚物Abs变化影响见图3,H2O2浓度对WBAX-BSA酶促共聚物的ESI/EAI影响见图4。
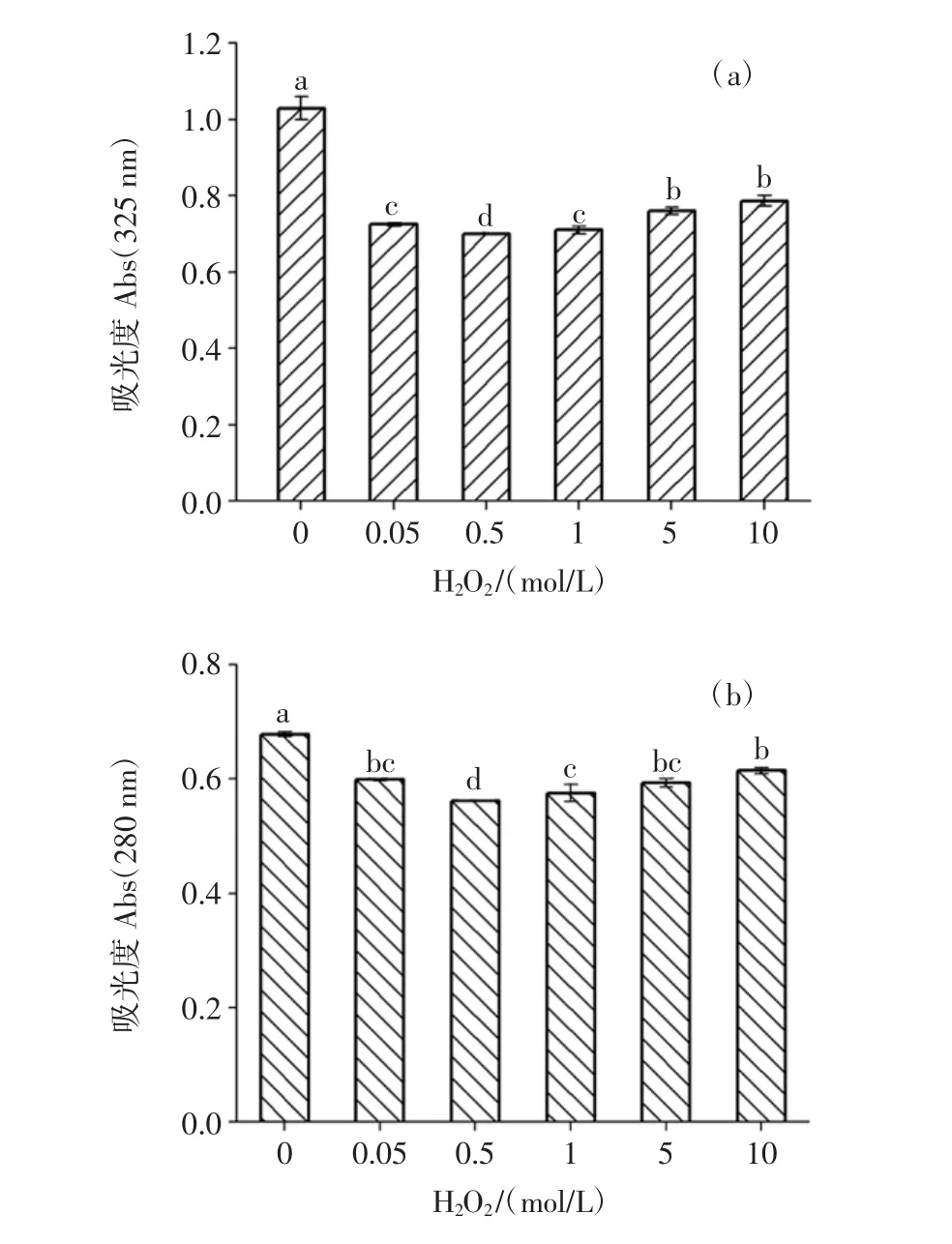
图3 H2O2浓度对WBAX-BSA酶促共聚物Abs变化影响Fig.3 Effect of H2O2 concentration on the Abs change of WBAXBSA conjugates

图4 H2O2浓度对WBAX-BSA酶促共聚物的ESI/EAI影响Fig.4 Effect of H2O2 concentration on the ESI/EAI of WBAX-BSA conjugates
当酶添加量0.2U/g,WBAX与BSA质量比为10∶1时,测定反应体系中不同 H2O2浓度(0、0.05、0.5、1、5、10 mol/L)对WBAX-BSA酶促共聚物Abs及乳化特性影响。由图3可知,随着体系中H2O2浓度增加,Abs325nm、Abs280nm呈现先增加后减小的趋势,当体系中的H2O2浓度为0.5 mol/L时,Abs325nm下降29.0%,Abs280nm下降16.7%,Abs325nm、Abs280nm较低,随后提高 H2O2浓度,Abs325nm、Abs280nm升高,说明与含有 0.5 mol/L H2O2的体系相比,过高的H2O2酶促体系中,阿魏酸与酪氨酸含量下降较少,WBAX与BSA交联度减小。这是因为过高的H2O2浓度会使HRP丧失酶活力,从而交联度降低[25]。
从图4可以看出,随着H2O2浓度增加,WBAXBSA酶促共聚物的EAI及ESI也呈现先增加后降低的趋势,当WBAX与BSA体系中加入HRP及H2O2时,EAI及ESI分别由 160.8 m2/g及18.4 min提升至211.8 m2/g及32.9 min,EAI及ESI分别提升了31.7%及78.8%,随着H2O2浓度增加,HRP酶活力逐渐丧失,WBAX与BSA交联度减小,当其应用在乳状液体系中时,迁移到油水界面处的WBAX-BSA酶促共聚物数量减少,当反应体系中的H2O2浓度达到10 mol/L时,EAI及ESI分别减小至160.0 m2/g及18.5 min,此时EAI及ESI与WBAX/BSA复合物体系EAI及ESI值相近,表明此时HRP酶活力在10 mol/L H2O2作用下接近完全失活,因此选定H2O2浓度0.5 mol/L作后续研究。
2.1.3 WBAX与BSA质量比对性质的影响结果
当H2O2浓度为0.5 mol/L,酶添加量0.2 U/g时,测定反应体系中不同WBAX与BSA质量比(1∶2、1∶1、2 ∶1、4 ∶1、10 ∶1、15 ∶1) 对 WBAX-BSA 酶促共聚物Abs及乳化特性影响。试验结果见图5及图6。
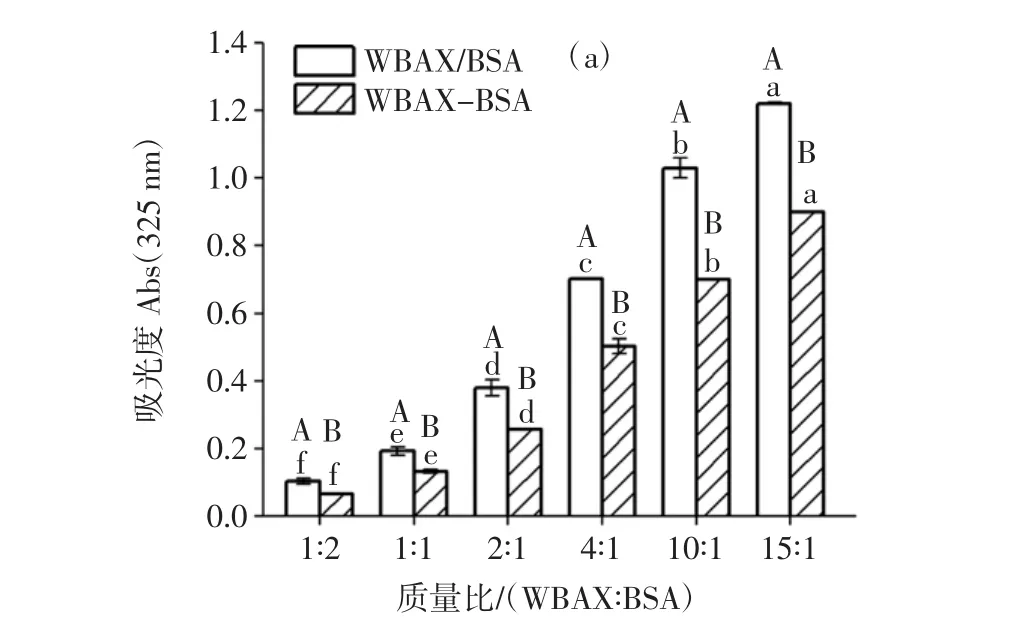
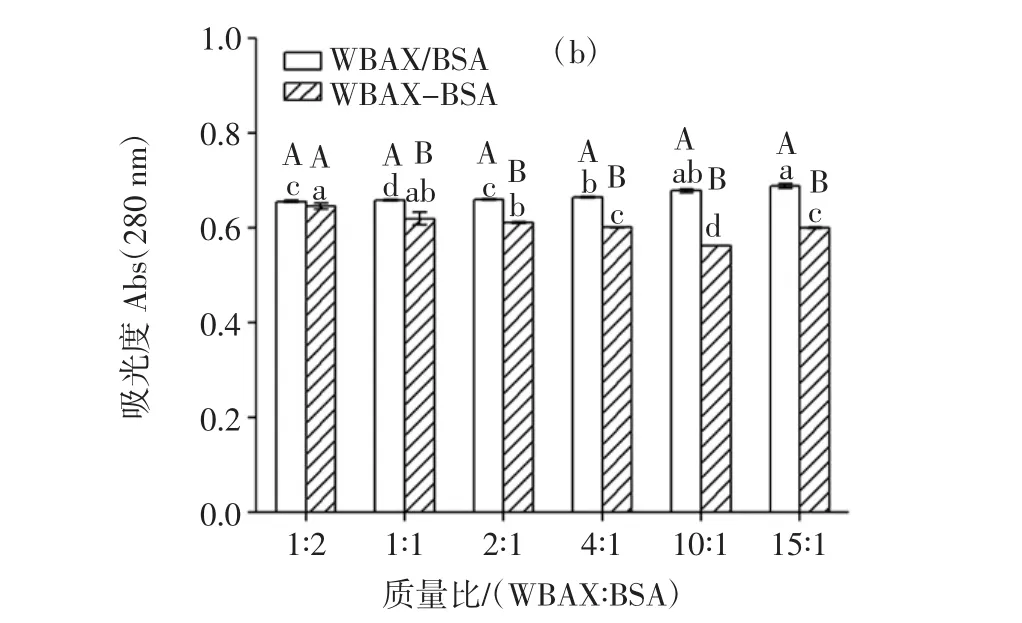
图5 WBAX与BSA质量比对WBAX-BSA酶促共聚物Abs变化影响Fig.5 Effect of the mass ratio between WBAX and BSA on the Abs change of WBAX-BSA conjugates
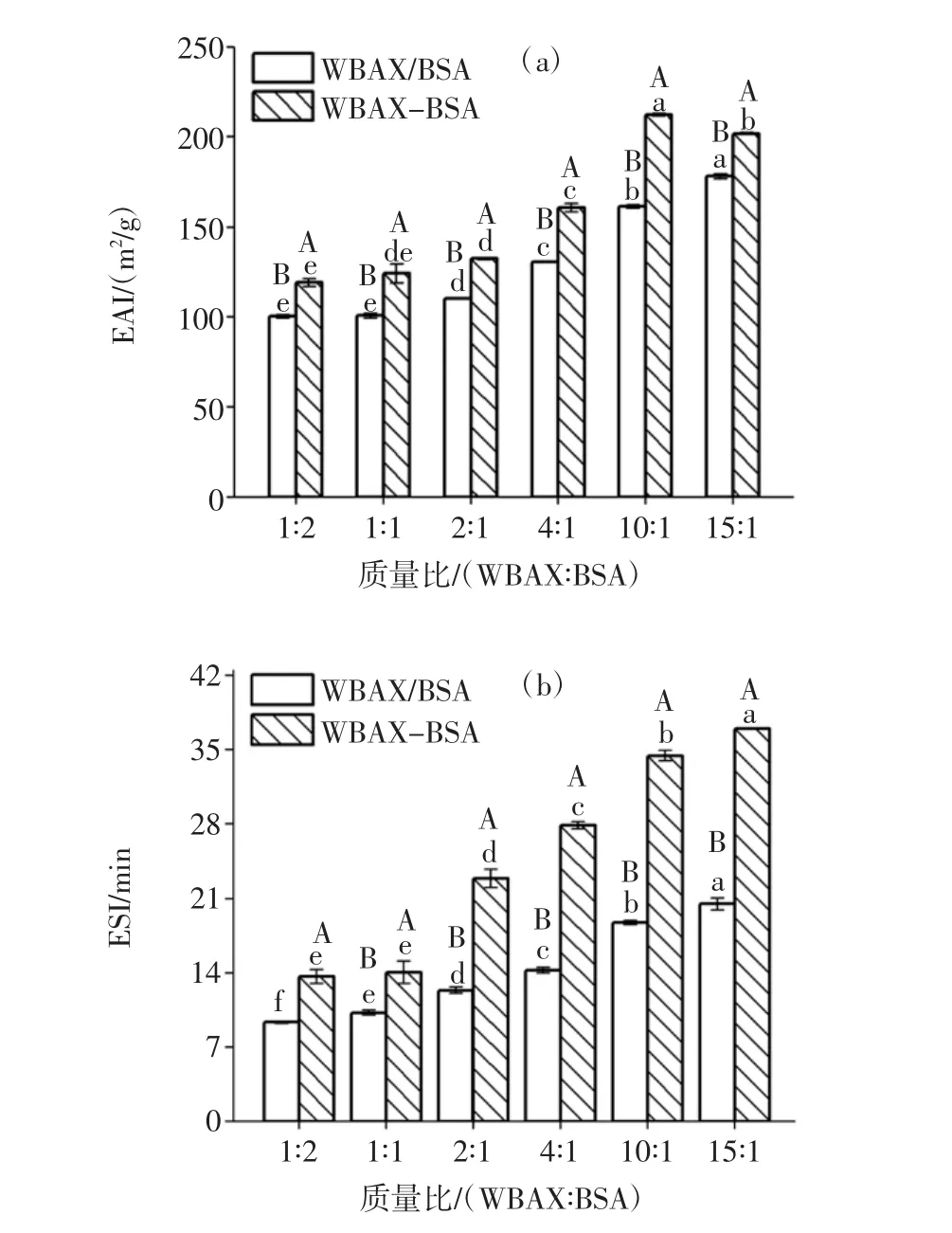
图6 WBAX与BSA质量比对WBAX-BSA酶促共聚物的EAI/ESI影响Fig.6 Effect of the mass ratio between WBAX and BSA on the EAI/ESI of WBAX-BSA conjugates
由图5可知,WBAX与BSA质量比影响其交联效果,所有WBAX-BSA酶促共聚物试验组Abs325nm、Abs280nm均高于WBAX/BSA复合物对照组,且不同的质量比组Abs325nm、Abs280nm下降幅度不一致,WBAX与BSA质量比 1∶2、1∶1、2∶1、4∶1、10∶1、15∶1 组 Abs325nm分别下降了20.5%、21.6%、22.3%、22.5%、28.9%、25.4%,而Abs280nm分别下降了1.3%、5.7%、7.4%、9.4%、17.2%、12.7%。试验过程中,控制体系中的BSA含量一定,通过改变WBAX浓度配置不同质量比的WBAX-BSA复合物,但是提取的WBAX中含有4.9%残余蛋白质,所以WBAX浓度高的样品蛋白质含量比WBAX浓度低的样品稍有升高,随着WBAX与BSA质量比的增加,Abs325nm、Abs280nm下降幅度先增加后减小,说明WBAX与BSA的交联度呈现先增加后降低的趋势,随着WBAX含量的增加,体系中阿魏酸含量增加,因此与酪氨酸交联的程度增加,但是随着WBAX含量的持续增加,溶液黏度升高,反应体系空间位阻增大,反应速率反而降低[26]。
从图6可以看出,随着WBAX与BSA质量比增加,WBAX-BSA的EAI呈现先增加后减小的趋势,但是WBAX-BSA酶促共聚物试验组的EAI都比WBAX-BSA复合物的EAI高,WBAX与BSA质量比1∶2、1∶1、2∶1、4∶1、10∶1、15∶1的 WBAX-BSA 酶促共聚物试验组EAI分别上升了18.7%、20.2%、22.8%、23.3%、31.6%、19.6%,其中WBAX与BSA质量比10∶1时,EAI值上升最明显,这是因为当WBAX∶BSA质量比为 10∶1时,WBAX与 BSA交联度最高,WBAX-BSA酶促共聚物形成较多,当其应用在乳状液体系中时,迁移到油水界面的酶促共聚物也较多,其中酶促共聚物的WBAX部分提供了大量的亲水羟基,BSA部分提供疏水性氨基酸。
不同质量比下的酶促共聚物ESI呈现逐渐增加的趋势,WBAX 与 BSA 质量比 1∶2、1∶1、2∶1、4 ∶1、10∶1、15∶1的WBAX-BSA酶促共聚物试验组ESI分别上升了 68.7%、69.6%、70.4%、71.1%、78.9%、78.8%。随着WBAX与BSA质量比的增加,酶促共聚物产量增多,迁移到油水界面处的目标产物增加,从而ESI增加,且体系中WBAX本身具有增稠力,可以增加乳状液的稳定性,所以WBAX与BSA质量比15∶1试验组ESI提升率与WBAX与BSA质量比10∶1组相近,因此综合这两项指标,选定WBAX与BSA质量比为10∶1作后续研究。
2.2 WBAX-BSA酶促共聚物形成表征
2.2.1 SDS-PAGE凝胶电泳分析
各样品SDS-PAGE图谱见图7。
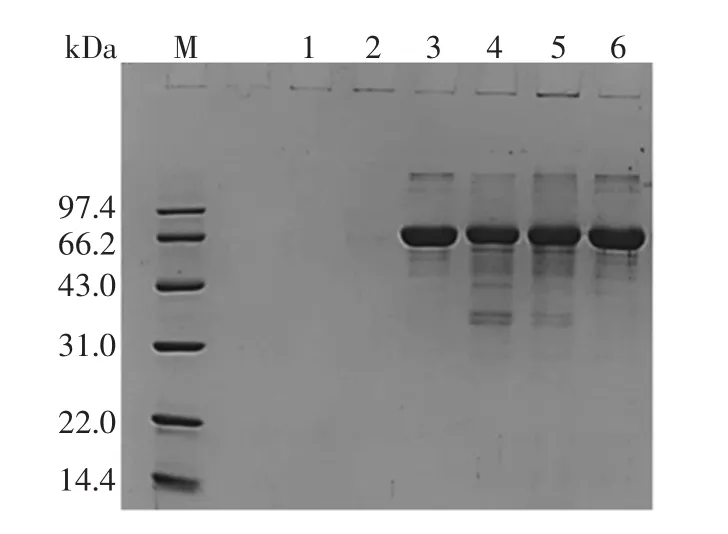
图7 各样品SDS-PAGE图谱Fig.7 SDS-PAGE of each sample
当多糖与蛋白质发生交联时,交联产物会在SDSPAGE的浓缩胶中显现染色条带或者在浓缩胶和分离胶的交界处展现拖尾条带[27]。由图7可知,泳道1的WBAX虽然含有杂蛋白,但是可能蛋白分子量过小或者含量过低不能通过SDS-PAGE检测到,当WBAX经HRP交联后(泳道2)也没有蛋白条带出现。据报道,天然BSA由3个染色条带组成,主要条带位于67 kDa处,在85 kDa~89 kDa和大于125 kDa处分别有两个小的染色条带[28]。BSA第五组分分子量约为68kDa(泳道3),在SDS-PAGE中呈现了3个条带,与上述报道相似。经过HRP作用后,在66.2 kDa左右的蛋白质条带上移且含量减少(泳道4),说明在HRP催化下,部分BSA能够发生分子内交联。当HRP作用于WBAX与BSA体系时(泳道5),浓缩胶出现染色条带,且进样孔呈现蓝色,而在WBAX/BSA复合物组(泳道6)中,浓缩胶中没有出现染色条带,且进样孔没有蓝色出现,说明在HRP的作用下,部分BSA与WBAX发生交联,形成分子量较大的酶促共聚物,被拦截在凝胶进样孔外侧未进入泳道。且根据 WBAX(HRP)、BSA(HRP)、WBAX/BSA复合物组的进样孔均无蓝色出现,说明拦截在凝胶外侧的大分子物质是由HRP作用的WBAX-BSA酶促共聚物。
2.2.2 HPSEC分析
WBAX、WBAX-BSA酶促共聚物及 WBAX/BSA复合物的HPSEC示差(RI)的结果如图8所示。
示差图可以反应各样品分子量分布,WBAX/BSA复合物相对于WBAX曲线相向左偏移,虽然反应体系pH值为6.5,此时混合体系中WBAX、BSA均带负电,理论上不能发生静电交联,但是BSA为心形球状结构,带负电的WBAX与其内部结构中裹带的正电荷可发生静电吸附作用,分子量变大造成分子量光谱向较大分子量方偏移。且WBAX-BSA酶促共聚物分子量光谱相比于WBAX/BSA复合物向左偏移,表明分子量比WBAX/BSA复合物分子量大,说明在HRP作用下,WBAX与BSA发生交联生成WBAX-BSA酶促共聚物。
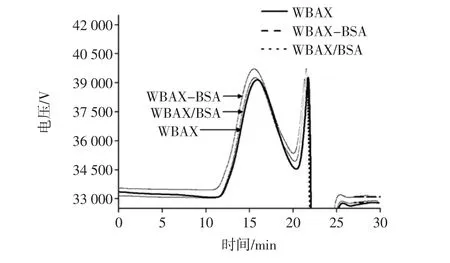
图8 各样品HPSEC图谱Fig.8 HPSEC of each sample
3 结论
本研究中WBAX与BSA通过HRP作用,在酶添加量为 0.2 U/g、H2O2浓度 0.5 mol/L、WBAX 与 BSA 质量比为10∶1时,Abs325nm、Abs280nm值最低,说明此时WBAX与BSA交联度最高,且其作用的乳状液EAI及ESI也较高,分别提升了31.6%、78.9%。并运用SDSPAGE及HPSEC技术分析表明WBAX在HRP作用下与BSA发生交联反应生成大分子的酶促共聚物,且WBAX与BSA的酶促共聚物能有效地改善其乳化特性。
