酸胁迫和冷胁迫对鼠李糖乳杆菌的交叉保护作用
2020-06-05印伯星车舒雅张臣臣顾瑞霞
印伯星,车舒雅,张臣臣,顾瑞霞,*
(1.扬州大学食品科学与工程学院,江苏扬州225009;2.扬州大学江苏省乳品生物技术与安全控制重点实验室,江苏扬州225009;3.江苏省乳业生物工程技术研究中心,江苏扬州225004)
乳酸菌能够提高乳制品的营养价值和功能特性,赋予其特殊的质地和风味,并延长其货架期[1]。此外,乳酸菌发酵乳制品具有多种益生功能,是目前最受欢迎的功能食品。截至2013年,乳酸菌食品占功能食品市场的比例达到60%~70%(1 060亿~1 240亿美元)[2]。强健的菌株活性,是乳酸菌发挥益生功能的重要基础。
在发酵乳生产和贮藏过程中,乳酸菌的代谢活动和菌体组分受到酸、氧化、热和渗透压等胁迫的影响,导致活性损失严重[3]。现有菌株活性维持手段主要分为胁迫隔离和菌株胁迫抗性增强两个方面,发酵乳生产和贮藏过程中的部分胁迫难以避免,因而增强菌株的胁迫抗性尤为重要[2]。
研究表明,单一胁迫能够诱导增强乳酸菌对同类胁迫,及其它胁迫的耐受能力,这种现象称为交叉适应[4-7]。根据这一规律,利用易于实现的弱胁迫预处理可以提高菌株对复杂胁迫的耐受能力,对于提高菌株的活性具有重要意义。
人源鼠李糖乳杆菌(Lactobacillus rhamnosus)作为重要的益生菌,是研究和应用最广的新型乳酸菌发酵剂之一。长期的研究和实际应用表明,鼠李糖乳杆菌及其发酵乳具有调整肠道菌群、保护肠道黏膜、缓解腹泻、调节免疫、预防龋齿和呼吸道感染,以及降低血脂等益生功能[8-9]。人源鼠李糖乳杆菌具有菌毛,是肠道定殖能力最强的乳杆菌,相对于德氏乳杆菌保加利亚亚种、干酪乳杆菌和嗜酸乳杆菌等传统乳制品发酵菌株更具优势[10]。大量国内外研究者和生产厂商将鼠李糖乳杆菌应用于乳制品发酵[11-12]。
以L.rhamnosus hsryfm 1301为研究菌株,利用低温预处理和酸预处理的手段,确定其对生产中常见的氧化、酸、渗透压和高温胁迫的交叉适应规律,为提高菌株在胁迫条件下的存活率提供依据。
1 试验材料、试剂与仪器设备
1.1 菌株
L.rhamnosus hsryfm 1301保藏于江苏省乳品生物技术与安全控制重点实验室,菌株放置于MRS培养基中37℃培养。
1.2 试剂
1)MRS培养基配方:葡萄糖20.0 g、蛋白胨10.0 g、醋酸钠·3H2O 5.0 g、柠檬酸三铵2.0 g、K2HPO4·7H2O 2g、MgSO4·7H2O 0.2 g、MnSO4·4H2O 0.05 g、吐温 1.0 mL、牛肉膏10.0 g、酵母膏5.0 g、蒸馏水1 L,121℃高温灭菌20 min。
2)1.0 mol/L HCl配制:用量筒量取43 mL 36%盐酸倒入烧杯,用适量蒸馏水溶解后,用玻璃棒引流注入500 mL容量瓶,用蒸馏水洗涤烧杯和玻璃棒2次~3次,洗涤液也需引流注入容量瓶中,然后向容量瓶中加蒸馏水至距离刻度线1 cm~2 cm,改用胶头滴管滴加,直至液面与刻度线相平,盖上塞子摇匀,装入试剂瓶,常用保险膜将瓶口封住再旋上瓶盖并贴上标签。
3)7.0%NaCl MRS液体培养基:用电子天平称取3.5 g NaCl固体溶解于50 mL液体培养基中,灭菌后使用。
4)5 mmol/L H2O2的稀释方法:用移液枪吸取57 μL 30%H2O2于 900 μL 液体 MRS 中,再从中吸取 100 μL混合液于另一支900 μL液体MRS中,重复两次。
5)pH=4、pH=3的酸性培养基:取两瓶50 mL液体MRS培养基,用pH计调节溶液为pH=4和pH=3,灭菌后使用。
1.3 仪器设备
BS210S型电子天平:北京赛多利斯天平有限公司;pHS-3C pH计:上海精密科学仪器有限公司;SPIN PLUS小型离心机:长沙湘仪离心机仪器有限公司;DK-S12型电热恒温水浴器:上海森信实验仪器有限公司;SX-500型高压蒸汽灭菌锅:南京市江宁电器仪器厂;DGX-9053B-2型生化培养箱:上海福玛实验有限公司;SW-CJ-1FD型单人单面净化工作台:苏州净化设备有限公司。
2 方法
2.1 菌株的纯化与活化
在实验室储藏的菌种按曲线划线接种于MRS固体培养基,置于37℃培养箱培养24 h,挑取单菌落接种分别于3支5 mL MRS液体培养基,置于37℃培养箱培养24 h后,4℃冷藏备用。将纯化过的L.rhamnosus hsryfm 1301按照2%的比例转接至新鲜的5 mL MRS液体培养基中,置于37℃培养箱中培养约15 h。
将纯化活化的L.rhamnosus hsryfm 1301按照2%的比例转接至新鲜的20 mL MRS液体培养基中,37℃静置培养,待OD值在0.5~0.6之间时进行分装,等待胁迫处理。
2.2 胁迫预处理
低温预处理:分装12支装有1.0 mL菌液的离心管,将6支放置于15℃培养箱中,处理1 h,其余6支放置于37℃培养箱中培养1 h,1 h后3支15℃与在37℃培养箱中培养1 h的3支1 mL菌液直接点板,记录菌落形成单位(colony-forming units,CFU)数,剩余的6支进行下一步交叉胁迫。
酸性预处理:将12支1 mL菌液经过经6 000 r/min离心3 min,其中6支换取新鲜的普通液体MRS培养基,另6支换取pH=4的液体培养基,12支均放置于37℃培养箱中,处理1 h,1 h后分别取3支与在37℃培养箱中培养1 h的3支1 mL菌液直接点板,记录CFU数,剩余的6支进行下一步交叉胁迫。
2.3 胁迫处理
氧化胁迫:在预处理之后,吸取准备好的2 mmol/L H2O2100 μL于6支1 mL菌液中,放置于37℃培养箱中培养1 h后,进行点板,记录CFU数。
酸性胁迫方法:在预处理后,将6支1 mL菌液经过经6 000 r/min离心3 min,换pH=3的液体MRS培养基1 mL,放置于37℃培养箱中胁迫3 h,3 h后点板,记录CFU数。
高温胁迫:在预处理之后,将6支1 mL菌液置于54℃水浴锅中胁迫1 h,1 h后点板,记录CFU数。
渗透压胁迫:在预处理后,将6支1 mL菌液经过经6 000 r/min离心3 min,换7%NaCl的液体MRS培养基1.0 mL,放置于37℃培养箱中胁迫4 h,4 h后点板,记录CFU数。
2.4 菌落计数
用移液器枪头吸取100 μL菌液于900 μL普通液体培养基中,稀释10倍,依次依次稀释102、103、104和105倍。用移液器吸取5 μL进行点板计数,点板完将平板用保鲜膜包裹好并倒置于37℃培养中培养24 h,选择菌落数在50~200之间(稀释梯度为T)的菌斑计数为 N。CFU/mL 计算方法为:CFU/mL=10T×200×N。
3 结果与分析
3.1 低温预处理
3.1.1 低温预处理对氧化胁迫的影响
乳酸菌是兼性厌氧菌,氧化胁迫是乳酸菌面临的最为严重的胁迫之一。低温预处理对L.rhamnosus hsryfm 1301在不同胁迫下的存活率影响见图1。

图1 低温预处理(15℃,1 h)对L.rhamnosus hsryfm 1301在不同胁迫下的存活率影响Fig.1 Survival rate of L.rhamnosus hsryfm 1301 under different stresses with cold pre-treatment(15 ℃,1 h)
结果表明,15℃低温预处理并未影响L.rhamnosus hsryfm 1301的活菌数量。5.0 mmol/L H2O2氧化胁迫严重影响L.rhamnosus hsryfm 1301的活性,处理1 h后,存活率降至万分之一以下。低温预处理对不同胁迫前后的活菌数影响见表1。
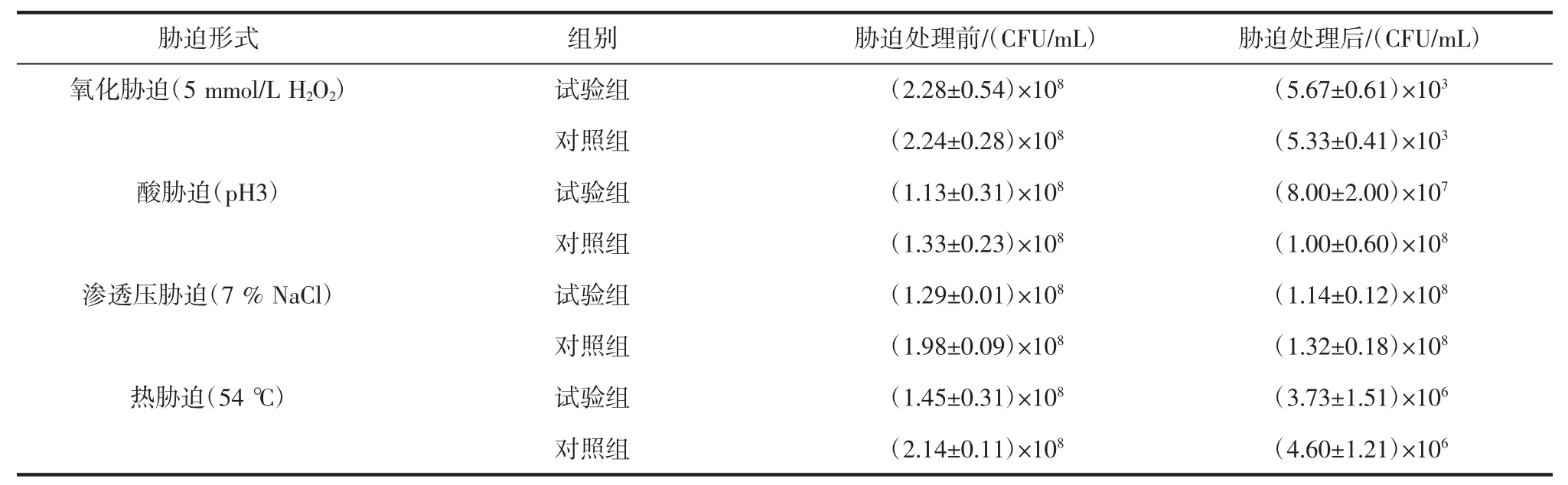
表1 低温预处理对不同胁迫前后的活菌数影响Table 1 Live count before and after cross-adaptations with cold pre-treatment
由表1可见,低温预处理后,L.rhamnosus hsryfm 1301的存活率未受到显著影响(p>0.5)。可知低温预处理并不能对5 mmol/L H2O2氧化胁迫起到保护作用。
3.1.2 低温预处理对酸性胁迫的影响
鼠李糖乳杆菌是兼性异性乳酸发酵菌,在利用六碳糖时以乳酸为主要产物,发酵终点pH值可达3.0;人体胃液也具有很低的pH值,因而酸胁迫也是鼠李糖乳杆菌要面临的重要胁迫。表1试验数据表明,经过低温预处理的L.rhamnosus hsryfm 1301比没有经过低温预处理的鼠李糖乳杆菌hsryfm 1301的存活率低(仅低约5%),所以低温预处理对酸性胁迫没有交叉保护作用。
3.1.3 低温预处理对渗透压胁迫的影响
发酵剂高密度发酵及腌制食品中存在渗透压胁迫。图1试验数据表明,经过低温预处理的L.rhamnosus hsryfm 1301比没有经过低温预处理的鼠李糖乳杆菌hsryfm 1301在7.0%NaCl渗透压胁迫下表现出更高的存活率(约高20%),说明15℃的低温预处理能够增强L.rhamnosus hsryfm 1301的渗透压胁迫耐受能力。
3.1.4 低温预处理对高温胁迫的影响
高温胁迫在发酵乳生产过程中并不常见。但是是发酵剂喷雾干燥中的主要胁迫。表1试验数据表明,低温预处理后的菌体与没有经过低温预处理的试验组在54℃高温胁迫下活菌数变化不大,低温预处理不能对高温胁迫产生保护作用。此结果与文献报道[13]存在差异,体现了乳酸菌胁迫耐受的菌种特异性。
3.2 酸性预处理
3.2.1 酸性预处理对氧化胁迫的影响
酸预处理对L.rhamnosus hsryfm 1301在不同胁迫下的存活率影响见图2。酸预处理对不同胁迫前后的活菌数影响见表2。

图2 酸预处理(pH=4,1 h)对L.rhamnosus hsryfm 1301在不同胁迫下的存活率影响Fig.2 Survival rate of L.rhamnosus hsryfm 1301 under different stresses with acid pre-treatment(pH=4,1 h)
由图2和表2可见,酸预处理后,L.rhamnosus hsryfm 1301的氧化胁迫存活率同样未受到显著影响;酸性预处理对L.rhamnosus hsryfm 1301氧化胁迫没有交叉保护作用。

表2 酸预处理对不同胁迫前后的活菌数影响Table 2 Live count before and after cross-adaptations with acid pre-treatment
3.2.2 酸性预处理对酸胁迫的影响
从表2和图2可以看出,经过pH=4的酸性预处理比没有经过pH=4预处理条件的L.rhamnosus hsryfm 1301在pH=3的酸性胁迫下表现出高约11%的活菌存活率,说明pH=4的预处理条件能够增加鼠李糖乳杆菌hsryfm 1301抗低酸性的能力。乳酸菌在较弱胁迫的影响下,会采取一定的适应机制,以获得对同种更强胁迫的耐受能力。L.rhamnosus hsryfm 1301对氧化胁迫也存在同样的表现[1]。
3.2.3 酸性预处理对渗透压的影响
图1试验数据表明,酸性预处理后的L.rhamnosus hsryfm 1301 在渗透压胁迫(7%NaCl,4 h)下表现出仅高约3%的活菌数,意味着酸性预处理对渗透压胁迫没有保护作用。
3.2.4 酸性预处理对高温胁迫的影响
表2试验数据表明,酸性预处理后的鼠李糖乳杆菌hsryfm 1301在54℃高温胁迫下仅表现出高0.07%的活菌数,意味着酸性预处理对54℃高温压胁迫没有保护作用。
4 结论
鼠李糖乳杆菌在生产和消费过程中会遭受氧化、酸、渗透压和热等复杂胁迫的影响,活性下降,从而影响生产和益生作用。交叉适应现象的存在为菌株活性维持提供了新的思路。冷胁迫和酸胁迫是生产过程中较容易实现,且对产品影响较小的预处理方式,有望应用于实际生产。酸预处理增强了L.rhamnosus hsryfm 1301对酸胁迫的抵御能力,但是并不能对L.rhamnosus hsryfm 1301的氧化胁迫、渗透压胁迫和高温胁迫产生交叉保护作用。低温预处理不能对氧化胁迫和高温胁迫起到明显的交叉保护作用,但是能够提高菌株对高渗透压的抵抗能力。本文探究了酸胁迫和低温胁迫对L.rhamnosus hsryfm 1301的交叉保护作用,低温预处理有利于提高其在高渗透压环境中的存活能力。
