紫外线对人皮肤成纤维细胞中Hrd1及Nrf2表达的影响
2020-05-21金轶陈斌丁帆成仙叶李谢伦陈芳苏东明
金轶 ,陈斌 ,丁帆 ,成仙叶 ,李谢伦 ,陈芳 ,苏东明
(1.南京医科大学第一附属医院,南京210029;2.南京医科大学,南京210029)
紫外线(Ultraviolet,UV)导致皮肤损伤的机制十分复杂,大量研究表明氧化应激是UV造成皮肤损伤的重要原因。UV可以干扰细胞信号转导过程,促进皮肤成纤维细胞产生过量活性氧簇(ROS),一旦ROS生成量超过机体抗氧化系统的清除能力时,即激活细胞氧化应激,导致细胞损伤[1]。核因子E2相关因子(Nrf)2已被证实是一种调节体内氧化平衡的关键因子,激活Nrf2介导的抗氧化损伤通路可以维持皮肤正常的屏障功能,从而保护皮肤细胞免受UV诱导的损伤[2]。当UV照射激活细胞氧化应激后,细胞内质网功能发生紊乱,错误折叠蛋白增多,称为内质网应激(ER stress),为了应对 ER stress,哺乳动物细胞内会激活一系列信号通路,称为未折叠蛋白反应(UPR),包括暂时停止早期蛋白质的合成和诱导内质网相关蛋白的降解(ERAD)等,羟甲基戊二酰辅酶A还原酶降解蛋白(Hrd)1是位于内质网膜上的一种E3泛素连接酶,又称为滑膜素(Synoviolin),其在识别、转运和泛素化折叠错误的蛋白的过程中起着重要作用。多种研究表明Hrd1与类风湿性关节炎[3]、阿尔茨海默病[3]、肝脏纤维化[5]、肾纤维化[6]、帕金森病[7]、癌症[8]等的发生有关。Wu等[5]的研究证实Hrd1是Nrf2的特异性E3泛素连1接酶,Hrd1的C端通过与Nrf2的Neh4-5区域相结合,对Nrf2进行泛素化,然后蛋白酶体识别并进一步降解Nrf2,加重细胞氧化损伤。
笔者前期研究发现,紫外线照射可明显促进皮肤成纤维细胞中Hrd1的表达,但Hrd1与Nrf2在人皮肤成纤维细胞中的表达是否存在关联,目前仍缺乏相关研究[9-10]。本实验通过收集临床标本及体外培养人皮肤成纤维细胞,进一步探讨UV照射与成纤维细胞中Hrd1、Nrf2表达水平的关系,以及Hrd1与Nrf2之间的关系。
1 材料与方法
1.1 主要试剂与仪器 Hrd1一抗(兔抗人多克隆抗体,美国Abcam公司)、Nrf2一抗(兔抗人单克隆抗体美国abcam公司)、β-actin一抗(CST公司)、羊抗兔二抗(美国Thermo公司)、荧光抗兔二抗(美国Thermo公司),荧光抗羊二抗(美国Thermo公司),PV-6000试剂盒(北京中杉金桥有限公司);Lipofetamine 2000(美国 Thermo公司);protein a/G agarose beads(美国Thermo公司);台式紫外线辐射仪(美国Sigma公司);LSM 700激光共聚焦扫描显微镜(Zeiss AG)。
1.2 方法
1.2.1 临床标本收集 临床皮肤标本来自2018年12月—2019年6月南京医科大学第一附属医院皮肤科患者浅表良性肿物病灶周围正常皮肤,共12例,均为女性。曝光部位皮肤取自面颈部,避光部位皮肤取自胸背部、大腿及臀部。根据部位将标本分为2组,每组6份,组1来自避光部位,平均年龄(40.30±10.19)岁,组2来自曝光部位,平均年龄(40.10±10.31)岁。本研究通过南京医科大学第一附属医院医学伦理委员会批准(2016-SRFA-033)。
1.2.2 免疫组化检测人皮肤中Hrd1和Nrf2表达 人皮肤组织用10%甲醛固定,石蜡包埋、切片、脱蜡,并进行抗原修复,然后滴加内源性过氧化物酶阻断剂,常温孵育,一抗4℃孵育过夜(Hrd1浓度为1∶150,Nrf2 浓度为 1∶200),滴加酶标羊抗兔 IgG 聚合物,37℃孵育;二氨基联苯胺染色液显色,然后复染、脱水、透明、封片。使用DP2-BSW采集图片,用Image J软件对图片进行半定量分析,计算平均光密度值(平均光密度值=IOD值/面积)。
1.2.3 细胞培养 取包皮环切手术患者的包皮标本,分离培养原代人成纤维细胞,方法参照文献[10]。人成纤维细胞培养于含10%胎牛血清、100 U/L青霉素和100 mg/L链霉素的DMEM培养基中,培养条件为37℃,5%CO2。选用4~8代处于对数生长期的细胞进行实验。
1.2.4 细胞照光 细胞分为对照组、长波紫外线(UVA)组、中波紫外线(UVB)组。UVA组和UVB组照光前用磷酸盐缓冲液(PBS)覆盖细胞上层,照射剂量为10 J/cm2UVA或30 mJ/cm2UVB。UVA组和UVB组(紫外线照射后)继续DMEM培养基培养24 h,收集细胞用于后续实验。
1.2.5 细胞蛋白提取及Western blot法检测细胞中Hrd1和Nrf2的表达 提取细胞蛋白:将体外培养的各组人皮肤成纤维细胞加入0.25%胰酶,于37℃孵育5 min,加入等量PBS后离心,弃上清,沉淀物加入裂解缓冲液(RIPA)中,静置20 min后离心(4℃,12 000 转/min,20 min),弃沉淀,取上清,根据蛋白浓度进行配平,然后加入5×SDS上样缓冲液,煮沸5 min后置于-20℃保存。
Western blot:将含有等量蛋白的样品上样后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,将蛋白转印到硝酸纤维素膜上,室温下,用5%脱脂奶粉封闭非特异性蛋白1 h。加入一抗(Hrd1浓度为1∶200,Nrf2浓度为1∶1 000),4℃冰箱中过夜,次日洗涤缓冲液(TBST)洗 3次,15 min/次,加入过氧化物酶标记的二抗室温下结合1.5 h,再用TBST洗3次。采用ECL化学发光试剂反应5 min,利用凝胶自动成像仪成像。采用Image J软件进行半定量分析,数据表达为Hrd1和Nrf2蛋白灰度值与内参蛋白灰度值的比值。
1.2.6 细胞siRNA转染 人靶向Hrd1基因的小干扰RNA(siRNA)由广州锐博生物技术有限公司的专业软件设计,si-Hrd1-1序列为5'-CCAUGAGGCAGUUCAAGAAdTdT-3',si-Hrd1-2 序列为5'-UGUCUGGCCUUCACCGUUU-3’。转染前取处于对数生长期且生长状态良好的细胞,用0.25%胰酶消化后,接种于6孔板中,培养24 h,待细胞生长至60%~70%汇合后,用LipofectamineTM2000转染,转染方法参照LipofectamineTM2000转染试剂说明书进行。转染后于培养箱内孵育5~6 h,更换新的培养基,继续培养48 h后收集细胞,用于后续实验研究。
1.2.7 免疫荧光 将细胞转移至激光共聚焦专用培养板内,在培养箱培养24 h后取出,PBS中洗3次,多聚甲醛固定30 min(室温),再用1%Triton-X 100在室温通透15~30 min后,加入二抗同源血清封闭 1 h,滴加一抗(Hrd1 浓度为 1∶50;Nrf2 浓度为1∶100)室温孵育 1 h,PBST 洗 3 次后,滴加荧光二抗避光孵育45 min,封片,使用LSM700共聚焦激光扫描显微镜(Zeiss AG)进行图像采集。
1.2.8 免疫共沉淀 细胞裂解物中分别加入Hrd1抗体、Nrf2抗体、对照IgG抗体,孵育1 h,随后加入ProteinA/G琼脂糖珠,4℃过夜,次日离心(4℃,14 000转/min,1 min),弃上清,用裂解缓冲液洗 3次后加入1×SDS上样缓冲液重新悬浮,95℃水浴5 min,后续进行 Western blot,检测 Hrd1和 Nrf2的表达。
1.3 统计学方法 采用SPSS 13.0软件,计量资料以±s表示,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Hrd1和Nrf2在人体皮肤中的表达 首先,笔者应用免疫组化法检测Hrd1及Nrf2在不同部位人皮肤组织中的表达,结果如图1所示,不同部位人皮肤标本中,均可发现成纤维细胞Hrd1及Nrf2的表达,曝光部位皮肤组织中Hrd1表达(0.4756±0.0785)明显高于避光部位(0.1270±0.0253,t=7.317,P<0.05),曝光部位皮肤组织中Nrf2表达(0.119 0±0.021 7)明显低于避光部位(0.262 9±0.026 3,t=7.306,P<0.05),提示紫外线照射可以增加皮肤组织中Hrd1的表达,并且抑制Nrf2的表达。
2.2 UV照射对体外培养人皮肤成纤维细胞中Hrd1和Nrf2表达的影响 笔者进一步在体外培养人皮肤成纤维细胞中验证了上述结果,将体外培养人皮肤成纤维细胞分为3组,分别为对照组、UVA组、UVB组,Western blot结果如图2显示:对照组、UVA组、UVB组的Hrd1蛋白水平分别是0.505 9±0.108 3、1.186 0±0.121 8、0.886 3±0.192 7,差异有统计学意(F=16.42,P<0.05);对照组、UVA 组、UVB组的Nrf2蛋白水平分别是1.174 0±0.064 7、0.401 8±0.196 9、0.395 3±0.076 1,差异有统计学意义(F=37.05,P<0.05)。UVA 组与对照组相比,Hrd1蛋白表达水平明显增高(t=7.227,P<0.05),Nrf2 蛋白表达水平明显下降(t=6.456,P<0.05);UVB 组与对照组相比,Hrd1蛋白表达水平明显增高(t=2.980,P<0.05),Nrf2蛋白表达水平明显下降(t=13.52,P<0.05)。
2.3 在体外培养人皮肤成纤维细胞中下调Hrd1的表达对Nrf2的影响 为了检测Hrd1和Nrf2在细胞内表达水平的关系,应用Hrd1-SiRNA转染体外培养人纤维细胞后,用Western blot检测细胞内Hrd1蛋白表达,结果显示,与对照组相比,Si-Hrd1-1组与Si-Hrd1-2组的Hrd1蛋白表达均明显下降(均P<0.05)见图3A,表示Hrd1-SiRNA转染有效。
无论是经UVA照射还是UVB照射,照射后UV组细胞内Nrf2的表达较对照组下降(UVA照射和 UVB 照射的 t值分别为 13.37、13.67,均 P<0.05),UV+Si-control组细胞内Nrf2的表达较对照组下降(t分别为 12.38、9.403,均 P<0.05),UV+Si-Hrd1-1组细胞内Nrf2的表达较UV组明显升高(t分别为9.263、17.76,均 P<0.05),UV+Si-Hrd1-2 组细胞内Nrf2的表达较UV组明显升高(t分别为25.77、25.84,均 P<0.05)见图 3B。
2.4 免疫荧光分析 绿色荧光染色的是Hrd1蛋白分子,红色荧光染色的是Nrf2蛋白分子,二者结合后有橙色荧光出现,表明Hrd1与Nrf2二者在细胞内存在共定位。
2.5 免疫共沉淀 Input为等量的总蛋白;IP-IgG为阴性对照免疫共沉淀;A.IP-Nrf2为Nrf2抗体免疫共沉淀所得蛋白,B.IP-Hrd1为Hrd1抗体免疫共沉淀所得蛋白。
笔者进一步应用免疫共沉淀明确Hrd1与Nrf2在体外培养人皮肤成纤维细胞中是否存在内源性结合,结果表明,无论用Nrf2一抗还是Hrd1一抗与体外培养人皮肤成纤维细胞总蛋白进行免疫共沉淀,均可证明Hrd1与Nrf2在细胞内存在内源性结合。
3 讨论
长期UV照射导致皮肤损伤机制十分复杂,大量研究表明氧化应激是UV造成皮肤损伤的重要原因[11]。Nrf2是一种调节体内氧化还原平衡的关键转录因子,以转录调控的方式对抗皮肤细胞的氧化应激[12],正常情况下,Nrf2由细胞质中的细胞骨架相关蛋白Keap1调控,Nrf2和细胞骨架相关蛋白Keap1以N端的Neh2区域结合成二聚体的形式存在于细胞浆中,从而使保护细胞的酶类和抗氧化物处于基础表达水平,维持细胞稳定状态[13],当细胞受到氧化应激刺激后,Nrf2可与Keap1分离并被转运到细胞核内,与抗氧化反应原件(Antioxidant response elemen,ARE)结合,启动Nrf2下游一系列抗氧化酶的合成和表达[14]。Nrf2/ARE信号通路的激活可以保护细胞和组织免受氧化应激的损伤,在UV致皮肤氧化应激的过程中起保护作用[2]。

图1 免疫组化法检测人皮肤组织中Hrd1的表达
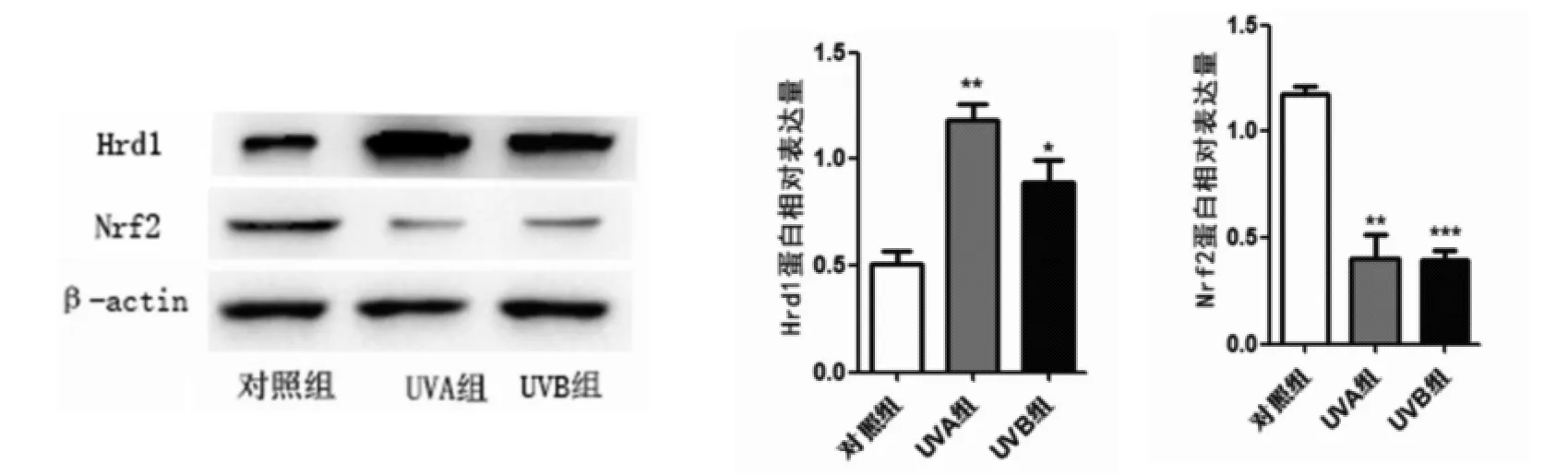
图2 Western印迹法检测紫外线照射对人成纤维细胞中Hrd1和Nrf2表达的影响

图3 Western blot法检测人成纤维细胞中下调Hrd1表达对Nrf2表达的影响

图4 免疫荧光分析法检测人成纤维细胞中Hrd1和Nrf2的共定位情况

图5 免疫共沉淀法检测Hrd1与Nrf2在人成纤维细胞中是否存在内源性结合
激活Nrf2介导的抗氧化损伤通路已被证明可以维持皮肤正常的屏障功能,从而保护皮肤细胞免受UV诱导的损伤。有研究显示,在同样UV照射的情况下,Nrf2基因敲除的小鼠与未敲除小鼠相比,前者明显出现了更强烈的日晒伤和细胞氧化损伤[15]。Nrf2激活剂在防止皮肤光老化中应用广泛,Nrf2激活剂通过激活Nrf2依赖的基因表达,在应激条件下对皮肤起到保护作用。Patwardhan等[16]研究秋葵提取物对光老化的防护作用及作用机制时发现,秋葵提取物可通过激活Nrf2通路增加其下游蛋白的表达,使其发挥下调活性氧簇水平和保持细胞内抗氧化物水平的作用,从而减少UVB照射引起的皮肤成纤维细胞氧化应激。
Hrd1作为内质网相关蛋白降解途经(ERAD)相关E3酶中的一种,在识别、转运和泛素化折叠错误的蛋白的过程中起着重要的作用。在正常生理情况下,Hrd1介导的ERAD可以降解发生错误折叠的蛋白,实现蛋白质量控制的目的。在细胞内质网应激条件下,未折叠蛋白反应(UPR)的感受器IRE1介导的通路可以通过上调Hrd1的表达来清除错误折叠蛋白,从而促进细胞存活[17]。在笔者的前期研究中,笔者已发现UV照射不论在体外还是体内都可以显著提高皮肤成纤维细胞中Hrd1的表达。
为进一步探究Hrd1与Nrf2之间的关系,本次实验中,笔者收集12例临床标本,发现曝光部位Hrd1的表达水平明显高于避光部位,且曝光部位人皮肤的Nrf2的表达水平明显低于避光部位,说明长期进行UV照射会引起皮肤中Hrd1的表达升高以及Nrf2的表达下降。同时,笔者在体外培养人成纤维细胞中进一步验证了上述结果,无论是UVA还是UVB照射后,与对照组相比,成纤维细胞中Hrd1的表达水平增高,Nrf2的表达水平下降,二者表达呈负相关。
有研究显示Hrd1是Nrf2的特异性E3泛素连接酶[5,18-19],Hrd1以Nrf2的Neh4-5结构域为靶点,在氧化应激条件下,Hrd1将Nrf2泛素化和降解,加重细胞的氧化损伤。本次实研究中,笔者利用Hrd1-SiRNA下调成纤维细胞中Hrd1的表达后,可观察到UV照射引起的Nrf2表达下降可以被逆转,Nrf2表达水平回升。笔者进一步应用免疫荧光分析和免疫共沉淀实验来明确Hrd1与Nrf2在细胞内定位和结合情况,免疫荧光分析结果显示Hrd1和Nrf2在成纤维细胞中均有表达,Hrd1与Nrf2共定位呈现橙色荧光,表明Hrd1与Nrf2在细胞内存在共定位和结合,免疫共沉淀结果同样也提示Hrd1与Nrf2存在内源性结合,这一结果与Wu等[5]的结果一致,表明Nrf2是Hrd1的特异性结合底物。
综上,本研究证实了UV照射不论在体内还是体外都可以显著提高人皮肤成纤维细胞中Hrd1表达,并抑制Nrf2在人皮肤成纤维细胞中的表达,二者表达呈负相关,且Hrd1与Nrf2存在共定位和内源性结合,抑制Hrd1的表达可逆转UV照射引起的Nrf2表达下降,提示UV照射可通过增加皮肤细胞中Hrd1的表达从而抑制Nrf2的表达,其机制可能与增高的Hrd1加大了对其特异性底物Nrf2的泛素化降解有关,对此笔者还需要进一步的深入研究。
