泛素链的体外制备、磷酸化修饰与标记方法
2022-08-20覃凌云聂泽锋
覃凌云 聂泽锋 唐 淳
(1)中国科学院精密测量科学与技术创新研究院,武汉 430071;2)北京大学化学与分子工程学院,北京 100871;3)中国科学院大学,北京 100049)
泛素(ubiquitin,Ub)是细胞中一类重要的信号蛋白。泛素的“泛”指的是它在细胞中普遍存在,并广泛参与调节细胞的生理功能。泛素蛋白行使功能主要过程包括:a.写入(writing),在泛素连接酶E1、泛素结合酶E2、泛素连接酶E3的顺序作用下,对蛋白质等底物(substrate)进行泛素化修饰;b.读取(reading),泛素本身与不同的靶蛋白相互结合,募集上下游的蛋白质,启动相应的信号通路;c.擦除(erasing),被去泛素化酶(deubiquintase,DUB)去泛素化,终止其作用[1-4]。目前已知能够与泛素蛋白结合的靶蛋白(target protein)有上千种,它们的结构和功能各异,泛素与靶蛋白的结合通过构像选择机制进行,而泛素之所以能够实现与众多靶蛋白的结合,主要原因是泛素单体存在动态结构,泛素链的亚基间存在丰富的动态结构[5-10]。
泛素的结构决定它的功能,而决定其结构的有以下几个原因。首先,泛素之间可以通过共价连接形成二聚泛素以及更长的多聚泛素链。一个泛素蛋白有7个赖氨酸(分别是K6、K11、K27、K29、K33、K48和K63),加上氮端的氨基,共有8种方式可以和另一个泛素蛋白的碳端羧基形成异肽键。这些链接方式,可以同种连接形成不同长度的泛素链。然而,泛素间也可以不同连接的方式形成分枝状的连接,形成各种不同的组合方式,这些连接方式的亚基较少。不同连接方式的多聚泛素链,其亚基之间的四级结构不同,使它们能够与不同的靶蛋白结合,参与调控不同的细胞功能。如K48连接的泛素链能够与蛋白酶体的泛素受体结合,参与蛋白质降解[11-12]。其次,泛素单体之间的极弱相互作用,使泛素链中两个相邻亚基之间形成动态的四级结构。泛素单体之间的非共价相互作用(KD≈5 mmol/L)[8],以共价连接形成的泛素链中两个相邻亚基能够达到这个有效浓度。这样的相互作用,使亚基之间能够处于不同的构象。如K63连接的二聚泛素(K63-diUb),可以有打开(open)、闭合(close)、部分打开(partially open)3种互变的构象[7],它们分别结合不同的靶蛋白,介导不同的功能,K63-diUb的不同构象,能够分别与激活和抑制NF-κB信号通路的靶蛋白结合。总之,由于共价连接方式的不同、各亚基之间非共价相互作用的存在,使得泛素链的四级结构多样复杂。泛素链通过构象选择性机制,在与特定的靶蛋白相结合时,使得某一种构象得以稳定。通过诱导契合机制,使结合更加紧密。最后,启动相应的信号通路。
泛素除了能够靶向底物从而实现不同的生理功能,自身也能够被修饰,比如乙酰化、磷酸化、ADP-核糖基化、磷酸核糖化、脱酰胺作用、SUMO修饰和琥珀酰化。以上这些定点修饰进一步增加了泛素网络的复杂性[2]。本文结合实验室研究较为成熟的磷酸化修饰为例来说明磷酸化对泛素网络的影响[9]。目前已有研究发现泛素链的四级结构可以受到泛素磷酸化的调节,从而有可能改变泛素的信号系统。泛素蛋白的Ser65能够被PINK1(PTEN-inducing kinase 1)磷酸化,磷酸化诱导泛素蛋白在生理温度下出现两种不同的结构,分别称为收缩态(retracted state)和舒张态(relaxed state)[13-15]。这两个态的出现,使泛素链的结构也发生更为复杂的变化。已经有研究发现,大部分E1、E2泛素酶利用磷酸化泛素时,泛素化底物和生成泛素链的活性降低,而少部分E1、E2泛素酶的活性增强[16-17],也就是说泛素单体一旦被泛素化后,可以影响写码器(writer)的活性。PINK1能够磷酸化泛素链中的任意亚基,以及结合在底物上的泛素,这些泛素一旦被磷酸化后,能够影响去泛素化酶的活性,大部分的去泛素化酶活性下降,而个别增加[17-21],也就是说可以影响擦除器(eraser)的活性。从细胞水平上来看,包括癌症、衰老和神经退行性疾病等,PINK1和pUb的水平都显著增加[22-24]。然而到目前为止,PINK1和pUb扮演的生理功能角色还远未确定[25]。因此这些定点修饰的样品制备也成为了泛素自身修饰研究最基础的步骤。
泛素链的样品制备对泛素的结构和功能研究具有决定作用。目前对于泛素链的制备主要分为生物酶法制备和化学合成两种方式。生物酶法制备指的是以下制备途径。首先,在E1的作用下形成E1-泛素硫酯中间体。接下来泛素被转移至E2上形成E2-泛素硫酯中间体,通常这一步骤的中间体能够特异性识别泛素的Lys侧链氨基或者M1氨基。但是对于部分链类型,E2-泛素硫酯中间体仍会在E3的帮助下特异性识别泛素的待链接位点。通过以上的E1-E2-E3级联反应,完成不同泛素链的链接过程。如果上述的级联过程特异性不专一,还可以通过去泛素化酶DUB特异性降解上述非特异性的链接方式。化学合成指的是采用蛋白多肽固态合成的方式,将泛素分成不同的几段,然后定点引入到待修饰的Lys侧链,从而实现制备不同链接方式的多聚泛素。清华大学刘磊等[26-27]采用化学合成的方式,已经在K27、K48和K63多聚泛素制备方面做了大量工作。接下来,本论文将主要讨论采用生物酶来制备各种形式的泛素样品,其中由于K27的特异性E2和E3酶缺失,将不予讨论。
1 材料与方法
1.1 E1、E2、E3及DUB酶的纯化
泛素链制备涉及到的各种E1、E2、E3及DUB酶所对应的泛素链类别见表1。各种酶的氨基酸图式见图1。E1酶[28-29]可用于所有的泛素链的合成。K6、K29、K33 3种连接方式的E2共用一种酶UBE2L3[30],但是其E3酶各不相同,分别是NIeL[31-32]、UBE3C[33]和AREL1[34]。K11的E2为UBE2S-UBD[35],Cezanne能够特异性降解K11泛素链[35]。K48的E2为E2-25K[36],OTUB1能够特异性降解K48泛素链[37]。K63的E2为ScUbc13和ScMMS2两种酵母E2的融合蛋白[38],AMSH能够特异性降解K63泛素链[34]。M1的E2为UBcH5c[39],E3为HOIP-RBR-C[40]。以上各种酶所构建的质粒转入BL21宿主中,挑单克隆菌落,由1 ml至1 L进行逐级扩大培养。当A600达到0.6~1.0时,加入IPTG终浓度为0.2 mmol/L,低温(18℃)诱导过夜。为了尽量减少纯化过程对酶活的影响,全程的纯化过程需要低温条件下进行。由于上述酶都带有His或者GST亲和标签,因此上述酶的纯化可以分为两类进行。His标签的缓冲液体系为:缓冲液A(20 mmol/L tris、pH 8.0,300 mmol/L NaCl,10%甘油),缓冲液B(缓冲液A+1 mol/L咪唑)。GST标签的缓冲液体系为:缓冲液A(20 mmol/L磷酸盐、pH 7.3,300 mmol/L NaCl,10%甘油),缓冲液B(20 mmol/L tris、pH 8.0,10%甘油)。样品经亲和柱纯化后,需要过排阻色谱进行进一步纯化,缓冲液体系为20 mmol/L tris、pH 8.0,150 mmol/L NaCl,10%甘油。一般来说,经过亲和纯化和排阻色谱纯化后,酶的纯度已经能够满足泛素多聚体的链接。

Table 1 E1,E2,E3 and DUB are involved in the synthesis of different ubiquitin chains
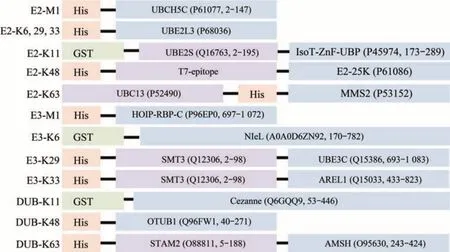
Fig.1 Schematic diagram of the amino acid structure of E2,E3 and DUB(UniProt ID and the corresponding amino acid number are shown in the brackets)
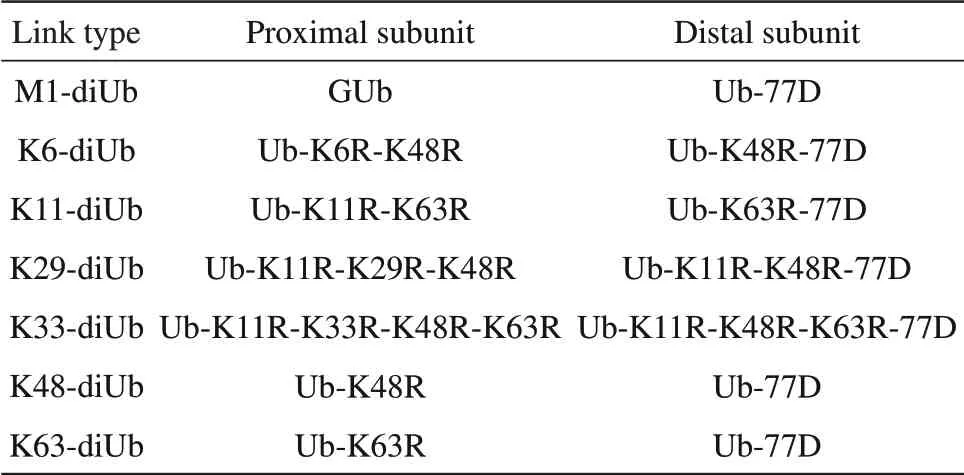
Table 2 The construction strategy of the distal and proximal subunits of different di-ubiquitin
1.2 非DUB参与的泛素链制备
多聚泛素制备采用的是体外生物酶法反应来制备多聚泛素。在生物酶法制备泛素链中,又分成了两种制备方式。一种是不采用DUB来制备泛素链,由于K6、K11、K29、K33在酶法反应过程中会生成其他非特异形式的泛素链,因此将近端亚基端的赖氨酸突变成精氨酸以封闭非特异性的连接方式,对远端亚基端也进行封闭(但是不能封闭需要连接的Lys位点)。另外,远端亚基的C端还需加入一个天冬氨酸(D77)将G76进行封闭。各种泛素链所需的近端亚基和远端亚基的Lys突变方案见表2。以K48泛素链为例,反应体系设置为:0.5 mmol/L Ub-K48R、0.5 mmol/L Ub-77D、250 nmol/L E1、5μmol/L E2、40 mmol/L Tris-HCl、20 mmol/L ATP、10 mmol/L PBDM(磷酸肌酸)、0.002 U磷酸肌酸激酶、0.5 mmol/L Ppase(无机焦磷酸化酶)、10 mmol/L MgCl2、0.5 mmol/L DTT,pH8.0,在25℃条件下反应6 h左右(其他的链接方式的反应体系以K48为参考)。二聚泛素链接成功后,如果需要再延长泛素链,再用YUH1酶[41]对远端的D77水解,然后以二聚泛素作为近端,以带有D77的泛素单体作为远端亚基再作酶反应。以此类推,可以得到满足实验要求的不同链长样品。最后用阳离子亲和柱(Source-S柱,GE Healthcare)对反应产物进行分离。
1.3 DUB参与的泛素链制备
另一种生物酶法制备方式是采用DUB来降解生成的非特异性链接泛素链。因此,此种方法的泛素材料可以直接使用野生型泛素。在E1、E2、E3反应以后,会得到不同聚合程度的泛素链。如果反应时间越长,得到的聚合程度会越高。因此,可以根据实验预期的泛素聚合程度,大致确定反应时间。以二聚泛素为例,对于M1、K48和K63来说,由于没有非特异性的泛素链产生,因此可以直接用阳离子亲和柱(Source-S柱)对反应产物进行分离。对于K6、K11、K29、K33来说,由于存在或多或少的非特异性链接,因此需要用对应的DUB酶作进一步的处理。DUB酶的反应量一般以Ub∶DUB=200∶1加入,反应温度为25℃或者37℃,过夜反应。
1.4 磷酸化泛素的制备
PINK1来源于体虱(phPINK1),其制备方法在之前已有描述[13]。对于野生型泛素的磷酸化反应,反应体系中泛素、phPINK1和ATP的摩尔浓度比为1∶0.01∶50。反应的缓冲液体系为:20 mmol/L HEPES,150 mmol/L NaCl,5 mmol/L DTT,5 mmol/L MgCl2,pH 7.4。反应温度设置为25℃,过夜反应。最后用阳离子亲和柱(Source-Q柱)对反应产物进行分离。用质谱(Agilent G6530QTOF)进行鉴定。当需要对泛素链中部分亚基进行磷酸化修饰时,有两种方案可供选择。一是先对待修饰的亚基进行磷酸化修饰,然后再按照1.2的方法进行泛素链的制备,此过程需要注意的是磷酸化以后的泛素可能会降低泛素链的酶活反应;第二种方案是将不进行磷酸化修饰的亚基S65位进行突变,先按照1.2的方法制备泛素链,然后再进行磷酸化反应。具体的实施方案根据实验的具体情况而定。
1.5 分支型泛素链的制备
上述讨论的都是同型多聚泛素,但细胞内也同样普遍存在着异型多聚泛素。异型多聚泛素也分为混合型和支链型。以三聚泛素为例说明,Ub1、Ub2、Ub3代表三聚泛素的3个亚基。混合型泛素链指的是Ub1通过其G76与Ub2的8个可能位点形成二聚,然后Ub2的G76与Ub3的剩余7个位点(除去Ub1/Ub2已经形成的聚合类型)继续延长泛素链,理论上混合型泛素链有56种形式。分支型泛素链指的是Ub1和Ub2都通过其G76与Ub3的8个可能位点中的两个位点形成共价连接,形成分支状,理论上分支型泛素链有28种形式[42]。目前异型泛素链的结构特征及功能研究已经被报道,已鉴定的异型泛素链包括K11/K48、M1/K63、K29/K48、K11/K63和K48/K63泛素链[32,43-44]。其中K11/K48分支型泛素链已经被证实能够促进其修饰的底物被蛋白酶体识别降解[45]。本文以本课题组正在研究的K11/K48分支泛素链为例,阐述其制备路线。其制备路线可以采用两种:一是首先制备K48二聚泛素,然后以K48二聚泛素为基础,通过合成K11二聚泛素的方法合成K11/K48分支泛素链;二是首先制备K11二聚泛素,然后再引入K48链接。上述各个步骤的反应条件与二聚泛素的反应条件一致,具体反应体系不再赘述。
2 结 果
2.1 非DUB参与的泛素链制备结果
在二聚泛素的链接过程中,为了控制链长,在近端亚基端引入D77。为了避免形成非特异性链接,将引起非特异性链接的Lys突变成Arg。以K63的多聚泛素制备为例,K63-diUb及K63-triUb的蛋白质胶图及质谱图见图2。这种策略可以精准控制多聚泛素的形成,从而实现对不同亚基的结构和功能研究。比如在研究二聚泛素磷酸化的过程中,需要表征不同亚基的磷酸化特征以及磷酸化以后蛋白质结构的变化,可以选择先对待研究亚基进行磷酸化,然后再进行二聚反应。对于反应过程中特异性较差的K29和K33而言,进一步发现其特异性的E3酶对泛素的精准制备显得尤为重要。同时有文献表明[46],将泛素的7个Lys全部突变成Arg后(简称为K0-Ub),K0-Ub的1H-15N-HSQC谱图相较于野生型泛素而言发生了一定程度的化学位移扰动,对K0-Ub的溶液结构解析发现,其骨架结构与野生型泛素仍然保持一致。因此认为Lys突变为Arg并不会引起泛素结构的变化。
2.2 DUB参与的泛素链制备结果
为了减少Arg突变对泛素体系的影响,可以选择使用DUB的方式来制备泛素链。这种方式制备的泛素链能够更加真实地模拟细胞内形成的泛素体系。M1、K6、K11、K29、K33、K48和K63的反应体系结果见图3a。如果E2/E3的特异性高,可以在反应完成后不加DUB处理,比如M1、K48和K63的链接形式。以M1的多聚反应为例,如果需要进一步的分离,需要过Source-S柱进行进一步纯化(图3b,c)。图3b中显示的纯化柱为手动制作,能够填装更多填料,且柱子呈细长,因此具有较好的分离效果。Source-S柱经过改良,保证了不同链长的分离效果,且在阳离子柱洗脱过程中,应将洗脱梯度尽可能的降低。取M1-diUb的纯化谱峰用作质谱鉴定,鉴定结果显示M1-diUb的表观分子质量与理论分子质量完全一致(图3d)。用此种方法制备的泛素链低聚产物会占较大比例,如果需要制备更高聚的产物,可以将反应的基础单元monoUb替换为diUb甚至是triUb。另外,可以适当延长反应时间以及增加酶量。以K48泛素链为例,反应体系原设置为:0.5 mmol/L Ub、250 nmol/L E1、5μmol/L E2-25K,反应条件为25℃,6 h。调整后可设置为:0.5 mmol/L Ub、500 nmol/L E1、10μmol/L E2-25K,反应条件为25℃,12 h。为了尽可能防止副产物的产生,反应体系应保持新鲜,即在适当的反应时间后,可以继续添加酶量,也可以将反应体系作粗纯化后得到只含有泛素的产物,然后再继续加入其他材料进行反应。
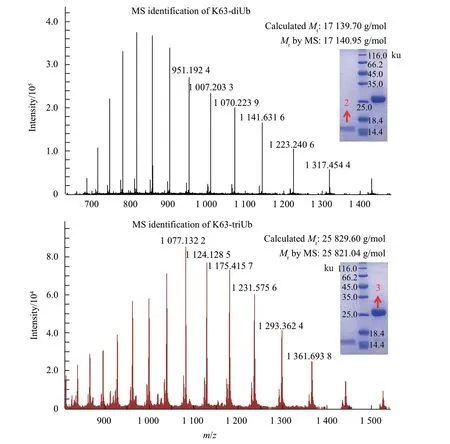
Fig.2 Mass spectra of di-and tri-K63 polyUb
2.3 磷酸化泛素制备结果
野生型泛素在PINK1激酶的作用下,能够高效地生成磷酸化泛素。对野生型泛素和磷酸化泛素分别进行质谱和phos-Tag蛋白胶的鉴定(图4a,b)。质谱结果显示,磷酸化泛素的相对分子质量正好增加了79 u,符合磷酸根的相对分子质量。Phos-Tag蛋白胶结果显示,pUb的条带明显高于野生型泛素,说明pUb的磷酸根与胶中的Mn2+结合,减缓了pUb的迁移速率。此外,也用核磁1H-15N-HSQC谱图表征了野生型泛素的磷酸化速率。同样,通过S65A突变的方式,对M1、K48、K63diUb的远端亚基和近端亚基的磷酸化速率进行了表征。通过一系列的磷酸化实验,能够证实不同泛素链的不同亚基都能够被磷酸化。但是在真实的细胞环境中,不同亚基的磷酸化速率如何,或者说不同亚基的磷酸化顺序如何,还需要做系统的研究。
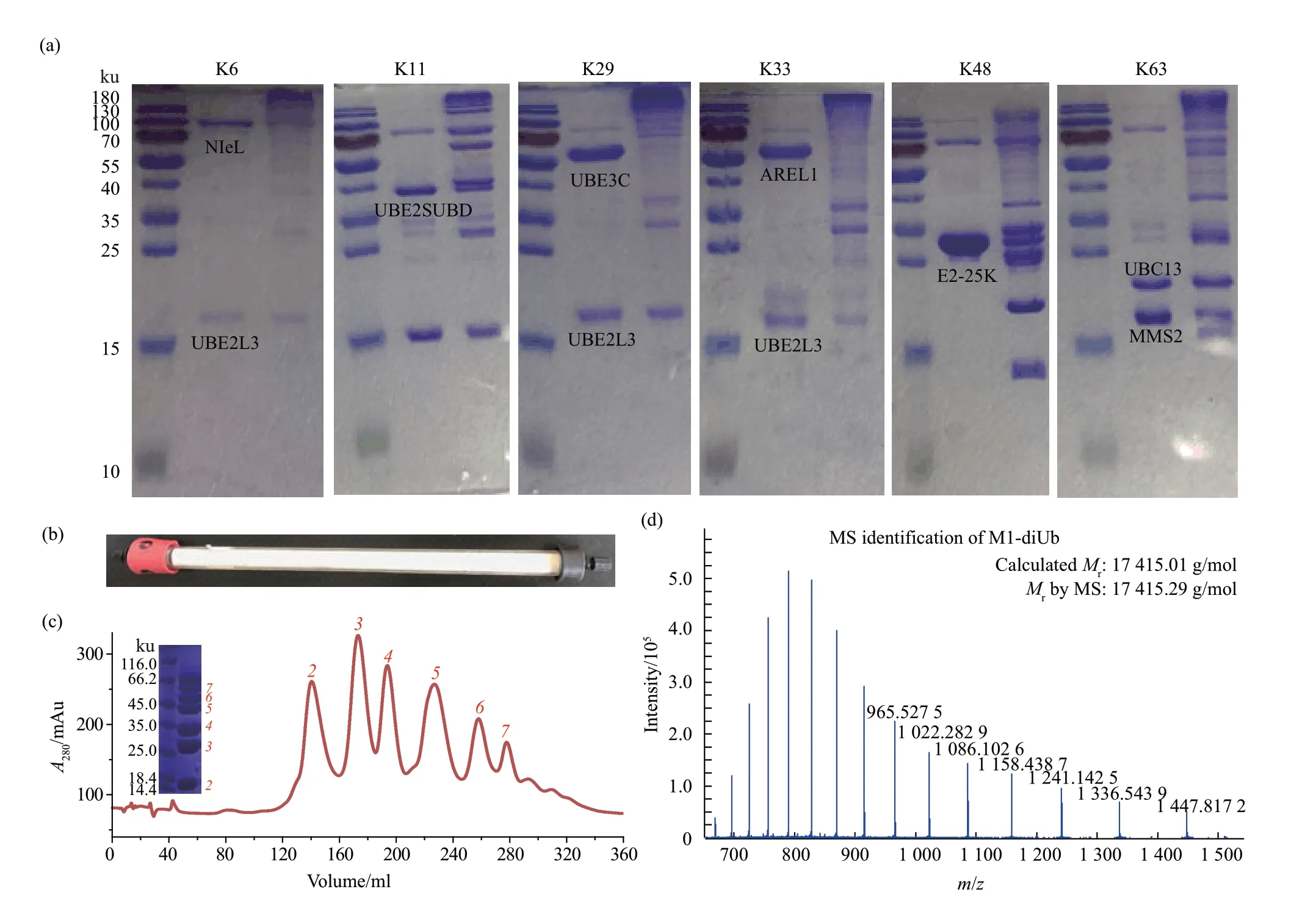
Fig.3 Deubiquitinating enzymes participate in the preparation of different types of polyubiquitin chains
2.4 分支型泛素链的制备结果
K11/K48分支泛素链制备,首先需要制备K48二聚泛素。按照上述泛素突变体的制备策略,将远端亚基的K48突变为R,防止被其他泛素在连接在48位点,在近端亚基的C端加上氨基酸D77,这是为了只使远端亚基提供游离的C端,从而控制只形成二聚泛素。之后,以Ub-K11R-K48R突变体为K11/K48分支型泛素链的最后一个亚基。Ub-K11R-K48R突变体的目的是为了在反应过程中生成K11-diUb和K48-diUb。然后以表1中K11的连接体系为参考,即可生成K11/K48分支型泛素链。但是由于UBE2S-UBD的非特异性作用,除了能够在K11位点反应,也能够在K63位点反应,因此会生成10%的K63连接泛素链。为了除去形成的K63链接泛素链,在最终的反应体系中加入DUB酶AMSH。当然,K11/K48分支泛素链制备也可以首先制备K11二聚泛素,之后的制备顺序同上。两种方式的制备效率相近。图4d为K11/K48分支泛素链的示意图。将制备好的K11/48-triUb样品通过OTUB1酶分别处理0、5、15、30、60、90 min。SDS-PAGE鉴定见图4c,可以证实K11/48-triUb样品也能够验证OTUB1的酶活效率。
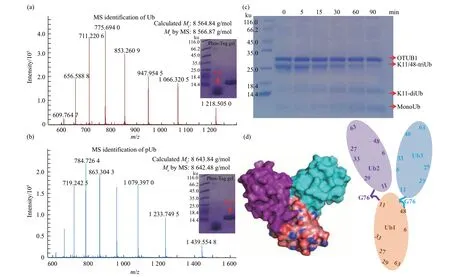
Fig.4 Identification of phosphorylated ubiquitin and branched ubiquitin
3 讨 论
泛素系统中涉及到的E1、E2、E3及DUB酶的研究对泛素样品的制备至关重要。由于目前对不同泛素组合链所需的E2、E3及DUB酶的研究认识仍然有限,因此对不同泛素组合链结构和功能也不全面。特别是缺乏对细胞中针对E3连接酶特异性的泛素化事件的直接鉴定方法[2]。目前关于K48和K63的泛素链研究已经非常深入,但是对于一些非典型的泛素链的研究仍然有待拓展。Xu等[47]通过质谱定量分析对酵母细胞中7种Lys链接的泛素链比例进行分析,结果显示如下:(10.9±1.9)%(K6)、(28.0±1.4)%(K11)、(9.0±0.1%)(K27)、(3.2±0.1%)(K29)、(3.5±0.1)%(K33)、(29.1±1.9)%(K48)和(16.3±0.2)%(K63)。上述证据意外发现K11与目前研究较为深入的K48链接的泛素链占比相当,而目前研究知之甚少的K27泛素链比例也并不是最低的。这还只是单纯的几种链形成的比例,还没有涉及到更加复杂的拓扑结构、分支结构和混合结构。这说明对细胞内的泛素研究仍然需要广泛而基础的研究。一个典型的例子是目前还无法用酶法来制备的K27泛素链。究其原因有以下两个方面。一是K27的侧链氨基由于处于被包埋状态,因此活性中心不易暴露导致其活化难度提高。二是K27泛素链的E2、E3和DUB酶现有研究过少,使得K27泛素链无法通过酶促组装进行体外合成,从而一定程度上阻碍了K27泛素链的结构和功能研究。
生物酶法制备泛素链的优势在于能够对特异性的亚基单元进行特异性的修饰与标记。比如磷酸化修饰、荧光探针标记、顺磁探针标记和同位素标记等等。以上这些特异性标记对于复杂泛素体系研究来说至关重要。通过特定亚基的磷酸化修饰,能够探究磷酸化修饰对泛素局部的构象影响。但是在磷酸化样品的制备过程中要注意的是磷酸化对酶联反应体系的影响,换言之,需要注意磷酸化反应和酶联反应的顺序。在前文中已经提到,磷酸化能够影响E1、E2、E3和DUB的酶活效率。一般来说磷酸化会降低酶联效率。因此会优化反应方案,此部分在前文中也已经提到。在生物体内,泛素链并没有完全被磷酸化,有文献显示体内的磷酸化水平维持在约20%左右[18]。如果需要模拟体内的磷酸化修饰,可以不需要针对特定亚基进行磷酸化。通过对野生型泛素链直接进行磷酸化修饰,只需要控制反应的酶量及时间即可。在特定亚基引入顺磁探针或者荧光探针,有两种引入方案可供选择。一是用非天然氨基酸的方法,此种方法需要先制备带有非天然氨基酸的亚基,然后通过生物酶法制备泛素链。另一种方案是先在泛素亚基上引入Cys突变,这种方案为了减少对酶联反应的影响,通常会选择在生物酶法制备泛素链以后,然后再通过探针与Cys的反应达到引入的目的。比如本课题组已经成功将Alexa488(Thermo Fisher)和Cy5马来酰亚胺(maleimide)(GE Healthcare)引入到K63-diUb或者磷酸化的K63-diUb的两个亚基上,然后通过smFRET技术探究K63-diUb在磷酸化前后的系综结构差异[6,13]。用同位素分别标记泛素链亚基,然后通过二维或者三维核磁共振实验研究单个泛素链的动力学行为和结构特征,从而得到泛素链里每个亚基的构象特征[35,48]。本课题组也通过在K63-diUb上引入顺磁探针,然后通过核磁PRE(顺磁弛豫增强)技术探究了K63-diUb系综结构的构象分布[7]。
除了制备不同种类的泛素链以外,制备带有泛素链修饰的底物复合体也是泛素研究的重点和难点。在泛素-蛋白酶体系统中,通常认为由E3连接酶催化泛素修饰底物的特定位点,换言之,泛素修饰底物的位置由E3泛素连接酶来确定。那么就引发了疑问:泛素是否也具有位点选择性?底物上的Lys位点是否都能够被泛素修饰?目前从识别机制出发很难回答这些问题。不过有研究人员通过在底物的不同Lys位点上人为引入泛素化修饰,发现部分敏感位点的泛素化修饰确实会破坏蛋白质天然结构的稳定性,并增加了蛋白酶体降解的速度[49]。同时也有分子动力学研究表明,泛素化修饰底物以后可能会破坏底物蛋白的稳定性,主要是通过降低底物的构象熵导致的[50-51]。目前关于泛素修饰底物的动态识别机制尚需要进一步研究,这就需要对不同底物的不同位点进行定点的泛素化修饰。对于天然底物和泛素之间异肽键的构建,有研究人员通过改进E1、E2和E3酶方法,成功在底物的Lys侧链ε-氨基上引入了泛素化修饰[49],清华大学刘磊等[52]也应用化学合成技术对组蛋白H2B-K34位点进行泛素化修饰。无论是生物酶法还是化学合成方法,希望通过不断的改进技术,使得底物的泛素化修饰具有更强的普适性。总的来说,无论是制备泛素链,还是制备泛素链修饰的底物复合物体,都需要化学生物学、蛋白质组学、结构生物学以及细胞生物学的协同合作,从而才能够系统的阐述泛素构建的生理网络。
4 结 论
本论文通过E1、E2、E3及DUB参与的方式,系统地阐述了不同泛素链的制备过程。以体外生物酶法的制备方式,能够高效高产地得到实验样品,为后续特定亚基的特异性修饰提供了充足的保障。在目前的实验过程中,一次酶反应后其长度能够达到十聚体左右,然后对不同链长的多聚泛素的分离纯化,即可得到不同链长的泛素链。本文虽然仅对泛素磷酸化这一泛素自身的修饰作了论述,但同样适用于制备其他翻译后修饰的样品,比如乙酰化和甲基化等,当然这主要依赖于特异性修饰酶的深入研究。本文对K11/K48分支链的论述也同样适用于其他分支链或者混合链的制备。通过对不同泛素形式的研究,进而全面且深入地研究泛素系统,对理解泛素、泛素链及修饰的泛素链在生理网络中扮演的角色至关重要。
