水稻粉质皱缩胚乳突变体fse4的表型分析与基因克隆
2019-11-18杜溢墨潘天田云录刘世家刘喜江玲张文伟王益华万建民
杜溢墨 潘天 田云录 刘世家 刘喜 江玲 张文伟 王益华 万建民
水稻粉质皱缩胚乳突变体的表型分析与基因克隆
杜溢墨 潘天 田云录 刘世家 刘喜 江玲 张文伟 王益华*万建民
(南京农业大学 作物遗传与种质创新国家重点实验室/农业部长江中下游粳稻生物学与遗传育种重点实验室/江苏省现代作物生产中心/江苏省植物基因工程技术研究中心,南京 210095;*通讯联系人,E-mail: yihuawang@njau.edu.cn)
水稻种子主要以淀粉形式储藏能量。淀粉合成需要多种酶类和调控因子参与,机制较为复杂。本研究利用水稻胚乳发育缺陷突变体,克隆和鉴定新的调控淀粉合成相关基因,旨在为研究淀粉合成及其调控提供理论依据。从化学诱变剂甲基亚硝基脲(1-methyl-1-nitroso-urea, MNU)处理的宁粳3号(Ningjing 3, WT)突变体库中筛选到一个能稳定遗传的胚乳粉质皱缩突变体,命名为()。与籼稻品种Dular杂交获得F1种子(F2),通过图位克隆的策略确定候选基因。利用杂合植株()分离出的粉质种子,观察形态学特征,分析其理化性质。使用扫描电镜和半薄切片技术观察胚乳结构。使用qRT-PCR和免疫印迹分析淀粉合成相关基因表达模式和淀粉合成相关酶类的蛋白积累量。利用全自动氨基酸分析仪测定成熟胚乳各氨基酸含量。突变体籽粒宽度、厚度以及千粒重显著下降,同时胚乳中总淀粉、总蛋白、直链淀粉含量亦显著下降,而脂肪含量显著上升;淀粉黏度、崩解值和消减值显著低于野生型。突变体中多为单粒型淀粉颗粒,且排列分散。定位于第5染色体长臂约252 kb的区间内,测序发现编码Δ1-吡咯啉-5-羧酸合成酶基因(Delta 1-pyrroline-5-carboxylate synthetase,)第1外显子上发生单碱基替换,导致一保守的氨基酸发生变异。突变体中大部分淀粉合成相关基因表达量下调,多种淀粉合成相关蛋白积累量减少。突变体米粉中多种氨基酸含量发生显著变化,游离氨基酸含量是其野生型的3.6倍。此外,外源喷施脯氨酸能部分恢复突变体种子萌发缺陷表型。编码脯氨酸合成关键限速酶P5CS,该基因对胚乳中氨基酸的合成及代谢起重要的调控作用,并影响淀粉的合成与积累。
粉质胚乳;淀粉合成;基因克隆;Δ1-吡咯啉-5-羧酸合成酶;氨基酸合成与代谢
水稻是世界上最主要的粮食作物之一,也是全球一半以上人口的主食[1]。我国人口众多,因此长期高度重视产量育种,导致近年来审定品种中优质品种比例偏低。随着人民生活水平不断提高,稻米品质改良显得愈加重要[2]。水稻种子发育过程中积累大量的淀粉,其中直链淀粉与支链淀粉含量、比例和支链淀粉的链长分布与稻米食味品质直接相关[3],因此解析稻米淀粉合成与调控的分子网络途径对稻米品质改良至关重要。淀粉合成过程需要腺苷二磷酸葡萄糖焦磷酸化酶(ADP glucose pyropho- sphorylase, AGPase)、颗粒淀粉合酶(Granule-bound starch synthase, GBSS)、淀粉合酶(Starch synthase, SS)、淀粉分支酶(Starch branching enzyme, SBE)、淀粉去分支酶(Debranching enzyme, DBE)等多种关键酶催化[4-5],同时还涉及到复杂的调控过程,虽然已经有部分调控基因的克隆报道,但淀粉的合成调控路径远未异清[6-8]。
大量的研究表明,利用胚乳缺陷突变体克隆鉴定新的淀粉合成调控相关基因是可行的[9]。目前已有多个水稻粉质胚乳形成相关基因被报道。如编码一个三角形四肽重复基序蛋白,突变后籽粒变小,外观呈暗胚乳表型,直链淀粉含量降低,其过表达植株籽粒变大[10]。编码一个丙酮酸磷酸双激酶,其突变体的支链淀粉合成受到影响[11]。编码一个含有CBM48结构域的蛋白,该蛋白与异淀粉酶1(Isoamylase 1, ISA1)互作,可能调节ISA1与淀粉颗粒的结合[12]。编码一个功能未知蛋白,其突变体胚乳外围呈粉质但中间部分正常[13]。编码一个P型PPR蛋白,该基因通过对水稻线粒体第1内含子的反式剪接影响线粒体功能,并对胚乳发育起重要作用[14]。编码依赖于NAD的胞质苹果酸脱氢酶CMDH,该突变体ATP含量降低,淀粉合成相关酶活性显著降低,过量表达显著提高籽粒重量,具有潜在的应用前景[15]。此外,也有一些粉质皱缩的突变体被报道。如编码含有DDHD结构域的膜结合蛋白,其表达产物可能具有磷酸水解酶活性,导致胚乳中的脂质合成存在缺陷,影响造粉体发育[16]。位于第3染色体短臂,编码一个鸟苷酸激酶OsGK1。该基因突变后,胚乳的淀粉颗粒变小且呈圆型[17]。被精细定位于第9染色体长臂约228 kb区间内,其突变体淀粉颗粒排列松散,大小不一,单粒型淀粉颗粒增多[18]。因此,对水稻粉质胚乳形成的研究能够进一步丰富淀粉合成调控网络,为稻米品质改良提供理论参考。
脯氨酸是一种重要的渗透调节物质,能够作为分子伴侣稳定蛋白质结构,也可以作为抗氧化剂调节植物体内活性氧平衡[19]。Δ1-吡咯啉-5-羧酸合成酶(Delta 1-pyrroline-5-carboxylate synthetase, P5CS)催化谷氨酸盐(Glutamate)生成谷氨酸半醛(Glutamate semialdehyde, GSA),是植物由谷氨酸通路合成脯氨酸的关键限速酶,可在逆境胁迫时增加植株脯氨酸水平[20]。基因已经在豇豆、苜蓿、高粱、大豆、刚毛柽柳等多种植物中被克隆,主要参与植物对逆境的响应[21-25]。将菜豆和的cDNA导入拟南芥中,在盐胁迫条件下,转基因植株叶片中的脯氨酸含量显著高于对照[26]。在水稻中,采用130 mmol/L NaCl溶液处理日本晴幼苗,其转录物水平强烈上调,脯氨酸含量升高[27]。昆虫和人类中也有关于的报道。在马铃薯甲虫中沉默或能够显著降低血淋巴中脯氨酸和精氨酸含量;敲除显著增加成虫死亡率[28]。人体中突变将会导致高氨血症、低脯氨酸血症等疾病,临床表现为皮肤松弛,小脑畸形[29]。因此,对动植物生长发育起重要作用,但水稻中如何调控水稻胚乳发育及淀粉合成等尚未见报道。
本研究从宁粳3号突变体库中筛选到胚乳粉质皱缩突变体,对其籽粒性状及米粉理化性质进行测定,并对其籽粒胚乳结构进行观察。通过图位克隆确定候选基因。借助细胞学、免疫印迹和氨基酸含量分析等实验,阐述与造粉体发育及籽粒中氨基酸合成的关系,为进一步完善水稻胚乳中淀粉合成调控提供参考。
1 材料与方法
1.1 材料种植
从化学诱变剂甲基亚硝基脲(1-methyl-1- nitroso-urea, MNU)处理的宁粳3号突变体库中筛选到一个能稳定遗传的胚乳粉质皱缩突变体,命名为()。突变体纯合致死,因而选择杂合单株与籼稻品种Dular配制杂交组合,用于基因的定位克隆。所有材料均种植于南京农业大学土桥实验基地和海南陵水南繁基地,栽培管理方式与大田生产相同。
1.2 成熟种子理化性状测定
杂合植株成熟种子去壳后于医用灯箱上挑选出粉质皱缩个体,磨成糙米粉并过筛(孔径为0.15 mm),50℃烘箱中放置12 h以上至恒重。直链淀粉含量测定使用GB-7648-87法。1)精确称量标样、野生型和突变体米粉0.1 g置于100 mL容量瓶底部,加入1.0 mL 95%乙醇湿润米粉;2)加入9 mL 1 mol/L氢氧化钠溶液,沸水浴10 min;3)取5 mL 样品溶液置于容量瓶中,再加入1 mL 1 mol/L乙酸溶液,待样品酸化后加1.5 mL碘液,定容至100 mL,静置20 min;5)利用分光光度计测量620 nm处样品的吸光度,以0.09 mol/L氢氧化钠溶液为空白对照。利用已知淀粉含量与吸光度值建立标准曲线,并计算样品直链淀粉含量。每个样品3次重复。
总淀粉含量使用Megazyme总淀粉含量测定试剂盒测定。总脂肪含量使用FOSS公司全自动脂肪测定仪测定。总蛋白含量使用FOSS公司全自动凯氏定氮仪测定。每个样品均重复测定3次,求平均值。用25 mL蒸馏水将3.0 g米粉混合均匀,采用瑞典Perten公司RVA快速黏度分析仪(Tecmaster)测定黏度特性。
1.3 成熟种子扫描电镜观察
选出典型的野生型与突变体种子,送至南京农业大学生命科学院电镜实验中心,由电镜中心完成样品制备,在日立S-3000N型扫描电镜下观察拍照。
1.4 TTC染色
取野生型与突变体成熟种子各30粒,30℃光照培养箱内浸种12 h,吸干水分后放入15 mL离心管中。称取0.1 g避光保存的2, 3, 5-氯化三苯基四氮唑(2, 3, 5-Triphenyltetrazolium chloride, TTC)粉末,溶于100 mL磷酸缓冲液(pH 7.0)中。每个离心管中分别加入10 mL现配的0.1% TTC溶液,避光放置于30℃光照培养箱,2 h和5 h后取出,蒸馏水冲洗后白纸上观察染色情况并拍照。
1.5 胚乳半薄切片观察
分别取野生型和突变体花后12 d(Days after flowering,DAF)胚乳,于冰上将胚乳从中间横向切取1 mm厚度薄片。1)样品放入离心管中,加入固定液[多聚甲醛2%(/),戊二醛2%(/),蔗糖250 mmol/L,PIPES-KOH 50 mmol/L,pH 7.2],4℃下避光保存。剩余部分放入2.0 mL 离心管中用于SDS-PAGE,鉴定所选极端的准确性。2)PBS漂洗3次后,分别在30%、50%的乙醇溶液处理样品,每次15 min(4℃下)。之后在−20℃下用70%乙醇溶液处理2次,每次30 min。3)在−20℃条件下使用70%乙醇∶LR White树脂(1∶2)、100% LR White树脂对样品进行渗透各2 h,100% LR White树脂渗透12 h。将样品放入60℃烘箱中高温聚合48 h以上。使用Leica RM2265切片机切成1 μm厚度薄片,0.1% I2-KI溶液染色后在Zeiss AX10显微镜下观察拍照。
1.6 基因的图位克隆
配制突变体与籼稻Dular的杂交组合,收获F1自交种子F2。烘箱干燥后去除种子颖壳,挑选与突变体表型一致的种子提取DNA。利用实验室已有的分子标记引物,筛选突变体和Dular之间的多态性标记,使用10个隐性个体进行连锁分析。确定连锁位点后,增加标记和隐性个体数量,扩大群体进行精细定位。所用引物由水稻变异图谱网站(http://www.ricevarmap.ncpgr.cn)和Primer Premier 5.0软件设计。根据水稻全基因芯片数据库网站(http://ricexpro.dna.affrc.go.jp/)上公布的日本晴序列预测定位区间内ORFs(Open reading frames)。所用引物见表1。
1.7 淀粉合成相关基因的表达分析
分别取野生型和突变体花后12 d的胚乳,使用TIANGEN公司试剂盒提取胚乳RNA,并反转录为cDNA;采用美国应用生物系统公司的7500实时PCR系统仪器,以水稻为内参进行PCR。反应体系包括cDNA模板8.0 μL(约80 ng)、前引物及后引物各1 μL(10 μmol/L)、10 μL SYBR Premix ExII (2 ×)。采用2法对基因表达数据进行分析处理[30]。
1.8 蛋白免疫印迹分析
提取成熟的野生型和突变体种子总蛋白进行SDS-PAGE。使用浓度为6%的浓缩胶,8%~18%梯度的分离胶。电泳完成后,用Bio-Rad公司的湿转系统将蛋白转印到PVDF膜上(Minipore 0.45 μm)。将PVDF膜在封闭液(5%脱脂牛奶,PBST溶解)中孵育1 h。之后分别转移到含有Anti-GBSSI、Anti-AGPS2b、Anti-Flo4、Anti-BEⅡb、Anti-BEⅠ、Anti-AGPL2、Anti-SSⅠ等一抗(1∶10000)的新封闭液中室温孵育2 h。PBST(氯化钠8 g, 氯化钾0.2 g,磷酸氢二钾0.27 g, 磷酸氢二钠3.85 g, 吐温-20 500 µL 溶于1 L蒸馏水中)漂洗PVDF膜3次,每次15 min。再将PVDF膜转移到含有二抗(1:5000)的封闭液中,孵育1 h,重复漂洗过程。使用ECL化学发光液检测杂交信号。所用抗体为ABclonal公司制备,内参抗体为Anti-EF-1α。
1.9 氨基酸序列比对
在NCBI(https://www.ncbi.nlm.nih.gov/)网站下载不同物种中P5CS同源蛋白序列,使用MEGA 7.0进行比对分析并构建其同源蛋白进化树。
1.10 候选基因OsP5CS的亚细胞定位
构建片段与GFP融合载体。挑选经测序正确的阳性克隆,采用TIANGEN公司的质粒大量提取试剂盒,提取质粒。水稻原生质体分离参考前人方法进行[31]。1)在200 µL(2×104)原生质体中加入10 µL高浓度(1 μg/ μL)质粒;2)加入220 µL 40% PEG溶液,混匀后28℃下避光放置20 min;3)加入880 µL W5溶液(氯化钠4.5 g,氯化钙6.935 g,氯化钾0.185 g,MES 0.195 g,蔗糖0.5 g溶于500 mL蒸馏水,过滤灭菌后使用)混匀;4)于28℃下150下离心3 min,除去PEG;5)加入220 µL W5溶液重悬沉淀,28℃、黑暗条件下培养过夜后使用Zeiss公司LSM710型激光共聚焦显微镜观察。
1.11 氨基酸含量的分析
取同一块田生长的野生型与突变体种子,磨成米粉。将米粉过筛后,于50℃烘箱中放置24 h以上烘至恒重。
米粉中水解氨基酸含量测定:称取0.1 g米粉放入水解管中,加入5 mL 6 mol/L浓盐酸,充氮封管后置于110℃烘箱中,22 h后取出;蒸馏水定容至100 mL,取1 mL真空干燥后加入1 mL蒸馏水复溶,使用0.22 µm水系滤头过滤后置于日本Hitachi公司L-8900型全自动氨基酸分析仪测定水解氨基酸含量。每个样品3次重复。
米粉中游离氨基酸含量测定:准确称取0.4 g米粉,浸入1.5 mL蒸馏水中,4℃下旋转过夜;12 000 r/min下离心15 min,取上清液到2.0 mL离心管中,加入等体积的4%磺基水杨酸溶液,摇匀后12 000 r/min下离心15 min;用0.22 µm水系滤头过滤上清液;使用Hitachi公司L-8900型全自动氨基酸分析仪测定游离氨基酸含量。每个样品3次重复。
2 结果与分析
2.1 突变体fse4的表型分析
突变体成熟籽粒去除颖壳后呈现粉质皱缩状,野生型种子胚乳则饱满透明(图1-A~B)。花后12 d野生型和突变体胚乳半薄切片观察显示,野生型胚乳细胞淀粉颗粒排列紧密,互相挤压(图1-D),而突变体中淀粉颗粒排列疏松,间隙很大(图1-E),说明突变体造粉体发育相对滞后。扫描电镜发现,突变体胚乳中淀粉颗粒大小不一,相互之间存在较大间隙(图1-G);野生型种子横断面的淀粉颗粒排列整齐,相互挤压呈多面体晶体结构(图1-F)。上述结果显示对胚乳中造粉体的发育至关重要。此外,SDS-PAGE显示,突变体蛋白质谱带与野生型相比发生明显变化,主要储藏蛋白的积累量极显著下降(图1-C)。相较野生型,突变体种子的粒长、粒宽和粒厚分别下降0.8%、7.6%和30.8%(图1-H),千粒重下降54.1%(图1-I)。因此,的突变显著影响了水稻种子的发育。
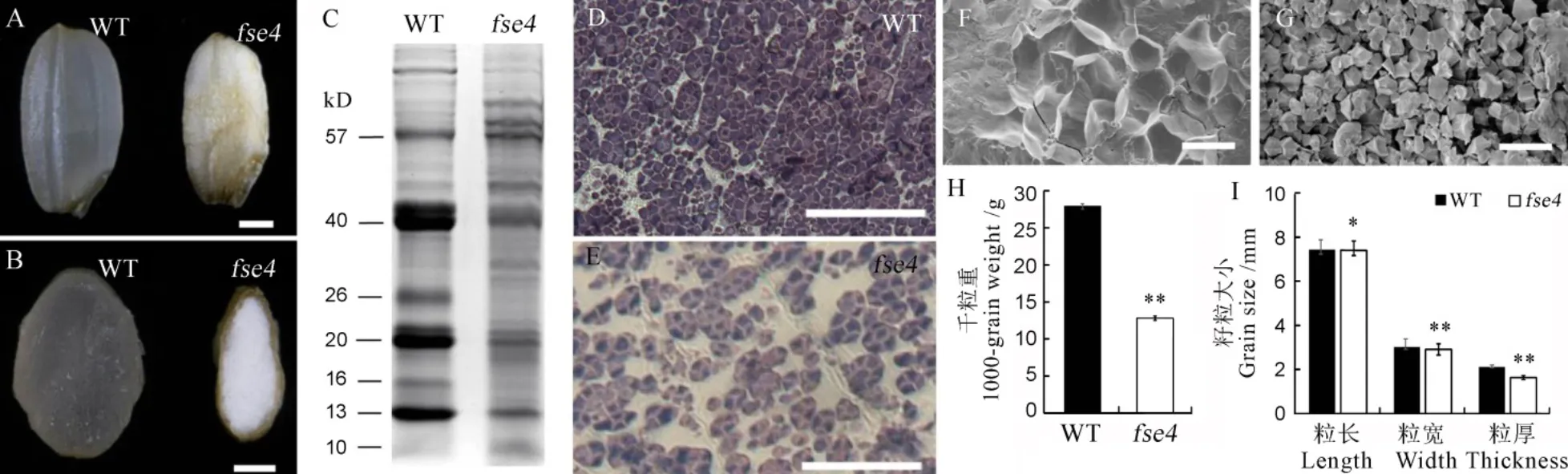
A−种子外观,标尺为1 mm;B−种子的横切面,标尺为1 mm;C− SDS-PAGE电泳图谱。D,E为花后12 d胚乳半薄切片,标尺50 μm;F,G为籽粒横截面扫描电镜观察,标尺为10 μm;H−千粒重比较,n=3;I−籽粒大小比较,n=20。数值为平均值±标准差;采用t测验,*P<0.05, **P<0.01。
Fig. 1. Phenotypic observation of seeds of WT and.
2.2 突变体fse4胚萌发观察
突变体胚萌发异常,少部分种子不能萌发,大部分种子长出约2 mm嫩芽后迅速死亡(图2-A)。TTC染色2 h结果显示,突变体胚活力极弱(图2-D)。将野生型和突变体种子放入30℃光照培养箱中,恒温吸涨12 h后将其胚进行纵切片观察,野生型胚出现明显萌动,具有很强生活力;而突变体胚内部结构尚不明显(图2-B)。恒温吸涨24 h后,突变体胚出现结构分化,但仍较野生型缓慢(图2-C)。TTC染色5 h后,突变体部分种子染上红色(图2-E)。说明突变使水稻胚发育产生缺陷,影响种子萌发。

A—种子发芽5 d后的表型。标尺为1 cm;B, C—种子在30℃下吸胀12 h(B)和24 h(C)后胚的纵切片,标尺为1 mm;D, E—种子TTC染色2 h(D)和5 h(E)后的着色情况。标尺为1 cm。
Fig. 2. Seed viability analysis of WT and.
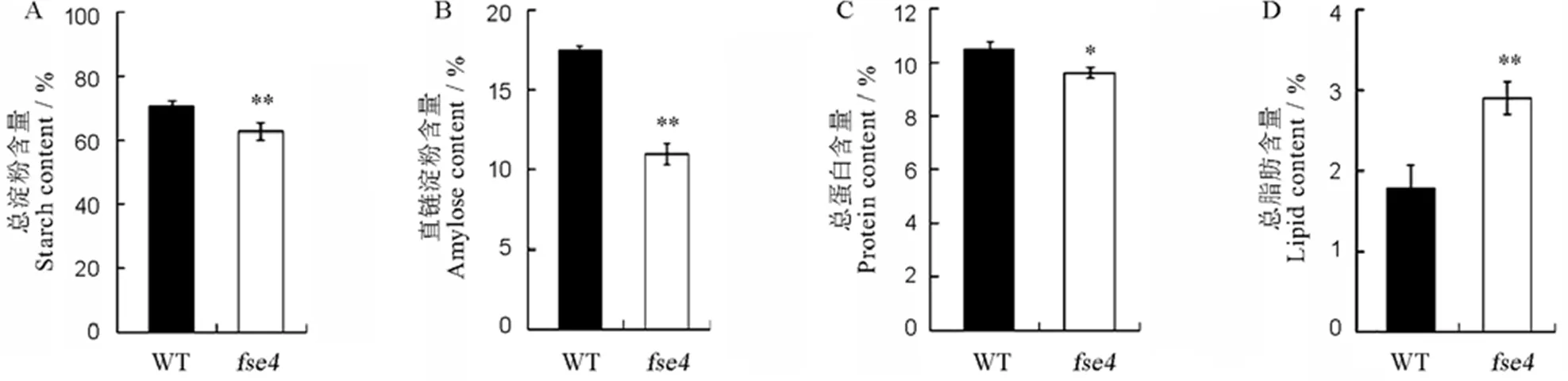
n=3,取平均值±SD;采用t检验,*P<0.05,**P<0.01。
Fig. 3. Physicochemical characteristics of WT andmature seeds.

表2 野生型和突变体fse4淀粉的RVA谱特征分析
PKV, Peak viscosity; HPV, Hot pasting viscosity; BDV, Breakdown viscosity; CPV, Cool pasting viscosity; SBV, Setback viscosity; PeT, Peak time; PaT, Past temperature.
2.3 突变体fse4成熟籽粒的理化性状分析
与野生型成熟种子相比,突变体总淀粉含量、直链淀粉含量和总蛋白含量分别下降11%、43%和8%(图3-A~C),总脂肪含量则升高62%(图3-D)。RVA谱分析结果显示,突变体与野生型米粉黏度曲线差异显著:突变体最高黏度(Peak viscosity, PKV)较野生型出现更早,但其最大值低于野生型。此外,突变体崩解值(Breakdown viscosity, BDV)、消减值(Setback viscosity, SBV)、冷胶黏度(Cool pasting viscosity, CPV)等显著低于野生型(表2)。说明突变影响胚乳淀粉的理化性状。
2.4 FSE4突变影响发育胚乳中淀粉合成相关基因的表达和蛋白积累
提取花后12 d野生型和突变体的胚乳总RNA,反转录为cDNA后进行淀粉合成相关基因的表达量分析(图4)。与野生型相比,突变体中包括AGPase各亚基编码基因,淀粉合酶(SS)各亚基编码基因在内的大部分与淀粉合成相关的基因表达量不同程度下降(图4-A)。提取野生型和突变体成熟种子总蛋白进行免疫印迹杂交实验,结果显示突变体中部分淀粉合成相关蛋白积累量显著降低(图4-B)。说明突变影响突变体中淀粉的合成。
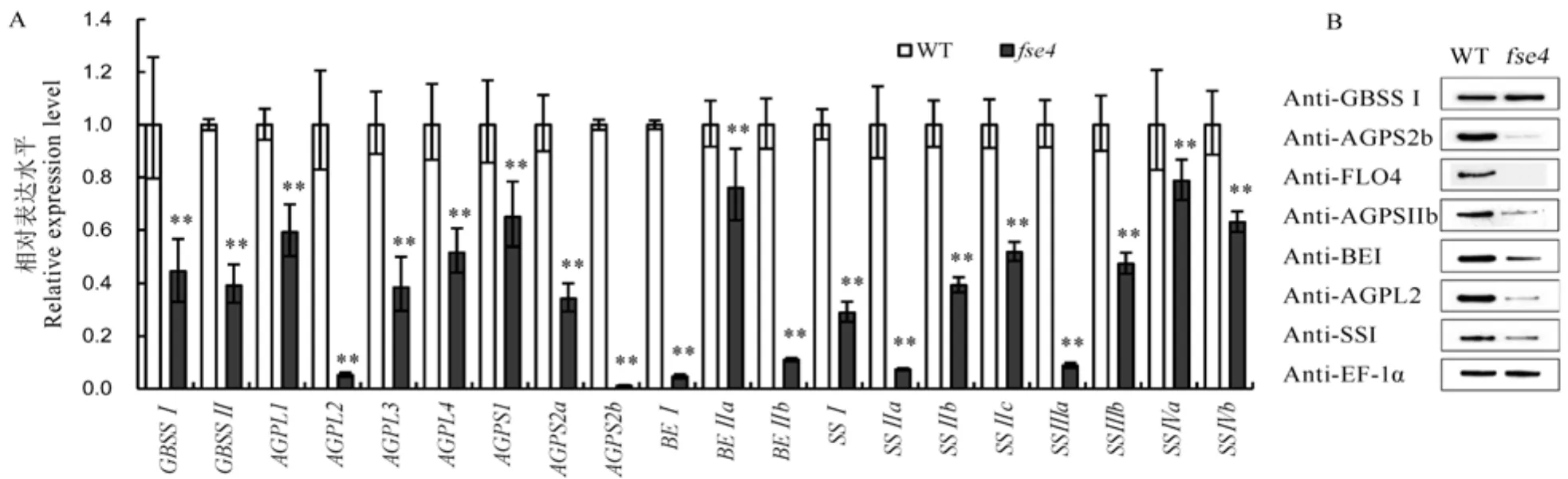
A—花后12 d胚乳的淀粉合成相关基因表达分析(n=3);采用t检验,**P<0.01。以Ubiquitin为内参;B—种子中淀粉合成相关蛋白的积累,以Anti-EF-1α为内参抗体。
Fig. 4. Transcripts and protein levels of starch biosynthesis related genes in WT and.

表3 FSE4遗传分析
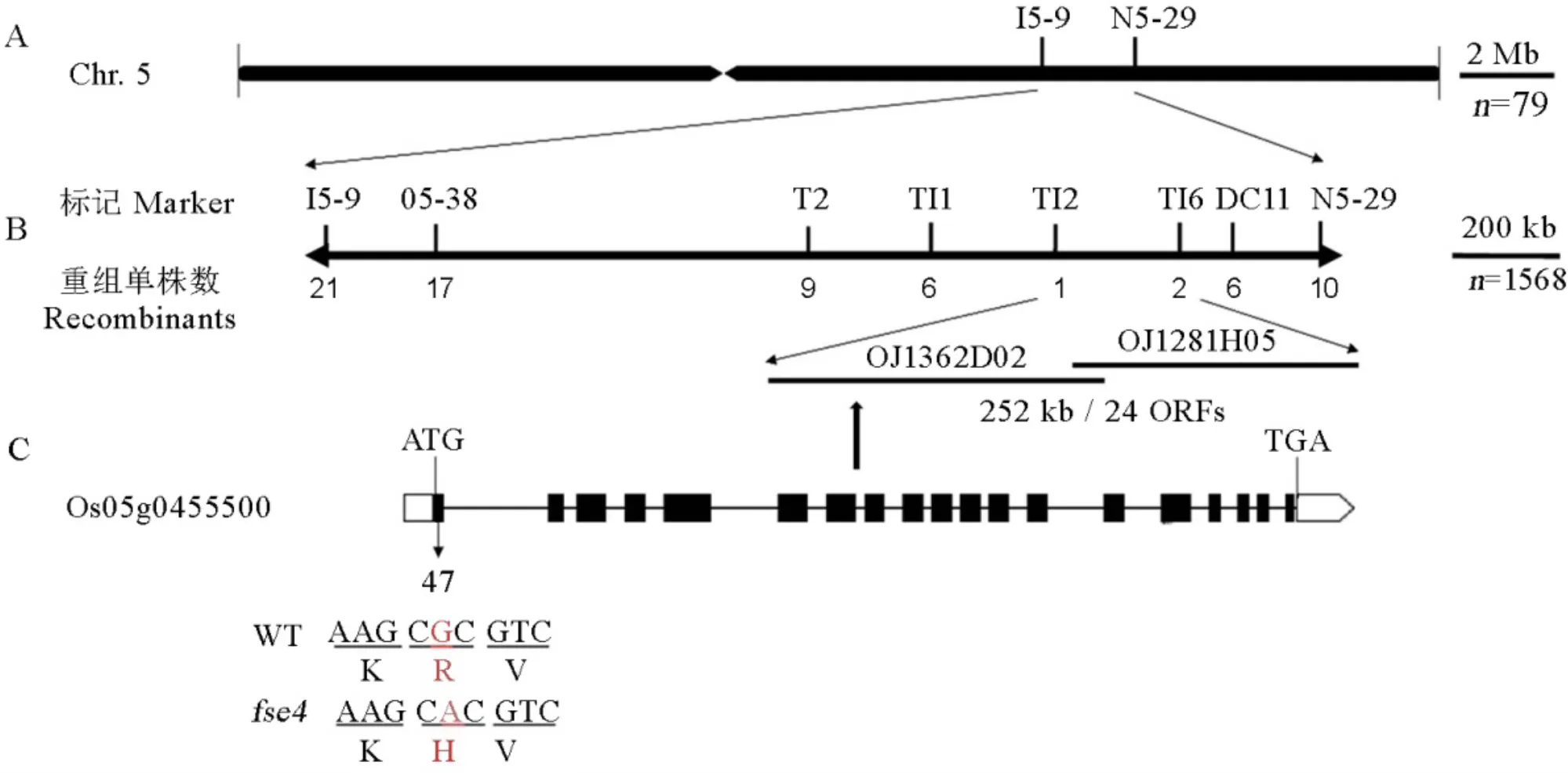
A—FSE4与标记I5-9和N5-29连锁;B—利用1568个隐性个体将FSE4定位到252 kb区间内。该区间内有24个ORFs。C—野生型和fse4在基因Os05g0455500序列第一个外显子上存在单碱基替换。线代表内元,黑盒代表外元,白框分别代表5’和3’非翻译区。
Fig. 5. Map-based cloning of
2.5 FSE4的遗传分析和图位克隆
鉴定杂合型植株的成熟种子分离比,透明饱满种子与粉质皱缩种子的性状分离比符合3∶1(表3),因此突变性状受一对隐性基因控制。
利用杂合植株()与籼稻品种Dular杂交配组,从F2群体中挑选与突变体亲本表型一致的粉质皱缩种子,用于的精细定位。使用79个隐性个体将定位于第5染色体长臂,分子标记I5-9和N5-29之间约13 cM区间内(图5-A)。进一步利用1568个隐性个体将区间限定在TI2和TI6之间约252 kb区间内(图5-B)。通过RiceXPro网站预测,该区间内含有24个开放阅读框(Open reading frames, ORFs)(表4)。测序发现,突变体的基因第一个外显子上出现单碱基替换:编码区的第 47个碱基由G突变为A,导致编码的精氨酸突变为组氨酸。NCBI网站预测,编码Δ1-吡咯啉-5-羧酸合成酶(Delta1-pyrroline-5-carboxylate synthetase,P5CS),基因组长6716 bp,包含19个外显子,18个内含子(图4-C),编码区(Coding sequence, CDS)长2151 bp,编码一个包含716个氨基酸残基的蛋白。根据以上结果,将定为的候选基因。
2.6 OsP5CS及其同源蛋白序列分析
进化树分析显示OsP5CS与小麦、拟南芥、玉米等植物中的P5CS蛋白序列有较高同源性(图6-A),说明OsP5CS蛋白功能上的保守性。突变体中突变发生在第16个氨基酸残基上,序列比对显示该位点在上述物种中高度保守(图6-B)。因此,该保守位点的突变可能是突变体表型产生的原因。
2.7 组织表达分析与亚细胞定位
为探究基因的表达模式,取野生型宁粳3号植株各个组织样品,提取RNA后反转录为cDNA,使用实时荧光定量PCR测定各组织中基因表达量。结果表明,基因在野生型宁粳3号中呈组成性表达,在茎中表达量相对较高(图7-A)。在胚乳发育过程中,基因花后6 d表达量较高,花后18 d表达量达到峰值(图7-B)。为了探究OsP5CS蛋白亚细胞定位,将融合表达载体(GFP为绿色荧光蛋白)高浓度质粒转化入水稻原生质体,过夜培养后激光共聚焦显微镜下观察OsP5CS定位情况。结果显示,OsP5CS-GFP融合蛋白的绿色荧光主要出现在胞质(图7-C)。因此OsP5CS定位于胞质。
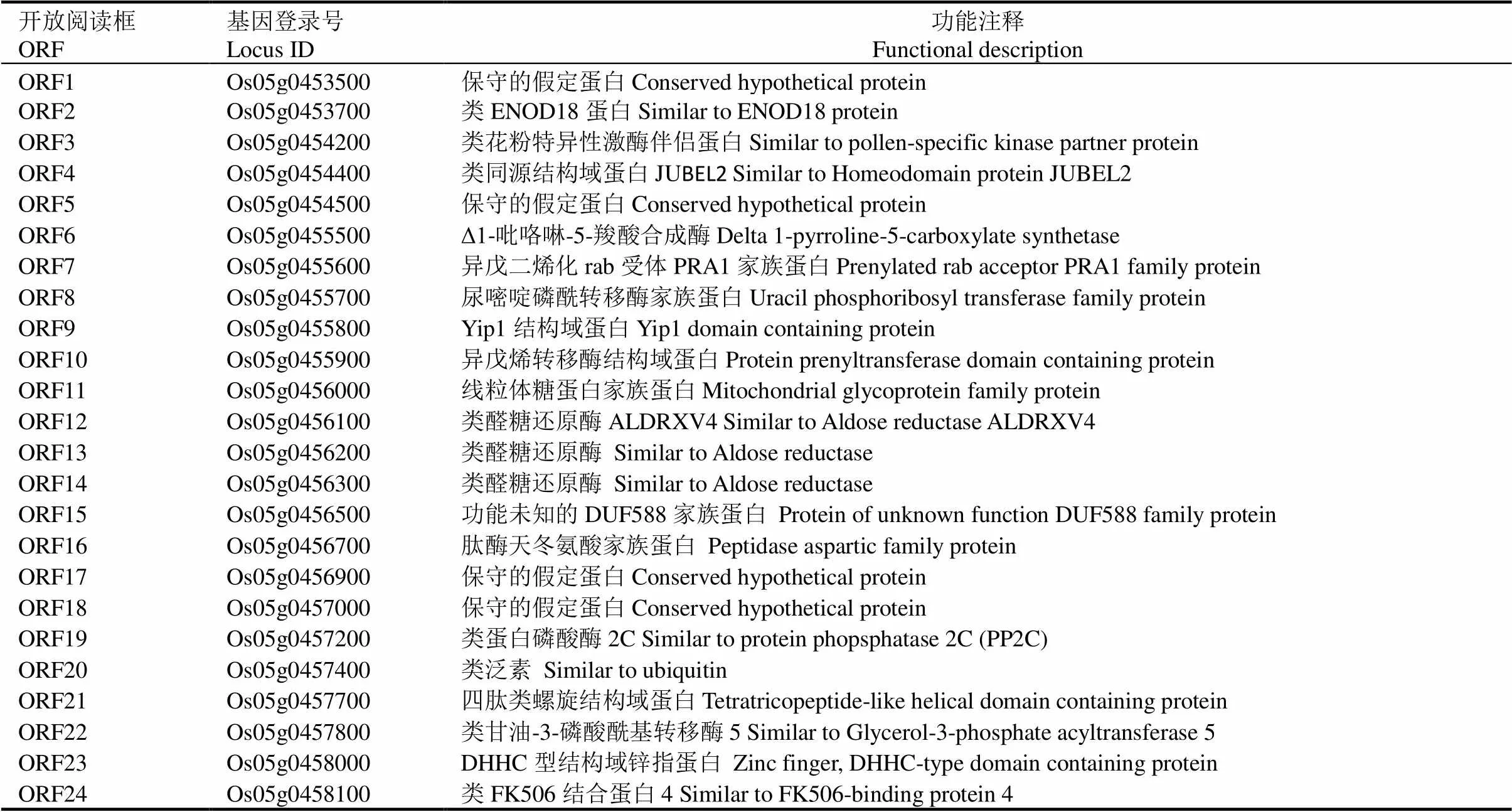
表4 候选区域内的24个开放阅读框
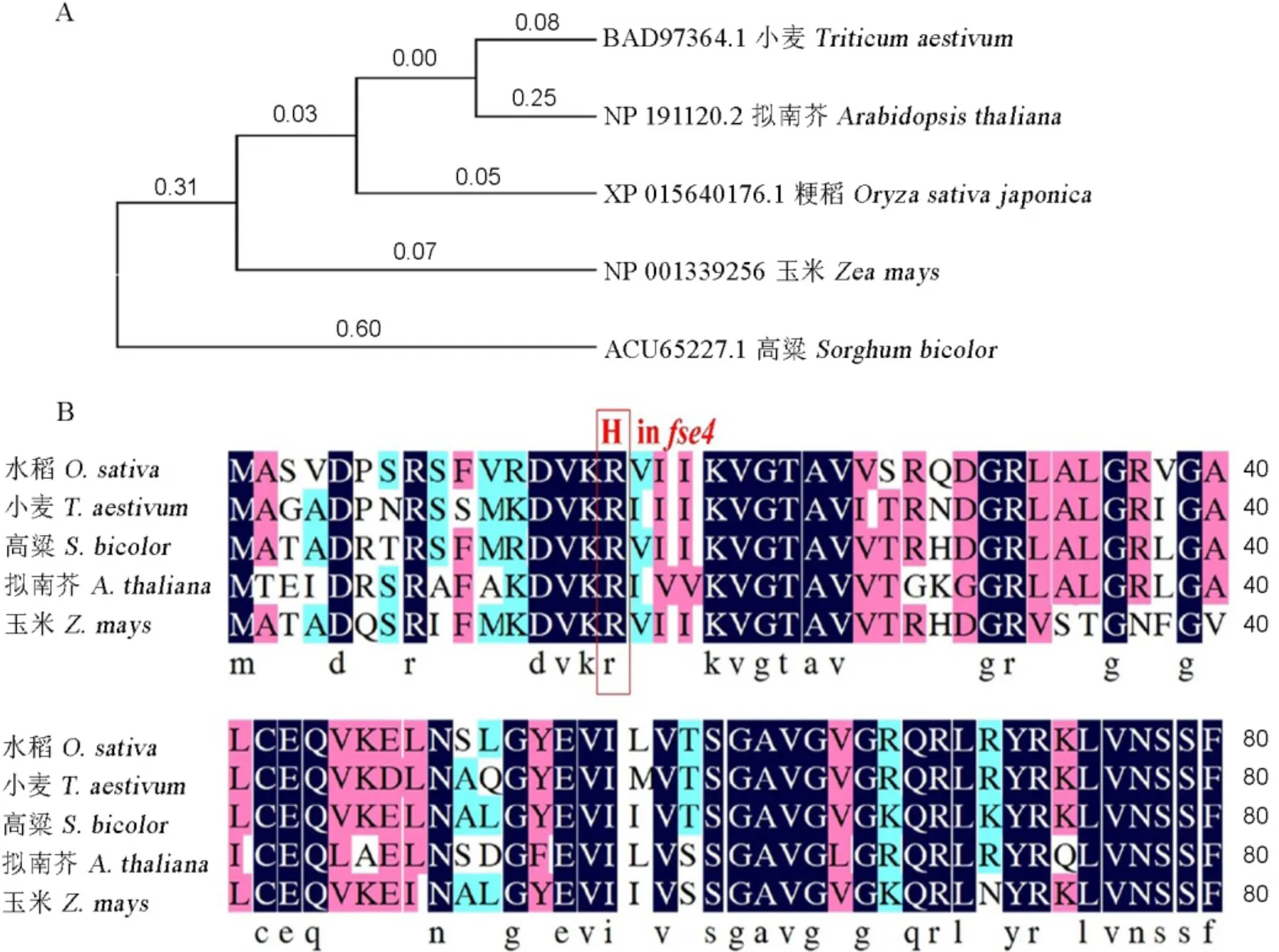
A—P5CS蛋白的进化树分析;B—对水稻、小麦、高粱、拟南芥、玉米中OsP5CS同源蛋白氨基酸序列进行比对,红色字和方框表示fse4突变体中氨基酸残基突变位点,该位点在上述物种中高度保守。GenBank蛋白序列登录号:水稻,XP_015640176.1;小麦,BAD97364.1;高粱,ACU65227.1;拟南芥,NP_191120.2;玉米,NP_001339256。
Fig. 6. Conservation analysis of P5CS and its homologous protein sequences.
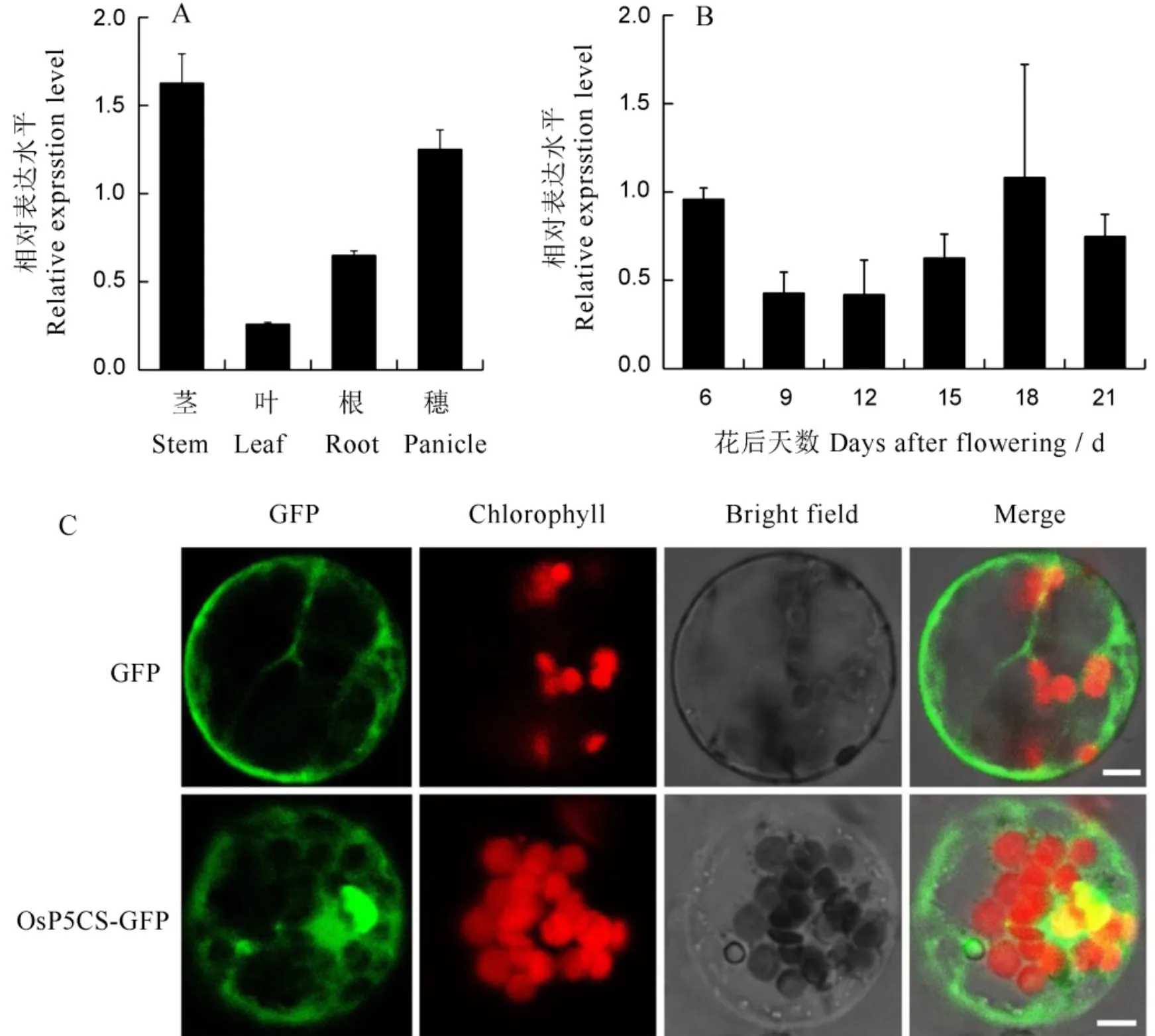
A, B—OsP5CS基因在茎、叶、根、穗等不同组织(A)和不同花后天数胚乳(B)中的表达水平,水稻Ubiquitin为内参基因。C—pAN580-GFP空载体作为对照(上图),融合载体OsP5CS-GFP在水稻原生质体中表达(下图)。标尺为5 μm。
Fig. 7. Tissue expression ofgene and subcellular localization of OsP5CS protein.
2.8 成熟种子中氨基酸含量分析
由于候选基因参与脯氨酸(Pro)的生物合成,所以我们对突变体米粉中水解氨基酸含量进行测定。结果显示,突变体的米粉除天冬氨酸(Asp)、赖氨酸(Lys)、甘氨酸(Gly)外,其他测定氨基酸较野生型均有不同程度下降,如谷氨酸(Glu)和脯氨酸(Pro)含量分别下降32.2%和11.1%(图8-A)。突变体米粉中水解氨基酸总量较野生型降低9.6%(图8-B)。
SDS-PAGE结果显示,野生型与突变体蛋白含量差异明显(图1-C),但二者氨基酸总量却相差不到1%(图3-C、图8-B)。因此我们对米粉中游离氨基酸含量(Free amino acids,FAA)进行测定。结果显示,突变体的米粉中游离脯氨酸、精氨酸(Arg)占FAA总量比例较野生型升高33.3%和265.5%;游离谷氨酸占FAA总量比例较野生型降低57.7%(图8-E)。有文献报道,精氨酸、谷氨酸等氨基酸与植物体内脯氨酸合成相关[32],突变体谷氨酸比例下降,精氨酸比例大幅上升,说明突变后籽粒中脯氨酸合成通路受到严重影响。此外,突变体米粉中各组分游离氨基酸含量均显著上升(图8-C),游离氨基酸总量是其野生型的3.6倍(图8-D)。说明突变影响种子胚乳中氨基酸的合成与代谢。
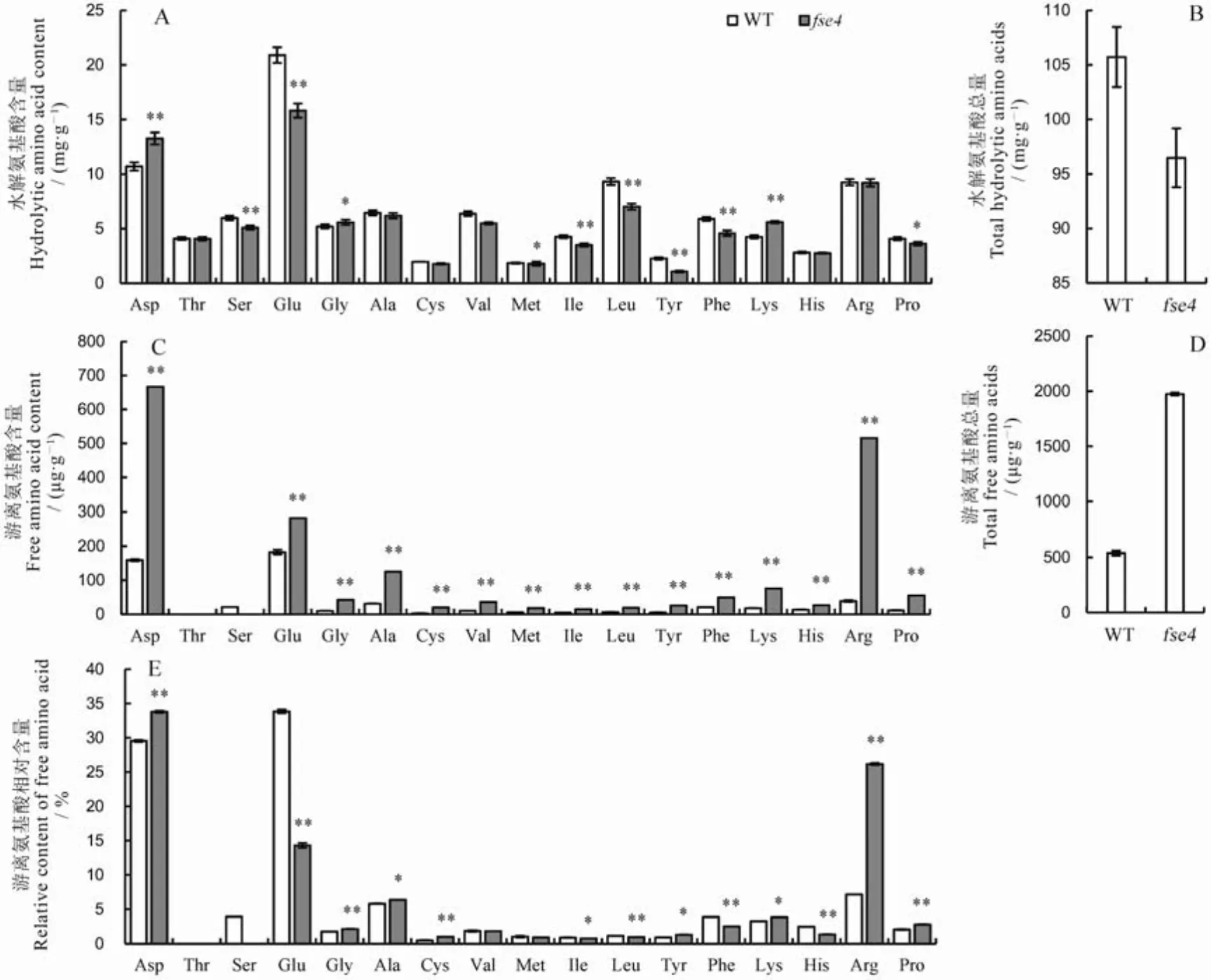
A—野生型与突变体fse4中米粉中水解氨基酸含量;B—野生型与fse4中水解氨基酸总量;C—野生型与fse4米粉中游离氨基酸含量;D—野生型与fse4米粉中游离氨基酸总量;E—野生型与突变体fse4中米粉中游离氨基酸的相对含量; n=3, 取平均值;采用t检验,*P<0.05, ** P<0.01。
Fig. 8. Analysis of amino acid composition in rice flour.
2.9 施加外源脯氨酸后突变体fse4萌发缺陷表型得到部分恢复
OsP5CS是谷氨酸途径中合成脯氨酸的关键限速酶,因此我们施加外源脯氨酸,观察突变体种子萌发的变化。将10粒突变体种子放入10 mmol/L 脯氨酸溶液, 10 d后突变体种子长出1~2 cm的嫩芽,部分种子生出幼根(图9-C, E)。对照组使用蒸馏水发芽,放入同样光照培养箱中,同等条件处理。10 d浸润在蒸馏水中的突变体种子仅能长出不超过5 mm长度嫩芽,大部分种子仅长出1~2 mm芽,种子没有根生成(图9-B, E)。与使用蒸馏水发芽的野生型种子相比,使用10 mmol/L脯氨酸溶液浸泡的野生型种子发芽10 d后生长受到抑制,无根生成,芽长显著降低(图9-A, D)。可见,外源施加10 mmol/L浓度脯氨酸溶液使野生型种子生长受到抑制,但突变体萌发缺陷可以得到部分恢复。
3 讨论
本研究通过对粉质皱缩胚乳突变体的研究,精细定位了基因,并测序发现突变体中发生单个碱基的变异,导致编码的蛋白质第16个氨基酸残基发生突变,该位点在植物中高度保守(图6-B),因此很可能是OsP5CS功能缺陷突变体。OsP5CS的突变很可能造成氨基酸合成和代谢的紊乱,并进一步影响蛋白的合成,这与我们的SDS-PAGE鉴定和氨基酸含量测定结果吻合(图1-C,图8-A、C)。同时,补充外源脯氨酸部分恢复了突变体的缺陷表型(图9-C)。拟南芥缺失突变体同样表现为种子皱缩,胚胎发育异常,种子萌发受到抑制[33],这与突变体胚乳粉质皱缩且胚发育异常的表型极为相似(图1-A~B)。综上所述,我们认为基因突变造成了突变体的表型。
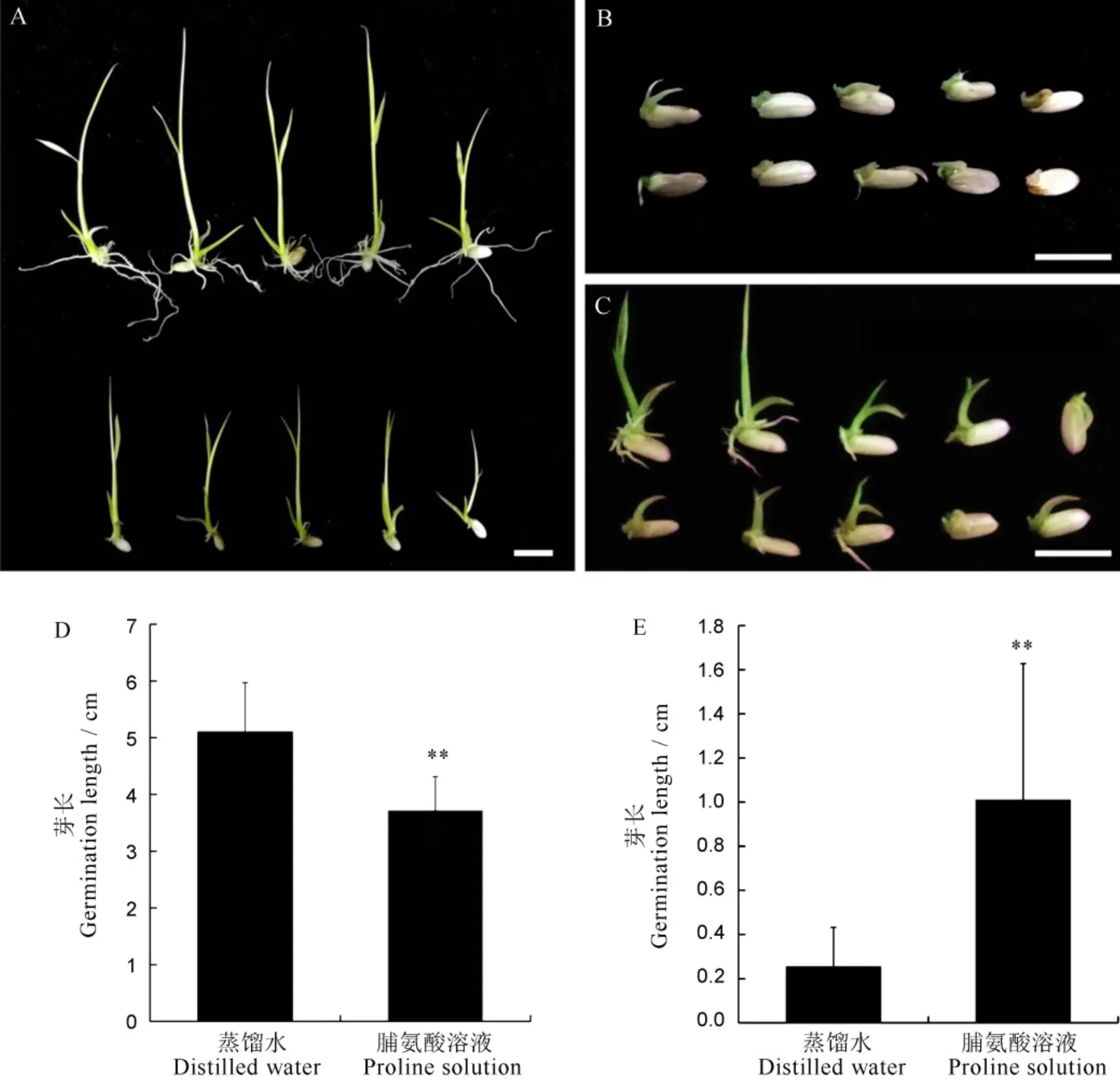
A—野生型宁粳3号在蒸馏水(上)和10 mmol/L脯氨酸溶液(下)中萌发10 d后表型;B, C—突变体fse4在蒸馏水(B)和10 mmol/L脯氨酸溶液(C)中萌发10 d后表型;D, E—野生型宁粳3号(D)和fse4 (E)分别在蒸馏水以及10 mmol/L脯氨酸溶液中萌发10 d后的芽长,n=3,取平均值;采用t检验,**P<0.01。标尺为1 cm。
Fig. 9. Partial recovery of themutant phenotype after application of exogenous proline.
根据起始底物的不同,植物中脯氨酸的合成分为谷氨酸途径和鸟苷酸途径两种[34]。在非胁迫和高氮条件下,由鸟氨酸途径合成脯氨酸;在渗透胁迫和低氮条件下由谷氨酸途径合成脯氨酸[34]。P5CS是谷氨酸途径关键限速酶,在胁迫条件下,基因表达活性增加[35]。精氨酸是鸟苷酸合成的前体氨基酸[36-37]。米粉中游离氨基酸含量测定结果显示,突变体中各组分游离氨基酸含量较野生型宁粳3号显著升高(图8-C),总量达到野生型的3.6倍(图8-D),这也解释了为什么利用凯氏定氮法测定的野生型和突变体蛋白质含量差异并不大,但SDS-PAGE电泳图谱却显示突变体中储藏蛋白积累极显著下降。进一步分析发现,突变体中游离精氨酸较野生型升高265.5%,游离谷氨酸较野生型下降57.7%,游离脯氨酸含量升高33.3%(图8-E)。这表明突变后,植株脯氨酸合成途径变化剧烈,鸟苷酸合成途径增强,谷氨酸合成途径受到抑制。米粉中水解氨基酸含量测定结果显示,突变体谷氨酸含量较野生型下降32.2%,精氨酸含量与野生型相当,脯氨酸含量下降11.1%(图8-A)。这表明由于脯氨酸合成的缺陷,影响了其他氨基酸的合成和代谢,造成胚乳中蛋白的合成存在缺陷,最终导致蛋白质合成的原料(游离氨基酸)大量积累。
前人研究表明,10 mmol/L的外源脯氨酸能够有效缓解苜蓿受到的盐胁迫,更高浓度的脯氨酸则对植株产生毒害[38]。用大于10 mmol/L的外源脯氨酸处理拟南芥幼苗,植株生长受到明显抑制,根长变短,线粒体和叶绿体结构改变,诱发细胞死亡[39]。本研究中施加10 mmol/L外源脯氨酸时,野生型种子发育迟缓,根生长受到抑制(图9-A),而突变体胚发育缺陷表型得到部分恢复,长出1~2 cm嫩芽,部分种子生出幼根(图9-C, E)。表明突变体体内脯氨酸不足与其胚发育缺陷直接相关。
我们的研究表明脯氨酸的合成缺陷导致胚乳和胚的发育形成一系列缺陷,但脯氨酸合成如何影响胚乳发育以及淀粉的合成与积累还需要进一步研究。
谢辞:感谢农业部长江中下游粳稻生物学与遗传育种重点实验室、江苏省现代作物生产中心和江苏省植物基因工程技术研究中心对本研究给予的资助。
[1] 谢华安, 张建福, 王乌齐,郑家团, 黄庭旭. 超级稻育种实践和前景. 分子植物育种, 2006, 4(S3): 4-10.
Xie H A, Zhang J F, Wang W Q, Zheng J T, Huang T X. Practice and prospect on breeding of super-hybridization rice in China., 2006, 4(3S): 4-10. (in Chinese with English abstract)
[2] 武小金, 尹华奇. 杂交水稻品质改良的遗传基础和途径. 杂交水稻, 1994(2): 5-8.
Wu X J, Yin H Q. Genetic basis of and approach to grain quality improvement in hybrid rice.,1994(2): 5-8. (in Chinese with English abstract)
[3] 卢毅, 路兴花, 张青峰, 余建国, 肖雄雄, 庞林江, 成纪予. 稻米直链淀粉与米饭物性及食味品质的关联特征研究.食品科技, 2018, 43(10): 219-223.
Lu Y, Lu X H, Zhang Q F, Yu J G, Xiao X X, Pang L J, Cheng J Y. Correlation of rice amylose with physical properties and taste quality of rice., 2018, 43(10): 219-223. (in Chinese with English abstract)
[4] Seferoglu A B, Koper K, Can F B, Cevahir G, Kavalir I H. Enhanced heterotetrameric assembly of potato ADP-Glucose pyrophosphorylase using reverse genetics., 2014, 55(8): 1473-1483.
[5] Dian W, Jiang H, Chen Q, Liu F, Wu P. Cloning and characterization of the granule-boundgene in rice: gene expression is regulated by the nitrogen level, sugar and circadian rhythm., 2003, 218(2): 261-268.
[6] 陈雅玲, 包劲松. 水稻胚乳淀粉合成相关酶的结构、功能及其互作研究进展. 中国水稻科学, 2017, 31(1): 1-12.
Chen Y L, Bao J S. Progress in structures, function and interactions of starch synthesis related enzymes in rice endosperm., 2017, 31(1): 1-12. (in Chinese with English abstract)
[7] 潘鹏屹, 朱建平, 王云龙, 郝媛媛, 蔡跃, 张文伟, 江玲, 王益华, 万建民. 水稻粉质胚乳突变体的表型分析及基因克隆. 中国水稻科学, 2016, 30(5): 447-457.
Pan P Y, Zhu J P, Wang Y L, Hao Y Y, Cai Y, Zhang W W, Wang Y H, Wan J M.Phenotyping and gene cloning of a floury endosperm mutantin rice., 2016, 30(5): 447-457.(in Chinese with English abstract)
[8] 方鹏飞, 李三峰, 焦桂爱, 谢黎红, 胡培松, 魏祥进, 唐绍清. 水稻粉质胚乳突变体的理化性质及基因定位. 中国水稻科学, 2014, 28(5): 447-457.
Fang P F, Li S F, Jiao G A, Xie L H, Hu P S, Wei X J, Tang S Q. Physicochemical property analysis and gene mapping of a floury endosperm mutantin rice., 2014, 28(5): 447-457.(in Chinese with English abstract)
[9] Kaushik R P, Khush G S. Genetic analysis of endosperm mutants in rice (L.)., 1991, 83(2): 146-152.
[10] She K, Kusano H, Koizumi K, Yamakawa H, Hakata M, Imamura T, Fukuda M, Naito N, Tsurumaki Y, Yaeshima M, Tsuge T, Matsumoto K, Kudoh M, Itoh E, Kikuchi S, Kishimoto N, Yazaki J, Ando T, Yano M, Aoyama T, Sasaki T, Satoh H, Shimada H. A novel factoris involved in regulation of rice grain size and starch quality., 2010, 22(10): 3280-3294.
[11] Kang H, Park S, Matsuoka M, An G. White-core endospermin rice is generated by knockout mutations in the C4-type pyruvate orthophosphate dikinase gene ()., 2005, 42(6): 901-911.
[12] Peng C, Wang Y, Liu F, Ren Y, Zhou K N, Lü J, Zheng M, Zhao S L, Zhang L, Wang C M, Jiang L, Zhang X, Guo X P, Bao Y Q, Wan J M.encodes a CBM48 domain-containing protein involved in compound granule formation and starch synthesis in rice endosperm., 2014, 77(6): 917-930.
[13] Zhang L, Ren Y, Lu B, Yang C Y, Feng Z M, Liu Z, Chen J, Ma W W, Wang Y, Yu X W, Wang Y L, Zhang W W, Wang Y H, Liu S J, Wu F Q, Zhang X, Guo X P, Bao Y Q, Jiang L, Wan J M.encodes a regulator of starch synthesis and amyloplast development essential for peripheral endosperm development in rice., 2016, 67(3): 633-647.
[14] Wu M M, Ren Y L, Cai M H, Wang Y L, Zhu S S, Zhu J P, Hao Y Y, Teng X, Zhu X P, Jing R N, Zhang H, Zhong M S, Wang Y F, Lei C L, Zhang X, Guo X P, Cheng Z J, Lin Q B, Wang J, Jiang L, Bao Y Q, Wang Y H, Wan J M. Riceencodes a pentatricopeptide repeat protein that is essential for the trans-splicing of mitochondrialintron 1 and endosperm development., 2019, 233: 736-750.
[15] Teng X, Zhong M S, Zhu X P, Wang C M, Ren Y L, Wang Y L, Zhang H, Jiang L, Wang D, Hao Y Y, Wu M M, Zhu J P, Zhang X, Guo X P, Wang Y H, Wan J M.encoding a NAD-dependent cytosolic malate dehydrogenase plays an important role in starch synthesis and seed development in rice., 2019, 17: 1914-1927.
[16] Long W, Wang Y, Zhu S,Jing W, Wang Y H, Ren Y L, Tian Y L, Liu S J, Liu X, Chen L M, Wang D, Zhong M S, Zhang Y Y, Hu T T, Zhu J P, Hao Y Y, Zhu X P, Zhang W W, Wang C M, Zhang W H, Wan J M.connects phospholipid metabolism and amyloplast development in rice., 2018, 177(2): 698-712.
[17] 李景芳, 田云录, 刘喜, 刘世家, 陈亮明, 江玲, 张文伟, 徐大勇, 王益华, 万建民. 鸟苷酸激酶OsGK1对水稻种子发育至关重要. 中国水稻科学, 2018, 32(5): 415-426.
Li J F, Tian Y L, Liu X, Liu S J, Chen L M, Jiang L, Zhang W W, Xu D Y, Wang Y H, Wan J M.The guanylate kinaseOsGK1is essential for seed development in rice.,2018, 32(5): 415-426. (in Chinese with English abstract)
[18] 于艳芳, 刘喜, 田云录, 刘世家, 王云龙, 张文伟, 江玲, 王益华, 万建民. 水稻粉质胚乳突变体的表型分析及基因定位. 中国农业科学, 2018, 51(11): 2023-2037.
Yu Y F, Liu X, Tian Y L, Liu S J, Wang Y L, Zhang W W,Jiang L, Wang Y H, Wan J M. Phenotypic analysis and gene mapping of a floury and shrunken endosperm mutantin rice., 2018, 51(11): 2023-2037. (in Chinese with English abstract)
[19] Zhang C S, Lu Q, Verma D P S. Removal of feedback inhibition of Δ1-pyrroline-5-carboxylate synthetase, a bifunctional enzyme catalyzing the first two steps of proline biosynthesis in plants.1995, 270(35): 20491-20496.
[20] Lehmann S, Funck D, Szabados L,Rentsch D. Proline metabolism and transport in plant development., 2010, 39(4): 949-962.
[21] Hu C, Delauney A J, Verma D. Bifunctional enzyme (Delta-1-pyrroline-5-carboxylate synthetase) catalyzes the 1st 2 steps in proline biosynthesis in plants., 1992, 89(19): 9354-9358.
[22] Kim G, Nam Y. A novel Δ1-pyrroline-5-carboxylate synthetase gene of medicago truncatula plays a predominant role in stress-induced proline accumulation during symbiotic nitrogen fixation., 2013, 170(3): 291-302.
[23] Zang D, Wang C, Ji X, Wang Y C. Tamarix hispida zinc finger protein ThZFP1 participates in salt and osmotic stress tolerance by increasing proline content and SOD and POD activities., 2015, 235: 111-121.
[24] Su M, Li X, Ma X, Peng X J, Zhao A G, Cheng L Q, Chen S Y, Liu G S. Cloning two P5CS genes from bioenergy sorghum and their expression profiles under abiotic stresses and MeJA treatmen., 2011, 181(6SI): 652-659.
[25] Chu H M, Nguyen T T H, Chu H L, Le V S, Chu H H. Characteristics of the gene encoding pyrroline-5- carboxylate synthase (P5CS) in Vietnamese soybean cultivars (L. Merrill)//Proceedings of International Conference on Biology, Environment and Chemistry, 2011: 319-323.
[26] Chen J B, Yang J W, Zhang Z Y, Feng X F, Wang S M. Twogenes from common bean exhibiting different tolerance to salt stress in transgenic., 2013, 92(3): 461-469.
[27] Kim D, Shibato J, Agrawl G K, Fujihara S, Iwahashi H, Kim du H, Shim IeS, Rakwal R. Gene transcription in the leaves of rice undergoing salt-induced morphological changes (L.)., 2007, 24(1): 45-59.
[28] Wan P, Fu K, Lu F, Guo W C, Li G Q. A putative Δ1-pyrroline-5-carboxylate synthetase involved in the biosynthesis of proline and arginine in., 2014, 71: 105-113.
[29] Bicknell L S, Pitt J, Aftimos S, Ramadas R, Maw M A, Robertso S P. A missense mutation in, encoding Delta 1-pyrroline-5-carboxylate synthase (P5CS), causes an autosomal recessive neurocutaneous syndrome., 2008, 16(10): 1176-1186.
[30] 易健明, 屈武斌, 张成岗. 实时荧光定量PCR的数据分析方法. 生物技术通讯, 2015, 26(1): 140-145.
Yi J M, Qu W B, Zhang C G. Date analysis methods of real-time fluorescent quantitative PCR., 2015, 26(1): 140-145. (in Chinese with English abstract)
[31] Wang Y, Wang C, Zheng M,Lyu J, Xu Y, Li X H, Niu M, Long W H, Wang D, Wang H Y, Terzaghi W, Wang Y H, Wan J M., a Val-tRNA synthetase regulating chloroplast ribosome biogenesis in rice, is essential for early chloroplast development., 2016, 170(4): 2110-2123.
[32] Hong Z L, Karuna L, Zhang Z M, Verma D. Removal of feedback inhibition of 1-pyrroline-5-carboxylate synthetase results in increased proline., 2000, 122(4): 1129-1136.
[33] Székely G, Ábrahám E, Cséplő A, Rigó G, Zsigmond L, Csiszár J, Ayaydin F, Strizhov N, Jásik J, Schmelzer E, Koncz C, Szabados L. Duplicatedgenes ofplay distinct roles in stress regulation and developmental control of proline biosynthesis., 2008, 53(1): 11-28.
[34] Deauney A J, Verma D. Proline biosynthesis and osmoregulation in plants., 1993 4(2): 215-223.
[35] Siripornadulsil S, Traina S, Verma D, Richard T. Sayre molecular mechanisms of proline-mediated tolerance to toxic heavy metals in transgenic microalgae., 2002, 14(11): 2837-2847.
[36] Makryaleas K, Drauz K, Bommarius A. Method for the preparation of-arginine and-ornithine., 1997(5): 591-613.
[37] Kurhajec A. Orgithine aynthesis.1961(3): 168-588.
[38] Ehsanpour A A, Fatahian N. Effects of salt and proline oncallus., 2003, 73(1): 53-56.
[39] Trovato M, Mattioli R, Costantino P. Multiple roles of proline in plant stress tolerance and development., 2008, 19(4): 325-346.
Phenotypic Analysis and Gene Cloning of Rice Floury Endosperm Mutant
DU Yimo, PAN Tian, TIAN Yunlu, LIU Shijia, LIU Xi, JIANG Ling, ZHANG Wenwei, WANG Yihua*,WAN Jianmin
(,,,,;Corresponding author, E-mail: yihuawang@njau.edu.cn)
Starch is the main energy reserve of rice endosperm. The biosynthesis of starch is complex, requiring a large number of synthetic enzymes and regulators. Screening rice endosperm defective mutants and cloning the underlying geneswill lay theoretical basis for starch biosynthesis and its regulation.A stable genetic floury and shrunken endosperm mutant termed as() were obtained from the mutant library of Ningjing 3 (WT), which was induced by N-methyl-N-nitrosourea (MNU). An F2mapping population was generated by crossing themutant with Dular (anrice variety) and the gene was finally isolated. The floury seeds segregated from theheterozygous plants were used to observe the morphological features, and the physicochemical properties of the brown rice flour were analyzed. The endosperm structure was observed with a scanning electron microscopy by the semi-thin section technology. The expression of starch synthesis related genes during grain filling was determined by qRT-PCR; Immunoblotting was used to detect the accumulation of proteins related to starch synthesis.The amino acids contents of each mature endosperm were determined with the fully automatic amino acid analyzer.The 1000-grain weight and grain size were significantly reduced in. Compared with WT, the contents of total starch, amylose and total protein were significantly lower in, while the lipid content was significantly higher. The starch viscosity, breakdown viscosity and setback viscosity of themutant were lower than WT. The endosperm of the mutant had many single dispersed starch granules with large spaces between each other. Using 1568 recessive individuals,was narrowed down to a 252 kb region.Sequencing revealed a single base substitution in the first exon of the delta 1-pyrroline-5-carboxylate synthetase (P5CS), resulting in a conserved amino acid variation.Most of the genes related to starch synthesis were downregulated inand the protein accumulation related to starch synthase were reduced. The contents of various amino acids inrice flour were increased or decreased, the total free amino acids contents inseeds was 2.6 times higher than those in WT. Exogenous proline was applied during the germination ofseeds, and the embryonic lethal phenotype was partially recovered.encode the key rate-limiting enzyme P5CS of proline synthesis, which plays an important role in the biosynthesis and metabolism of amino acids in endosperm and affects the accumulation of starch.
floury endosperm; starch synthesis; gene cloning; delta 1-pyrroline-5-carboxylate synthetase;amino acid synthesis and metabolism
Q343.5; S511.032
A
1001-7216(2019)06-0499-14
10.16819/j.1001-7216.2019. 9058
2019-05-27;
2019-06-18。
国家转基因生物新品种培育重大专项(2016ZX08001006);国家重点研发计划资助项目(2016YFD0100101-08);江苏省重点研发项目(BE2018388, BE2017368)。
