籼稻背景下抑制不同ALK等位基因表达对稻米品质的影响
2019-11-18陈专专李先锋仲敏葛家奇范晓磊张昌泉刘巧泉
陈专专 李先锋 仲敏 葛家奇 范晓磊, 2 张昌泉, 2 刘巧泉, 2, *
籼稻背景下抑制不同等位基因表达对稻米品质的影响
陈专专1, 2, #李先锋1, #仲敏1葛家奇1范晓磊1, 2张昌泉1, 2刘巧泉1, 2, *
(1扬州大学 农学院 植物功能基因组学教育部重点实验室/江苏省作物基因组学和分子育种重点实验室,江苏 扬州 225009;2扬州大学 江苏省粮食作物现代产业技术协同创新中心,江苏 扬州 225009;#共同第一作者;*通讯联系人, E-mail: qqliu@yzu.edu.cn)
稻米糊化温度是影响稻米品质的重要指标,该性状受主效基因/调控,基因具有多个复等位基因,本研究旨在通过RNAi技术明确籼稻亚种中两个不同等位基因的效应。以分别含有ALK和ALK等位基因的高糊化温度品种珍汕97B和低糊化温度品种龙特甫B为试验材料,使用RNAi技术构建表达下调的转基因株系,通过对其稻米理化品质的测定来明确不同等位基因表达下调对稻米品质的影响。对不同转基因水稻目的基因的表达分析显示本研究中转基因株系的基因受到了不同程度的干扰。重点分析了不同RNAi株系稻米的糊化温度,结果表明珍汕97B的RNAi转基因稻米的糊化温度极显著降低,而在低糊化温度品种龙特甫B背景中下调表达基因后对糊化温度的影响较小;转基因株系与未转化亲本相比,米粉的起始糊化温度都显著降低,表现为提前糊化;在珍汕97B背景下干扰系的峰值温度与未转化亲本相比极显著降低,而在龙特甫背景下米粉的峰值温度与未转化对照相比显著降低。对不同转基因系的理化品质分析表明,下调表达植株稻米的表观直链淀粉含量显著增加,下调表达后会引起米粉峰值黏度和崩解值的改变。高糊化温度品种珍汕97B干扰系与未转化对照相比胶稠度呈现极显著性差异,而低糊化温度品种龙特甫干扰系的胶稠度与未转化对照相比没有差异。下调表达等位基因对稻米理化品质产生显著影响,并且干扰不同等位基因的效应存在明显差异,即籼稻中的两个等位基因的效应存在显著差异。
水稻;等位基因;RNA干扰;糊化温度;稻米品质
水稻是世界上近一半人口的主食。随着人们生活水平的不断提高和水稻单产的不断增加,优质稻米已经成为引导消费和品种改良的首要目标[1-4],其中稻米的蒸煮食味品质是当前品质改良育种的关键,一般通过稻米的理化特性包括直链淀粉含量、糊化温度、胶稠度以及淀粉黏滞性等指标对蒸煮食味品质进行综合评价。
糊化温度作为评价稻米蒸煮食味品质的主要指标,是指大约90%淀粉颗粒吸热膨胀,自然的晶体结构被破坏和双折射性丧失,发生非均质改变的不可逆过程时所需要的临界温度[4]。根据糊化温度的不同,可将稻米分为高、中、低糊化类型。其中,中等以及较低糊化温度的稻米蒸煮后米饭质地较软且食味特性较好,在市场上广受消费者欢迎。迄今为止,稻米糊化温度的形成在遗传和受环境影响方面已有广泛研究[3, 5, 6]。尽管稻米糊化温度是一个在较大范围内表现出持续变化的数量性状,但其主要由基因编码的可溶性淀粉合成酶SSⅡ-3控制[7-11]。基因在栽培稻中存在多种等位变异类型,是导致不同水稻品种之间糊化温度差异,进而影响稻米蒸煮食味品质的主要原因[12]。基因的定位和克隆最早由高振宇等[8]完成,前人通过分析不同水稻品种间基因的序列差异,证明了基因序列差异引起的氨基酸改变会引起SSⅡ-3酶活性改变,从而影响支链淀粉的中等长度分支链的合成,使晶体层结构改变,最终表现为糊化温度的差异[8, 13-14]。
多个研究显示,位于基因第8外显子的3个单核苷酸差异(SNP)对功能和淀粉的糊化特性至关重要[15-18]。根据这3个SNP,可将栽培品种中的基因分为A-GC,G-TT和G-GC三种单倍型。其中的G-GC型等位基因(简称为ALK)控制稻米的高糊化温度,A-GC(简称为ALK)和 G-TT(简称为ALK)控制低糊化温度。由于ALK(A-GC)主要存在于粳稻中[18-21],而ALK(G-TT)和ALK(G-GC)主要存在于籼稻中。因此,本研究选取了籼稻背景下低糊化温度的龙特甫B(携ALK基因)和高糊化温度的品种珍汕97B(携ALK基因)为受体品种,利用RNAi技术下调表达等位基因,以明确下调表达籼稻中两个等位基因对稻米品质的影响。
1 材料与方法
1.1 水稻材料和种植方法
用于本研究的两个籼稻品种(L. subsp.)为龙特甫B和珍汕97B。两个籼稻品种分别含有不同的等位基因,稻米的糊化特性差异较大,含有ALK(G-TT)的龙特甫B对应低糊化温度,含有ALK(G-GC)的珍汕97B对应高糊化温度。两个受体品种龙特甫B和珍汕97B稻米分别为低糊化温度和高糊化温度品种,两者的等位基因类型可通过引物4342(GC/TT)区分。如图1A,两个品种中的基因型不同,龙特甫B中表现为G-TT的ALK型,而珍汕97B中表现为G-GC的ALK型。所用水稻材料在扬州大学农学院作物遗传育种实验田或海南三亚育种基地种植(加代),按常规方法进行栽培管理。用于品质测定的材料均种植于江苏省扬州大学农学院作物遗传育种实验田。
1.2 载体构建与水稻转化
以来自日本晴 RNA所合成的第一链cDNA为模板,以ALK-5和ALK-3为引物(表1)扩增基因编码区片段;将PCR扩增片段连入含有H Ⅰ/Ⅰ和H Ⅰ/Ⅰ双酶切位点的p1022载体中,形成同时含有正向和反向基因片段的结构。将整个含有正反向重复的片段连入含有水稻谷蛋白基因Gt1启动子(胚乳特异性表达)的p3002载体中,构建-RNAi载体(图1-B)。
利用农杆菌介导的遗传转化方式[22]将以上载体导入籼稻品种龙特甫B中,获得L-ALK- RNAi转基因材料,选取3个转基因纯合系L-ALK-RNAi-1、-2和-3用于后续品质分析。以L-ALK-RNAi-2转基因材料为供体,与珍汕97B杂交,后自交。通过分子标记辅助选择筛选杂交后代,在F3代获得同时携带有ALK等位基因和ALK-RNAi干扰结构的转基因材料,选取3个纯合转基因系Z-ALK-RNAi-2-1、Z-ALK-RNAi-2-2和Z-ALK-RNAi-2-3用于后续的品质分析。
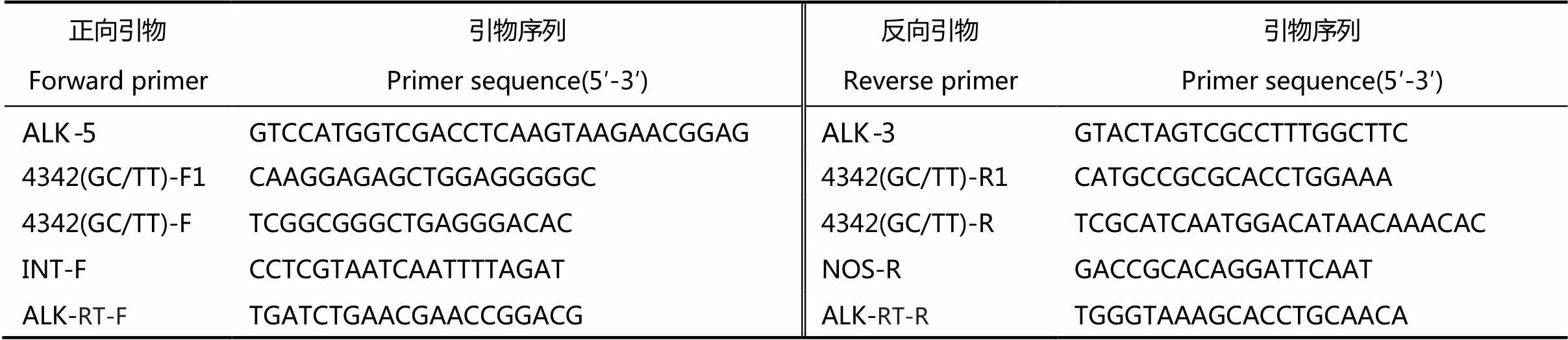
表1 本研究所用的PCR引物
1.3 基因型鉴定
水稻基因组DNA抽提按Murray等[23]的方法进行。等位变异位点用四引物4342进行基因型鉴定,RNAi株系的基因型用引物INT-F和NOS-R进行PCR验证,所有引物序列列于表1。
1.4 ALK基因的表达量分析
利用总RNA提取试剂盒(TIANGEN)提取水稻花后15 d种子胚乳中的总RNA并纯化定量,每个样品取3 µg预处理后的RNA,用含有去除基因组DNA进行实时荧光定量PCR的专用反转录试剂盒(Prime script RT reagent kit with gDNA Eraser,TaKaRa)除去RNA样品中的基因组DNA后对RNA样品进行反转录,获得第一链cDNA。随后用实时荧光定量PCR的专用试剂盒(TaKaRa)和实时荧光定量PCR仪(CFX96 Touch Real-time PCR detection system, Bio-Rad)进行实时定量PCR分析。基因的表达量分析所用引物为ALK-RT-F和ALK-RT-R(表1)。
1.5 稻米理化品质测定
米粉的制备以及直链淀粉含量、胶稠度、碱消值等指标的测定采用农业部颁布的标准《米质测定方法》(NY147−1988)。米粉热力学特性参照Zhang等[24]的方法测定,用带有配套分析软件的差示扫描量热仪DSC 200 F3(德国耐驰公司)进行作图分析。淀粉的黏滞性采用3-D型淀粉黏滞性快速测定仪(Newport Scientific,澳大利亚)进行测定,配套分析软件为TCW(Thermal Cycle for Windows)。粗蛋白含量利用凯氏定氮法测定。
1.6 精米食味值的测定
采用RCTA-11A米饭食味计(日本佐竹)测定食味值,称取整精米20.0 g,使用配套的淘米用具在清水下清洗,清洗完毕转移至含有40 mL 蒸馏水的铝制容器中,用电饭锅蒸煮30 min后室温冷却平衡20 min,称取8.0 g冷却好的米饭,装入金属环内,正反方向各压10 s,置于食味仪上测得食味值。
1.7 淀粉链长分布的测定
采用高效阴离子交换色谱法测定支链淀粉的链长分布,样品制备参考Zhu等[25]的方法。
1.8 数据分析
数据采用Microsoft Excel 2016以及SPSS 19.0 软件进行方差分析;采用Adobe Illustrator制图;新复极差法进行多重比较检验差异显著性。
2 结果与分析
2.1 转基因水稻植株的获得及其表达分析
通过分子标记辅助选择筛选杂交后代,在F3代获得同时携带有ALK等位基因和RNAi干扰结构的三份转基因株系Z-ALK-RNAi-2-1、Z-ALK- RNAi-2-2和Z-ALK-RNAi-2-3,其生育期与珍汕97B基本一致。以RNAi载体中的引物INT-F和NOS-R(引物位置如图1-B)对RNAi干扰株系进行PCR扩增,所有转基因水稻植株中都能扩增出大小为534 bp的目的片段(图1-C)。
由于基因主要在水稻胚乳中表达,为验证RNAi株系中对表达的干扰效果,我们利用荧光实时RT-PCR技术对花后15 d胚乳中基因的表达量进行分析(图1-D)。不论是高糊化温度品种珍汕97B背景还是低糊化温度品种龙特甫背景,-RNAi转基因材料的表达量都大幅度下降,表明RNA干扰结构确实导入水稻体内并发挥了作用。
2.2 ALK-RNAi转基因稻米的热力学特性
干扰基因表达后,与各自未转化亲本相比,碱消值显著上升,糊化温度明显下降(图2)。结合表2来看,在含有ALK等位基因的龙特甫B背景下,干扰株系稻米糊化温度T变化较小,仅下降了0.7℃~1.1℃;在含有ALK等位基因的珍汕97B背景下,干扰株系稻米糊化温度变化较大,相比亲本极显著下降了5.8℃~6.8℃。各干扰材料的起始糊化温度和终止糊化温度也呈现出相同的规律,表现为高糊化温度品种珍汕97B中干扰等位基因对糊化温度的效应较强,而低糊化温度品种龙特甫中干扰等位基因对糊化温度的效应较弱。
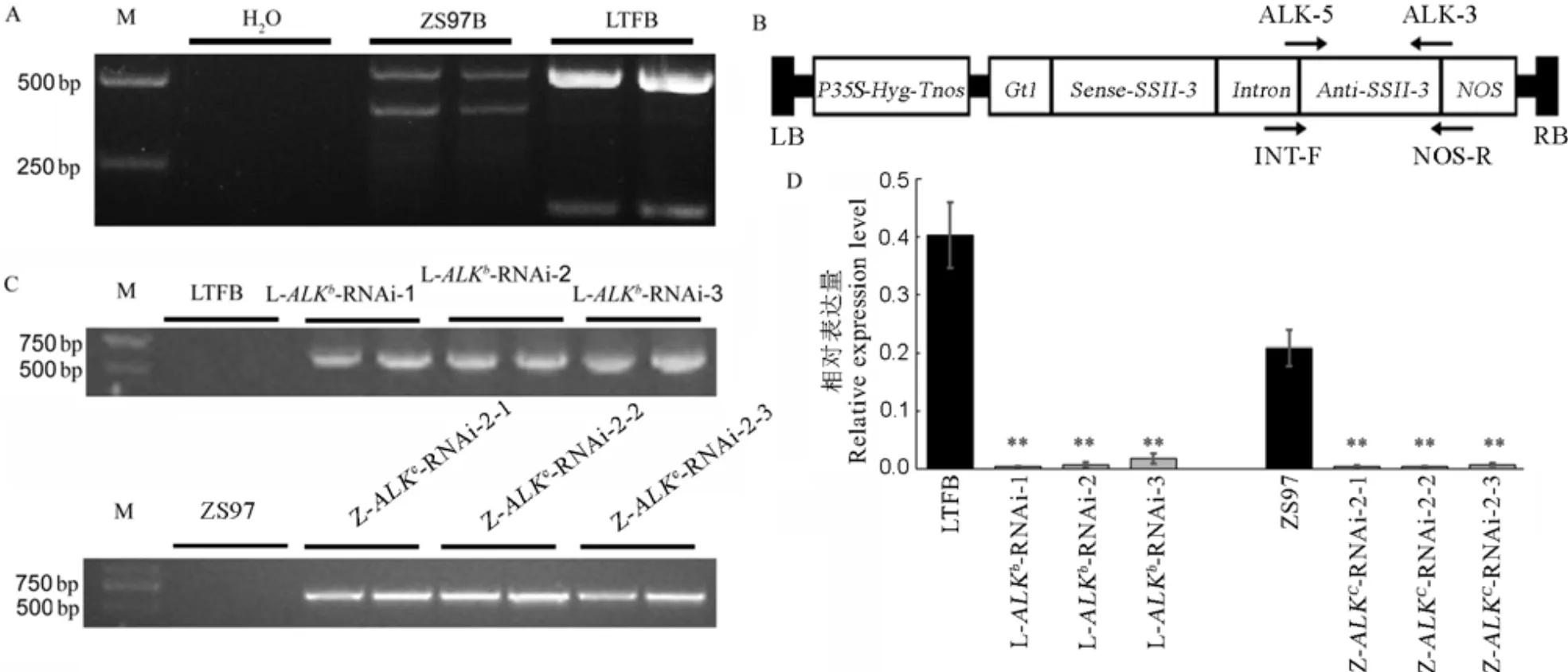
A−用引物4342(GC/TT)鉴定亲本对照龙特甫B(LTFB)和珍汕97B(ZS97B)的ALK基因型。B−含ALK-RNAi 结构双元载体的T-DNA区结构。P35S和Tnos, 分别表示CaMV35S基因的启动子和终止子区; NOS−农杆菌胭脂碱合成酶基因终止子; Hyg−潮霉素抗性基因; LB和RB分别表示T-DNA区的左右边界序列; Anti和Sense分别表示目的基因片段的反向和正向结构;图中箭头表示设计引物方向。C−ALK-RNAi转基因水稻植株的PCR鉴定。D−ALK-RNAi转基因水稻植株胚乳中ALK基因表达量分析。L-ALKb-RNAi-1、L-ALKb-RNAi-2和L-ALKb-RNAi-3为龙特甫背景下的ALKb-RNAi转基因纯合系;Z-ALKc-RNAi-2-1、Z-ALKc-RNAi-2-2和Z-ALKc-RNAi-2-3为同时携带有ALKc等位基因和ALKb-RNAi干扰结构的转基因材料纯合系。对不同背景下的转基因系和未转化对照的表达量进行方差分析,并用新复极差法进行多重比较。**表示转基因系与未转化对照之间的差异达0.01显著水平,*表示转基因系与未转化对照之间的差异达0.05显著水平(n=3)。
Fig. 1.-RNAi construction and idendification of transgenic rice.
2.3 RNAi转基因系稻米的表观直链淀粉含量和胶稠度
下调表达基因后,转基因株系米粉的表观直链淀粉含量都有所上升,其中高糊化温度品种珍汕97B干扰系的表观直链淀粉含量与未转化对照相比上升了1.5~2.7个百分点(表2),呈现极显著差异,而低糊化温度品种龙特甫干扰系的表观直链淀粉含量与未转化对照相比没有显著差异。在两个不同糊化温度品种中下调表达后,胶稠度数值都有所下降,米胶变硬。低糊化温度的龙特甫背景下干扰系的胶稠度与未转化对照无显著差异;相反,高糊化温度的珍汕97B品种干扰系的胶稠度与未转化对照相比存在极显著差异,相较于未转化对照下降幅度为13~33 mm。可以看出,通过RNAi下调表达基因对高糊化温度品种珍汕97B米粉的理化性质影响较大,导致相应的转基因株系胶稠度数值极显著下降。
2.4 ALK-RNAi转基因系稻米的RVA谱分析
本研究用黏度速测仪测定了龙特甫B和珍汕97B及其RNA干扰系米粉的黏滞性(图3-A)。结合表3可以看出,从峰值黏度、热浆黏度和崩解值来看,龙特甫B和珍汕97B的干扰系与各自亲本相比都明显升高,高糊化温度品种珍汕97B干扰后表现出更高的峰值黏度、热浆黏度和崩解值;就消减值而言,龙特甫B背景仅仅下降了184~441 cP,而在珍汕97B背景下,相较于未转化对照下降了948~1429 cP。起浆温度也呈现出同样的规律,低糊化温度品种龙特甫的干扰系相较于未转化对照只下降了0.1℃~1.0℃,而高糊化温度品种珍汕97B的干扰系则下降了11.2℃~12.1℃,这与糊化温度的数据规律相一致。
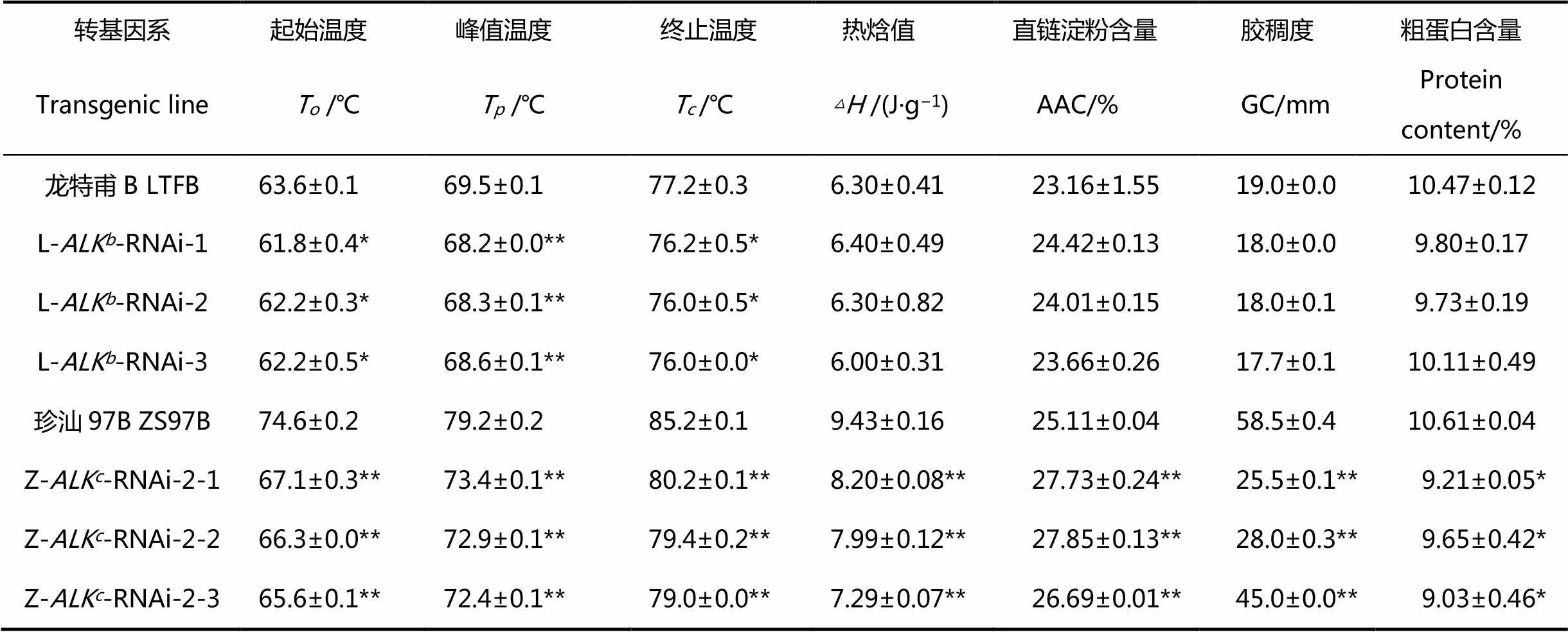
表2 ALK-RNAi转基因水稻株系米粉的热力学特性和理化特性
平均值±标准差(=2)。**表示转基因系与未转化对照差异极显著(<0.01),*表示转基因系与未转化对照差异显著(0.01≤0.05)。下表同。
Data are shown as mean±SD(=2). Double asterisks denote a highly significant difference between transgenic line and its wild type at<0.01, single asterisk denotes a significant difference between transgenic line and its wild type at 0.01≤<0.05. The same as below.
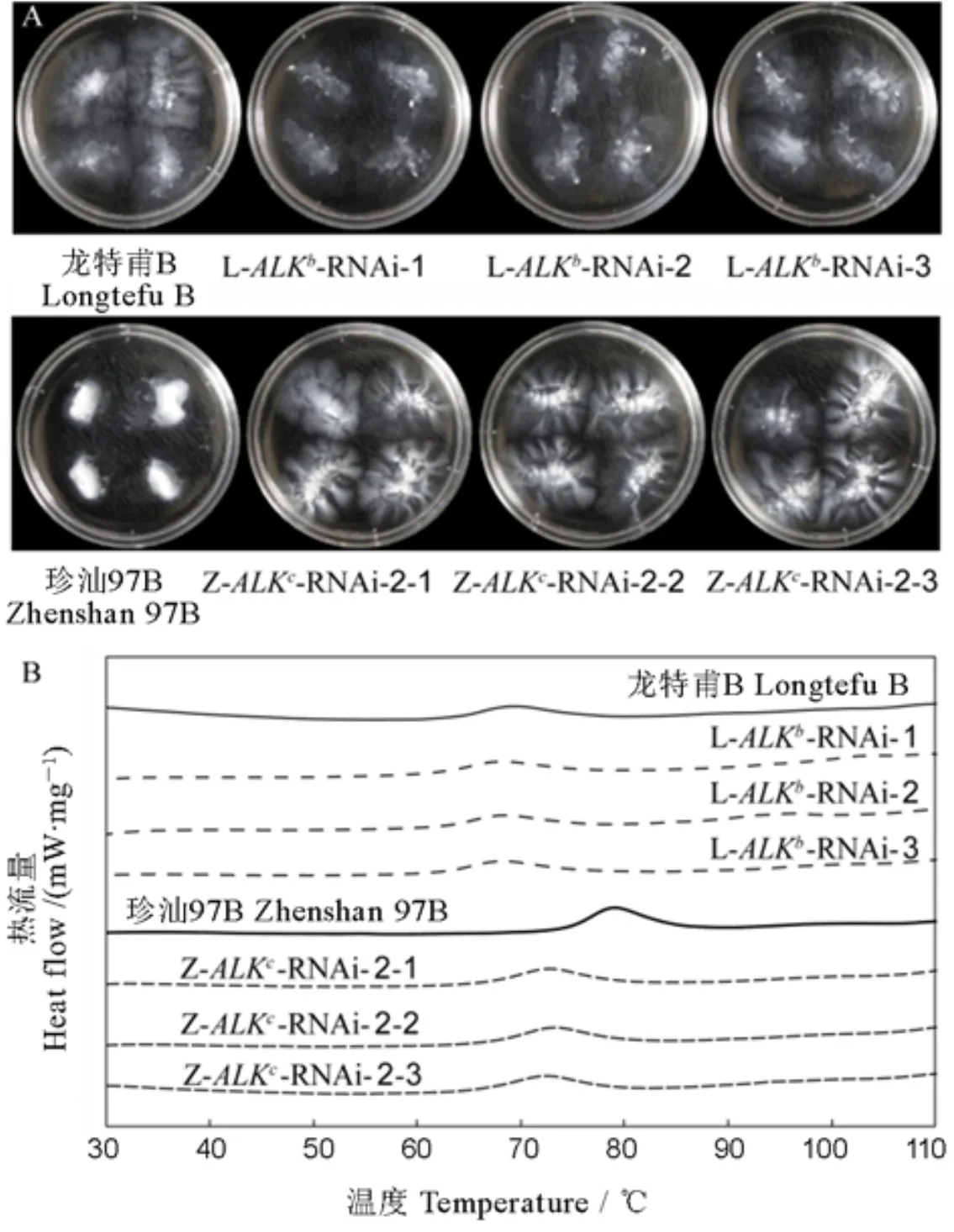
A−ALK-RNAi水稻株系精米在1.7% KOH中的碱消值; B−ALK-RNAi 水稻株系米粉的DSC曲线。
Fig 2. Gelatinization properties of-RNAi transgenic rice.
2.5 RNAi转基因稻米的食味值
为进一步确认-RNAi对稻米食味品质的影响,我们测定了转基因株系稻米的食味值,结果如表4所示。在水稻中干扰基因后,稻米的食味值会出现显著甚至极显著下降。在龙特甫背景下ALK干扰株系热米饭的食味值降幅较小,为2.2~5.0,珍汕97B背景下ALK干扰株系热米饭的食味值降幅较大,为9.5~13.0。食味值的变化与糊化温度的变化规律一致,食味值的下降主要由于下调表达后引起了直链淀粉含量的增加和胶稠度的下降而使得稻米的外观和口感变差,最终导致食味值的综合评分降低。
2.6 RNAi转基因稻米的淀粉精细结构
前人研究表明,等位变异会引起支链淀粉结构短链(DP<11)的增加以及中短链(DP 12−24)含量的减少,进而导致稻米糊化温度降低[7, 26, 27]。因此,我们利用HPAEC技术分析了水稻干扰株系中支链淀粉的链长分布情况。如图3-B所示,干扰等位基因会改变支链淀粉结构,淀粉中的短链含量受基因干扰的影响较大。在两个不同糊化温度品种中干扰等位基因后,淀粉链长分布变化曲线差异较大。低糊化温度品种干扰株系的支链淀粉结构与未转化对照相比,DP 6−8和DP 13−30的中长链淀粉含量增加,DP 9−12含量减少;高糊化温度品种干扰株系的支链淀粉结构与未转化对照相比DP 6−11和DP 25−36的中长链淀粉含量增加,DP 12−24含量减少(图3-B)。这些结果可以很好地解释干扰基因引起的糊化温度的变化,因为DP<10支链淀粉的减少可以提高糊化温度[26, 28]。同时也能从一定程度上解释不同等位基因之间的差异,ALK-RNAi株系的糊化温度的大幅降低是由于短链的DP 6−11显著增加以及DP 25−36的显著减少导致的。
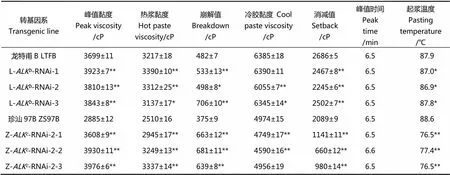
表3 ALK-RNAi转基因水稻株系米粉的RVA谱特征值
