外源脯氨酸对缺硼下棉花幼苗生长、生理特性以及脯氨酸代谢的影响
2020-08-08曾钰闫磊刘亚林曾紫君姜存仓
曾钰,闫磊,刘亚林,曾紫君,姜存仓
(华中农业大学微量元素研究中心/ 资源与环境学院,湖北 武汉430070)
棉花是我国重要的经济作物之一,其生产健康稳定发展,对我国农业增效、农村经济稳定具有重要意义[1]。 近年来,随着科技的进步,对棉花的可持续发展以及不断提高其有效供给提出了新的挑战[2]。 硼(B)是作物生长发育所必需的营养元素之一[3],而棉花属于中等需硼的作物[4],一旦缺硼,便会导致棉花生长受阻,同时,对根、叶柄、叶片厚度等都会产生一定的影响[5]。除此之外,缺硼也会导致植物生理功能与代谢的紊乱[6]。例如,缺硼会使细胞膜透性增加,诱导活性氧类物质的积累,从而产生脂膜过氧化作用影响细胞正常的结构和功能[7,36]。
脯氨酸(Pro)作为一种多功能的氨基酸,在植物遭受逆境胁迫条件下可作为渗透调节物质[8]、化学伴侣[9],活性氧清除剂[10]以及金属螯合剂[11]来维持细胞的正常功能。 同时,它还能作为一种信号分子调控植物的生长发育[12]。 脯氨酸是植物受到胁迫的一种信号物质,许多研究证实,植物中脯氨酸的合成途径有两条: 谷氨酸途径(Glutamate pathway,Glu)和鸟氨酸(Ornithine pathway,Orn)途径,它们的主要区别在于初始底物的不同[13]。 其中,合成脯氨酸途径中涉及的关键酶分为两类: 一是Glu 中的合成酶, 包括Δ1- 吡咯啉-5- 羧酸合成酶 (Δ1-pyrroline-5-carboxylate synthetase,P5CS) 和Δ1- 吡 咯 啉-5- 羧 酸 还 原 酶(Δ1-pyrroline-5-carboxylate reductase,P5CR),另一类则是Orn 中的鸟氨酸转氨酶(Ornithine-δaminotransferase,OAT)。 植物中脯氨酸的积累除了可以通过促进脯氨酸的合成,也可以通过抑制其降解来实现。 由脯氨酸到谷氨酸的氧化途径是在两种酶的催化下进行的,一个是脯氨酸脱氢酶(Proline dehydrogenase,PRODH), 另一个为吡咯啉-5- 羧酸脱氢酶(Pyrroline-5-carboxylate dehydrogenase,P5CDH)。 许多研究发现,对受到外界环境胁迫的植株施用外源脯氨酸可以产生预防或恢复作用[14]。Paulo 等[15]通过施用不同浓度外源脯氨酸对玉米耐盐性的研究发现,叶面喷施脯氨酸可以改变毒性离子和有机溶质含量。 Zouari等[16]发现,外源脯氨酸通过提高幼年枣椰树的光合活性和抗氧化酶活性以及改善水分状况来缓解镉胁迫。 然而,高浓度的脯氨酸会导致代谢失衡,从而损害植物生长与发育[17]。例如,Bruria[18]发现在盐敏感的番茄中,添加高浓度外源脯氨酸不但不能抵消盐胁迫效应,反而还会产生毒性而导致植株死亡。 另外,脯氨酸还可以通过调节酶促和非酶促抗氧化系统有效减少氧化损伤[19]。 目前关于施用外源脯氨酸的研究主要集中于缓解金属离子毒害,盐、干旱[20]、冷害[21]胁迫等方面,Wu等[22]在进行缺硼条件下枳壳幼苗根系代谢组学研究中发现, 缺硼显著增加了根中的脯氨酸含量,但是在重新供硼1 周后,其脯氨酸含量能恢复到正常硼浓度处理的水平,说明脯氨酸对缺硼胁迫的响应具有较强的敏感性;近期研究表明,外源脯氨酸的施用能够缓解缺硼对枳壳幼苗造成的损伤,但加剧了枳壳幼苗的铝毒害[23]。而对于外源脯氨酸能否缓解棉花的缺硼胁迫尚不清楚。 因此,本试验以鄂抗8 号棉花品种为材料,分析添加外源脯氨酸对缺硼棉花苗期生长、生理特性以及脯氨酸代谢的影响,揭示外源脯氨酸对缺硼棉花幼苗影响的生理机制,为棉花生产中脯氨酸的施用提供理论依据。

试验于2019 年4-5 月在华中农业大学温室进行,试验材料为华中农业大学棉花遗传育种研究室提供的鄂抗8 号棉花品种。 采用改良的阿夫多宁和阿农营养液培养[24],配方为:0.240 g·L-1NH4NO3、0.100 g·L-1Na2HPO4·12H2O、0.100 g·L-1NaH2PO4·2H2O、0.360 g·L-1CaCl2·2H2O、0.500 g·L-1MgSO4·7H2O、48.5 mg·L-1Fe-EDTA、1.81 mg·L-1MnCl2·4H2O、0.22 mg·L-1ZnSO4·7H2O、0.08 mg·L-1CuSO4·5H2O、0.09 mg·L-1Na2MoO4·2H2O。 如表1 所示,本试验设置以下6 个处理,每个处理4 次重复,共培养棉花幼苗24 株。
将棉花种子用浓硫酸进行脱绒,之后挑选均匀饱满的种子, 在36 ℃的烘箱中处理48 h 以破除种子休眠,然后用60 ℃的水浸泡6 h,将浸泡好的种子置于纱布上催芽, 待初生根长至1 cm左右时再将其移到盛蒸馏水的塑料桶上继续培养。 待子叶展开之后转移到黑色塑料桶中培养。营养液每7 d 更换1 次, 第1 周采用1/4 浓度培养,第2 周用1/2 浓度处理,从第3 周开始使用全量营养液浓度培养, 每4 h 通气20 min, 共培养39 d,棉花植株出现明显症状后收获。

表1 不同硼和脯氨酸浓度处理Table 1 Treatment with different concentrations of boron and proline

试验完成收样当天,先从每个处理中挑选有代表性的1 株棉花拍照,之后,将样品用超纯水洗净,分为根、茎和叶3 个部分;用剪刀分别从每株样品的同一部位(叶片选取倒3 叶,根选取根尖部分)剪取相同质量的样品,锡箔纸包好放入装有液氮的泡沫箱中,带回实验室用液氮进行研磨,放入-80℃冰箱中保存,用于相关指标的测定;其余样品测定完株高、根长、鲜物质质量之后,于105 ℃的烘箱中杀青30 min,在75 ℃下烘干至恒重,称完干物质质量后粉碎过筛用于硼含量的测定。
硼含量测定。 粉碎后的样品在500 ℃马弗炉灰化5 h 后使用0.1 mol·L-1的HCl 溶液浸提,取滤液用姜黄素比色法测定硼[25]。
脯氨酸含量测定。 称取根和叶片鲜样0.5 g,用3%磺基水杨酸溶液5 mL 进行研磨提取,在沸水浴中提取10 min, 冷却后吸取2 mL 滤液置于10 mL 离心管中,加入2 mL 冰醋酸和2 mL 酸性茚三酮,沸水浴加热30 min 后加入4 mL 甲苯显色,520 nm 处比色[26]。
抗氧化酶以及MDA 含量测定。 根据Rout等[27]的方法对叶片和根系中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)以及抗坏血酸过氧化物酶(APX) 进行提取; 采用NBT[28]法(EC 1.15.1.1)测定SOD 活性,愈创木酚法[29](EC 1.11.1.7)测 定POD 的 活 性,CAT[30](EC 1.11.1.6)、APX[31](EC 1.11.1.11)用分光光度计(UV-1800,Mapada) 测量不同吸光度下的光密度(OD)变化;MDA 含量用硫代巴比妥酸法测定[32]。
H2O2含量测定。 称取0.5 g 鲜样, 用0.067 mol·L-1磷酸缓冲液(PBS)5 mL 提取之后,用南京建成生物工程研究所试剂盒测定。 脯氨酸代谢酶测定。 P5CS、PRODH、P5CR 和OAT 4 种酶液的提取分别参照Shan 等[33-34],用江苏酶标生物有限公司的Elisa 试剂盒测定。

采用Excel 软件,利用统计分析软件SPSS21对各处理试验数据进行显著性差异分析(ANOVA),用Origin2017 作图。

如图1 所示,LB 处理下棉花幼苗正常的生长发育受到了抑制,顶芽叶片萎缩,叶片肥厚,根系生长缓慢且呈褐色,侧根膨大加粗;而MB 处理以及CK 处理则未出现此症状。 表2 可知,不同硼浓度下添加外源脯氨酸对棉花苗株高和叶片数的变化无明显差异;施用外源脯氨酸(CK+Pro)棉花幼苗叶片鲜物质质量与干物质质量分别比CK 下降了35.9%和54.3%,表明CK 处理下添加脯氨酸抑制了棉花幼苗的生长。 而从统计学水平来看,硼和脯氨酸的交互作用主要抑制了叶片干物质质量、鲜物质质量的积累,从而影响棉花植株总干物质质量、 总鲜物质质量的变化,而对株高,叶片数以及根和茎的干物质质量、鲜物质质量变化无显著影响。

图1 不同处理对棉花幼苗长势影响Fig. 1 Effects of different treatments on the growth of cotton seedlings

从表3 看出,随着硼浓度的升高,根、茎和叶中的硼含量均呈显著上升的趋势,其中叶片中的硼含量明显高于根和茎;与LB 处理相比,添加外源脯氨酸(LB+Pro)增加了根、茎和叶中的硼含量,其中,根、茎部位硼含量比LB 增加1.3 和1.6倍;CK+Pro 处理的根、 茎和叶中的硼含量相对CK 处理无显著变化。从统计学水平上看,硼和脯氨酸的联合施用显著减少了硼向地上部转移和分配,虽然不同硼与脯氨酸浓度分别对根中的硼含量产生显著影响,但是两者的交互作用却对根中硼含量的增加无显著效应。
从外源脯氨酸施用对硼在棉花幼苗各部位的分配可以看出,适硼处理(CK)下施用外源脯氨酸对硼在棉花各部位的分配率变化不明显。 在MB 和LB 处理下添加外源脯氨酸 (MB+Pro、LB+Pro)降低了叶片中硼的分配率,而明显促进了硼在根中的分配(图2)。

如表4 所示,随着硼浓度的升高,叶片中脯氨酸含量均下降。 在叶片中,LB 和MB 处理下,添加外源脯氨酸后(LB+Pro、MB+Pro),脯氨酸含量分别下降了76.2%和36.8%; 而在根中,相较于LB 处理,CK 处理脯氨酸含量显著下降51.3%, 不同硼浓度处理下添加外源脯氨酸对根中脯氨酸含量无显著影响。 添加外源脯氨酸在不同硼浓度处理下均使根系中的H2O2含量显著上升,CK+Pro、MB+Pro 和LB+Pro 比CK、MB和LB 处理分别提高了1.2、1.2 和0.71 倍;CK 和MB 处理下叶片的H2O2含量较LB 处理显著下降, 添加外源脯氨酸后显著降低了CK 和LB 处理下叶片中的H2O2含量, 而增加了MB 处理中叶片的H2O2含量。 LB 和MB 处理下添加外源脯氨酸对叶片中MDA 含量无显著差异, 而CK 处理时添加脯氨酸显著降低了叶片中MDA 含量;根中LB+Pro 和CK+Pro 相较于LB 和CK 处理,MDA 含量分别增加了0.3 和1.6 倍。 以上结果表明,不同硼浓度下添加外源脯氨酸会使根系中的H2O2及MDA 含量增加, 从而对根系造成一定损伤,但可降低叶片中这些逆境胁迫物质的积累。

表2 外源脯氨酸对不同硼浓度棉花幼苗生长指标的影响Table 2 Effects of exogenous proline on growth index of cotton seedlings with different boron concentrations
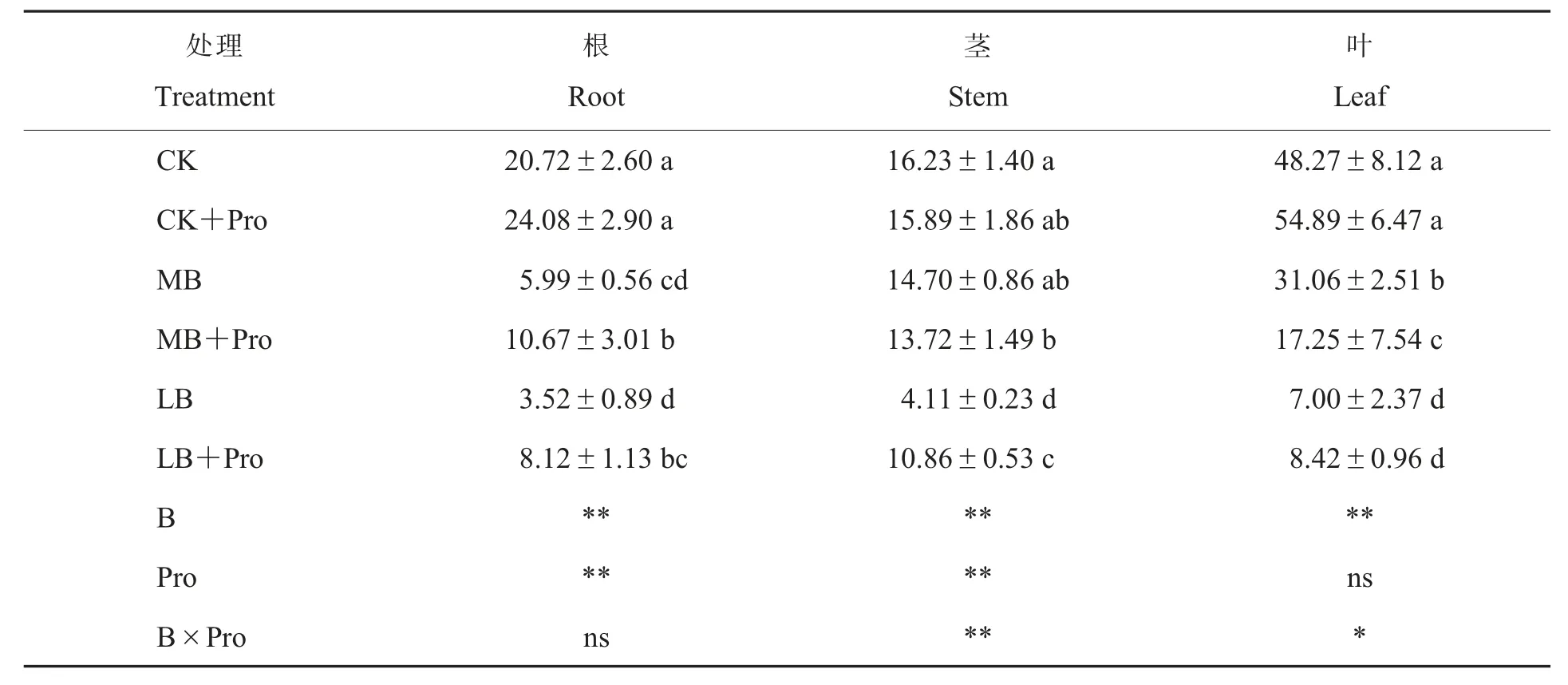
表3 外源脯氨酸对不同硼浓度棉花幼苗各部位硼浓度的影响Table 3 Effects of exogenous proline on boron content in different parts of cotton seedlings with different boron concentrations mg·kg-1
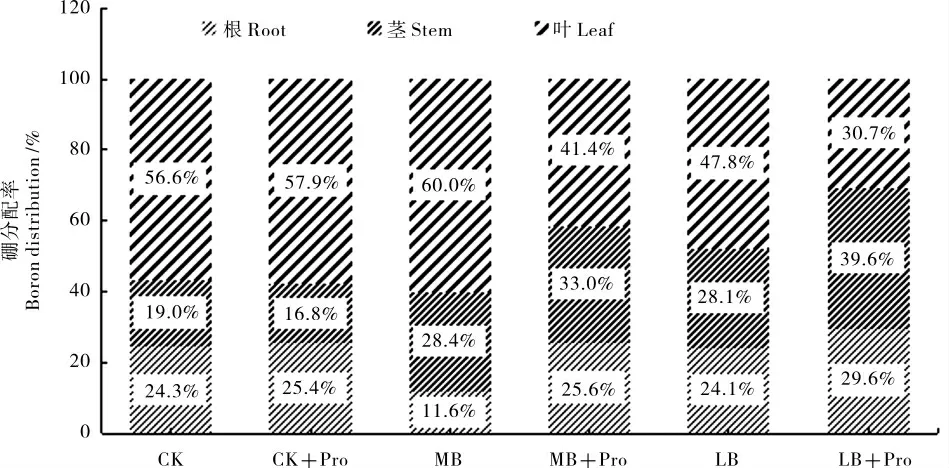
图2 外源脯氨酸对不同硼浓度处理棉花幼苗各部位硼浓度分配的影响Fig. 2 Effects of Exogenous Proline on the distribution of boron in different parts of cotton seedlings with different boron concentrations

表4 外源脯氨酸对不同硼浓度棉花幼苗中脯氨酸、过氧化氢和丙二醛含量的影响Table 4 Effects of exogenous proline on the contents of proline, H2O2 and MDA in cotton seedlings treated with different boron concentrations

从表5 看出,叶片中不同硼浓度处理间SOD活性无显著差异, 根系中LB+Pro 处理的SOD活性相对于LB 处理增加了34.3%。 在LB 处理下, 添加外源脯氨酸使叶片和根系中的POD 活性下降了38.5%和19.1%。 CAT 活性随着硼浓度的增加而增加,MB 处理下, 添加外源脯氨酸(MB+Pro) 显著增加叶片和根中CAT 的活性;CK+Pro 相对于CK 处理, 叶片中CAT 活性降低了36.9%而根中增加了36.3%。LB 处理下,外源脯氨酸的施用(LB+Pro)显著增加了叶片和根中的APX 活性。 说明外源脯氨酸可以增加植物体内APX 酶活性来缓解缺硼胁迫。

表5 外源脯氨酸对不同硼浓度棉花幼苗中抗氧化酶活性变化的影响Table 5 Effects of exogenous proline on the activities of antioxidant enzymes in cotton seedlings treated with different boron concentrations

随着硼浓度的升高,OAT 和PRODH 酶的活性呈现先上升后下降的趋势,且在MB 处理时活性最高, 不添加脯氨酸不同硼浓度对P5CS 酶活性变化无显著影响; 外源脯氨酸的施用(LB+Pro、CK+Pro) 显著提高了LB 和CK 处理下P5CS 的活性, 分别增加了26.4%和21.8%(图3A);LB 和MB 条件下添加脯氨酸 (LB+Pro、MB+Pro) 显著增加了P5CR 活性, 而CK+Pro相较于CK 处理P5CR 的活性无明显差异 (图3B);LB 条件下添加脯氨酸(LB+Pro)使OAT 的活性增加了90.0%(图3C); 在LB 和MB 处理下,外源脯氨酸的施用(LB+Pro、MB+Pro)对叶片中PRODH 的活性呈现相反的趋势, 相对于LB 处理,LB+Pro 处理下PRODH 的活性增加了25.6%,而在MB 处理中,添加脯氨酸(MB+Pro)使PRODH 活性下降了27.3 %,CK 浓度下添加脯氨酸(CK+Pro)对棉花叶片的PRODH 活性影响不大, 虽有上升的趋势, 但差异不显著 (图3D)。

低硼对多数植物的生长具有抑制作用。 研究表明,适量施用外源脯氨酸能够缓解植物生长过程中所遭受的逆境胁迫,但施用过高浓度脯氨酸也会在一定程度上抑制植物的生长,甚至加重胁迫损伤[35]。 Bruria[18]发现无论是否遭受逆境胁迫,施用外源脯氨酸均显著降低了番茄幼苗的鲜物质质量。 在本试验也发现适硼浓度条件下施用脯氨酸会显著降低棉花幼苗的总干物质质量、总鲜物质质量(表2),这可能是由于施用外源脯氨酸产生了一定的毒性作用而抑制了植株的生长。 同时,本研究还发现缺硼条件下添加外源脯氨酸可以显著促进棉花根系对硼的吸收(表3,图2),说明脯氨酸的添加对于缓解缺硼胁迫在一定程度上产生了积极作用。

图3 外源脯氨酸对不同硼浓度棉花幼苗叶片脯氨酸代谢酶活性的影响Fig. 3 Effects of exogenous proline on proline metabolizing enzyme activities in leaves of cotton seedlings treated with different boron concentrations
研究表明, 缺硼会导致细胞膜透性升高,诱导活性氧类物质的积累,从而产生脂膜过氧化作用[36]。正常情况下,植物可以激活体内的抗氧化系统(包括SOD、POD、CAT 和APX 等细胞膜保护酶)清除细胞内活性氧类物质,而减少对细胞质膜的氧化损伤[37],但是,缺硼对抗氧化酶活性的改变会影响植物清除活性氧类物质的能力[38]。 已有研究表明,脯氨酸能增强植物体内CAT、SOD 和POD 等抗氧化酶活性来清除活性氧[39],本试验中发现,低硼条件下添加脯氨酸能增加根和叶片中SOD 和APX 活性, 而降低了POD 的活性 (表5),这与宋敏等[40]在镉胁迫下添加外源脯氨酸对小麦幼苗生长的影响得出的结果相似。 Ghaffari等[41]发现干旱胁迫下施用脯氨酸显著降低甜菜叶片中H2O2含量,这与本试验研究结果一致,说明脯氨酸的添加使叶片受到的氧化损伤减弱。 李爱军等[42]研究表明,脯氨酸处理对低温胁迫下高粱叶片MDA 含量的降低有一定影响, 但是与不添加脯氨酸相比差异不显著,这与本试验发现的研究结果类似。 以上结果说明缺硼胁迫下添加外源脯氨酸通过增强抗氧化酶活性同时减少叶片中MDA 和H2O2含量以保护细胞质膜完整性(表4)。
Suekawa 等[43]通过对比施用外源脯氨酸对水稻和烟草生长的影响,发现外源脯氨酸显著增加了水稻培养细胞的脯氨酸含量,而对烟草细胞无明显影响,说明烟草和水稻对外源脯氨酸的吸收可能不同,并且也表明脯氨酸的施用对植物生长产生的影响因植物的种类不同而存在差异。 Yu等[44]在探究施用外源脯氨酸对水稻镉胁迫的影响时发现,培养时间在72 h 之后,根中脯氨酸含量与对照相比无显著差异,这与本试验中无论是否缺硼,添加脯氨酸之后根中脯氨酸含量与不添加脯氨酸相比均无显著差异的结果相似,因此也说明,脯氨酸含量的变化可能与培养时间的长短有关。 在本试验中,通过对棉花幼苗叶片中脯氨酸相关代谢酶的活性变化分析发现,与适硼处理相比, 低硼胁迫显著降低了P5CR 和OAT 合成酶的活性, 而对P5CS 合成酶和PRODH 分解酶的活性变化不显著,在低硼处理下施用外源脯氨酸之后发现以上4 个酶的活性均显著增加(图3)。本研究中,外源脯氨酸的施用反而降低了棉花幼苗叶片中脯氨酸含量,其原因可能是低硼条件下外源脯氨酸的添加虽然使得P5CS、P5CR 及OAT 合成酶活性升高,但同时分解酶PRODH 活性显著增加,导致了脯氨酸降解高于合成,从而叶片中脯氨酸的积累降低,这与Paulo 等[45]的研究结果相似,即玉米在盐胁迫下施用脯氨酸在培养时间7 d 时叶片内源脯氨酸含量显著增加,此时P5CS 活性降低,而PRODH 的活性增加,从而防止脯氨酸可能产生的毒害作用,但随着培养时间的增加,在14 d 时脯氨酸含量呈现出显著下降的趋势。

在适硼浓度下添加外源脯氨酸对棉花的生长有一定的抑制作用。 在缺硼处理时施用外源脯氨酸促进了根系对硼的吸收,通过提高叶片中抗氧化酶APX 活性而降低叶片中膜脂过氧化物质的积累。 另外,与适硼处理相比,低硼胁迫导致植株体内脯氨酸的积累,而低硼处理添加脯氨酸会降低叶片中脯氨酸的含量,其诱因主要是影响了脯氨酸代谢途径(谷氨酸和鸟氨酸途径)中关键的合成酶和分解酶活性,主要是由于促进分解代谢的脯氨酸脱氢酶活性显著增加所致。
