硫化氢提高水稻磷吸收转运的生理和分子机制
2019-11-18朱春权曹小闯朱练峰白志刚黄洁梁清铎金千瑜张均华
朱春权 曹小闯 朱练峰 白志刚 黄洁 梁清铎 金千瑜 张均华
硫化氢提高水稻磷吸收转运的生理和分子机制
朱春权 曹小闯 朱练峰 白志刚 黄洁 梁清铎 金千瑜 张均华*
(中国水稻研究所 水稻生物学国家重点实验室,杭州 310006;*通讯联系人,E-mail: zhangjunhua@caas.cn)
低磷胁迫是限制水稻产量的主要因素之一。水稻淹水条件下产生H2S,然而,H2S作为信号分子是否参与调节水稻响应缺磷胁迫还未可知。在正常磷和低磷条件下测定水稻H2S含量,揭示H2S在水稻响应缺磷胁迫中的作用。用2 μmol/L H2S前体物质NaHS预处理水稻1 d,然后在加磷和低磷条件下培养6 d,测定水稻体内总磷含量、酸性磷酸酶活性、抗氧化酶活性、木质部汁液磷含量、磷转运子基因表达以及根系构型变化,从而探究H2S参与调节水稻响应缺磷胁迫的生理和分子机制。低磷胁迫下,水稻根系和地上部H2S含量显著增加。NaHS预处理水稻显著增加低磷条件下水稻体内有效磷和总磷含量,提高根系酸性磷酸酶活性,提高抗氧化酶活性、木质部汁液磷含量和磷转运子基因表达水平,同时还改变水稻根系构型,增加总根长、总根表面积、总根体积和总根尖数,从而促进低磷条件下水稻对外界磷的吸收和转运,最终缓解缺磷胁迫。
水稻;低磷胁迫;硫化氢;磷转运子;根系构型
磷是植物所需的仅次于氮的第二大营养元素,植物中的全磷含量约占其干质量的0.05%~ 0.50%[1]。植物体内的磷广泛参与光合作用、信号转导、酶促反应、呼吸作用和碳氮代谢等过程,同时,磷也是植物体内众多细胞组织的组成成分,比如核酸、酶、细胞膜等[2]。然而,由于土壤中的磷易被土壤颗粒和阳离子固定或者被微生物转化为有机磷[3],因此土壤中能被植物直接吸收利用的磷含量很低,不能满足植物正常生长。
生产上常通过增施磷肥保证作物正常磷肥供应。然而,施入土壤中的磷利用率很低,当季利用率约为10%~20%[4]。剩余的磷肥通过雨水等进入湖泊,造成富营养化污染。植物拥有多种调控机制缓解缺磷胁迫,比如改变根系构型,促使根系向含磷量较高的表层土延伸或者通过增加根系侧根或根毛扩大磷的吸收利用范围[5-7]。同时,根系也会分泌质子、有机酸和次级代谢物等,促使土壤中的磷溶解出来,供植物吸收利用[2, 8, 9]。除了扩大对外界磷的吸收,植物还会通过提高体内磷的再利用缓解缺磷胁迫。比如改变糖酵解途径,绕过需要ATP的步骤[10];提高酸性磷酸酶酶活,促进体内有机磷的再利用[11];提高细胞壁果胶含量,增加细胞壁结合态磷的再利用[12]等。
众多信号分子参与调控植物缓解缺磷胁迫。比如乙烯参与调控矮牵牛花衰老组织中磷的释放和增加高亲和磷转运子基因的表达,将衰老组织中的磷向新生组织转运[13];一氧化氮(NO)通过调节白羽扇豆中排根的形成并且促进柠檬酸的释放使其增加对外界磷的吸收利用[14]。硫化氢(H2S)是除NO和一氧化碳(CO)外的第三种气体信号物质,其广泛参与植物的正常生理活动和对外界逆境的抵抗[15]。如促进植物种子的萌发[16]和植物器官的形成[17],调节气孔的闭合[18],缓解离子毒害[19]和高温胁迫[20]等。H2S参与调控植物响应养分胁迫的研究较少,但也有研究发现,H2S参与水稻在完全缺磷条件下对水稻细胞壁结合态磷的再利用过程,从而缓解缺磷胁迫[21]。
本研究以常规水稻品种日本晴作为研究材料,通过外源添加H2S供体硫氢化钠(NaHS),测定水稻在正常磷和低磷胁迫下体内磷含量变化和生理分子变化,以期进一步探究H2S调控水稻响应低磷胁迫的生理和分子机制,从而为实际生产中提高水稻磷利用率提供理论基础。
1 材料与方法
1.1 水稻培养条件与处理
本研究以粳稻品种日本晴作为实验材料,在30℃条件下将水稻种子催芽后,铺在2 mm格子的塑料板上,将其培养在0.5 mmol/L CaCl2溶液中。当水稻芽长至1 cm左右时,将CaCl2溶液换成改良的木村营养液[12]。待水稻长至两叶一心,将其移到1.5 L水培罐中,每罐10株水稻。
H2S测定实验:将两叶一心的水稻在低磷(18 mmol/L)的营养液中培养,分别在0(即正常磷含量),1,3,5,7 d收集水稻根系和地上部,用于测定H2S含量。
H2S促进水稻磷吸收实验:两叶一心的水稻在正常磷(180 mmol/L;P)和低磷(18 mmol/L;LP)营养液中培养,分别添加或者不加2 μmol/L的H2S供体NaHS,1 d后将营养液倒掉,分别继续在正常磷和低磷营养液中培养6 d,每隔3 d换一次营养液,营养液pH为5.6。四个处理分别标记为P(正常磷含量)、P+NaHS、LP(低磷)和LP+NaHS。
1.2 硫化氢含量的测定
收取水稻根和地上部,洗净称重。用液氮研磨后加入5 mL 50 mmol/L pH6.8的磷酸(PBS)缓冲液,内含0.1 mol/L乙二胺四乙酸二钠(EDTA-Na2)和0.2 mmol/L抗坏血酸。H2S含量的根据加入20 mmol/L二甲基对苯二胺二氢氯胺(溶解在7.2 mol/L HCl中)后生成的亚基蓝深浅进行测定[22]。
1.3 总磷的提取和测定
收集水稻根和地上部后装入信封在烘箱中105℃下杀青30 min,然后在75℃下将植物样本烘干至恒重。称取根和地上部干质量,用浓H2SO4和过氧化氢(H2O2)消煮,超纯水定容后用钼锑抗法测定水稻总磷含量[23]。
1.4 酸性磷酸酶的测定
收集水稻根系鲜样称重,冰上研磨后用0.2 mmol/L醋酸钠缓冲液提取根系酸性磷酸酶。将酶粗提液与反应液(0.2 mmol/L pH 5.8 的醋酸钠缓冲液,内含0.5 g/L对硝基苯磷酸二钠)混合,在25℃黑暗条件下培养1 h,加入6 mol/L的NaOH终止反应,在400 nm波长下比色。通过单位时间内单位重量的根催化对硝基苯磷酸二钠生成对硝基苯酚的量来表示酶活[24]。
1.5 抗氧化酶的活性测定
收集水稻根和地上部,鲜样称重。冰上研磨,加入2 mL 提取液(50 mmol/L pH 7.8的PBS缓冲液,内含1 mmol/L EDTA-Na2和1 mmol/L 醋酸),在15 000、4℃温度下离心15 min,取上清,作为酶粗提液。
SOD酶活测定:取50 μL酶粗提液与1.5 mL 50 mmol/L的pH 7.8 PBS缓冲液,0.3 mL 20 μmol/L的核黄素,0.3 mL 150 μmol/L L-蛋氨酸,0.3 mL 750 μmol/L氮蓝四唑,0.3 mL 100 μmol/L EDTA-Na2和0.25 mL水混合,在室温光照条件下反应20 min。做一个阴性对照,560 nm下比色[25]。
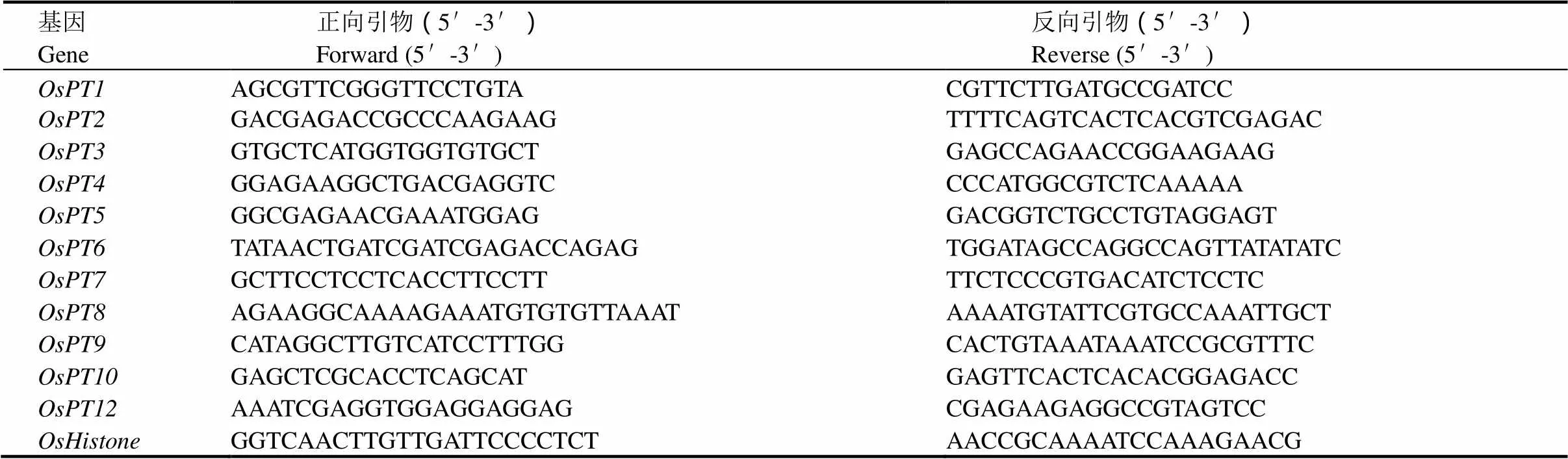
表1 本研究中使用的引物序列
CAT酶活测定:取0.1 mL酶粗提液与1.9 mL 50 mmol/L pH7.0的PBS缓冲液和 1 mL 0.1% H2O2反应,在反应刚开始和1 min后分别记录240 nm下的吸光值[26]。
APX酶活测定:取0.1 mL酶粗提液与1.5 mL 50 mmol/L的磷酸钾缓冲液(pH 7.0),0.5 mL 0.3 mmol/L的抗坏血酸, 0.5 mL 0.1 mmol/L乙二胺四乙酸钠0.4 mL 0.06 mmol/L H2O2混合,在反应10和30 s分别记录290 nm下的吸光值[27]。
POD酶活测定:取50 μL酶粗提液与1 mL 50 mmol/L的磷酸钾缓冲液(pH 5.5),0.95 mL 0.2%愈创木酚, 1 mL 0.3% H2O2混合,分别在反应30和90 s记录470 nm下的吸光值[28]。
1.6 木质部汁液磷的提取和测定
将水稻距离根上部2 cm处切断,用移液器吸取流出的伤流液,持续2 h[29]。将吸取的伤流液合并记录体积,适当稀释后用电感耦合等离子体质谱法(ICP-MS)测定磷含量。
1.7 水稻根系构型参数的测定
将水稻根系剪下后铺在含水的塑料盘中,用EPSON 10000XL扫描仪获得根系的扫描图片。然后运用WinRHIZO根系分析系统(加拿大Regent 仪器公司)计算根系的总根长、总表面积、平均直径、总体积和根尖数等指标[30]。
1.8 水稻总RNA的提取和基因表达测定
水稻的根系吸干水分后剪下,立即在液氮中研磨。利用TRizol法提取里面的总RNA。在NanoDrop上测定RNA的含量并用琼脂糖凝胶电泳法检测RNA的完整性。运用PrimeScript反转录试剂盒(TaKaRa,日本)将RNA反转成cDNA并用Sybgreen(TaKaRa,日本)进行实时荧光定量PCR。表1为所选基因的引物和内参基因引物[31-36]。
1.9 统计学分析
实验均设4个生物学重复,每个处理重复3次。数据采用SPSS 21.0.0 软件进行统计分析(单因素方差分析),均数采用图基(Tukey)检验统计学差异。图中不同字母表示不同处理间均值在< 0.05水平上有统计学差异。
2 结果与分析
2.1 H2S提高水稻体内总磷含量
相较于正常磷条件,水稻根部和地上部的H2S含量在低磷胁迫1 d后急剧增加,随着低磷胁迫时间的增加,水稻体内H2S含量逐渐下降,并最终恢复到起始含量(图1)。
在正常磷和低磷胁迫条件下,用H2S的供体NaHS预处理水稻后,显著增加了水稻根部和地上部的总磷含量(图2)。
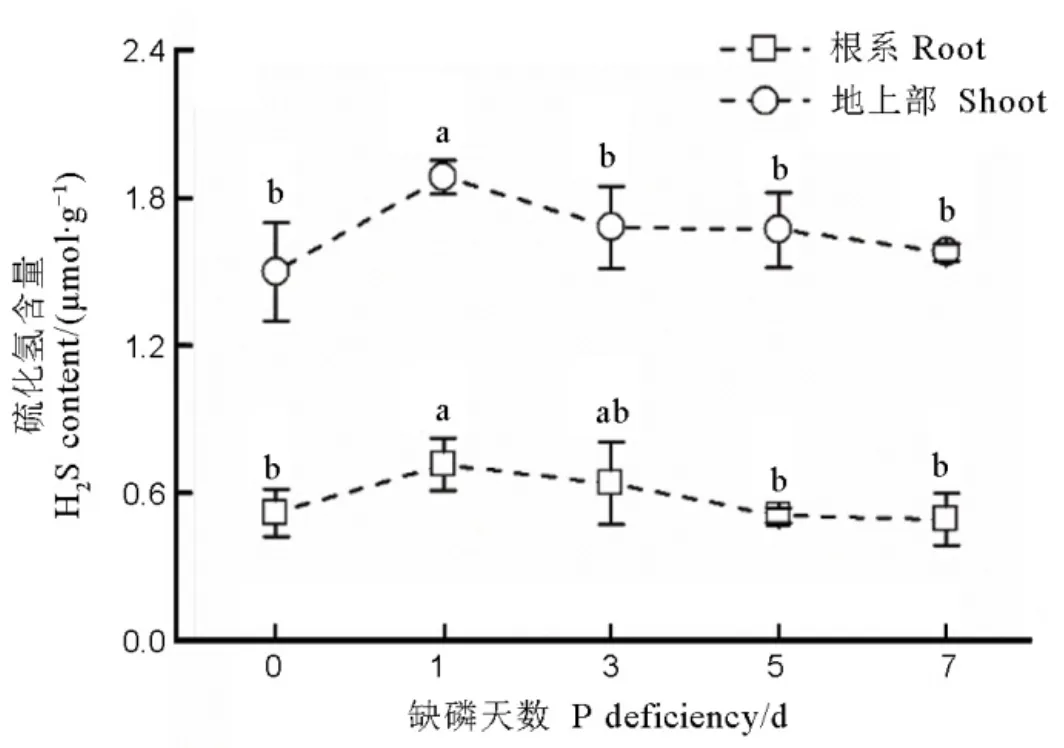
数据用均值±标准差(n = 4)表示。数据用均值±标准差(n = 4)表示。不同的小写字母代表处理间差异在0.05水平上显著。缺磷处理的磷浓度为18 mmol/L。
Fig. 1. Content of H2S in rice root and shoot under different phosphorus deficient durations.
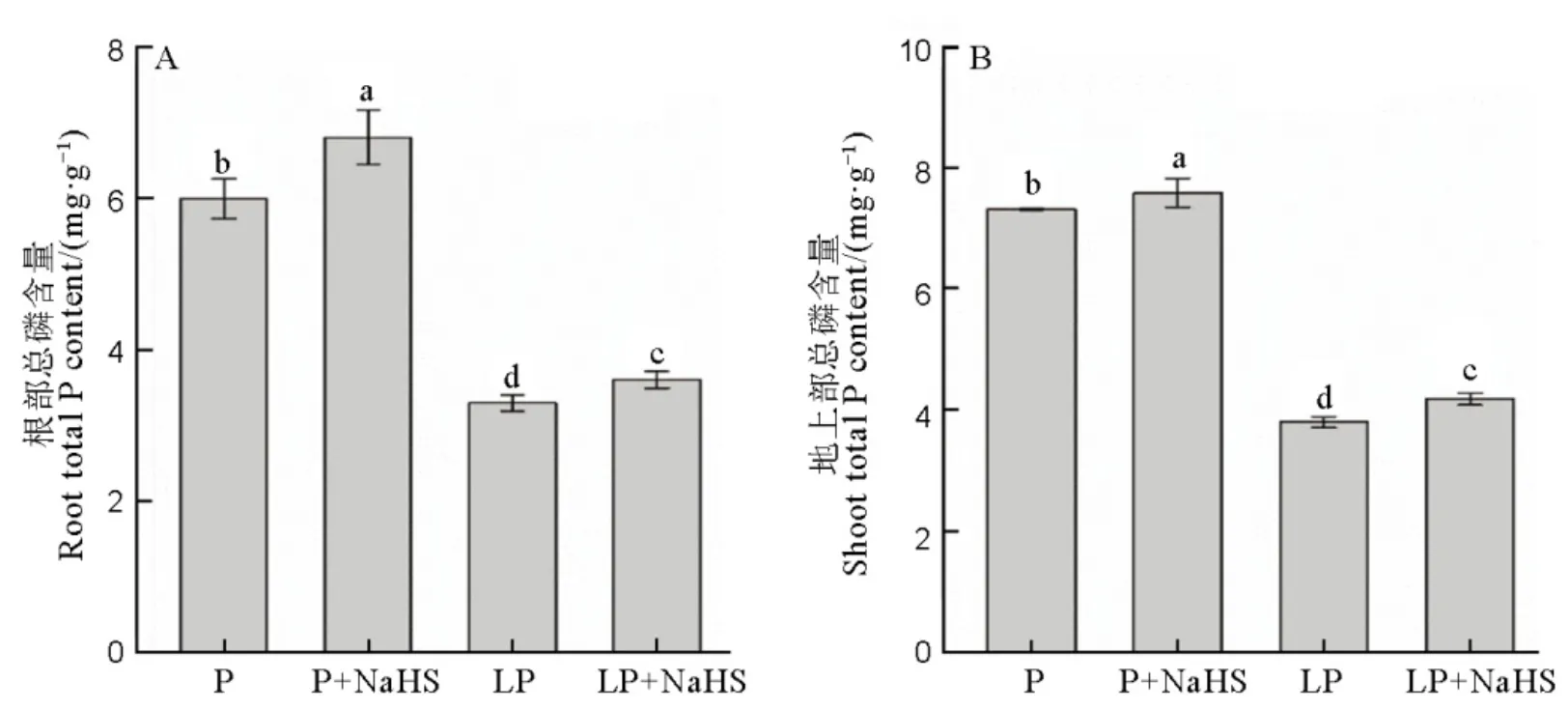
数据用均值±标准差(n = 4)表示。不同的小写字母代表处理间差异在P < 0.05水平上显著。P-营养液中磷浓度为180 mmol/L, LP-18 mmol/L。
Fig. 2. Available P and total P contents in rice roots and shoots.
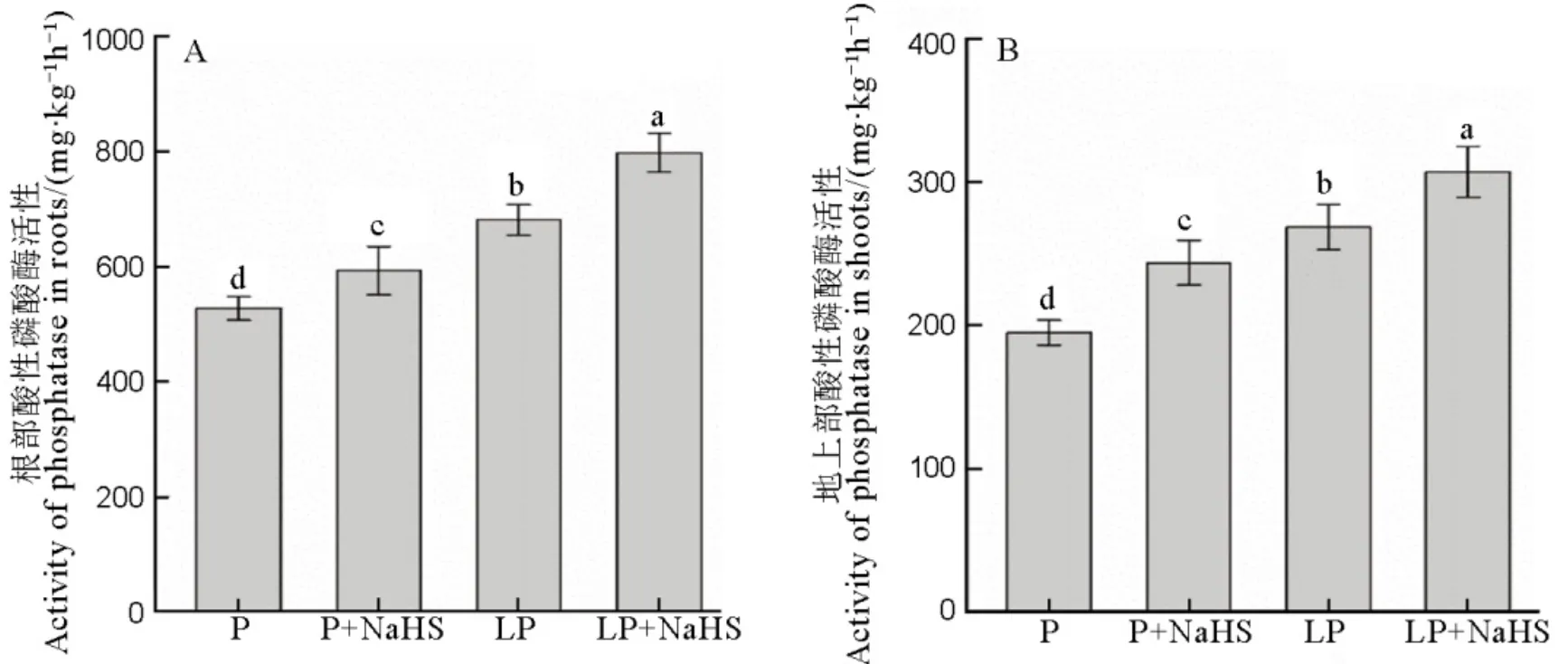
数据用均值±标准差(n = 4)表示。不同的小写字母代表处理间差异在P < 0.05水平上显著。P-180 mmol/L; LP-18 mmol/L。
Fig. 3. Activites of acid phosphatase in rice roots and shoots.
2.2 H2S提高酸性磷酸酶活性
在低磷条件下,水稻根部和地上部的酸性磷酸酶活性显著高于正常磷条件,用NaHS预处理后,水稻根系和地上部的酸性磷酸酶活性进一步增强(图3)。
2.3 H2S提高磷转运子基因的表达
无论是正常磷还是低磷胁迫条件下,NaHS预处理均显著增加水稻木质部汁液中的磷含量(图4)。
水稻体内磷转运子PHT1家族共有13个成员,分别为~。其中和主要在菌根共生过程中诱导[37, 38]。因此,本研究没有测定以上两个磷转运子基因的表达。//主要参与水稻体内磷的转运。在本研究中,和基因的表达虽然在低磷胁迫下显著增加,但是与NaHS预处理组没有显著差异,只有基因的表达量在添加NaHS后进一步增加(图5)。
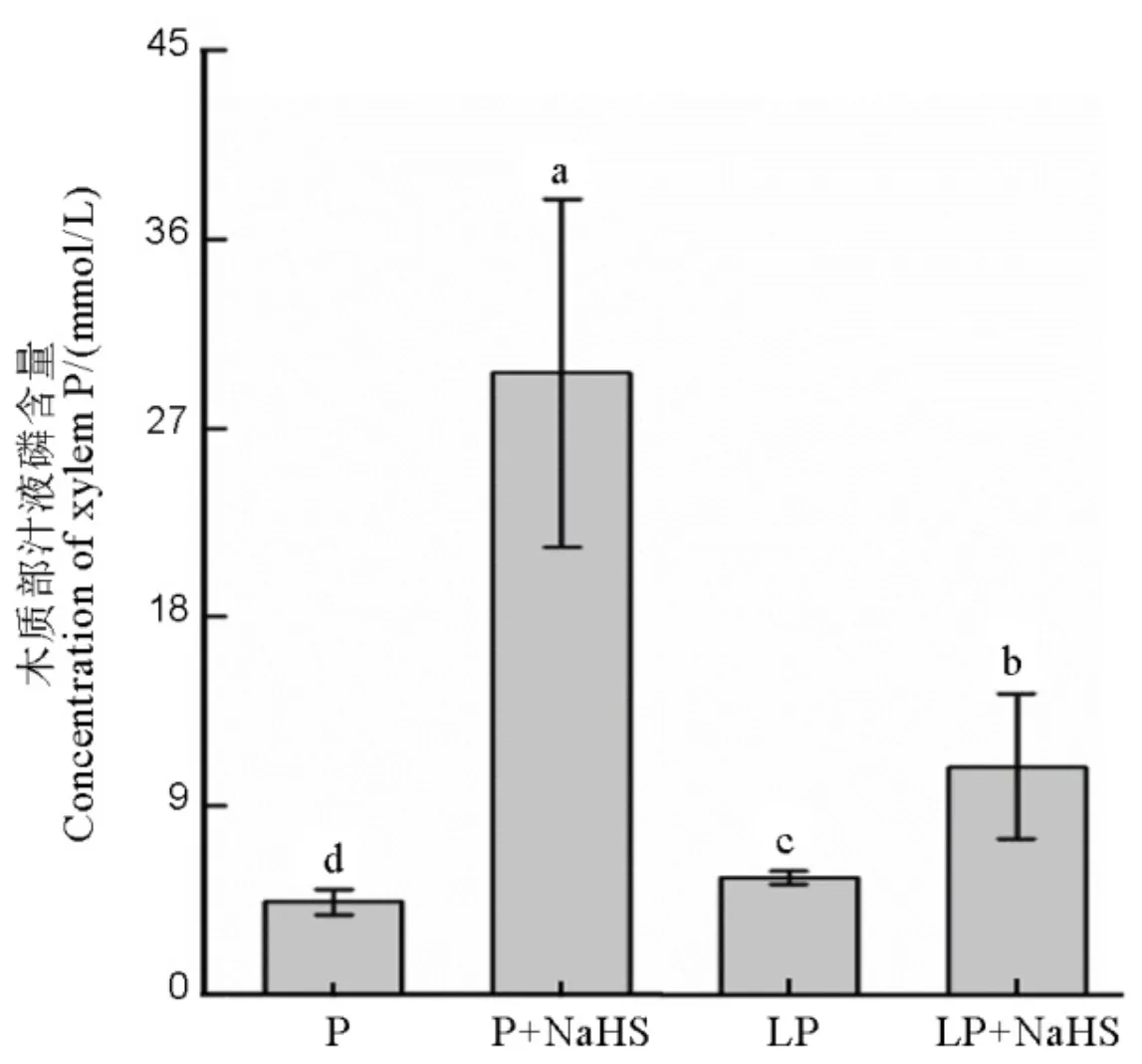
数据用均值±标准差(n = 4)表示。不同的小写字母代表处理间差异在P < 0.05水平上显著。P-180 mmol/L, LP-18 mmol/L。
Fig. 4. Xylem P concentration in rice.
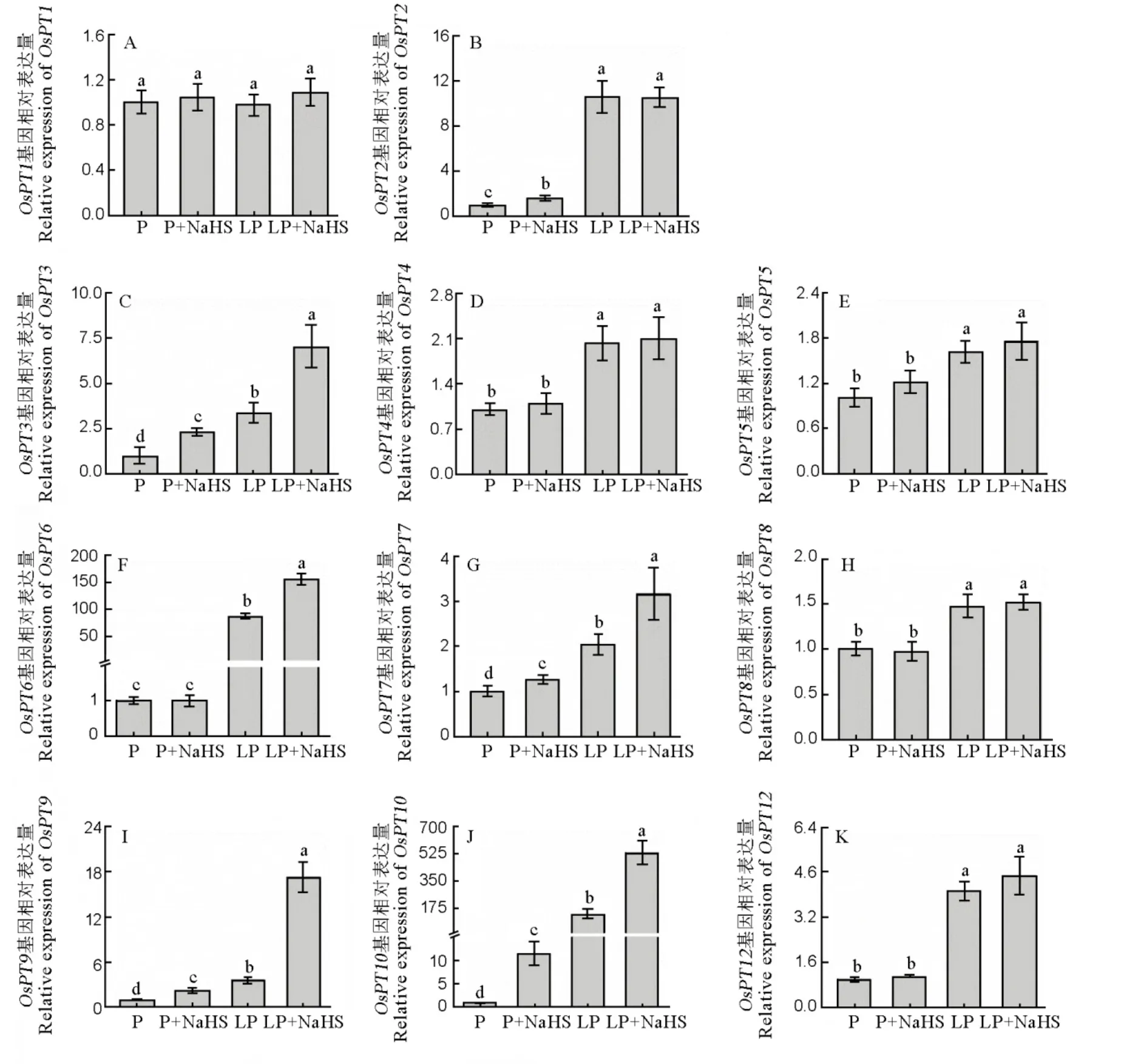
数据用均值±标准差(n = 4)表示。不同的小写字母代表处理间差异在P < 0.05水平上显著。P-180 mmol/L, LP-18 mmol/L。
Fig. 5. Relative expression level of P transporter genes.
同时,通过测定磷转运子PHT1家族其余已经证明功能的基因成员的表达,发现、、和的基因表达均在低磷胁迫下显著高于正常磷条件,并且用NaHS预处理后表达量进一步增加(图5)。
2.4 H2S提高抗氧化酶活性
共测定了水稻根部和地上部4种抗氧化酶系统的酶活性,发现在低磷胁迫下,水稻根系和地上部的SOD、CAT、APX和POD的酶活均显著增强,并且在用NaHS预处理后进一步增加了以上4个酶的活性(表2)。
2.5 H2S改变水稻根系构型
在缺磷条件下,水稻根系总根长、总表面积、总体积和总根尖数显著增加,并且在用NaHS预处理后,低磷条件下以上4个根系生长指标均进一步增加(图6和表3)。
3 讨论
H2S是一种新型信号分子,主要参与调节植物响应逆境胁迫,比如高温胁迫[20]、铝胁迫[39]和缺磷胁迫[21]等。在本研究中,水稻根系和地上部的H2S含量均在缺磷1 d后显著增加,然后逐渐减少,并在缺磷7 d时回到正常水平(图1),同时,在外源添加H2S供体NaHS后,在低磷胁迫下水稻根部和地上部的总磷含量显著增加(图2),进一步证明了H2S作为信号分子,参与调节水稻响应低磷胁迫。
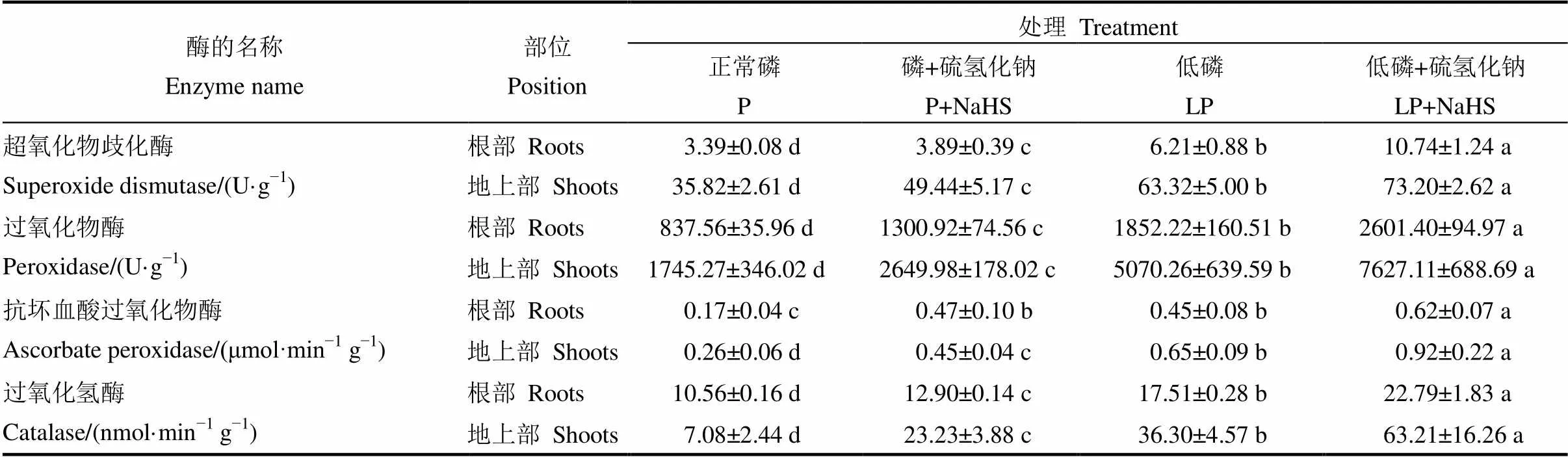
表2 水稻根系和地上抗氧化酶活性
数据用均数±标准差(= 4)表示。不同的小写字母代表处理间差异在< 0.05水平上显著。其中正常磷(P)处理的磷浓度为180 mmol/L,低磷(LP)处理的磷浓度为18 mmol/L。
Data are means ± SD (= 4). Different letters mean significantly difference at< 0.05. P, 180 mmol/L, LP, 18 mmol/L.
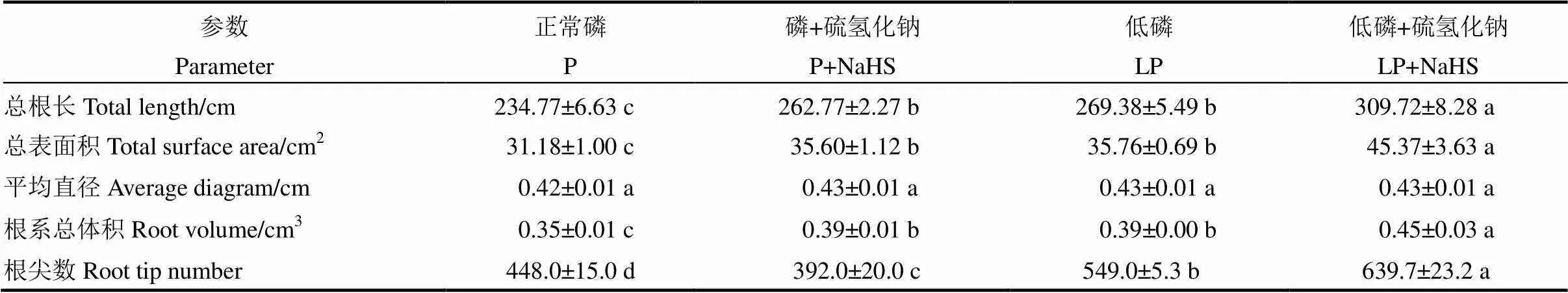
表3 水稻根系发育相关指标
数据用均数±标准差(=4)表示。不同的小写字母代表处理间差异在< 0.05水平上显著。其中正常磷(P)的磷浓度为180 mmol/L,低磷(LP)处理的磷浓度为18 mmol/L。
Data are means±SD (=4). Different letters mean significantly difference at< 0.05. P, 180 mmol/L, LP, 18 mmol/L.
酸性磷酸酶作为一种诱导酶,其活性显著受植物供磷水平的影响[40]。在玉米和黄瓜的研究中均发现,在缺磷胁迫下,植物体内的酸性磷酸酶活性显著增加[41, 42]。虽然酸性磷酸酶活性与植物耐低磷能力并不总是存在显著正相关[43],但是一般认为,植物在缺磷胁迫下提高酸性磷酸酶的活性,可以将体内的有机磷转化为无机磷,供植物再次利用;同时,酸性磷酸酶还能促进植物中的磷从衰老组织向幼嫩组织的转运,从而优先保证植物幼嫩组织的生长[44]。在本研究中发现,水稻根系和地上部的酸性磷酸酶活性在低磷条件下显著增加,并且用NaHS预处理后进一步提高了酸性磷酸酶的活性(图3),结合NaHS提高了低磷条件下水稻根系和地上部的总磷含量(图2),暗示H2S在一定程度上可以通过调节酸性磷酸酶的活性缓解水稻低磷胁迫。
植物体内分为PHT1、PHT2、PHT3和PHT4共4个磷转运子家族,分别负责转运细胞膜、叶绿体膜、线粒体膜和高尔基体膜上的磷。水稻的PHT1磷转运子家族共有13个基因成员(分别为~),在水稻体内磷的吸收和转运中分别起特定功能。目前研究发现,水稻体内的、和负责水稻体内磷的转运。主要在水稻根中柱中表达并且负责将磷从根部往地上部的运输;主要在水稻根表皮、皮质和中柱表达,具有磷吸收和体内转运双重功能[31];在水稻根系和叶片中表达,参与水稻体内磷库和源的再分配和磷的吸收[32]。在本研究中,在低磷条件下,用NaHS预处理后水稻木质部汁液中的磷含量显著高于单纯的低磷处理(图4),说明H2S提高了水稻根系中的磷往地上部的转运。磷转运子基因表达结果显示,在低磷条件下,、和三个基因的表达均比正常磷条件下显著增加,然而用NaHS预处理后,只有基因的表达进一步增加(图5),说明H2S通过调节磷转运子基因的表达提高体内磷从根部往地上部的转运。
Fig. 6. Phenotype of rice roots.
水稻磷转运子家族PHT1的其余成员在水稻磷吸收中也发挥重要作用。比如过表达基因显著增加水稻体内的磷含量和分蘖数[45]。磷转运子主要在水稻根系质膜上表达,负责水稻根系对外界磷的吸收并且与水稻胚的发育密切相关[47]。缺磷胁迫显著增加和基因的表达,并且在水稻中过表达这2个基因后,显著增加水稻在缺磷条件下和正常磷条件下对外界磷的吸收[34]。在本研究中,低磷胁迫显著增加了、、和的表达,并且在用NaHS预处理后进一步提高了它们的表达(图5),说明在低磷胁迫下,H2S主要通过调节以上4个基因的表达促进水稻从外界吸收磷。低磷胁迫同时促进了、和的表达,但是NaHS预处理并没有进一步增加它们的表达(图5),说明以上3个基因受缺磷胁迫诱导,但是不受H2S调节。测定的基因中,只有基因的表达在4个处理下均未有显著变化(图5),其主要原因是基因是一个组成型基因,它的表达不受外在磷含量的影响[47]。
过氧化物在植物体内持续产生,并且在遭受胁迫时大量产生[48]。在胁迫条件下,植物体内产生和积累的大量活性氧物质,比如H2O2,·OH−,O2·−对植物的质膜造成过氧化损伤,从而影响植物正常生长。植物体内存在抗氧化酶系统,主要负责将植物体内的活性氧物质进行还原,从而缓解过氧化损伤。超氧化物歧化酶主要负责催化植物体内的超氧化阴离子自由基,将其转化成氧和H2O2[49]。过氧化氢酶、过氧化物酶和抗坏血酸过氧化物酶均负责还原植物体内的过氧化物,从而缓解过氧化损伤[48]。在本研究中,缺磷条件下,用NaHS预处理后,水稻根部和地上部的抗氧化酶的活性均显著增加(表2),从而进一步清除水稻体内的过氧化物,缓解由于缺磷而导致的过氧化损伤。
改变根系构型是植物缓解缺磷胁迫的有效手段之一。在缺磷胁迫下,植物的根系在土壤中的空间布局发生变化,更多的根分布在含磷量较高的表层土壤[5],同时由于铁元素的大量积累,缺磷条件下植物的主根伸长受到抑制[50],然而,植物根系的侧根和根毛却能大量生长和伸长[6, 51],增加植物根冠比,从而促进植物对环境中磷的吸收。比如缺磷时,甜菜的侧根显著增多增长[6],黑麦草根毛含量显著增加[7],从而提高磷吸收。在本研究中,低磷条件下水稻根系的总根长、总表面积、总体积和总根尖数均显著增加(图6和表3),说明水稻也通过改变根系构型来响应缺磷胁迫。用NaHS预处理后,以上4个指标均进一步增加(图6和表3),说明H2S还通过调节水稻根系构型的变化,增加其对外界磷的吸收,从而缓解缺磷胁迫。
4 结论
在低磷条件下,H2S通过调控酸性磷酸酶活性,提高磷转运子基因表达和改变根系构型扩大水稻对外界磷的吸收以及体内磷的转运平衡。同时H2S还通过调节抗氧化酶的活性减少低磷胁迫导致的过氧化损伤,从而最终缓解缺磷胁迫。
[1] Marschner H. Mineral Nutrition of Higher Plants. 2nd edn.Boston, MA, USA: Academic Press, 1995.
[2] Vance C P, Uhde-Stone C, Allan D L. Phosphorus acquisition and use: Critical adaptations by plants for securing a nonrenewable resource., 2003, 157: 423-447.
[3] Shen J B, Yuan L X, Zhang J L, Li H G, Bai Z H, Chen X P, Zhang W F, Zhang F S. Phosphorus dynamics: From soil to plant., 2011, 156: 997-1005.
[4] Holford I. Soil phosphorus: its measurement, and its uptake by plants., 1997, 35: 227-240.
[5] Lynch J P, Brown K M. Topsoil foraging-an architectural adaptation of plants to low phosphorus availability., 2001, 237: 225-237.
[6] Steingrobe B, Schmid H, Claassen N. Root production and root mortality of winter barley and its implication with regard to phosphate acquisition, 2001, 237: 239-248.
[7] Clarkson D T, Nutrient interception and transport by root systems. Physiological processes limiting plant productivity, London: Butterworths, 1981: 307-330.
[8] Bolan N, Elliott J, Gregg P, Weil S. Enhanced dissolution of phosphate rocks in the rhizosphere., 1997, 24: 169-174.
[9] Otani T, Ae N, Tanaka H. Phosphorus (P) uptake mechanisms of crops grown in soils with low P status: Ⅱ. Significance of organic acids in root exudates of pigeonpea, 1996, 42: 553-560.
[10] Theodorou M E, Plaxton W C. Metabotic adaptations of plant respiration to nutrional phosphate deprivation., 1993, 101: 339-344.
[11] Miller S S, Liu J Q, Allan D L, Menzhuber C J, Fedorova M, Vance C P. Molecular control of acid phosphatase secretion into the rhizosphere of proteoid roots from phosphorus-stressed white lupin, 2001, 127: 594-606.
[12] Zhu C Q, Zhu X F, Hu A Y., Wang C, Wang B, Shen R F. Differential effects of nitrogen forms on cell wall phosphorus remobilization are mediated by nitric oxide, pectin content, and phosphate transporter expression, 2016. 171: 1407-1417.
[13] Chapin L J, Jones M L. Ethylene regulates phosphorus remobilization and expression of a phosphate transporter() during petunia corolla senescence., 2009, 60: 2179-2190.
[14] Wang B, Tang X, Cheng L, Zhang A Z, Zhang W H, Zhang F S, Liu J Q, Cao Y, Allan D L, Vance C P, Shen J B. Nitric oxide is involved in phosphorus deficiency -induced cluster-root development and citrate exudation in white lupin, 2010, 187: 1112-1123.
[15] Li L, Rose P, Moore P.K. Hydrogen sulfide and cell signaling., 2011, 51: 169-187.
[16] Zhang H, Tan Z Q, Hu L Y, Wang S H, Luo J P, Jones R L. Hydrogen sulfide alleviates aluminum toxicity in germinating wheat seedlings., 2010, 52: 556-567.
[17] Zhang H, Tang J, Liu X P, Wang Y, Yu W, Peng W Y, Fang F, Ma D F, Wei Z J, Hu L Y. Hydrogen sulfide promotes root organogenesis in Ipomoea batatas, Salix matsudana and Glycine max, 2009, 51: 1086-1094.
[18] García-Mata C, Lamattina L. Hydrogen sulphide, a novel gasotransmitter involved in guard cell signalling, 2010, 188: 977-984.
[19] Wang B L, Shi L, Li Y X, Zhang W H. Boron toxicity is alleviated by hydrogen sulfide in cucumber (L.) seedlings, 2010, 231: 1301-1309.
[20] Li Z G, Ding X J,. Du P F. Hydrogen sulfide donor sodium hydrosulfide-improved heat tolerance in maize and involvement of proline, 2013, 170: 741-747.
[21] 朱春权, 朱晓芳, 沈仁芳. 硫化氢促进缺磷条件下水稻根系细胞壁磷的再利用土壤, 2018, 50: 51-58.
Zhu C Q, Zhu X F, Shen R F. Hydrogen sulfide promote rice () cell wall P remobilization under P starvation condition., 2018 50: 51-58. (in Chinese with English abstract)
[22] Zhang H, Ye Y K, Wang S H, Luo J P, Tang J, Ma D F. Hydrogen sulfide counteracts chlorophyll loss in sweetpotato seedling leaves and alleviates oxidative damage against osmotic stress, 2009, 58: 243-250.
[23] Chang C, Hu Y S, Zhu Y, Ma G, Xu G H. Proton pump OsA8 is linked to phosphorus uptake and translocation in rice., 2009, 60: 557-565.
[24] Toshiaki T, Hiroshi S. Secretion of acid phosphatase by the roots of several crop species under phosphorus -deficient conditions, 1991, 37: 129-140.
[25] Beauchamp C, Fridovich I. Superoxide dismutase: improved assays and an assay applicable to acrylamide gels., 1971, 44: 276-287.
[26] Dhindsa R S, Plumbdhindsa P, Thorpe T A. leaf senescence: correlated with increased levels of membrane permeability and lipid peroxidation, and decreased levels of superoxide dismutase and catalase, 1981, 32: 93-101.
[27] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts., 1981, 22: 867-880.
[28] Chen J, Wang W H, Wu F H, You C Y, Liu T W, Dong X J, He J X, Zheng H L. Hydrogen sulfide alleviates aluminum toxicity in barley seedlings, 2013, 362: 301-318.
[29] Che J, Yamaji N, Shao J F, Ma J F. Silicon decreases both uptake and root-to-shoot translocation of manganese in rice., 2016, 67: 1535-1544.
[30] Zhang H, Xue Y H, Wang Z Q, Yang J C, Zhang J H. Morphological and physiological traits of roots and their relationships with shoot growth in “super”rice., 2009, 113: 31-40.
[31] Ai P, Sun S, Zhao J, Fan X R, Xin W J, Guo Q, Yu L, Shen Q R, Wu P, Miller A J. Two rice phosphate transporters, OsPht1; 2 and OsPht1; 6, have different functions and kinetic properties in uptake and translocation., 2009, 57: 798-809.
[32] Jia H, Ren H, Gu M, Zhao J N, Sun S B, Zhang X, Chen J Y, Wu P, Xu G H. The phosphate transporter gene OsPht1; 8 is involved in phosphate homeostasis in rice., 2011, 156: 1164-1175.
[33] Liu F, Wang Z, Ren H,Shen C, Li Y, Ling H Q, Wu C, Lian X, Wu P.suppresses the function ofin the regulation of expression ofand phosphate homeostasis in shoots of rice., 2010, 62: 508-517.
[34] Wang X, Wang Y, Piñeros M A, Wang Z, Wang W, Li C, Wu Z, Kochian LV, Wu P. Phosphate transportersandare involved in phosphate uptake in rice, 2014, 37: 1159-1170.
[35] Xia J, Yamaji N, Ma J F. A plasma membrane-localized small peptide is involved in rice aluminum tolerance., 2013, 76: 345-55.
[36] Zhou J, Jiao F C, Wu Z C, Li Y Y, Wang X M, He X W, Zhong W Q, Wu P.is involved in phosphate- starvation signaling and excessive phosphate accumulation in shoots of plants, 2008, 146: 1673-1686.
[37] Li H, Guo L, Tao C, Yang L M, Wang X Z. Nonredundant regulation of rice arbuscular mycorrhizal symbiosis by two members of thegene family, 2012, 24: 4236-4251.
[38] Paszkowski U, Kroken S, Roux C, Briggs SP. Rice phosphate transporters include an evolutionarily divergent gene specifically activated in arbuscular mycorrhizal symbiosis., 2002, 99: 13324-13329.
[39] Zhu C Q, Zhang J H, Sun L M, Zhu L F, Abliz B, Hu W J, Zhong C, Bai Z G, Sajid H, Cao X C, Jin Q Y. Hydrogen sulfide alleviates aluminum toxicity via decreasing apoplast and symplast Al contents in rice, 2018, 9.
[40] Dracup M N H, Barrett-Lennard E G, Greenway H, Robson, A D. Effect of phosphorus deficiency on phosphatase activity of cell walls from roots of subterranean clover, 1984, 35: 466-480.
[41] 庞欣, 张福锁, 李春俭. 部分根系供磷对黄瓜根系和幼苗生长及根系酸性磷酸酶活性影响. 植物生理与分子生物学学报, 2000, 26: 153-158.
Pang X, Zhang F S, Li C J. Effect of the part of P-supply roots on cucumber seedling growth, P concentration in shoot and root and secreted acid phosphatase activity by root., 2000, 26: 153-158. (in Chinese with English abstract)
[42] 樊明寿, 徐冰, 王艳. 缺磷条件下玉米根系酸性磷酸酶活性的变化. 中国农业科技导报, 2001, 3: 33-36.
Fan M S, Xu B, Wang Y. Acid phosphatase activities of intact roots and ground root tissues of maize grown in high P or low P nutrient solution., 2001, 3: 33-36. (in Chinese with English abstract)
[43] 张丽梅, 郭再华, 张琳, 贺立源. 缺磷对不同耐低磷玉米基因型酸性磷酸酶活性的影响. 植物营养与肥料学报, 2015, 21: 898-910.
Zhang L M, Guo Z H, Zhang L, He L Y. Effect of phosphate deficiency on acid phosphatase activities of different maize genotypes tolerant to low-P stress., 2015, 21: 898-910. (in Chinese with English abstract)
[44] 黄宇, 张海伟, 徐芳森. 植物酸性磷酸酶的研究进展华中农业大学学报, 2008, 27: 148-154.
Huang Y, Zhang H W, Xu F S. Research progress on plant acid phosphatase., 2008, 27: 148-154. (in Chinese with English abstract)
[45] Seo H M, Jung Y, Song S, Kim Y, Kwon T, Kim D H, Jeung S J, Yi Y B, Yi G, Nam M H. Increased expression of, a high-affinity phosphate transporter, enhances phosphate acquisition in rice., 2008, 30: 1833-1838.
[46] Zhang F, Sun Y, Pei W, Jain A, Sun R, Cao Y, Wu X, Jiang T, Zhang L, Fan X. Involvement ofin phosphate acquisition and mobilization facilitates embryo development in rice., 2015, 82: 556-569.
[47] Sun S, Gu M, Cao Y, Huang X P, Zhang X, Ai P H, Zhao J N, Fan X R, Xu G H. A constitutive expressed phosphate transporter,, modulates phosphate uptake and translocation in phosphate-replete rice., 2012, 159: 1571-1581.
[48] Suzuki N.Suzuki N, Miller G, Morales J, Shulaev V, Torres M A, Mittler R. Respiratory burst oxidases: The engines of ROS signaling., 2011, 14: 691-699.
[49] Marques A T, Santos S P, Rosa M G, Rodrigues M A, Abreu I A, Frazão C, Romão C V. Expression, purification and crystallization of MnSOD from., 2014, 70: 669-672.
[50] Ward J T, Lahner B, Yakubova E, Salt D E, Raghothama K G. The effect of iron on the primary root elongation ofduring phosphate deficiency, 2008, 147: 1181-1191.
[51] Bates T R, Lynch J P. Root hairs confer a competitive advantage under low phosphorus availability, 2001, 236: 243-250.
Physiological and Molecular Mechanisms of Hydrogen Sulfide Enhancing Phosphorus Absorption and Transportation in Rice
ZHU Chunquan, CAO Xiaochuang, ZHU Lianfeng, BAI Zhigang, HUANG Jie, LIANG Qingduo, JIN Qianyu, ZHANG Junhua*
(,,,;Corresponding author,:)
Low phosphorus (P) stress is one of the main factors limiting rice yield. Hydrogen sulfide (H2S) is produced in rice under flooding conditions. However, whether H2S is involved in the regulation of rice response to phosphorus deficiency stress as a signal molecule is still unclear.The content of H2S in rice was determined under normal and low P conditions to illuminate the role that H2S plays in regulating rice response to P deficiency stress.Rice was pretreated with 2 μmol/L H2S precursor NaHS for 1 day, then cultured for another 6 days under P sufficient and deficient conditions. The total P contents, acid phosphatase activity, antioxidant enzyme activity, xylem P concentration, P transporter genes’ expression and rice root architecture were determinedto explore the physiological and molecular mechanism of H2S in regulating rice response to phosphorus deficiency stress.Low P stress significantly increased the content of H2S in rice roots and shoots. NaHS pretreatment significantly increased total P contents, root acid phosphatase activity, root antioxidant enzymes activity, xylem P concentration and stimulated the expression of P transporter genes. Meanwhile, NaHS pretreatment modified rice root architecture, including increased total root length, total root surface area, total root volume and total root tip numbers. Therefore, our present study demonstrated that H2S improved P absorption and translocation in rice under P deficiency conditions and finally alleviate P deficiency stress in rice.
rice; P deficiency stress; H2S; P transporter; root architecture
S143.2; S511.01
A
1001-7216(2019)06-0532-09
10.16819/j.1001-7216.2019.9055
2019-05-13;
2019-07-31。
国家重点研发计划资助项目(2016YFD0101801);国家自然科学基金面上项目(31872857);浙江省自然科学基金资助项目(LY18C020005);国家公益研究所基础研究基金资助项目(2017RG004-2)。
