烟草叶形突变体的形态特征与关键基因表达差异研究
2020-03-15周蕾张彦张娟吴晓颖马兴华
周蕾, 张彦, 张娟, 吴晓颖, 马兴华
(1.中国农业科学院烟草研究所,农业农村部烟草生物学与加工重点实验室,山东 青岛 266101; 2.中国农业科学院研究生院, 北京 100081)
叶片发育遵循着一个基本的模式,叶原基(shoot apical meristem,SAM)从植物地上部分的顶端分生组织周围区起始发育,经过一系列细胞分裂和分化的程序最终发育为成熟的叶片[1]。叶原基最初进行细胞分裂,产生大小一致且体积较小的新细胞。随后,细胞分裂逐渐减弱至停止,叶片的继续发育主要靠个体细胞的增大,最终形成完整的叶片。叶片大小的突变通过影响细胞分裂与扩展这两个过程,进而影响到细胞的数目与体积的大小。龙海馨[2]通过对水稻窄叶突变体进行细胞学观察,发现窄叶突变体的细胞大小变化不明显,细胞数目显著减少,从而确定叶片变窄主要是由于细胞数量减少造成的。Yang等[3]研究发现,拟南芥atcsp3突变株植株整体较小,莲座叶发育不全呈圆形且叶片卷曲,栅栏组织叶肉细胞在突变体叶片中体积较小。在an3或ant突变体中,细胞数量的减少与细胞大小的增加有关,但叶面积最终还是会呈现减小的趋势[4-5]。除此之外,AtGRF1和AtGRF2的过表达导致叶片和子叶变大,AtGRF1-AtGRF3的三插入缺失突变体叶片和子叶较小[6]。DELLA蛋白降低了细胞增殖速率,减慢细胞的扩展速度,抑制植物的生长发育[7]。AtRPT2a突变体表现出一种因细胞体积增加而导致叶片增大的特殊表型[1,8]。
烟草是我国的重要经济作物,以收获叶片为目的,叶片的大小与烟叶产量和品质密切相关。烟叶的大小受多种农艺措施的调控,付仲毅[9]研究发现,滴灌更能促进烟叶长和宽的生长;刘继坤[10]研究发现,随着种植密度的降低,烟叶的长、宽增加;秦燚鹤等[11]研究发现,增施腐熟秸秆处理后,烟叶面积增加;杨兴有[12]研究发现,随着光强减弱,上部烟叶与中部烟叶的长宽变化呈抛物线变化趋势。上述研究主要集中于农艺措施对烟叶大小的影响研究,关于烟草叶片大小差异的机理研究尚少。本研究以烟草品种‘红花大金元’的两个叶形突变体为试验材料,通过叶片的形态指标和解剖学特征比较以及关键基因表达量的分析,初步解析烟草叶片大小差异的机理。
1 材料与方法
1.1 试验材料
试验所用材料为烟草(NicotianatabacumL.)品种‘红花大金元’及其两个突变体(突变体1和突变体2),种子均来自中国农业科学院烟草研究所中国烟草突变资源生物信息库和利用平台。
1.2 试验方法
1.2.1植株培养 按照烟草托盘育苗法进行育苗操作和管理,育苗基质(泥炭和蛭石比例为1∶1)经120 ℃灭菌20 min后装盘。将烟草种子均匀播撒于播种盘中,3周后选择长势均匀一致的幼苗移栽到花盆中,规格为10 cm×10 cm(底面直径×高),置于温度为23~28 ℃,相对湿度为60%~70%的温室中培养120 d。
1.2.2烟叶生长指标测定 取中部全展叶,用卷尺人工测量叶长、叶宽,以叶长/叶宽表示叶形指数(leaf shape index)。叶面积计算参考肖强等[13]的方法。后将烟叶置于烘箱中105 ℃杀青15 min,然后70 ℃下烘干至恒重,称取干重,计算比叶重(leaf mass per area, LMA)[14]。
LMA=叶干重/叶面积
1.2.3叶形态解剖学特征比较 取中部全展叶,用蒸馏水清洗干净。在叶片中部,距离叶脉0.5 cm处切取面积1 cm2的组织,参考Tsukaya等[15]的方法,在 FAA 固定液(体积百分比5%醋酸,体积百分比45%乙醇和体积百分比5%福尔马林)中固定,然后经酒精逐级脱水,将预埋材料切割成2 μm厚的切片,用甲苯胺蓝、藏红花素以及橙色G进行染色,中性树胶封片,利用光学显微镜(NIKON Eclipse Ci,上海衡浩仪器有限公司)观察海绵层的纵切面以及叶片的横切面。用镊子撕取叶片下表皮并制成临时装片,用光学显微镜(Leica DMC 2900,上海徕卡仪器有限公司)观察细胞形态。细胞形态指标采用Image J 1.52r软件进行测量,细胞数目估算参考黄淦等[16]方法。
1.2.4RNA提取和qRT-PCR 为了验证与叶片大小相关基因在两个突变体以及野生型叶片中的表达情况,参考已发表的拟南芥、番茄和马铃薯的叶片发育基因,在茄科基因组数据库(Sol Genomics Network:http://www.sgn.cornell.edu)以及美国国立生物技术中心(NCBI:http://www.ncbi.nlm.nih.gov)数据库中搜索,筛选得到12个与叶片形态大小有关的基因,用于qRT-PCR分析,这些基因主要通过影响细胞的数量和体积大小进而控制叶片的大小,详细基因信息见表1。于苗期(七叶期)取新生叶位的叶片,迅速置于液氮,-80 ℃保存,用RNA提取试剂盒MiniBEST Plant RNA Extraction Kit(TaKaRa公司)提取RNA,琼脂糖凝胶电泳检测RNA的浓度和完整性,利用反转录酶Primescript RT reagent Kit(TaKaRa公司)将RNA反转录为cDNA,采用Primer Primer 5.0软件设计引物,以Actin为内参基因[17],引物由上海派森诺生物科技股份有限公司合成,序列见表2。定量体系为 20 μL,其中包含DNA 1 μL,SYBR qPCR Master Mix 10 μL,上下游引物各0.4 μL,DEPC水8.2 μL,3次重复。采用 2-△△Ct法[18]进行基因相对定量分析。

表1 基因信息Table 1 Gene information

表2 引物信息Table 2 Primer sequences
1.3 数据统计与分析
采用Microsoft Excel 2018和SAS 9.4进行数据分析和绘图。
2 结果与分析
2.1 叶形突变体的生长指标
不同叶形突变体的形态测量结果(表3)显示,突变体1的叶长、叶宽显著低于野生型,突变体2的叶长显著低于野生型,叶宽与野生型无显著差异。突变体1与野生型的叶形指数和叶面积均存在显著差异,突变体1的叶形指数为野生型的2.52倍,叶面积为野生型的10.12%,该突变体最显著的特征是叶宽生长受到抑制,其叶宽仅为野生型的25.88%。突变体2的叶形指数与野生型无显著差异,叶面积却显著小于野生型,主要是叶长生长受到抑制,突变体2的叶长为野生型的78.82%。此外,突变体与野生型的叶片鲜重和干重也存在差异。突变体1与突变体2的单叶鲜重显著小于野生型,但突变体2的叶片干重与野生型无显著差异。突变体1的比叶重为野生型的1.91倍,突变体2的比叶重为野生型的1.35倍,说明突变体1与突变体2叶片较厚。
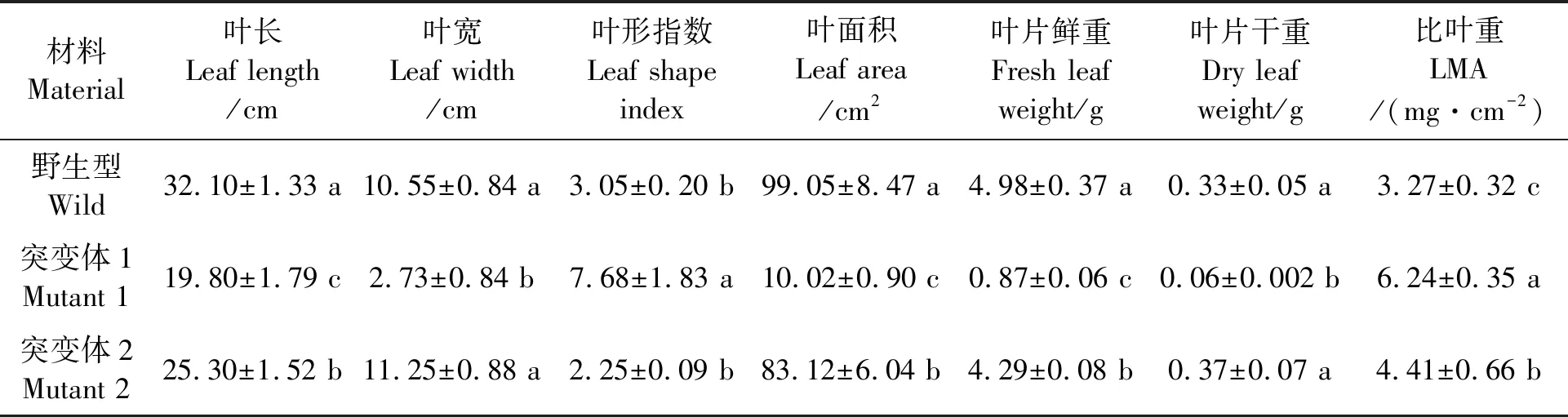
表3 突变体与野生型叶片形态指标Table 3 Leaf morphological indexes of wild and mutants of tobacoo plants
2.2 叶形突变体的叶片解剖结构比较
不同材料的叶片解剖结构结果(图1A-I)可见,突变体1叶片下表皮细胞的褶皱稍弱,细胞形状整体较规则;突变体2下表皮细胞的褶皱较强,细胞形状不规则。与野生型相比,突变体1的海绵组织细胞排布更为紧凑,而突变体2的海绵组织细胞排布更为疏松。突变体1与野生型的叶片栅栏组织细胞大小基本一致,且排列整齐,突变体2的栅栏组织细胞排布相对杂乱。

注:A:野生型下表皮纵切面;B:突变体1下表皮纵切面;C:突变体2下表皮纵切面;D:野生型海绵层纵切面;E:突变体1海绵层纵切面;F:突变体2海绵层纵切面;G:野生型叶片横切面;H:突变体1叶片横切面;I:突变体2叶片横切面;J:0.067 5 mm2视野下海绵组织的细胞数目;K:海绵组织的估算细胞总数。柱子上的不同小写字母表示不同材料间差异在P<0.05水平有统计学意义。Note: A: Paradermal sections of lower epidermis of wild; B: Paradermal sections of lower epidermis of mutant 1; C: Paradermal sections of lower epidermis of mutant 2; D: Paradermal sections of spongy layer of wild; E: Paradermal sections of spongy layer of mutant 1; F: Paradermal sections of spongy layer of mutant 2; G: Cross section of the leaf lamina of wild; H: Cross section of the leaf lamina of mutant 1; I: Cross section of the leaf lamina of mutant 2; J: Cell amount in 0.067 5 mm2 area; K: Estimated cell amount. Different lowercase letters on the top of column indicate statistically significant differences between different materials at P<0.05 level.图1 野生型与突变体叶片解剖结构Fig.1 Leaf anatomy of wild and mutants of tobacco plants
为进一步明确突变体1与突变体2海绵组织细胞出现差异的原因,统计了相同视野大小中海绵组织细胞的数目,结果(图1J)显示,相同部位相同面积情况下,突变体2叶片的细胞数目显著少于野生型,突变体1的细胞数目略高于野生型,但差异不显著。通常叶片中细胞数目的不同可能会导致叶片大小差异,因此对叶片中同一层海绵组织的细胞总数进行估算,结果(图1K)显示,与野生型相比,突变体1与突变体2叶片中的海绵组织细胞总数均显著减少。
野生型和突变体的不同叶片组织结构统计结果(表4)显示,突变体1和突变体2的叶片厚度均显著大于野生型。突变体1的栅栏组织厚度显著高于野生型,而海绵组织厚度与野生型没有显著差异,因此突变体1叶片较厚主要是由于栅栏组织较厚。突变体2的叶片海绵组织厚度显著高于野生型,而栅栏组织厚度与野生型没有显著差异,因此其叶片较野生型厚,主要是因为海绵组织更厚。突变体1、突变体2与野生型的栅栏组织/海绵组织比值均小于1,其中突变体1的栅栏组织/海绵组织比值显著高于野生型。与野生型相比,突变体1的海绵组织细胞直径较小,突变体2的海绵组织细胞体积较大。因此,突变体2叶片厚度的增加与海绵组织细胞体积的增加有关。

表4 突变体与野生型叶片组织结构比较Table 4 Leaf structure of WT and mutants of tobacco plants
2.3 叶形突变体的基因表达比较
12个基因在3个材料中的表达量结果见图2,可见,突变体1中NtARF2-1、NtDA1、NtTOR1、NtARF10-2、NtEBP1、NtGRF8和NtGRF16共7个基因的表达与野生型有较大差异,其中NtEBP1基因表达量上调幅度最大,上调2.22倍;NtGRF8和NtGRF16基因表达量显著下调,表达量分别为野生型的16.06%和13.07%。突变体2中12个基因的表达量与野生型相比均有较大的差异,其中NtTOR1和NtARF10-1表达量上调幅度较大,分别上调3.17倍和2.51倍,NtARF2-1、NtARF2-2、NtDA1、NtGRF8、NtGRF16显著下调,其中NtGRF8、NtGRF16的下调幅度最大。在突变体1和突变体2中,NtTOR1、NtARF10-2和NtEBP1的基因表达量均显著高于野生型,NtGRF8和NtGRF16的基因表达量均显著低于野生型,表达量分别为野生型的13.43%和21.68%。NtARF2-1在突变体1中的表达量显著上调,在突变体2中显著下调。
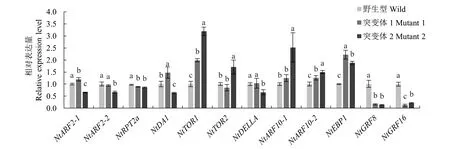
注:不同小写字母表示同一基因在不同材料间差异在P<0.05水平有统计学意义。Note: Different lowercase letters of the same gene indicate statistically significant differences between different materials at P<0.05 level.图2 叶发育关键基因的表达特性分析Fig.2 Analysis of expression characteristics of key genes in leaf development
3 讨论
叶片是植物进行光合作用与呼吸作用的主要器官,烟草叶片大小是影响烟草产量与质量的重要指标之一。突变体1与突变体2的叶面积均显著低于野生型。与野生型相比,突变体1的叶宽显著减小,突变体2的叶长生长受到抑制。在细胞水平上,叶片的生长受细胞增殖与细胞扩张两个过程共同调控,细胞体积增加后,细胞数量随之下降,反之,细胞数量减少,细胞体积增加[24]。大量研究表明[15,25-26],细胞数量与叶片大小之间存在直接的相关性,叶片大小生长受到的抑制往往与细胞数目的减少有关。本研究中,通过对叶片形态解剖学特征比较发现,突变体1与突变体2叶片细胞总数与野生型相比显著降低,这与以往的研究结果[18]相似。突变体1同一层海绵组织细胞总数仅为野生型的10.93%,细胞体积也显著低于野生型;突变体2的同一层海绵组织细胞总数为野生型的48.12%,细胞体积显著高于野生型。因此,与细胞体积相比,细胞总数的减少与突变体1和突变体2的叶形变化关系更密切。在相同大小视野下,突变体1的细胞体积显著低于野生型,细胞数目略高于野生型;突变体2的细胞数目显著低于野生型,细胞体积显著高于野生型。这种现象与Tsukaya[27]提出的经典细胞决定理论相同。这一理论强调了细胞状态和行为之间相互影响,即叶片细胞数量和体积相互补偿。本研究中,即使细胞数量与大小之间出现了相互补偿作用,叶片的最终大小仍然受到抑制,并且在突变体1中,这种抑制作用首先体现在中-边轴,突变体2中这种抑制作用首先体现在茎-顶轴。细胞数量与体积的补偿作用是否会对叶极性发育产生影响,有待进一步探讨。
目前,许多叶发育相关的关键基因、小分子 RNA 和生长素等调控因子被相继发现,它们之间复杂的相互作用也得到初步地阐述。Kim等[6]研究指出,过表达AtGRF2能够通过促进细胞体积的增加,进而促进叶面积的扩大。本研究发现,突变体1的细胞总数和体积显著低于野生型,而且NtGRF8和NtGRF16基因的表达量显著低于野生型,说明NtGRF8和NtGRF16基因的表达量与细胞体积密切相关,同时也可能控制细胞的数量。Li等[20]研究表明,AtDA1能够通过限制细胞的增殖,进而抑制叶片面积的增加。本研究中,NtDA1基因的表达量显著高于野生型,突变体1的细胞总数减少,这与Li等[20]研究结果相似。Deprost等[21]研究表明,随着AtTOR表达量的增加,拟南芥的莲坐叶叶面积逐渐增加,细胞大小也相应增加。本研究结果显示,突变体2的细胞体积显著大于野生型,并且NtTOR1和NtTOR2基因的表达量分别上调3.17和1.71倍,说明NtTOR1和NtTOR2基因的表达量与突变体2细胞体积的增加有关。Hendelman等[22]通过叶形态解剖学研究发现,过表达SlARF10后,细胞体积变小,叶片中细胞总数减少,进而抑制叶面积的增加。本研究中,突变体2的细胞总数显著低于野生型,NtARF10-1和NtARF10-2基因的表达量显著高于野生型,说明突变体2细胞总数的减少与NtARF10-1和NtARF10-2表达量的上调密切相关。Horváth等[23]研究指出,StEBP1表达量降低导致细胞体积增加,而过表达StEBP1则导致幼叶发育过程中细胞体积减小。本研究中,突变体1和突变体2幼叶中的NtEBP1的表达量显著高于野生型,突变体1中的细胞体积显著低于野生型,这与以往的研究结果相似,而突变体2中的细胞体积显著高于野生型,结合突变体2中NtTOR1、NtTOR2和NtARF10-2的表达情况,初步推测NtTOR1和NtTOR2的高表达能够恢复NtARF10-1、NtARF10-2和NtEBP1高表达所造成的细胞体积减小。因此,NtGRF8和NtGRF16表达量的下调与NtEBP1表达量的上调,可能是突变体1细胞体积小于野生型的原因,NtTOR1和NtTOR2表达量的上调可能是突变体2细胞体积大于野生型的原因,突变体1与突变体2中NtTOR1和NtTOR2的差异表达,可能是突变体1与突变体2细胞体积不同的原因。
