毕赤酵母不同甲醇利用表型M ut+和M uts表达FsGLUm基因的比较
2015-10-21杨玉霞罗艳丽张慧玲裴建华
杨玉霞,罗艳丽,张慧玲,汪 艳,陈 勇,*,裴建华
(1.新疆农业大学新疆肉乳用草食动物营养与饲料重点实验室,新疆乌鲁木齐830052;2.新疆农业大学草业与环境科学学院,新疆乌鲁木齐830052)
毕赤酵母不同甲醇利用表型M ut+和M uts表达FsGLUm基因的比较
杨玉霞1,罗艳丽2,张慧玲1,汪艳1,陈勇1,*,裴建华1
(1.新疆农业大学新疆肉乳用草食动物营养与饲料重点实验室,新疆乌鲁木齐830052;2.新疆农业大学草业与环境科学学院,新疆乌鲁木齐830052)
将来源于产琥珀酸丝状杆菌的β-葡聚糖酶基因根据毕赤酵母的偏好性进行密码子优化,通过全基因合成该优化基因(FsGLUm)并构建重组表达载体pPIC9K-FsGLUm。将pPIC9K-FsGLUm分别用SalⅠ和BglⅡ酶切线性化后电击转化入毕赤酵母GS115染色体DNA中,经过表型筛选和抗性筛选获得不同甲醇利用表型Mut+和Muts阳性菌株。经刚果红平板检测,在摇瓶水平下,Mut+型菌株表达产物产生的水解透明圈明显大于Muts型菌株表达产物。在发酵罐水平下,Mut+型菌株各时间段表达产物酶活性明显高于Muts型菌株。Mut+型菌株表达的酶活性在甲醇诱导96h达到最大值,为6424U/mL,比活性为2607U/mg,菌体干重为123.6g/L。Muts型菌株表达的酶活性在诱导后108h达到最大值,为119U/mL,比活性为1867U/mg,菌体干重为113.5g/L。以上结果表明,Mut+型毕赤酵母更有利于产琥珀酸丝状杆菌β-葡聚糖酶基因的表达。
产琥珀酸丝状杆菌,β-葡聚糖酶,毕赤酵母,甲醇利用表型
1,3-1,4-β-D-葡聚糖酶(EC 3.2.1.73,简称β-葡聚糖酶)在食品、饲料和纺织等领域具有广泛的应用[1-2]。目前,β-葡聚糖酶主要来源于可培养的细菌和真菌[3-4]。研究发现,在反刍动物瘤胃中,产琥珀酸丝状杆菌(Fibrobacter succinogenes)产生的β-葡聚糖酶(FsGLU)具有较高的比活性。Shyur等最早利用基因工程技术在大肠杆菌BL21(DE3)中表达FsGLU基因,通过去除β-葡聚糖酶C端部分氨基酸,其比活性增加了3倍;在90℃保持10m in后,剩余酶活性为初始活性的80%~85%[5]。Wen等则在毕赤酵母X-33中表达了FsGLU,其活性达到1940U/m L[6]。本实验室根据毕赤酵母对密码子的偏爱性、基因G+C含量以及mRNA折叠自由能对FsGLU基因进行了密码子优化,通过基因合成技术合成了FsGLUm基因,并构建了毕赤酵母表达载体pPIC9k-FsGLUm,FsGLUm基因在毕赤酵母中获得了表达[7]。
外源基因在毕赤酵母表达系统中的整合方式有两种:一种是在His4或5’AOX1 DNA片段的单酶切位点将质粒载体切成线性,通过插入整合进入酵母染色体,A0X1基因在表达时起主导作用,这样得到的利用甲醇正常型菌株(Mut+);另一种酶切质粒载体,释放出包含A0X1末端序列的表达盒,与宿主染色体上的A0X1基因发生基因置换,这样得到的表达菌株为A0X1缺陷型,它们代谢甲醇的速度明显减慢,为利用甲醇缓慢型菌株(Muts)[8]。由于不同表型菌株对甲醇利用速率不同,因此在表达外源基因的效率有所不同。哪种表型更适合外源基因的表达,则因不同基因而定。因此,不同的外源基因在毕赤酵母中表达时,需进行表型筛选,以获得相应基因的高水平表达菌株。
本研究通过不同方式将FsGLUm基因整合入酵母细胞GS115染色体DNA中,并对酶活性、菌体产量等进行比较,以筛选出FsGLUm基因高水平表达菌株,为其应用奠定基础。
1 材料与方法
1.1材料与仪器
毕赤酵母(Pichia pastoris)GS115、分泌型表达质粒pPIC9K新疆农业科学院微生物所;限制性内切酶、T4DNA连接酶、Taq DNA聚合酶等宝生物工程(大连)有限公司;DNA Marker、琼脂糖凝胶电泳回收试剂盒天根生化科技(北京)有限公司;大麦β-葡聚糖Sigma公司;遗传霉素G418硫酸盐北京鼎国昌盛生物技术有限责任公司;其他试剂国产分析纯;LB、YPD、MM、MD、RDB、BMGY、BMMY培养基参见Invitrogen公司毕赤酵母操作手册配制;FM 22和PMT4培养基参见Higgins等的方法配制[9]。
Mycycler PCR仪、Doc XR凝胶成像仪美国Bio-Rad公司;GeneQuant核酸蛋白检测仪美国Anersham Biosciences公司;ECM 399型电转化仪美国BTX公司;GUJS-10L型全自动发酵罐镇江东方生物工程设备技术有限责任公司;FiveEasy Plus pH仪和PL2002型电子天平梅特勒-托利多仪器有限公司;M ini spin plus离心机、移液器德国eppendorf公司。
1.2实验方法
1.2.1产琥珀酸丝状杆菌β-葡聚糖酶基因的优化和合成在GenBank中检索出FsGLU基因序列(登录号:M 33676)。选取FsGLU成熟肽编码区,利用密码子在线优化工具JCat对该编码区进行密码子优化。优化后序列送交上海生工生物有限公司进行合成。
1.2.2β-葡聚糖酶基因酵母重组表达载体的构建FsGLUm基因和毕赤酵母表达载体pPIC9K用EcoRⅠ和NotⅠ双酶切,酶切产物进行纯化回收。纯化的目的基因和表达载体采用T4连接酶连接,转化大肠杆菌DH 5α,随机挑选候选阳性菌落,接种于LB培养基中,37℃振荡培养过夜。取1m L菌液送交华大基因用于DNA测序,将DNA序列正确的重组质粒命名为pPIC9K-FsGLUm。
1.2.3酵母的电击转化及多拷贝重组子的筛选将构建好的载体pPIC9K-FsGLUm分别用限制性内切酶SalⅠ和BglⅡ酶切线性化,以1%琼脂糖凝胶电泳分离DNA片段,采用琼脂糖DNA纯化试剂盒回收目的DNA片段备用。取1~5μg目的DNA,以1500V,5ms电击转化80μL感受态毕赤酵母GS115后分别涂布于MD和RDB平板上,30℃培养2~4d直至长出转化子。挑取转化子分别点于筛选培养基MM和MD平板上,30℃培养2d。在MD与MM板上都正常生长的为甲醇利用正常型Mut+,在MD上生长正常而在MM上生长缓慢的为甲醇利用缓慢型Muts。根据不同酶切整合方式筛选不同表型转化子,即经SalⅠ酶切后获得的Mut+为阳性转化子,经BglⅡ酶切后获得的Muts为阳性转化子。挑取阳性转化子分别接种于0.5、1、2、4mg/m L G418硫酸盐的YPD平板进行多拷贝重组子筛选[7]。
1.2.4Mut+和Muts重组子的鉴定将上述筛选得到的抗4mg/m LG418硫酸盐的重组子扩大培养,通过煮-冻-煮的方法提取酵母基因组DNA[10],以此为DNA模板、5’AOX1/3’AOX1为上下游引物进行PCR鉴定。5’AOX1序列为5’GACTGGTTCCAATTGACAAGC3’,3’AOX1序列为5’GCAAATGGCATTCTGACATCC3’。PCR反应体系为ddH2O 11.0μL,10×PCR buffer 2.0μL,dNTP 2.0μL,上下游引物各0.5μL,模板DNA 3.0μL,Taq DNA聚合酶1.0μL。PCR扩增条件为95℃预变性5m in,94℃45s,65℃45s,72℃45s,进行33个循环,72℃最终延伸5m in。PCR产物经1%琼脂糖凝胶电泳后成像。对PCR鉴定正确的阳性菌落回收并纯化其目的DNA PCR产物,送交华大基因以5’AOX1/3’AOX1为上下游引物进行DNA双向测序。
1.2.5重组酵母在摇瓶及发酵罐水平的诱导表达
1.2.5.1Mut+和Muts重组子在摇瓶水平下的诱导表达将重组的Mut+型与Muts型酵母菌株分别划线接种于YPD固体培养基,28.5℃培养2d。用无菌牙签挑取Mut+型与Muts型单菌落分别接种于25m L和500m L BMGY培养基中,250×g,29.5℃,培养至OD600到2~6。将菌液3000×g下离心10m in,弃上清,收集菌体。Mut+和Muts用BMMY培养基重悬菌体,使OD600为1左右。将上述培养基在250×g,29.5℃下培养至96h。每24h添加甲醇,维持终浓度0.5%,并且每24h取样1m L于-80℃保存备用。培养结束后于12000×g离心5min,分别收集上清和沉淀,用于刚果红平板定性判断β-葡聚糖酶的活性。
1.2.5.2Mut+和Muts重组子在发酵罐水平下的诱导表达将筛选的Mut+型与Muts型酵母菌株分别划线接种于YPD固体培养基,28.5℃培养2d。用无菌牙签挑取单克隆于600m L YPD液体培养基中,28.5℃培养至OD600到6。将种子液接种到含有FM 22培养基的10L发酵罐中,其他发酵条件参照Higgins等的方法进行[9]。根据培养基溶解氧浓度控制甲醇的流速,Mut+菌株甲醇流加速率平均为3.0m L/(L·h),Muts菌株甲醇流加速率为1.2m L/(L·h)。在甲醇流加24h后,每12h取10m L样品,用于测定酶活性、蛋白质含量和菌体质量。
1.2.6酶活性、蛋白质含量和菌体质量的测定
1.2.6.1刚果红平板定性鉴定制备含0.5% β-葡聚糖的琼脂平板,取表达产物上清液20μL加入平板孔穴中,在37℃下孵育1h,用0.1%的刚果红溶液染色30m in,再用1mol/L的NaCl脱色30m in。根据透明圈的大小初步判断表达产物酶活性大小[11]。
1.2.6.2菌体湿重和干重的测定取1m L发酵液在1000×g下离心10m in,完全弃去上清后,称量细胞重量即为菌体湿重,然后在60℃下烘至恒重,即为菌体干重。
1.2.6.3β-葡聚糖酶活性和比活性的测定采用DNS法测定β-葡聚糖酶活性。取适当稀释的酶液200μL,0.8%的大麦葡聚糖200μL(用pH5.0的缓冲液配制),于37℃反应5m in,立即加入1m L DNS,振荡混匀后于95℃水浴显色5m in,冷却后加入3.6m L去离子水,振荡混匀后于540nm处测定吸光度。定义在pH 5.0、37℃条件下,每分钟水解产生1μmol葡萄糖所需的酶量为1个酶活性单位(U)。以牛血清白蛋白为标准,采用Brad ford法测定,发酵液中的蛋白质质量。比活性(U/mg)=酶活性(U)/蛋白质质量(mg)。
2 结果与分析
2.1重组表达载体pPIC9K-FsGLUm的构建与鉴定
将抽提的pPIC9K-FsGLUm质粒经EcoRⅠ和NotⅠ双酶切后产生了1条900bp左右的条带(图1),与目的基因的分子大小基本一致,初步证实目的基因成功插入载体pPIC 9K。重组质粒利用5’AOX1/3’AOX1双向测序和DNA序列比对后,确认合成目的基因序列无误并与pPIC 9K重组成功。

图1 毕赤酵母表达酶切质粒鉴定Fig.1 Identification of expression plasmids for P.pastoris by restriction endonuclease digestion
2.2Mut+和Muts菌株的筛选
pPIC9K-FsGLUm重组质粒分别经SalⅠ和BglⅡ线性化后电击转化入毕赤酵母GS115,涂板于相应的培养基板上,分别长出480和132个表型为HIS+的转化子。将所有转化子在MM与MD板上进行表型鉴定发现,以SalⅠ线性化后转化得到101个Mut+型菌落,以BglⅡ线性化后转化得到23个Muts型菌落。再经YPD-G418板筛选,抗4mg/m L G418的转化子共有11个,其中Mut+型菌落9个,Muts型菌落2个。
2.3Mut+和Muts菌株的鉴定
酵母染色体DNA经PCR和琼脂糖凝胶电泳后发现,GS115的PCR产物在2.2kb有一条清晰的条带,为酵母基因组中AOX1条带。GS115-pPIC9K的PCR产物在2.2kb和0.5kb有两条清晰的带,为酵母基因组中AOX1条带和pPIC 9K中α因子条带。Mut+型菌株的PCR产物在2.2kb和1.05kb处可见两条清晰条带,为酵母基因组中AOX1条带和pPIC9K-FsGLUm中α因子及目的基因条带。Muts型菌株的PCR产物只在1.05kb处有一条清晰的条带,为pPIC9K-FsGLUm中α因子及目的基因条带(图2)。以上结果表明目的基因已经成功整合入酵母基因组上,而且Mut+型为单交换整合,Muts型为置换整合。PCR产物DNA测序进一步证明,FsGLUm基因序列正确。
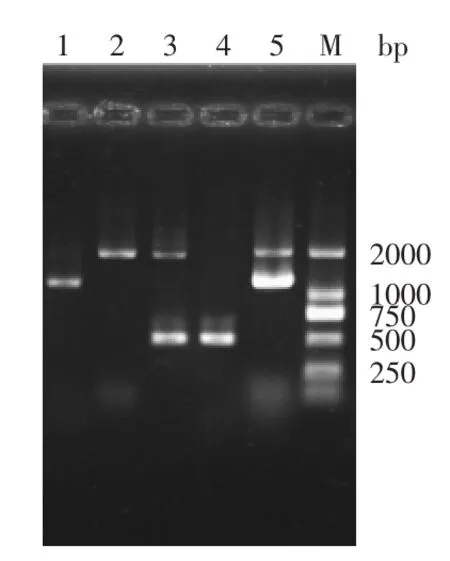
图2 重组毕赤酵母PCR鉴定Fig.2 Identification of recombinant P.pastoris by PCR
2.4Mut+和Muts菌株表达β-葡聚糖酶活性的鉴定
从图3中可以看出,受体酵母菌GS115和转化空表达载体pPIC9K的酵母菌在培养96h后,培养上清未检测到β-葡聚糖酶活性。Mut+型(176号)和Muts型(611号)菌株在诱导0h时均无β-葡聚糖酶活性。Mut+型菌株在36h和96h时透明圈直径分别为19mm和23mm,而Muts型菌株的透明圈直径仅为8mm和11mm。这表明Mut+型和Muts菌株表达产物均具有β-葡聚糖酶活性,且酶活性随时间的延长而增加,Mut+型表达产物的酶活性高于Muts型菌株。
2.5Mut+和Muts菌株在发酵罐水平下表达β-葡聚糖酶的比较
2.5.1Mut+和Muts菌体生长的比较如图4所示,在发酵罐水平条件下,Mut+和Muts菌体湿重及干重均随发酵时间的延长而增加,Mut+在诱导后96h时菌体湿重和干重均达到最大值,为274.6g/L和123.6g/L。而Muts型菌株则在诱导后120h达到最大值,分别为267.3g/L和113.5g/L。在前108h时间段,Mut+湿重及干重均高于Muts,在120h时两者则基本相同。

图3 Mut+型和Muts型菌株β-葡聚糖酶的刚果红平板检测Fig.3 Congo-plate test forβ-glucanase activity ofMut+and Mutsstrains

图4 Mut+和Muts菌体湿重和干重的比较Fig.4 Comparison ofwet and dry cellsweightofMut+and Mutsstrain
2.5.2Mut+和Muts菌株β-葡聚糖酶活性及比活性的比较如图5和图6所示,随时间的延长,Mut+和Muts菌株表达的β-葡聚糖酶活性和比活性均不断增加。Mut+型菌株从诱导开始酶活性和比活性开始增加,在96h时达到最大值,分别为6424U/m L和2607U/mg;Muts型菌株则在诱导60h后才开始表达,在108h时才达到最大值,分别为119U/m L和1867U/mg。Mut+型菌株最高酶活性及比活性均高于Muts型菌株,Mut+型菌株的酶活性是Muts型菌株的53倍,且Mut+型菌株到达最高表达量的时间早于Muts型菌株。

图5 Mut+和Muts菌株酶活性变化曲线Fig.5 Change curve of Enzyme activity ofMut+and Mutsstrains

图6 Mut+和Muts菌株酶比活性变化曲线Fig.6 Change curve of specific activity ofMut+and Mutsstrains
3 讨论
巴氏毕赤酵母GS115是一种能利用甲醇作为唯一碳源的微生物。在以甲醇为碳源时,GS115代偿性地大量产生醇氧化酶。在毕赤酵母基因组中有A0X1和A0X2两种基因编码醇氧化酶。细胞中90%醇氧化酶活性由A0X1提供,剩余的10%由A0X 2提供[12]。在本实验中,以SalⅠ对pPIC9k-FsGLUm重组载体线性化,载体上His4基因与酵母染色体上His4位点之间发生单交换事件,结果FsGLUm基因插入染色体DNA His4位点。由于基因组上A0X1基因被保留,因此细胞利用甲醇能力正常,在甲醇介质上生长较快,获得了表达FsGLUm基因Mut+型菌株。当用BglⅡ对pPIC9k-FsGLUm线性化时,载体及基因组中A0X1启动子及3’A0X1区发生双交换事件,FsGLUm基因以交换形式整合到酵母染色体DNA上,AOX 1基因被置换敲除,大部分的醇氧化酶活性丧失,细胞利用甲醇能力降低,因而细胞在甲醇介质上生长很慢,即获得的菌株表型为Muts。无论是Mut+型菌株还是Muts型菌株,以甘油或葡萄糖为碳源时二者生长速度并无区别,而以甲醇为碳源时,Mut+型菌株的生长显著快于Muts型菌株[13-14]。
到目前为止,大部分的研究集中在Mut+型菌株上,因为Mut+型菌株利用甲醇速度快,因此被认为表达外源蛋白质的水平也高。然而,一些研究发现,Muts型菌株表达外源蛋白质水平优于Mut+型菌株。由此看来,究竟Mut+型菌株还是Muts型菌株更适合外源基因的表达,还要因具体情况而异。在本研究中Mut+型菌株表达的FsGLUm活性远高于Muts,这主要与A0X的启动子活性有关。研究发现,当毕赤酵母以甲醇为唯一碳源时,A0X1可占细胞中可溶性蛋白质的30%,而A 0X2的活性仅占细胞中A0X总活性的15%,表明A0X1的启动子pA0X1的活性要明显强于A0X 2的启动子pA0X2[15]。这也导致Mut+型和Muts型菌株在表达外外源基因时表现出不同的特性。
每种表型都有其各自的特点,Muts型菌株在甲醇诱导阶段的生长能力要明显劣于Mut+型菌株,但是在某些外源蛋白的表达上既可以消耗较少的甲醇又达到了较高的表达水平。而Mut+型菌株则可以适应培养基中较高的甲醇浓度,抵抗甲醇毒害的能力也优于Muts型菌株[15]。在本研究中,Mut+型酵母菌的前期生长速度明显快于Muts型菌株,而到120h时,二者的菌体质量基本相同。这可能与Mut+和Muts型菌株的甲醇利用速度和延迟有关。在诱导初期,Mut+型菌株利用甲醇速度较快,培养基中的甲醇累积较少,而Muts型菌株利用甲醇较Mut+型菌株慢,培养基中的甲醇浓度可能较高,而影响了宿主菌的生长。研究发现,高浓度甲醇易产生有害的代谢产物如甲醛和过氧化氢的累积而导致细胞死亡[16]。毕赤酵母对甲醇利用呈非线性指数增长,当渡过延迟期后,宿主细胞逐渐增加,对甲醇的利用也相应自增加,甲醇累积减少,生长速度加快。以毕赤酵母表达美洲商陆抗病毒蛋白基因时,Mut+型菌株在诱导培养48h后即有表达,而Muts型菌株在72h才有微弱表达,但表达产物的活性无显著差异[14]。
外源基因在Mut+和Muts型菌株中的表达水平因不同基因而异。张齐等利用毕赤酵母表达真菌α-淀粉酶时发现,Mut+型菌株的产酶活性一直高于Muts,在发酵终点Muts型菌株的酶活最终只达到Mut+型菌株的78.6%[8]。Kim等用重组毕赤酵母表达Coprinus cinereus过氧化物酶时,Mut+型菌株比Muts型菌株的酶活性高3倍,酵母细胞生长速度快2倍[17]。但Barba Cedillo等分别以Muts和Mut+表型的重组子在毕赤酵母中表达甾醇酯酶,结果显示Muts型菌株的比活是Mut+型菌株的2倍[18]。在本研究中,无论是在摇瓶水平还是发酵罐水平,Mut+型菌株的酶活性均高于Muts型菌株,Mut+型菌株的最高酶活性是Muts型菌株最高酶活性的53倍,且Mut+型菌株到达最高表达量的时间早于Muts型菌株。导致上述差异的原因之一是外源基因的分子量。有报道认为,Mut+型菌株表达速率较快,适于小分子蛋白的表达;尽管Muts型菌株达到生长缓慢,最高表达量的诱导时间较长,但大分子可正确折叠、加工和修饰,因此更适于大分子的表达[19]。
流加适宜的碳源是提高外源基因在毕赤酵母中表达的重要措施之一,特别是对于Muts型菌株来说,更是如此。甘油、山梨醇、乳酸与甲醇的混合添加均可以提高毕赤酵母表达碱性果胶酶的产量,其中山梨醇与甲醇的混合流加效果最为显著。通过双碳源混合流加可以提高细胞活性,增强醇氧化酶活性,提高毕赤酵母表达外源蛋白效率[20]。在本研究中,流加碳源为甲醇时,β-葡聚糖酶的活性达到了6424U/m L。通过进一步优化流加碳源的组合,琥珀酸丝状杆菌β-葡聚糖酶在毕赤酵母GS115中的表达水平可能还有继续提高的空间。
4 结论
产琥珀酸丝状杆菌β-葡聚糖酶基因在毕赤酵母GS115 Mut+型和Muts型菌株中均得到分泌表达,Mut+型菌株较Muts型菌株诱导表达时间更短,表达水平更高,更适宜该基因的表达。
[1]刘德海,王红云,刘金娥.饲用β-葡聚糖酶的研究及应用进展[J].饲料工业,2011(S1):37-39.
[2]毕静.β-葡聚糖酶在啤酒生产中的应用研究[J].中国酿造,2011(9):105-106.
[3]唐艳斌,闫巧娟,江正强,等.枯草芽孢杆菌产β-1,3-1,4-葡聚糖酶的响应面优化[J].微生物学通报,2013,40(4):551-557.
[4]刘晓玲,王金晶,李永仙,等.产β-1,3-1,4-葡聚糖酶特基拉芽孢杆菌Bacillus tequilensis CGX5-1发酵培养基的优化[J].食品与生物技术学报,2013,32(6):645-650.
[5]Shyur L F,Chen JL,Yang N.Truncated form of Fibrobacter succinogenes 1,3-1,4-β-D-glucanase with improved enzymatic activity and thermo-tolerance[P].USA:US7037696 B1,2006
[6]Wen T N,Chen JL,Lee SH,et al.A truncated Fibrobacter succinogenes 1,3-1,4-D-glucanase with improved enzymatic activity and thermotolerance[J].Biochemistry,2005,44(25):9197-9205.
[7]杨玉霞.产琥珀酸丝状杆菌1,3-1,4-β-葡聚糖酶基因在毕赤酵母中的表达[D].乌鲁木齐:新疆农业大学,2014.
[8]张齐,李松,沈微,等.重组巴斯德毕赤酵母Muts型与Mut+型菌株产真菌α-淀粉酶发酵性能的比较[J].工业微生物,2013,43(3):44-50.
[9]Higgins D R,Cregg JM.Pichia protocols[M].In Methods in Molecular Biology,1998,103:1-264.
[10]唐天乐,高炳淼,长孙东亭,等.高质量毕赤酵母基因组DNA提取方法比较[J].生物技术通报,2010(1):196-199.
[11]Shumiao Z,Huang J,Zhang C,et al.High-level expression of an aspergillusniger endo-β-1,4-glucanase in Pichia pastoris through gene codon optimization and synthesis[J].Journal of Microbiology and Biotechnology,2010,20(3):467-473.
[12]Hellwig S,Emde F,Raven N PG,et al.Analysis of singlechain antibody production in Pichia pastoris using on-line methanol control in fed-batch and mixed-feed fermentations[J]. Biotechnology and Bioengineering,2001,74(4),344-352.
[13]彭毅,步威,康良仪.甲醇酵母表达系统[J].生物技术通报,2000(1):38-41.
[14]周倩,王锡锋,李莉,等.毕赤酵母Mut+和Muts重组子表达美洲商陆抗病毒蛋白基因的比较[J].植物病理学报,2003,33(5):425-428.
[15]Krainer FW,Dietzsch C,Hajek T,etal.Recombinantprotein expression in Pichia pastoris strainswith an engineered methanol utilization pathway[J].Microbial Cell Factories,2012,11:22.
[16]ZhangW H,Bevins M A,Plantz B A,et al.Modeling Pichia pastoris growth on methanol and optimizing the production a recombinant protein,the heavy-chain fragment C of botulinum neurotoxin,serotype A[J].Biotechnology and Bioengineering,2000,70(1):1-8.
[17]Kim S J,Lee J A,Kim YH,et al.Optimization of the functional expression of Coprinus cinereus peroxidase in Pichia pastoris byvaryingthe host andpromoter[J].Journal of Microbiology and Biotechnology,2009,19(9):966-971.
[18]Barba Cedillo V,Arnau C,Martínez MJ,et al.Production of a sterol esterase from 0 phiostoma piceae in batch and fed-batch bioprocesses using different Pichia pastoris phenotypes as cellfactory.Biotechnology progress,2014,doi:10.1002/btpr.1939.[Epub ahead of print]
[19]郭美锦,朱泰承,张明.重组毕赤酵母甲醇利用表型与基因拷贝数对外源基因表达的影响[J].中国生物工程杂志,2007, 27(7):7-11.
[20]汪志浩,张东旭,李江华,等.混合碳源流加对重组毕赤酵母生产碱性果胶酶的影响[J].生物工程学报,2009,25(12):1955-1961.
Evaluation of Mut+and MutsPichia pastoris phenotypes for expression of Fibrobacter succinogenesβ-glucanase gene
YANG Yu-xia1,LUO Yan-li2,ZHANG Hui-ling1,WANG Yan1,CHEN Yong1,*,PEI Jian-hua1
(1.Xinjiang Key Laboratory of Herbivore Nutrition for Meat&Milk Production,Xinjiang Agricultural University,Urumqi830052,China;2.Collage of Grassland and Enviroment Science,Xinjiang Agricultural University,Urumqi830052,China)
Accord ingto the codon op tim ization of Pichia pastoris,β-g lucanase gene fromFib robacter succinogenes(FsGLUm)was synthesized and the recombinant exp ression vec tor,named pPIC9K-FsGLUm,was constructed.With SalⅠand Bg lⅡ,the pPIC9K-FsGLUm was linearized and theβ-g lucanase gene was electroporated into chromosome DNA of Pichia pastoris GS115.The d ifferent methanol utilization phenotype positive strains,Mut+and Muts,were ob tained after phenotype and resistance screening.In the shake flask level,the halo zones on Congo red p late p roduced by exp ression p roducts of Mut+strain were significantly larger than that of Mutsstrain.In the fermenter level,β-g lucanase activity exp ressed by Mut+strain was significantly higher than those of Mutsstrain in each time period.Enzyme activity,specific enzyme activity,and d ry cellweight of Mut+strain reached the maximum of 6424U/m L,2607U/mg,and 123.6g/L,respectively at 96h aftermethanol induction.While,that of Mutsstrain reached the maximum of 119U/m L,1867U/mg,and 113.5g/L,respectively at 108h after induction.The above results showed that,Mut+strain of Pichia pastoris GS115 was more conducive for exp ression of Fib robacter succinogenesβ-g lucanase gene.
Fibrobac ter succinogenes;β-g lucanase;Pichia pastoris;methanolutilization phenotype
TS201.3
A
1002-0306(2015)06-0220-06
10.13386/j.issn1002-0306.2015.06.041
2014-06-23
杨玉霞(1988-),女,硕士研究生,研究方向:酶工程。
陈勇(1972-),男,博士,教授,研究方向:酶的基因工程。
新疆维吾尔自治区科技支疆项目(201191138);新疆维吾尔自治区高技术研究发展项目(201211104);自治区重点产业紧缺人才专业大学生创新项目(JQRCP32010023)。
