家鸡免疫性状调控基因研究进展
2024-02-02曹建艳闫世雄张瑞芳豆腾飞
曹建艳 闫世雄 张瑞芳 豆腾飞
摘要 鸡的免疫性状是一种由多个微效基因调控的经济性状。随着规模化和集约化养鸡业的发展,家鸡免疫功能受环境中的病原体影响加重,传统的疾病治疗方案受限。应用分子生物学技术手段,探究家鸡的免疫相关基因的调控机制,有助于从根本上提高家鸡的免疫力。对家鸡免疫系统进行了概述,从免疫防治和疾病方向综述了TLRs、MHC、MX、IFN、NRAMP和IL等影响家鸡免疫性状的关键调控基因,旨在为家鸡抗病育种提供理论依据。
关键词 家鸡;免疫;调控基因;抗病育种
中图分类号 S831 文献标识码 A
文章编号 0517-6611(2024)02-0010-05
doi:10.3969/j.issn.0517-6611.2024.02.003
开放科学(资源服务)标识码(OSID):
Progress in Gene Regulation of Immune Traits in Domestic Chickens
CAO Jian-yan, YAN Shi-xiong, ZHANG Rui-fang et al
(College of Animal Science and Technology, Yunnan Agricultural University, Kunming,Yunnan 650201 )
Abstract The immune trait in chickens is an economic trait regulated by several microgenes. With the development of large-scale and intensive chicken industry, the immune function of domestic chickens is more affected by the pathogens in the environment, and the traditional disease treatment programs are limited. The application of molecular biology technology to explore the regulation mechanism of immune-related genes in domestic chickens helps to fundamentally improve the immunity of domestic chickens. This paper gives an overview of the immune system of domestic chickens, reviews the key regulatory genes of TLRs, MHC, MX, IFN, NRAMP, IL and so on, aiming to provide a theoretical basis for the breeding of disease resistance.
Key words Domestic chicken;Immunity;Gene regulation;Breeding of disease resistance
基金项目 云南省邱声祥专家工作站项目(202005AF150039);云岭产业技术领军人才项目(YNWR-CYJS-2015-027)。
作者简介 曹建艳(1997—),女,云南大理人,硕士研究生,研究方向:动物营养与饲料科学。
*通信作者,讲师,博士,从事动物遗传育种研究。
收稿日期 2022-10-27;修回日期 2023-03-22
家鸡是疾病研究重要的理想实验动物模型,其饲养周期短、新陈代谢快以及繁殖力高,但是易受环境因素的影响,应激较大。集约化养殖的快速发展使高密度下生存的鸡群健康受到严重影响,免疫力降低和发病率提高,导致养殖体经济损失。家鸡的免疫功能与其生产性能息息相关,其免疫性状受到多个基因网络调控。影响家鸡免疫性状的因素包括环境、遗传、应激源、母源抗体、免疫抑制和疫苗接种等。在家鸡的选种育种中,免疫性状的选择对抗病育种具有重要意义。与家鸡免疫相关的基因是不断进化的,面对快速进化和多样化的病原体动物群,高免疫基因多样性可以为宿主提供选择性优势。随着分子生物学研究的介入,如SNP芯片技术、全基因组测序技术、GWAS和MAS,免疫调控的基因逐续被发现。该研究对家鸡免疫系统进行概述,从免疫防治和疾病方向综述了影响家鸡免疫性能的关键调控基因,旨在为分子辅助标记选择提供理论基础,从根本上提高家鸡免疫力,培育出抗病力增强的配套系,充分利用家鸡品种资源。
1 家鸡免疫系统概述
免疫系统可以识别自身和非己物质,是机体产生免疫应答和执行免疫功能的物质基础,包括免疫器官、免疫细胞和免疫分子。广义上免疫系统可以分为天然免疫和获得性免疫,前者在遇到病原体时反应迅速,相对稳定且非特异性,后者分为正反应和负反应,且具有特异性和免疫记忆。这2个系统都有一定的生理机制,当病原微生物入侵,宿主免疫系统对其识别并做出免疫应答,通过破坏和清除抗原性异物,发挥抗感染作用、维持宿主生理平衡和免疫监视作用。家鸡免疫系统通过产生抗体和细胞免疫对抗原刺激,是抗病最重要的機制,但是天然免疫和获得性免疫都不可以独立发挥作用,通常是协同作用的。天然免疫可以通过特异性模式识别受体(PRRs)识别宿主微生物分子中的病原相关分子模式(PAMPs),诱导免疫应答和炎症反应,对宿主早期抗感染有重要作用。PRRs能够介导天然免疫调节获得性免疫,主要机理是微生物感染机体后,通过胞内或胞外,抗原递呈细胞激活天然免疫反应,识别并清除病原体,发挥淋巴细胞介导的抗原特异性免疫作用。
2 与家鸡免疫性状相关的调控基因
2.1 TLRs
Toll样受体(TLRs)是最早被研究发现的天然免疫模式识别受体,PAMPs的识别导致天然免疫被激活,特异性抗原产生,介导TLR信号传导,信号通路由MyD88依赖性通路和TRIF依赖性通路(MyD88非依赖性途径)组成,两者都可以诱导基因表达。与哺乳动物一样,所有鸡的TLRs具有相同的蛋白质二级结构,由几个富含亮氨酸的结构域、一个跨膜结构域和Toll/白细胞介素-1受体结构域组成。
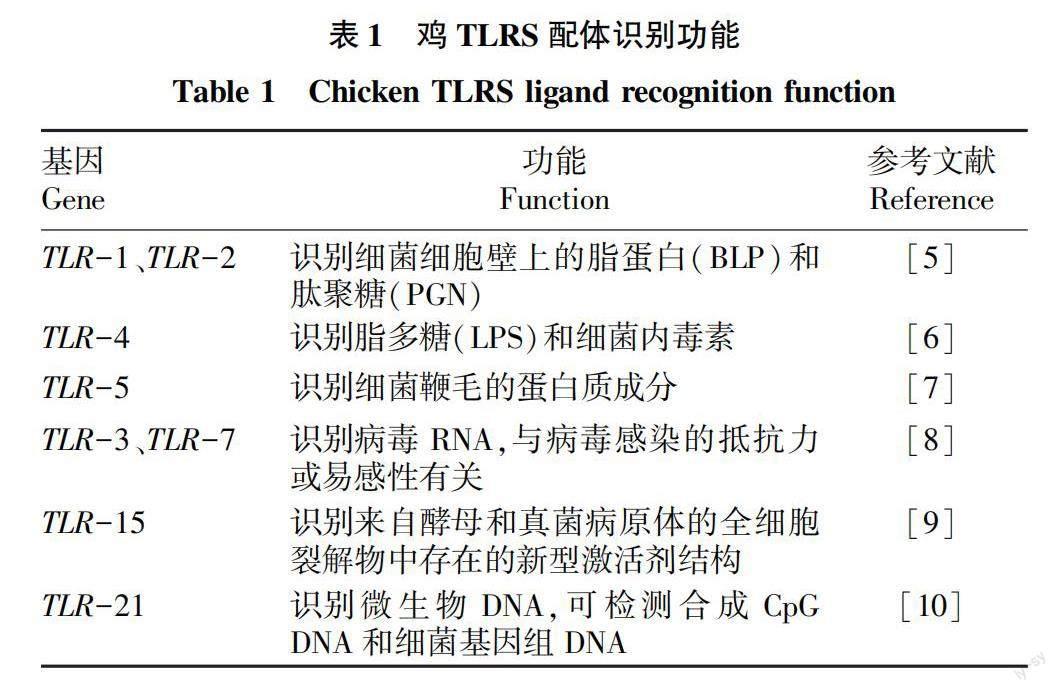
目前,在鸡中已经发现了10个TLRs基因,包括TLR1-Ⅰ、TLR1-Ⅱ、TLR2-Ⅰ、TLR2-Ⅱ、TLR-3、TLR-4、TLR-5、TLR-7、TLR-15和TLR-21,它们可以识别配体并参与TLR信号通路。已研究发现的TLRs识别配体功能见表1。Fukui等在2001年,用基于小鼠和果蝇进行序列的简并引物设计从鸡法氏囊cDNA文库中克隆2种类型的TLR,首次研究发现鸡TLR-1和TLR-2。TLRs基因在鸡大多数组织中都表达,只有少部分基因表现出更受限的表达模式。TLR2仅在鸡盲肠扁桃体、脾脏、肝脏、法氏囊、B细胞、CD8 +细胞和嗜异性细胞中表达。TLR-4仅在DC、自然杀伤(NK)细胞和单核细胞的表面上表达,部分在内皮细胞中也表达。TLR的多态性可以影响病原微生物入侵宿主时的反应。研究表明,TLR-4、TLR-15、TLR-21、MD-2、ILs、IFN和iNOS是针对沙门氏菌感染的耐药基因。TLR-4中的G247A位点与肠炎沙门氏菌的耐药性增加有关。Chen 等研究发现,TLR-2、 MyD88、 NF-κB 3条信号通路可以激活鸡毒支原体(MG)染后NLRP3炎症小体,降低自噬水平和能量代谢受损,引发炎症反应,从而导致鸡胸腺组织损伤,免疫失调。Tian等研究表明,TLR2-Ⅱ和TLR-6在MG感染时均上调,随后下游NF-κB介导的炎症反应上调。TLR的表达模式不同,对鸡的病原体产生不同反应,可能与其遗传调节和免疫增强有联系,但是TLR在引起抗病性的个体作用是有限的。Zhang等报道,鸡骨髓巨噬细胞系HD11中毒性新城疫病毒的复制增强,是由于抑制TLR7对细胞的激活而导致的。Barjesteh等研究发现,TLR-2、TLR-4和TLR-21配体能够在巨噬细胞中诱导IL-1β、IFN-γ、IRF7和IFN-β的表达,与H4N6禽流感病毒(AIV)复制减少有关。
2.2 MHC
鸡主要组织相容性复合体(MHC)是在16号染色体长臂上发现的一组编码宿主主要组织相容性抗原的基因簇,最主要的功能是参与免疫调控,与抗病性密切相关,影响病原体入侵的反应性和易感性,具有多基因型和多态性的特点。鸡MHC 目前已知至少由F、L和G 3个区域组成,编码为Ⅰ类、Ⅱ类和Ⅳ类,G区域是鸡特有的,F区域和L区域相连紧密,也被称为B-F / B-L区域。B复合体(B complex)是第1个在分子水平上表征的非哺乳动物MHC。在MHC上,除B位点外,还有Rfp-Y和Rfp-Y。鸡MHC在鸡基因组中跨越约209 kb区域中含有约46个基因。鸡MHC小而简单,但是含有哺乳动物MHC基因的基本对应物,常被认为是最小的必须基因集。
Kim等研究表明,BF1和BF2免疫功能不相同,BF1负调节NK细胞杀伤活性,BF2限制抗原特异性CTL免疫反应。MHC与鸡多种病毒性和细菌性疾病之间存在抗性,如禽流感、马立克氏病、肉瘤病、新城疫、禽白血病、沙门氏菌和大肠杆菌感染等,探究其中的分子机制,有利于鸡生长发育,能够更好地应用在育种实践中。研究表明,鸡MHC B单倍型对雏鸡呼吸道病原体具有更有效免疫反应。B21单倍型对病毒的宿主抵抗力高于鸡肉中B2单倍型。MHC Ⅰ类和Ⅱ类基因均对沙门氏菌属(SE)的耐药性有作用效果,B18和B15可以诱导SE的死亡。对B2、B12、B13、B19和B21 MHC同源的白来航鸡品系和具有不同背景基因但具有相同B2 MHC单倍型的品系,鼻内接受低剂量的高致病性禽流感病毒。研究发现,B21影响H5N1高致病性禽流感暴发的存活率,B13 与其高死亡率相关。MHC对致癌逆转录病毒Rous肉瘤病毒(RSV)控制复杂,各种B基因型之间的RSV肿瘤反应的差异可能由于肿瘤特异性抗原的免疫识别或免疫系统对病毒复制的影响。MHC单倍型B(Q)和B17之间的等位基因互补可以影响免疫应答,增加红细胞肉瘤的消退。多个研究表明,MHC决定马立克病毒(MDV)的差异性抗性。研究报道,在孵化白来航鸡感染禽白血病病毒J亚组(ALV-J)毒株后,免疫反应受到B单倍型的影响。鸡胚胎感染新城疫病毒(NDV)后诱导的先天免疫反應可能由MHC位点遗传控制。同样的,Li等研究发现,MHC B-LBII的不同位点与LH、LWH和BR 3个本土鸡群的SRBC、ND和AI抗体滴度的抗体有显著相关性,影响免疫性状。Alber等研究发现,不止MHC-Ⅰ类抗原与家禽大肠杆菌感染抗菌天然免疫反应有关,MHC-II也有同样的作用,表明 B-F/B-L区域的研究有重要意义。
2.3 Mx
Mx蛋白是一种GTP酶活性的三磷酸鸟苷(GTP)结合蛋白,是主要由Ⅰ型干扰素诱导的基因产物,对致病性RNA病毒具有先天性抗性。研究发现,鸡Mx基因的整个长度跨度约为21 kb,1号染色体上有13个外显子,5′端非编码区的多样性最高,3′端非编码的多样性最低。不同宿主物种的抗病毒活性或能力与Mx基因家族基因数的变化以及Mx基因上游调节因子的存在有关。
在家鸡上研究较多的主要是Mx基因对新城疫病毒和禽流感病毒的影响。Mpenda等采用候选基因和选择性基因分型相结合的方法,首次研究发现鸡Mx基因启动子多态性与鸡胚胎存活变异性及新城疫病毒存在关联。Zhang等将具有抗病毒感染的Mx和NA 2种蛋白对新城疫病毒耐药性进行试验。研究发现,2个基因结合在一起对病毒感染的抵抗力要优于单个基因。家鸡Mx蛋白通过阻断复制周期的早期阶段来抑制多种病毒的扩繁,可以有效对抗禽流感病毒。Ewald等研究表明,Mx1 Asn631变异等位基因对降低感染高致病性AIV(H5N2)的鸡的发病率、早期死亡率、病毒脱落和细胞因子反应有影响。除此之外,陶换等运用q RT-PCR技术,检测法氏囊病病毒(IBDV)感染后白来航公鸡的法氏囊和脾脏中Mx的 mRNA表达水平。结果表明,法氏囊和脾脏中Mx的转录水平随着IBDV在法氏囊中的增殖而迅速升高,脾脏中转录水平变化更快,而IBDV减少后Mx的转录水平下降,为Mx蛋白与法氏囊病毒之间作用的抗病毒机制提供进一步研究的理论依据。通过对Mx基因的多态性的检测,可以筛选能够产生对传染病具有抗性的品种,为抗病育种提供借鉴。Mx蛋白的抗病毒能力与基因位点、来源以及易感性有关。研究发现,鸡Mx蛋白在631氨基酸位点的多态性可以改变抗病毒活性和细胞内分布位置,鸡Mx蛋白的抗病毒特异性由羧基末端的氨基酸取代决定。Gosu 等通过分子建模与动态模拟,揭示了野生型和突变型chMx之间结构和动力学差异的信息,为研究与chMx蛋白抗病毒活性相关的S631N突变体的结构特征提供帮助。Sironi等使用PCR-RFLP基因分型的方案,再次解释了与S631N突变相关的Mx基因多态性。
通过分析多个鸡系和祖先品种与禽流感病毒复制的抗性或易感性相关的Mx基因密码子,发现肉鸡品系相对于蛋鸡品系,在易感性等位基因方面具有较高的频率,且该差异在祖先品种中也存在。
2.4 NRAMP
天然抗性相关巨嗜蛋白(NRAMP)家族可以通过细胞膜运输必需的过渡金属微量营养素,如铁和锰,在生物体内充当金属离子转运蛋白,并且和细胞内病原体的耐药性相关。NRAMP1和NRAMP2是NRAMP的同源物,NRAMP1可以从吞噬体中提取必需金属来帮助杀死被吞没的病原体,有利于先天免疫系统的金属抑制防御;NRAMP2可以促进饮食中的铁摄取和供应红细胞前体的铁的全身分布。目前在家鸡上研究较多的是NRAMP1,它与鸡沙门氏菌的抗性有关,遗传的差异取决于基因的多态性。Dar等发现,受感染鼠伤寒沙门氏菌的鸡的盲肠、肝脏和脾脏中NRAMP基因mRNA表达显著增加,表明NRAMP1和NRAMP2基因在鼠伤寒沙门氏菌诱导疾病中具有特定作用。Liu等将近交系肉鸡父系和3种不同的高自交系杂交产生的F后代接種致病性SE,检测脾脏和盲肠细菌负荷和抗体水平。结果表明,NRAMP1基因的Ser379位SNP与SE感染后雏鸡的脾脏细菌减少相关,也与SE疫苗的抗体产生有关。Hu等研究发现,与易感雏鸡相比,抗SE感染的雏鸡中由异嗜性粒细胞和脾脏中NRAMP1 mRNA上调而引起的宿主免疫增强更明显和出现更早。关于NRAMP与家鸡免疫相关的报道较少,国内将NRAMP1基因与免疫性状进行相关分析,为分子标记育种提供新依据。胡国顺等采用PCR - SSCP 技术检测如皋鸡和隐性白羽鸡Nramp1基因第 9 外显子的多态性,并对不同基因型与免疫性状进行联合分析。结果初步显示,如皋鸡的综合免疫性能优于隐性白羽鸡,AA 基因型的综合免疫性能优于 AB 型和 BB 型。仇玲玲等研究表明,斗鸡AA基因型的综合免疫性能要优于AB和BB型,可作为一种高抗性基因型。
2.5 IFN
干扰素(IFN)是一类广谱的抗病毒剂,对DNA病毒和RNA 病毒都具有抑制作用,能够增强宿主自然杀伤有害细胞的活性,调节免疫的自身稳定。IFN不会直接杀死或抑制病毒,而是通过转录诱导大量干扰素刺激的基因(ISG)发挥抗病毒作用。Dai等采用RNA测序技术,在鸡中鉴定了25种Ⅰ型、299种Ⅱ型和421种Ⅲ型干扰素刺激基因(ISG)。Ⅰ型IFN是鸡先天免疫系统的关键抗病毒剂,尤以IFN-α和IFN-β代表。与IFN途径的激活相关的细胞模式识别受体(PRRs)主要包括RLRs家族、TLR家族和DNA传感器家族。chISG可防止病毒在鸡细胞内的复制和传播,是针对禽流感病毒病原体的有效抗病毒药物。鸡TRIM25可以抑制鸡的白血病病毒的复制并上调鸡中MDA5受体介导的Ⅰ型干扰素反应。Susta等将鸡IFN-γ基因的编码序列插入高毒力NDV菌株的基因组中,测定IFN-γ表达量。结果发现,相比对照组,在4周龄鸡中致病性显著降低,表明IFN-γ的早期表达对鸡中高毒力新城疫病毒感染的影响具有显著的保护作用。Masuda等研究表明,鸡肉IFN-λ抑制鸡胚胎成纤维细胞中的流感病毒复制;与鸡肉IFN-γ和IFN-β相比,需要更高的剂量来实现有效的抗病毒活性并诱导ISG。张贝从全基因组水平上对鸡IFITM/IFIT基因家族成员进行鉴定,研究表明IFITM2、IFITM3和IFIT5参与禽流感病毒诱发的免疫反应,IFIT5是H5N1病毒早期诱导免疫应答的枢纽基因。Kint等研究报道,感染伽马冠病毒(IBV)会诱导原代肾细胞、气管上皮细胞和鸡细胞系中I型IFN反应的激活,IBV的辅助蛋白3a和3b参与调节转录以及I型IFN的蛋白质产生,首次全面分析了伽马冠病毒与禽类先天免疫反应的宿主病毒相互作用。
2.6 IL
白細胞介素(IL)是在白细胞或免疫细胞间相互作用的细胞因子,可以刺激B细胞和T细胞增殖以及CTL活化,参与炎症反应,在免疫调节和疾病防控方面越来越被人们重视。白介素种类众多,鸡IL-6是一种热休克基因,是炎症的负调节因子。鸡IL-9可能是一种分子量为25 kD的糖基化蛋白质,重组 IL-9在激活单核细胞/巨噬细胞和促进 CD3 T 细胞增殖方面具有生物学活性。鸡IL-26在T细胞中表达,通过JAK / STAT和NF-κB信号通路激活T细胞和巨噬细胞的分子结合,诱导促炎细胞因子的表达。白细胞介素治疗成本较高,在动物疾病中应用较少,但是蛋白纯化效果较好,在疫苗开发有很大前景。Huo 等研究报道,鸡chIL-2和chIL-7具有协同增效的作用,可以增强VP2 DNA疫苗在鸡中针对鸡传染性法氏囊病毒的免疫性和保护功效。崔凯玲等采用基因佐剂配合鸡球虫活疫苗对雏鸡进行免疫攻毒试验,研究结果表明,IL-4 和 IL-2重组基因佐剂可提高鸡球虫活疫苗的免疫效果,缩短免疫产生期和免疫间隔。Wang等对180只感染的京海黄鸡DNA进行测序,用于检测IL-8基因启动子区中的单核苷酸多态性(SNP)。结果显示,IL-8基因启动子区的突变对球虫病耐药指数具有显著的调控作用。Wang 等从无特异性(SPF)鸡胚胎脾脏细胞中克隆了全长鸡IL-18基因,通过联合注射IL-18质粒和灭活新城疫病毒疫苗,在鸡中检查ChIL-18质粒的潜在遗传佐剂活性。结果表明,IL-18质粒和NDV疫苗的共用能够增强体液和细胞水平上的免疫反应,是一种适用于NDV疫苗接种的新型免疫佐剂。
3 结语
该研究重点从免疫防治和疾病方向综述了TLRs、MHC、MX、IFN、NRAMP和IL 等影响家鸡免疫性状的关键调控基因,可以为抗病新品种的培育提供理论基础。随着养殖业的变革,疾病发生严重威胁整个行业的发展,饲养过程中大量滥用抗生素的现象将不复存在,如何减少药物或疫苗使用量,减少病原体在宿主中的传播,提高动物的抗病力和免疫力,是今后疾病防控的趋势。现代分子生物技术的发展与应用可以为今后家禽免疫系统的结构与功能研究、抗病与免疫基因的发掘利用、免疫信号传导机制以及临床免疫和抗病育种提供技术支撑。目前对免疫机制的研究报道更多的是关注特异性免疫,在未来的研究中,需要更加关注非特异性免疫,为疾病的防控与治疗提供新的思路。
参考文献
[1]CHAPMAN J R,HELLGREN O,HELIN A S,et al.The evolution of innate immune genes:Purifying and balancing selection on β-defensins in waterfowl[J].Mol Biol Evol,2016,33(12):3075-3087.
[2]刘争辉,韩代书.模式识别受体介导的天然免疫反应调节获得性免疫的机理[J].中国组织化学与细胞化学杂志,2013,22(6):545-551.
[3]TAKEDA K,AKIRA S.Toll-like receptors[J].Curr Protoc Immunol,2015,109(1):1-10.
[4]REHMAN M S,REHMAN S U,YOUSAF W,et al.The potential of Toll-like receptors to modulate avian immune system:Exploring the effects of genetic variants and phytonutrients[J].Front Genet,2021,12:1-16.
[5]HIGUCHI M,MATSUO A,SHINGAI M,et al.Combinational recognition of bacterial lipoproteins and peptidoglycan by chicken Toll-like receptor 2 subfamily[J].Dev Comp Immunol,2008,32(2):147-155.
[6]ZHANG Y S,LIANG X J,BAO X F,et al.Toll-like receptor 4(TLR4)inhibitors:Current research and prospective[J].Eur J Med Chem,2022,235:1-20.
[7]KEESTRA A M,DE ZOETE M R,VAN AUBEL R A,et al.Functional characterization of chicken TLR5 reveals species-specific recognition of flagellin[J].Mol Immunol,2008,45(5):1298-1307.
[8]RUAN W K,AN J,WU Y H.Polymorphisms of chicken TLR3 and 7 in different breeds[J].PLoS One,2015,10(3):1-8.
[9]BOYD A C,PEROVAL M Y,HAMMOND J A,et al.TLR15 is unique to avian and reptilian lineages and recognizes a yeast-derived agonist[J].J Immunol,2012,189(10):4930-4938.
[10]KEESTRA A M,DE ZOETE M R,BOUWMAN L I,et al.Chicken TLR21 is an innate CpG DNA receptor distinct from mammalian TLR9[J].J Immunol,2010,185(1):460-467.
[11]FUKUI A Y,INOUE N,MATSUMOTO M,et al.Molecular cloning and functional characterization of chicken Toll-like receptors a single chicken toll covers multiple molecular patterns[J].J Biol Chem,2001,276(50):47143-47149.
[12]ALKIE T N,YITBAREK A,HODGINS D C,et al.Development of innate immunity in chicken embryos and newly hatched chicks:A disease control perspective[J].Avian Pathol,2019,48(4):288-310.
[13]TOHIDI R,IDRIS I B,PANANDAM J M,et al.The effects of polymorphisms in IL-2,IFN-γ,TGF-β2,IgL,TLR-4,MD-2,and iNOS genes on resistance to Salmonella Enteritidis in indigenous chickens[J].Avian Pathol,2012,41(6):605-612.
[14]GUPTA S K,DEB R,DEY S,et al.Toll-like receptor-based adjuvants:Enhancing the immune response to vaccines against infectious diseases of chicken[J].Expert Rev Vaccines,2014,13(7):909-925.
[15]LI P,WANG H H,ZHAO X W,et al.Allelic variation in TLR4 is linked to resistance to Salmonella Enteritidis infection in chickens[J].Poult Sci,2017,96(7):2040-2048.
[16]CHEN C L,LI J C,ZHANG W,et al.Mycoplasma gallisepticum triggers immune damage in the chicken thymus by activating the TLR-2/MyD88/NF-κB signaling pathway and NLRP3 inflammasome[J].Vet Res,2020,51(1):1-13.
[17]TIAN W,ZHAO C C,HU Q C,et al.Roles of Toll-like receptors 2 and 6 in the inflammatory response to Mycoplasma gallisepticum infection in DF-1 cells and in chicken embryos[J].Dev Comp Immunol,2016,59:39-47.
[18]ZHANG P Z,DING Z,LIU X X,et al.Enhanced replication of virulent Newcastle disease virus in chicken macrophages is due to polarized activation of cells by inhibition of TLR7[J].Front Immunol,2018,9:1-13.
[19]BARJESTEH N,BEHBOUDI S,BRISBIN J T,et al.TLR ligands induce antiviral responses in chicken macrophages[J].PLoS One,2014,9(8):1-11.
[20]FULTON J E,MCCARRON A M,LUDN A R,et al.A high-density SNP panel reveals extensive diversity,frequent recombination and multiple recombination hotspots within the chicken major histocompatibility complex B region between BG2 and CD1A1[J].Genet Sel Evol,2016,48:1-15.
[21]KIM T,HUNT H D,PARCELLS M S,et al.Two class I genes of the chicken MHC have different functions:BF1 is recognized by NK cells while BF2 is recognized by CTLs[J].Immunogenetics,2018,70(10):693-694.
[22]BANAT G R,TKALCIC S,DZIELAWA J A,et al.Association of the chicken MHC B haplotypes with resistance to avian coronavirus[J].Dev Comp Immunol,2013,39(4):430-437.
[23]JIN Y C,WANG W,YU M M,et al.Study on the contrast of the MHC-peptide interaction of B2/B21 haplotype and MHC-related virus resistance in chickens[J].Immun Inflamm Dis,2021,9(4):1670-1677.
[24]LIU W,MILLER M M,LAMONT S J.Association of MHC class I and class II gene polymorphisms with vaccine or challenge response to Salmonella enteritidis in young chicks[J].Immunogenetics,2002,54(8):582-590.
[25]HUNT H D,JADHAO S,SWAYNE D E.Major histocompatibility complex and background genes in chickens influence susceptibility to high pathogenicity avian influenza virus[J].Avian Dis,2010,54(S1):572-575.
[26]TAYLOR R L,JR.Major histocompatibility(B)complex control of responses against Rous sarcomas[J].Poult Sci,2004,83(4):638-649.
[27]SENSENEY H L,BRILES W E,ABPLANALP H,et al.Allelic complementation between MHC haplotypes B(Q)and B17 increases regression of Rous sarcomas[J].Poult Sci,2000,79(12):1736-1740.
[28]HALABI S,GHOSH M,STEVANOVIC' S,et al.The dominantly expressed class II molecule from a resistant MHC haplotype presents only a few Marek’s disease virus peptides by using an unprecedented binding motif[J].PLoS Biol,2021,19(4):1-12.
[29]THANTHRIGE-DON N,READ L R,ABDUL-CAREEM M F,et al.Marek’s disease virus influences the expression of genes associated with IFN-gamma-inducible MHC class II expression[J].Viral Immunol,2010,23(2):227-232.
[30]LIAN L,QU L J,ZHENG J X,et al.Expression profiles of genes within a subregion of chicken major histocompatibility complex B in spleen after Marek’s disease virus infection[J].Poult Sci,2010,89(10):2123-2129.
[31]MAYS J K,BACON L D,PANDIRI A R,et al.Response of white leghorn chickens of various B haplotypes to infection at hatch with subgroup J avian leukosis virus[J].Avian Dis,2005,49(2):214-219.
[32]SCHILLING M A,KATANI R,MEMARI S,et al.Transcriptional innate immune response of the developing chicken embryo to Newcastle disease virus infection[J].Front Genet,2018,9:1-9.
[33]LI F W,LI S Q,LU Y,et al.Relationships among immune traits and MHC B-LBII genetic variation in three chicken breeds[J].Chin J Biotechnol,2013,29(7):904-913.
[34]ALBER A,MORRIS K M,BRYSON K J,et al.Avian pathogenic Escherichia coli(APEC)strain-dependent immunomodulation of respiratory granulocytes and mononuclear phagocytes in CSF1R-reporter transgenic chickens[J].Front Immunol,2020,10:1-16.
[35]LI X Y,QU L J,HOU Z C,et al.Genomic structure and diversity of the chicken Mx gene[J].Poult Sci,2007,86(4):786-789.
[36]QI F R,YANG A R,AMBREEN S,et al.Birth and death of Mx genes and the presence/absence of genes regulating Mx transcription are correlated with the diversity of anti-pathogenicity in vertebrate species[J].Mol Genet Genomics,2019,294(1):121-133.
[37]MPENDA F N,KEAMBOU C T,KYALLO M,et al.Polymorphisms of the chicken Mx gene promoter and association with chicken embryos’ susceptibility to virulent Newcastle disease virus challenge[J].Biomed Res Int,2019,2019:1-7.
[38]ZHANG Y N,FU D Z,CHEN H,et al.Partial antiviral activities detection of chicken Mx jointing with neuraminidase gene(NA)against Newcastle disease virus[J].PLoS One,2013,8(8):1-7.
[39]HALLER O,STAEHELI P,KOCHS G.Protective role of interferon-induced Mx GTPases against influenza viruses[J].Rev Sci Tech,2009,28(1):219-231.
[40]EWALD S J,KAPCZYNSKI D R,LIVANT E J,et al.Association of Mx1 Asn631 variant alleles with reductions in morbidity,early mortality,viral shedding,and cytokine responses in chickens infected with a highly pathogenic avian influenza virus[J].Immunogenetics,2011,63(6):363-375.
[41]陶換,余燕,刘晓晓,等.IBDV感染雏鸡法氏囊和脾脏中抗病毒基因Mx的表达变化[J].中国家禽,2016,38(18):14-17.
[42]SASAKI K,YONEDA A,NINOMIYA A,et al.Both antiviral activity and intracellular localization of chicken Mx protein depend on a polymorphism at amino acid position 631[J].Biochem Biophys Res Commun,2013,430(1):161-166.
[43]KO J H,TAKADA A,MITSUHASHI T,et al.Native antiviral specificity of chicken Mx protein depends on amino acid variation at position 631[J].Anim Genet,2004,35(2):119-122.
[44]GOSU V,SHIN D,SONG K D,et al.Molecular modeling and dynamic simulation of chicken Mx protein with the S631N polymorphism[J].J Biomol Struct Dyn,2022,40(2):612-621.
[45]SIRONI L,RAMELLI P,WILLIAMS J L,et al.PCR-RFLP genotyping protocol for chicken Mx gene G/A polymorphism associated with the S631N mutation[J].Genet Mol Res,2010,9(2):1104-1108.
[46]BALKISSOON D,STAINES K,MCCAULEY J,et al.Low frequency of the Mx allele for viral resistance predates recent intensive selection in domestic chickens[J].Immunogenetics,2007,59(8):687-691.
[47]BOZZI A T,GAUDET R.Molecular mechanism of nramp-family transition metal transport[J].J Mol Biol,2021,433(16):1-31.
[48]DAR M A,AHMED R,URWAT U,et al.Expression kinetics of natural resistance associated macrophage protein(NRAMP)genes in Salmonella Typhimurium-infected chicken[J].BMC Vet Res,2018,14(1):1-11.
[49]LIU W,KAISER M G,LAMONT S J.Natural resistance-associated macrophage protein 1 gene polymorphisms and response to vaccine against or challenge with Salmonella enteritidis in young chicks[J].Poult Sci,2003,82(2):259-266.
[50]HU Y,SHAN Y J,ZHU C H,et al.Upregulation of NRAMP1 mRNA confirms its role in enhanced host immunity in post-artificial infections of Salmonella enteritidis in chicks[J].Br Poult Sci,2015,56(4):408-415.
[51]胡国顺,常国斌,王克华,等.鸡Nramp1基因多态性与部分免疫指标相关性分析[J].中国畜牧杂志,2011,47(15):5-8.
[52]仇玲玲,栾德琴,廖和荣,等.斗鸡Nramp1基因多态性与部分免疫指标相关性分析[J].中国家禽,2015,37(6):11-14.
[53]DAI M M,XIE T T,LIAO M,et al.Systematic identification of chicken type I,II and III interferon-stimulated genes[J].Vet Res,2020,51(1):1-12.
[54]ANJUM F R,ANAM S,RAHMAN S U,et al.Anti-chicken type I IFN countermeasures by major avian RNA viruses[J].Virus Res,2020,286:1-8.
[55]ZHOU J R,LIU J H,LI H M,et al.Regulatory effects of chicken TRIM25 on the replication of ALV-A and the MDA5-mediated type I interferon response[J].Vet Res,2020,51(1):1-11.
[56]SUSTA L,CORNAX I,DIEL D G,et al.Expression of interferon gamma by a highly virulent strain of Newcastle disease virus decreases its pathogenicity in chickens[J].Microb Pathog,2013,61/62:73-83.
[57]MASUDA Y,MATSUDA A,USUI T,et al.Biological effects of chicken type III interferon on expression of interferon-stimulated genes in chickens:Comparison with type I and type II interferons[J].J Vet Med Sci,2012,74(11):1381-1386.
[58]张贝.鸡全基因组中IFITM/IFIT基因家族的鉴定及分析[D].秦皇岛:河北科技师范学院,2021.
[59]KINT J,FERNANDEZ-GUTIERREZ M,MAIER H J,et al.Activation of the chicken type I interferon response by infectious bronchitis coronavirus[J].J Virol,2015,89(2):1156-1167.
[60]HE S J,CHEN L N,HAO X L,et al.First characterization of chicken interleukin-9[J].Front Immunol,2022,13:1-13.
[61]TRUONG A D,HONG Y,HOANG C T,et al.Chicken IL-26 regulates immune responses through the JAK/STAT and NF-κB signaling pathways[J].Dev Comp Immunol,2017,73:10-20.
[62]HUO S S,ZHANG J L,FAN J H,et al.Co-expression of chicken IL-2 and IL-7 enhances the immunogenicity and protective efficacy of a VP2-expressing DNA vaccine against IBDV in chickens[J].Viruses,2019,11(5):1-17.
[63]崔凱玲,郝飞飞,郑明学,等.鸡IL-4和IL-2重组融合基因佐剂对鸡球虫活疫苗的增效作用研究[J].黑龙江畜牧兽医,2022(9):18-22.
[64]WANG X H,YU H L,ZOU W B,et al.Study of the relationship between polymorphisms in the IL-8 gene promoter region and coccidiosis resistance index in Jinghai yellow chickens[J].Genes,2020,11(5):1-12.
[65]WANG C,LI X K,ZHANG C,et al.A eukaryotic expression plasmid carrying chicken interleukin-18 enhances the response to Newcastle disease virus vaccine[J].Clin Vaccine Immunol,2015,22(1):56-64.
