物维生素B1生物合成及生物强化的研究进展
2024-02-02孙亚丽唐家琪毛馨晨王子瑞张超于恒秀
孙亚丽 唐家琪 毛馨晨 王子瑞 张超 于恒秀

摘要 维生素B是所有生物所必需的微量元素,其作为多个酶的辅因子,参与重要的细胞代谢途径。人体缺乏维生素B会增加罹患心血管及神经失调性疾病的风险。与植物和微生物不同,人类和其他动物不能从头合成维生素B,必须从饮食中获取。因此,研究植物中维生素的生物合成途径,并在此基础上对植物中的维生素B含量进行生物强化具有重要意义。维生素B合成途径中有许多酶的参与,如嘧啶合成酶(THIC)、噻唑合成酶(THI1)、硫胺素磷酸合成酶(TH1)、硫胺素单磷酸酶(TH2)和硫胺素焦磷酸激酶(TPK)等。结合相关研究,对维生素B在植物中的生物学功能、生物合成途径及合成相关基因的功能进行总结,并介绍了通过代谢工程实现生物强化的研究进展,以期为进一步提高植物中维生素B含量提供参考。
关键词 维生素B;硫胺素;生物合成;生物强化;植物
中图分类号 Q946 文献标识码 A
文章编号 0517-6611(2024)02-0005-05
doi:10.3969/j.issn.0517-6611.2024.02.002
开放科学(资源服务)标识码(OSID):
Research Progress on Biosynthesis and Biofortification of Vitamin B in Plants
SUN Ya-li, TANG Jia-qi, MAO Xin-chen et al
(Agricultural College of Yangzhou University/Jiangsu Key Laboratory of Crop Genetics and Physiology/ Key Laboratory of Plant Functional Genomics of the Ministry of Education/Jiangsu Key Laboratory of Crop Genomics and Molecular Breeding/ Jiangsu Co-Innovation Center for Modern Production Technology of Grain Crops,Yangzhou,Jiangsu 225009)
Abstract Vitamin B is an essential micronutrient for all living organisms. As a cofactor of many enzymes, it participates in important cellular metabolic pathways. Vitamin B deficiency increases the risk of cardiovascular and neurological disorders in human. Unlike plants and microbes, humans and other animals cannot synthesize vitamin B de novo and must acquire it from their diets. Therefore, it is of great significance to study the vitamin B biosynthesis pathway and to biofortify the vitamin B content in plants. There are many enzymes involved in the vitamin synthesis pathway, such as pyrimidine synthetase (THIC), thiazole synthetase (THI1), thiamine phosphate synthetase (TH1), thiamine monophosphatase (TH2) and thiamine pyrophosphate kinase (TPK). In this paper, the biological functions of vitamin B in plants, biosynthetic pathways and functions of synthesis-related genes were summarized based on the latest research progress, and the progress of biofortification through metabolic engineering was reviewed. This paper may highlight opportunities for further improving the content of vitamin B in plants.
Key words Vitamin B;Thiamin;Biosynthesis;Biofortification;Plants
基金項目 江苏省自然科学基金青年项目(BK20200951)。
作者简介 孙亚丽(1998—),女,河南信阳人,硕士研究生,研究方向:水稻遗传育种。
*通信作者,教授,博士,从事水稻遗传育种研究。
收稿日期 2023-02-06
維生素B于1926年从米糠中分离,是最早被提纯的维生素。维生素B有助于促进人类神经健康、改善情绪、增强心脏和减少胃灼热,同时维生素B也是一种抗氧化剂。当维生素B摄入量不足时,往往会出现微量营养素缺乏症。若严重缺乏维生素B,则会干扰中枢神经和循环系统,并导致脚气病。“脚气病”是一种人类致命疾病,在以高碳水化合物为主食的国家中普遍存在。
维生素B在植物的生长发育、非生物和生物胁迫的响应中发挥着重要的作用。维生素B参与许多细胞代谢途径并作为一些重要酶的辅酶,如三羧酸循环(tricarboxylic acid cycle,TCA cycle)、己糖二磷酸途径(embden-meyerhof-parnas pathway,EMP)等。维生素B缺乏会导致植物新陈代谢速率减慢、呼吸作用减弱、光合作用下降、蔗糖和氨基酸残基的累积量增高。在玉米维生素B合成缺陷的突变体中,新生叶的数量和花序的形成都会受到影响。
维生素B能够触发植物的防御系统。当病原体侵染植物时补施维生素B,植物会大量且迅速地积累致病相关蛋白(pathogenesis related protein,PR)的mRNA,使植物抵抗病原体的能力增强。而且,维生素B处理会增加水稻对纹枯病及白叶枯病的抗性以及黄瓜对白粉病的抗性。
当植物遭受非生物胁迫(例如渗透压、盐和氧化应激胁迫)以及暴露于冷、热和强光条件下,维生素B含量会增加,维生素B生物合成途径关键酶的mRNA转录水平也会增加。对向日葵根部进行外源施加维生素B,其可溶性糖和K含量升高、叶片水势含量降低。此外,有研究发现植物对非生物胁迫所诱导损伤的耐受度与维生素B的含量呈正相关性。
1 维生素B在植物中的从头生物合成
1.1 维生素B的分子结构
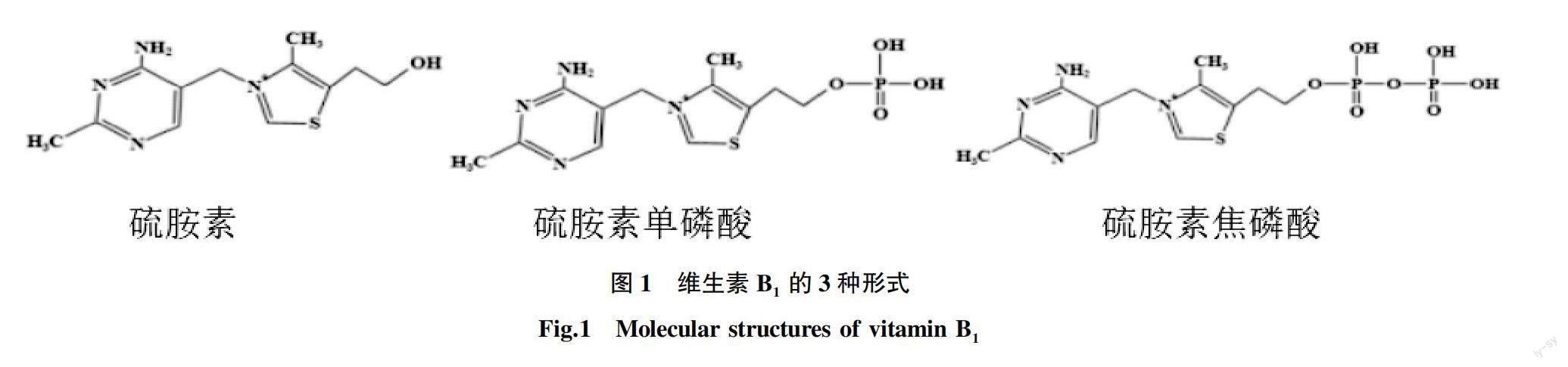
维生素B主要以硫胺素(thiamin)、硫胺素单磷酸(thiamin monophosphate,TMP)及硫胺素焦磷酸(thiamin pyrophosphate,TPP)3种形式在植物体内存在(图1)。TPP在一些细胞代谢途径中主要起到辅酶的作用。在酸性条件下,硫胺素在嘧啶N1氮和噻唑N3氮上为正电荷;在碱性条件下,随着噻唑环的打开产生硫醇形式。
1.2 维生素B的生物合成途径
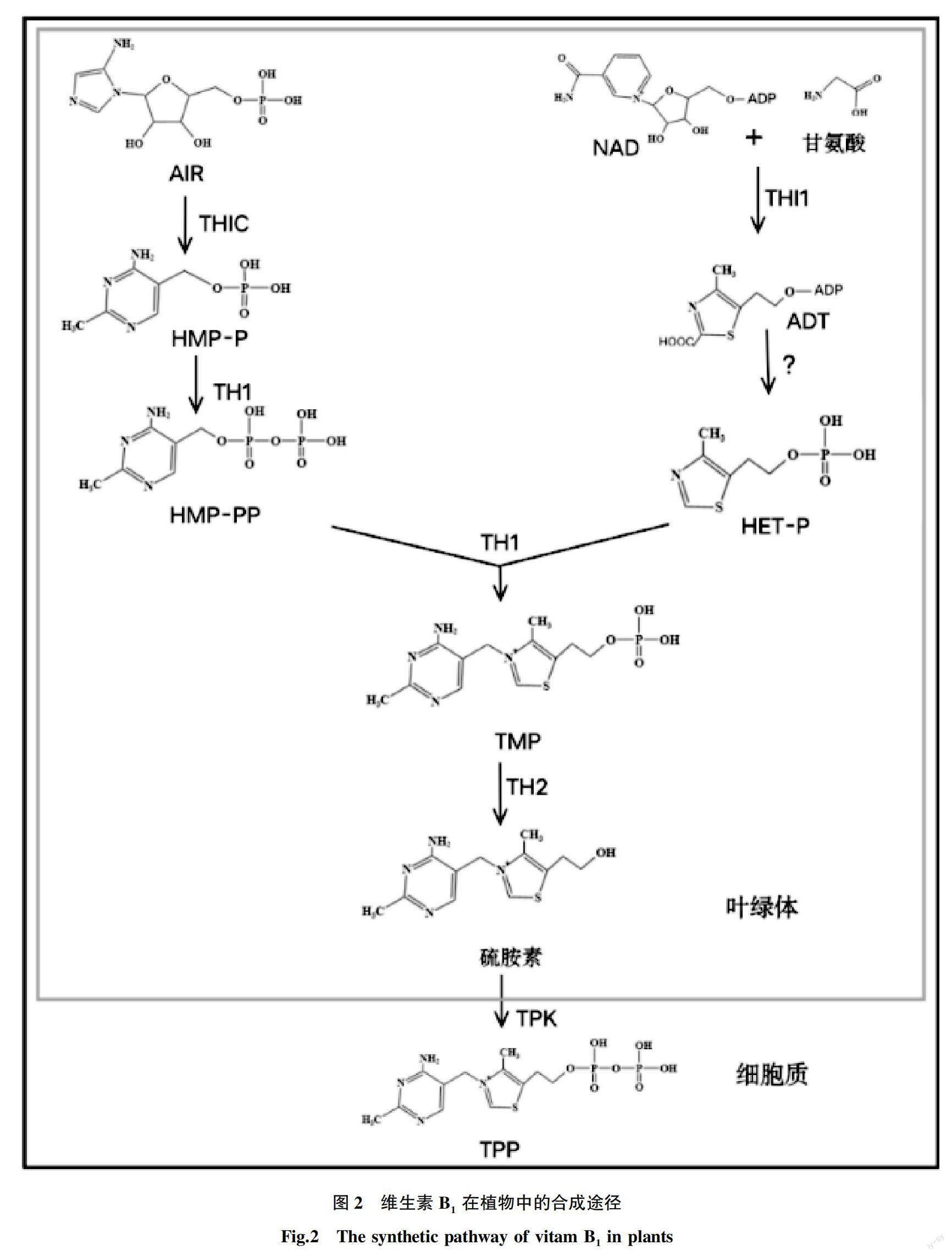
在模式植物拟南芥中,对维生素B的合成研究比较深入。它主要由噻唑环(4-甲基-5-β-羟乙基噻唑)和嘧啶环(4-氨基-5-羟甲基嘧啶)2个部分组成。2个部分在质体中单独合成,然后结合在一起,最终形成TPP的形式(图2)。
嘧啶是通过嘧啶合成酶(HMP-P synthase,THIC)催化底物5-氨基咪唑核糖核苷酸(5-aminoimidazole ribonucleotide,AIR)合成4-氨基-2-甲基-5-羟甲基嘧啶单磷酸(4-amino-2-methyl-5-hydroxymethylpyrimidine monophosphate,HMP-P)。在此过程中需要辅助因子还原性酰胺NADH和S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)的参与。最终形成的4-氨基-2-甲基-5-羟甲基嘧啶焦磷酸(4-amino-2-methyl-5-hydroxymethylpyrimidine diphosphate,HMP-PP)是由硫胺素磷酸合成酶(thiamine phosphate synthase,TH1)催化HMP-P而完成。
噻唑部分的生物合成是通过噻唑合成酶(HEP-T synthase,THI1)催化底物形成腺苷二磷酸-5-(β-乙基)-4-甲基噻唑-2-羧酸(adenylated thiazole,ADT)。ADT随后在一种迄今为止尚未表征的酶的作用下形成4-氨基-2-甲基-5-羟甲基嘧啶磷酸(4-amino-2-methyl-5-hydroxymethylpyrimidine phosphate,HET-P)。
硫胺素从头合成的2个前体HET-P和HMP-PP被TH1催化,耦联形成TMP。TMP在原核生物中可以直接转化为TPP,但在拟南芥中,TMP首先被TMP磷酸酶(TMP phosphatase,TH2)脱磷酸为硫胺素。然后被2种硫胺素焦磷酸激酶(thiamine pyrophosphokinase,TPK1和TPK2)焦磷酸化成TPP。
2 维生素B生物合成途径中的关键酶
维生素B生物合成途徑受到许多生物合成酶的调控。其中,THIC、THI1、TH1、TH2和TPK是维生素B从头合成途径中的关键酶,对植物体内维生素B的合成具有重要的调控作用(表1)。
2.1 THIC
THIC是嘧啶合成酶,参与植物硫胺素嘧啶部分的生物合成过程。THIC蛋白含有一个[Fe-S]簇,该[Fe-S]簇起到了稳定THIC蛋白构象的作用。在植物中,半胱氨酸脱硫酶(CpnifS)为[Fe-S]簇提供硫。拟南芥的CpnifS蛋白定位于叶绿体并且对于质体[Fe-S]蛋白的成熟至关重要。在细菌中,THIC是SAM家族的成员。细菌THIC的[4Fe-4S]簇还原SAM以产生腺苷自由基,然后该自由基参与AIR异构化为HMP-P。植物THIC中[Fe-S]簇的存在表明植物中可能发生类似的反应。
核糖开关(riboswitch)是mRNA前体元件,可调节基因表达以响应细胞内特定代谢物配体的浓度。核糖开关在细菌中广泛存在,而在真核生物中仅报道了一种TPP核糖开关,该核糖开关存在于硫胺素生物合成基因THIC的3′UTR中。TPP核糖开关控制THIC RNA转录物的剪接和可变的3′末端加工,并介导THIC表达对细胞TPP水平变化的反馈调节,而这会影响mRNA积累和蛋白质产生。
THIC蛋白定位于叶绿体基质中。THIC基因转录本主要存在于绿色组织中,在根和茎中几乎无法检测到,并且在光合作用强的植物组织中更加丰富。拟南芥thic突变体幼苗出现褪绿表型,并且发育不超过子叶期,但这种表型可以通过补充硫胺素来挽救。若补充1.5 μmol/L硫胺素,幼苗可以生长,但仍然出现褪绿表型;若补充100 μmol/L硫胺素,幼苗具有正常的着色,但比野生型幼苗弱小。
2.2 THI1
THI1是目前发现的参与硫胺素噻唑部分生物合成的唯一合成酶。THI1突变会导致植株发育异常,叶片变成白色,并且在幼苗期死亡,但通过补充硫胺素可以使其恢复正常。
THI1是一个单拷贝核基因,转录起始位点位于第一个ATG上游39 bp处,并编码单个1.3 kb转录物。预测的蛋白质长度为349个氨基酸,包含一个典型的叶绿体转运肽和一个位于N末端的线粒体前序列样结构,能够进行双重细胞器靶向。双重靶向可以使THI1在靶向线粒体时起到保护DNA损伤的作用,靶向叶绿体时可以在硫胺素生物合成过程中起作用。除了已知的参与硫胺素生物合成和线粒体DNA损伤耐受性功能外,THI1还在植物非生物胁迫反应中发挥作用。研究发现,THI1可参与脱落酸(abscisic acid,ABA)调节的气孔运动、S型阴离子通道和植物的干旱反应。此外,THI1在气孔关闭过程中还充当ABA诱导的慢型阴离子通道活化的正调节剂。与野生型相比,THI1过表达增强了植物对ABA的敏感性,降低了植物的水分损失率,从而提高了植物的耐旱性。
2.3 TH1 TH1是硫胺素磷酸合成酶,在嘧啶和噻唑的连接方面发挥重要的作用。TH1的转录本在植物的不同组织(根、茎、叶、穂)都广泛表达,其中在叶中的表达量最高。TH1蛋白包含一个cTP结构域、一个HMP-P激酶结构域和一个TP合酶结构域。蛋白质序列比对显示HMP-P激酶结构域的氨基酸序列与原核生物中的ThiD的氨基酸序列同源,具有催化HMP-P转化为HMP-PP的磷酸甲基嘧啶激酶的活性。此外,TP合酶结构域与原核蛋白ThiE的结构域一致。ThiE是一种TMP合酶,可将嘧啶和噻唑部分缩合以产生TMP。
在水稻中,OsTH1由于选择性剪接而具有2个转录异构体,导致蛋白质具有定位多样性。一种蛋白质含有548个氨基酸,包含2个保守结构域,与在拟南芥中的同源物TH1一致,显示出叶绿体靶向特性,并且充当HMP-P激酶和TMP合酶。另一种蛋白质亚型具有388个氨基酸,仅包含TP-S结构域,并定位于细胞质。
植物受到氧化应激胁迫时,TH1表达量会增高,并且蛋白表达量也会增高。在拟南芥中,th1突变体叶片白黄色,仅在叶缘有少许毛状体,并且植株在幼苗期死亡,若补充硫胺素可以使其恢复正常。但补充HEP以及HMP时,突变体仍无法正常合成TMP。在四叶期之前,水稻突变体OsTH1表现出正常的种子萌发和幼苗生长,但第四叶本身开始出现褪绿表型。随着植株的生长,黄化变得更严重并蔓延至其他叶片,最终在幼苗萌发后4周左右死亡,外源补施硫胺素可使其表型恢复正常。这些研究表明,TH1对于植物体内硫胺素的生物合成是必需的。
2.4 TH2 TH2是硫胺素单磷酸酶,可将TMP去磷酸化为硫胺素。拟南芥TH2含有一个N末端靶向肽、一个转录增强A(TenA)和一个卤酸脱卤酶(HAD)结构域。靶向肽末端附近的Met可作为TH2的替代翻译起始位点。第一个Met的翻译将TH2蛋白靶向线粒体,而从Met的翻译产生了细胞溶质TH2,其胞质形式主要在TPP合成中起作用。
PALE1与TH2是等位基因。水稻敲除突变体Ospale1的淡绿色至黄棕色表型与拟南芥硫胺素缺陷突变体pale1的表型相似。尽管如此,PALE1至少有两个不同的方面。首先,OsPALE1是水稻的必需基因。Ospale1叶中的TPP水平约为对照WT的40%,含有的TMP浓度比对照WT更高,突变也是致死的。同样,拟南芥pale1/th2突变体幼苗中的TPP水平也约为WT的40%,含有的TMP浓度也比对照WT高,但突变体并不致死。补充硫胺素可以使其突变体的表型恢复正常。
这些结果表明,在完成水稻生命周期过程中,可能对TPP的要求更高。其次,PALE1/TH2很可能是负责植物细胞内大多数硫胺素和TPP合成的主要TMP磷酸酶。PALE1/TH2的缺失可能会激活另一种磷酸酶,导致pale1突变体中较低但可以检测到的TPP水平。
2.5 TPK TPK是硫胺素焦磷酸激酶,将细胞质溶胶的硫胺素磷酸化成TPP,是硫胺素辅因子活化的核心。在拟南芥中发现AtTPK1和AtTPK2 2个蛋白,且其氨基酸序列一致性约为93%。这2种基因在叶片中的表达较高,而在其他组织中的表达较低,这说明叶片需要高水平的TPP进行光合作用和碳水化合物代谢。尽管AtTPK基因编码生化冗余蛋白,但这2种AtTPK转录本仍存在差异表达。这2种AtTPK mRNA在叶、茎、长角果和花中的转录物积累模式相似,但在根中的表达明显不同,AtTPK1转录物比ATPK2转录物更丰富。
在氧化应激条件下,TPKs的表达量会增高。虽然单个TPK的拟南芥突变体与野生型相比并未产生突变表型,并且可以合成硫胺素;但在双突变植株中,几乎不能产生TPP,而是积累了TPK反应的前体游离硫胺素,并在幼苗期死亡。另外双突变体表型只能通过外源施用TPP来使其恢复正常,而补施硫胺素或TMP是无法挽救的。在水稻中,若沉默TPK1/ROX1基因,则植株对稻瘟病的易感性会明显增强。这些结果表明,TPK活性是外源性和从头衍生的硫胺素转化为酶促辅助因子TPP的唯一机制。
3 维生素B在植物体内的生物强化进展
生物强化是通过育种或基因工程手段提高农作物产品中的天然微量营养素水平,是对抗微量营养素营养不良(MNM)的关键工具。植物性食物是人类硫胺素的主要来源,但许多主要作物的硫胺素含量相对较低。对主要粮食作物进行硫胺素生物强化是避免硫胺素缺乏症的一种有效措施。
游离硫胺素是水稻种子中储存维生素B的主要形式。因此,刺激TMP下游的酶可能不会对胚乳组织中的总硫胺素水平产生有益影响。首先,嘧啶和噻唑合成途径中的第一个酶分别是HMP-P合酶(THIC)和HET-P合酶(THI1),因此将它们看作硫胺素生物强化的重点研究对象。其次,THIC催化拟南芥中硫胺素生物合成的限速步骤,这一特征也可能保存在水稻胚乳中。另外,THIC基因包含一个位于其3′UTR的TPP核糖开关,当TPP水平增加时,该核糖开关负调节THIC基因表达和蛋白质产生,这种机制会阻止硫胺素积累。携带缺乏核糖开关的拟南芥植物叶片和种子中的总硫胺素水平分别增加1.6和1.2倍;同样,过表达THIC的拟南芥植株相较于其野生型叶片中總硫胺素含量增加了1.5倍。与野生型相比,过表达THI1的拟南芥植株叶片中的总硫胺素含量增加了2.0倍。尽管如此,THIC或THI1单基因过表达植物中硫胺素的积累均不高于其对照野生型。
将THIC和THI1单基因过表达植物杂交以产生THIC×THI1过表达系。在THIC×THI1过表达的拟南芥或水稻叶片中,硫胺素含量与其对照野生型相比增加了6倍以上,占总硫胺素的45%;TPP水平增加了2倍,占总硫胺素的50%以上,但TMP水平仍然很低,只占总硫胺素的5%左右;而种子的总硫胺素含量增加了5倍。另外,与野生型相比,THIC×THI1叶绿体中的硫胺素含量仅增加了2.3倍,TPP含量增加了1.9倍,TMP低于检测水平。这说明,硫胺素在叶绿体中的积累程度远低于在整个叶片组织中的积累,可能是硫胺素或TMP被迅速转运出叶绿体所导致的。虽然THIC×THI1未抛光种子中的硫胺素水平高于未抛光的对照种子,但它们在精制白米中的含量却相似,最多增加1.3倍,这说明硫胺素含量的增加主要或完全在种子的麸皮中,而不是在胚乳中。
4 总结
硫胺素对人类健康至关重要。植物是大多数人类饮食中硫胺素的最终来源,但白米等主食的硫胺素含量较低。因此,以低硫胺素作物作为主粮的人群常患有硫胺素缺乏症。当前,作物硫胺素的生物强化研究主要集中在对其代谢途径中关键酶的研究上,并且也取得了一定的进展。
增加植物体内维生素B的含量,可满足维生素B缺乏人群的需求,但其生物合成和累积机制尚不明确。其中,嘧啶、噻唑等代谢通路上的关键酶目前还不清楚,有待于深入研究;在植物生长发育过程中任何部位都需要硫胺素的参与,而硫胺素的生物合成主要存在于绿色组织中,对于硫胺素在植物中的转运机制尚不十分明确;如何积累硫胺素的研究仍处于瓶颈期。
未來应重点研究种子中硫胺素的代谢分工,并开发组织特异性代谢模型,以设计合理的工程策略,对水稻胚乳进行硫胺素生物强化。另外,也可以针对硫胺素及其中间体的运输及限速步骤,解决胚乳与麸皮之间硫胺素水平的差异。
参考文献
[1]JANSEN B C P,DONATH W F.On the isolation of the anti-beriberi vitamin[J].Proc Kon Ned Akad Wet,2023,29:1390-1400.
[2]SAMBON M,WINS P,BETTENDORFF L.Neuroprotective effects of thiamine and precursors with higher bioavailability:Focus on benfotiamine and dibenzoylthiamine[J].Int J Mol Sci,2021,22(11):1-19.
[3]FARDET A.New hypotheses for the health-protective mechanisms of whole-grain cereals:What is beyond fibre?[J].Nutrition research reviews,2010,23(1):65-134.
[4]STSIAPURA V,STEPURO I I.Antioxidant properties of thiamine and its hydrophobic metabolites[M]//KOZYREV D,SLUTSKY V.Handbook of free radicals:Formation,types and effects.New York:Nova Science Publishers,2010.
[5]HUANG H M,CHEN H L,GIBSON G E.Thiamine and oxidants interact to modify cellular calcium stores[J].Neurochemical research,2010,35(12):2107-2116.
[6]NOSAKA K.Recent progress in understanding thiamin biosynthesis and its genetic regulation in Saccharomyces cerevisiae[J].Applied microbiology & biotechnology,2006,72(1):30-40.
[7]WHITFIELD K C,SMITH T J,ROHNER F,et al.Thiamine fortification strategies in low-and middle-income settings:A review[J].Annals of the New York academy of sciences,2021,1498(1):29-45.
[8]LONSDALE D.A review of the biochemistry,metabolism and clinical benefits of Thiamin(e)and its derivatives[J].Evidence-based complementary and alternative medicine,2006,3(1):49-59.
[9]DONG W,STOCKWELL V O,GOYER A,et al.Enhancement of thiamin content in Arabidopsis thaliana by metabolic engineering[J].Plant and cell physiology,2015,56(12):2285-2296.
[10]NIE Y S,YU L,MAO L L,et al.Vitamin B THIAMIN REQUIRING1 synthase mediates the maintenance of chloroplast function by regulating sugar and fatty acid metabolism in rice[J].Journal of integrative plant biology,2022,64(8):1575-1595.
[11]GOYER A.Thiamine in plants:Aspects of its metabolism and functions[J].Phytochemistry,2010,71(14/15):1615-1624.
[12]WOODWARD J B,ABEYDEERA N D,PAUL D,et al.A maize thiamine auxotroph is defective in shoot meristem maintenance[J].The plant cell,2010,22(10):3305-3317.
[13]BOUBAKRI H,GARGOURI M,MIKI A,et al.Vitamins for enhancing plant resistance[J].Planta,2016,244(3):529-543.
[14]AHN I P,KIM S,LEE Y H,et al.Vitamin B-induced priming is dependent on hydrogen peroxide and the NPR1 gene in Arabidopsis[J].Plant physiology,2007,143(2):838-848.
[15]AHN I P,KIM S,LEE Y H.Vitamin B functions as an activator of plant disease resistance[J].Plant physiology,2005,138(3):1505-1515.
[16]WANG G N,DING X H,YUAN M,et al.Dual function of rice OsDR8 gene in disease resistance and thiamine accumulation[J].Plant molecular biology,2006,60(3):437-449.
[17]RAPALA-KOZIK M,KOWALSKA E,OSTROWSKA K.Modulation of thiamine metabolism in Zea mays seedlings under conditions of abiotic stress[J].Journal of experimental botany,2008,59(15):4133-4143.
[18]TUNC-OZDEMIR M,MILLER G,SONG L H,et al.Thiamin confers enhanced tolerance to oxidative stress in Arabidopsis[J].Plant physiology,2009,151(1):421-432.
[19]RAPALA-KOZIK,M,WOLAK N,KUJDA M,et al.The upregulation of thiamine(vitamin B)biosynthesis in Arabidopsis thaliana seedlings under salt and osmotic stress conditions is mediated by abscisic acid at the early stages of this stress response[J].BMC plant biology,2012,12:1-14.
[20]SAYED S A,GADALLAH M A A.Effects of shoot and root application of thiamin on salt-stressed sunflower plants[J].Plant growth regulation,2002,36(1):71-80.
[21]GUAN J C,HASNAIN G,GARRETT T J,et al.Divisions of labor in the thiamin biosynthetic pathway among organs of maize[J].Frontiers in plant science,2014,5:1-10.
[22]孫中兴,魏德强,杨梅,等.植物硫胺素的生物合成及功能[J].植物生理学报,2018,54(12):1791-1796.
[23]JURGENSON C T,BEGLEY T P,EALICK S E.The structural and biochemical foundations of thiamin biosynthesis[J].Annual review of biochemistry,2009,78:569-603.
[24]MIMURA M,ZALLOT R,NIEHAUS T D,et al.Arabidopsis TH2 encodes the orphan enzyme thiamin monophosphate phosphatase[J].The plant cell,2016,28(10):2683-2696.
[25]HSIEH W Y,LIAO J C,WANG H T,et al.The Arabidopsis thiamin-deficient mutant pale green1 lacks thiamin monophosphate phosphatase of the vitamin B biosynthesis pathway[J].The plant journal,2017,91(1):145-157.
[26]AJJAWI I,RODRIGUEZ MILLA M A,CUSHMAN J,et al.Thiamin pyrophosphokinase is required for thiamin cofactor activation in Arabidopsis[J].Plant molecular biology,2007,65(1/2):151-162.
[27]MARTINIS J,GAS-PASCUAL E,SZYDLOWSKI N,et al.Long-distance transport of thiamine(vitamin B)is concomitant with that of polyamines[J].Plant physiology,2016,171(1):542-553.
[28]KONG D Y,ZHU Y X,WU H L,et al.AtTHIC,a gene involved in thiamine biosynthesis in Arabidopsis thaliana[J].Cell research,2008,18(5):566-576.
[29]HSIEH W Y,WANG H M,CHUNG Y H,et al.THIAMIN REQUIRING2 is involved in thiamin diphosphate biosynthesis and homeostasis[J].The plant journal,2022,111(5):1383-1396.
[30]LI C L,WANG M,WU X M,et al.THI1,a thiamine thiazole synthase,interacts with Ca-dependent protein kinase CPK33 and modulates the S-type anion channels and stomatal closure in Arabidopsis[J].Plant physiology,2016,170(2):1090-1104.
[31]HSIEH P H,CHUNG Y H,LEE K T,et al.The rice PALE1 homolog is involved in the biosynthesis of vitamin B[J].Plant biotechnology journal,2021,19(2):218-220.
[32]LEE I,SEO Y S,COLTRANE D,et al.Genetic dissection of the biotic stress response using a genome-scale gene network for rice[J].Proceedings of the national academy of sciences of the United States of America,2011,108(45):18548-18553.
[33]RASCHKE M,BRKLE L,MLLER N,et al.Vitamin B biosynthesis in plants requires the essential iron-sulfur cluster protein,THIC[J].Proceedings of the national academy of sciences of the United States of America,2007,104(49):19637-19642.
[34]VAN HOEWYK D,ABDEL-GHANY S E,COHU C M,et al.Chloroplast iron-sulfur cluster protein maturation requires the essential cysteine desulfurase CpNifS[J].Proceedings of the national academy of sciences of the United States of America,2007,104(13):5686-5691.
[35]CHATTERJEE A,LI Y,ZHANG Y,et al.Reconstitution of ThiC in thiamine pyrimidine biosynthesis expands the radical SAM superfamily[J].Nature chemical biology,2008,4(12):758-765.
[36]CHEAH M T,WACHTER A,SUDARSAN N,et al.Control of alternative RNA splicing and gene expression by eukaryotic riboswitches[J].Nature,2007,447(7143):497-500.
[37]CROFT M T,MOULIN M,WEBB M E,et al.Thiamine biosynthesis in algae is regulated by riboswitches[J].Proceedings of the national academy of sciences of the United States of America,2007,104(52):20770-20775.
[38]WACHTER A,TUNC-OZDEMIR M,GROVE B C,et al.Riboswitch control of gene expression in plants by splicing and alternative 3′ end processing of mRNAs[J].The plant cell,2007,19(11):3437-3450.
[39]CHABREGAS S M,LUCHE D D,FARIAS L P,et al.Dual targeting properties of the N-terminal signal sequence of Arabidopsis thaliana THI1 protein to mitochondria and chloroplasts[J].Plant molecular biology,2001,46(6):639-650.
[40]MIZOTE T,TSUDA M,SMITH D D S,et al.Cloning and characterization of the thiD/J gene of Escherichia coli encoding a thiamin-synthesizing bifunctional enzyme,hydroxymethylpyrimidine kinase/phosphomethylpyrimidine kinase[J].Microbiology,1999,145(2):495-501.
[41]BEGLEY T P,DOWNS D M,EALICK S E,et al.Thiamin biosynthesis in prokaryotes[J].Archives of microbiology,1999,171(5):293-300.
[42]BACKSTROM A D,MCMORDIE R A S,BEGLEY T P.Biosynthesis of thiamin I:The function of the thiE gene product[J].Journal of the American chemical society,1995,117(8):2351-2352.
[43]AJJAWI I,TSEGAYE Y,SHINTANI D.Determination of the genetic,molecular,and biochemical basis of the Arabidopsis thaliana thiamin auxotroph th1[J].Archives of biochemistry & biophysics,2007,459(1):107-114.
[44]ABDOU E,HAZELL A S.Thiamine deficiency:An update of pathophysiologic mechanisms and future therapeutic considerations[J].Neurochemical research,2015,40(2):353-361.
[45]STROBBE S,VERSTRAETE J,STOVE C,et al.Metabolic engineering of rice endosperm towards higher vitamin B1 accumulation[J].Plant biotechnology journal,2021,19(6):1253-1267.
[46]FITZPATRICK T B,BASSET G J C,BOREL P,et al.Vitamin deficiencies in humans:Can plant science help?[J].The plant cell,2012,24(2):395-414.
[47]MANGEL N.Natural variation,molecular determinants and genetic engineering of vitamin B1 and vitamin B6 biosynthesis in cassava and rice[D].Frace:Université de Lorraine,1988.
[48]DONG W,THOMAS N,RONALD P C,et al.Overexpression of thiamin biosynthesis genes in rice increases leaf and unpolished grain thiamin content but not resistance to Xanthomonas oryzae pv.oryzae[J].Frontiers in plant science,2016,7:1-11.
[49]SEAVER S M D,BRADBURY L M T,FRELIN O,et al.Improved evidence-based genome-scale metabolic models for maize leaf,embryo,and endosperm[J].Frontiers in plant science,2015,6:1-17.
