PI3K/Akt信号通路在鹿茸增强内皮祖细胞活性及其细胞迁移中的作用
2022-03-29李廷荃李子娟王雁彬
韩 杰,李廷荃,李子娟,王雁彬,霍 凯
下肢动脉硬化闭塞症(arteriosclerosis obliterans of the lower extremities,ASOLE)是临床上常见的一种周围血管疾病,由于动脉硬化造成内膜增厚、管腔狭窄闭塞,导致相应区域供血不足,甚至引起肢体末端坏疽,导致截肢[1-2]。前期研究表明,鹿茸能够促进下肢动脉硬化闭塞大鼠血管新生、内皮祖细胞(endothelial progenitor cells,EPCs)增殖及促血管生成相关因子升高[3],但具体机制尚未明确。磷脂酰肌醇3-羟基激酶(PI3K)是蛋白激酶B(Akt)的上游信号分子,可激活Akt来调节细胞内信号通路和细胞功能的变化,在血管新生中发挥着重要作用[4-5]。本实验以下肢动脉硬化闭塞症大鼠为模型,通过检测CD133+细胞比例、血清血管内皮生长因子(VEGF)、基质细胞衍生因子(SDF)-1α含量以及腓肠肌内皮型一氧化氮合酶(eNOS)、趋化因子受体4(CXCR4)阳性表达来研究鹿茸通过PI3K/Akt信号通路促进血管新生及细胞迁移的作用机制。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级雄性SD大鼠80只,2月龄,体质量250~300 g,由山西省中医药研究院提供,实验动物质量合格证号:1103221911003889。
1.2 饲料制备 高脂饲料,含80.3%基础饲料、15%猪油、0.5%胆酸钠、0.2%丙基硫氧嘧啶、4%胆固醇。
1.3 药物与试剂 鹿茸采用马鹿茸,购自北京同仁堂(集团)有限责任公司,用普通粉碎机制成粗粉,再用气流超微粉碎机制成微粉(粒径小于10 μm),温水调,搅拌均匀,即用即配。PI3K抑制剂LY294002购于美国Selleck公司中国分公司(美国辉瑞公司授权经销商),用二甲基亚砜(DMSO)配制母液(10 mg LY294002溶于6.507 5 mL DMSO中)于-20 ℃冰箱保存,每日配制当日所需工作液(10%母液+40%PEG300+5%Tween-80+45%氯化钠溶液),即用即配;维生素D3针剂(哈尔滨摩天农科兽药有限责任公司,批号:20190318);CD133抗体、CD133同型对照抗体(BD公司,批号:751261);VEGF酶联免疫吸附实验(ELISA)测定试剂盒(Elabscience,货号:E-EL-R2603c)、SDF-1α ELISA试剂盒(Elabscience,货号:E-EL-R2495c);CXCR4、eNOS抗体(Abcam公司);PI3K、Akt抗体(Abcam公司)。
1.4 仪器 电子天平(Metter,瑞士);移液器(Eppendorf,德国);微量加样吸头(北京中衫金桥生物有限公司);微型高速离心机(Froilabo,法国);显微镜(Olympus公司,日本);脱水机、包埋机、冻台(武汉俊杰电子有限公司);病理切片机(上海徕卡科技有限公司);烤箱、微波炉、冰箱(美的电器制造有限责任公司);流式细胞仪(美国贝克曼库尔特公司);全自动酶标仪(Thermo scientific)、Multiskan Mirco-plate reader(Thermo)、VE180 Mini-protean 3 Dodeca(Tanon)、VE186 TBC(Tanon)、PowerPac HC Power Supply(BioRad)、PH meter(Sartorius)、Shaker(Kylin-Bell)、Homogenizer(Fluko)。
1.5 方法
1.5.1 动物模型制备 采用随机数字表法将大鼠分为8组:空白组、模型组、鹿茸低剂量组、鹿茸中剂量组、鹿茸高剂量组、LY294002+鹿茸低剂量组、LY294002+鹿茸中剂量组、LY294002+鹿茸高剂量组,每组10只,分组后将大鼠以10%水合氯醛溶液(3.5 mL/kg)腹腔麻醉,随后取平卧位,固定于手术台上,左侧腹股沟备皮,碘伏消毒左侧腹股沟区域后,于此处行一长约1.5 cm纵切口,暴露血管鞘,分离股动脉及其分支,齿镊沿股动脉走形钳夹约30 s,分别结扎并离断左侧股动脉的分支;用0号线缝合皮下组织及皮肤,背部皮下注射生理盐水10 mL补液抗休克,观察大鼠各项生命体征平稳后放回鼠笼;给予3×105U青霉素肌肉注射3 d,预防感染;高脂饲料喂养12周;予维生素D3(3×105U/kg)右下肢肌肉注射,每月1次。
1.5.2 给药方法 鹿茸低剂量组、中剂量组、高剂量组灌胃给药[0.143 g/(kg·d)、0.286 g/(kg·d)、0.572 g/(kg·d)]。LY294002组腹腔注射LY294002[1 mg/(kg·d)];空白组、模型组给予等容量蒸馏水。LY294002+鹿茸低剂量组、LY294002+鹿茸中剂量组、LY294002+鹿茸高剂量组先行腹腔注射再灌胃。于造模完成第1天开始给药,每日1次,连续28 d,28 d后处死。
1.5.3 标本采集及处理方法 将大鼠麻醉后,用小镊子摘去1只眼球,收集外周血到EP管中;取大鼠术侧下肢股骨,注射器抽吸磷酸缓冲盐溶液(PBS)反复冲洗骨髓腔,滤网过滤骨髓冲洗液,离心,吹打制成均匀的骨髓悬液,收集到EP管中,-80 ℃冻存。
1.5.4 检测指标
1.5.4.1 流式细胞术检测外周血、骨髓中CD133+细胞比例 每只大鼠各设置5个管,2个单染测定管及同型对照管,另加1个三染测定管。于抗凝管中加红细胞裂解液5 mL,37 ℃恒温水温箱中避光孵育10 min,1 500 r/min离心5 min,弃上清,再次于抗凝管中加红细胞裂解液5 mL,37 ℃恒温水温箱中避光孵育10 min,1 500 r/min离心5 min,弃上清,加PBS缓冲液350 μL,每个样品分装到5个1.5 mL的离心管中,每管50 μL按CD133对照、CD133检测、三色检测顺序标明各管,共5管。各管中加入对应的抗体,4 ℃避光孵育20~25 min,各管加1 mL PBS缓冲液洗涤1次,1 500 r/min离心5 min,弃上清。加PBS缓冲液定容至500 μL,将样本按CD133对照、CD133检测、三色检测移至流式管中备用。将样品重悬,按CD133对照、CD133检测、三色检测顺序上机检测,以488 nm氢离子激光激发,每次计数50 000,软件分析各管双阳性细胞所占比例。
1.5.4.2 ELISA法检测外周血SDF-1α、VEGF水平 将试剂盒、标本预先在37 ℃中平衡至少30 min;确定检测所需的已包被抗体的酶标板孔数目,并增加1孔作为四甲基联苯胺(TMB)空白显色孔;将2 000 pg/mL、1 000 pg/mL、500 pg/mL、250 pg/mL、125 pg/mL、62.5 pg/mL、31.2 pg/mL的标准品各0.1 mL依次加入一排7孔中,1孔只加样品稀释液作为零孔;加已用样品稀释液稀释的样品100 μL,酶标板加上盖,37 ℃反应90 min;自动洗板机吸去酶标板内的液体;将准备好的生物素抗大鼠相应抗体工作液按每孔0.1 mL依次加入,37 ℃反应60 min;用0.01 mol/L PBS洗涤3次;将准备好的ABC工作液按每孔0.1 mL依次加入,37 ℃反应30 min;PBS洗涤5次;按每孔90 μL依次加入已在37 ℃平衡30 min的TMB显色液,37 ℃避光反应25 min;按每孔0.1 mL依次加入TMB终止液,此时蓝色转变为黄色;用酶标仪在450 nm测定吸光度(OD)值;以浓度作为横坐标,OD值作为纵坐标,根据样品的OD值在坐标上找出对应的浓度,用ELISA应用软件计算及绘图。
1.5.4.3 免疫荧光技术检测腓肠肌中eNOS、CXCR4水平 涂片后用多聚甲醛进行固定10 min;用PBS微振荡洗涤5 min(2次)。加0.4% Triton-X100破膜5~10 min,用PBS微振荡洗涤3 min(3次);用1%PBS封闭液室温封闭30 min至1 h;用0.5% PBS稀释一抗,比例为1∶100;4 ℃过夜;从冰箱拿出后37 ℃复温45 min;或室温2~3 h;或37 ℃1 h;孵育后用PBS微振荡洗涤5 min(3次);用0.5% PBS稀释二抗,比例为1∶400;室温30 min至1 h;孵育后用PBS微振荡洗涤5 min(3次);4,6二脒基2苯基吲哚(DAPI)原液为1 g/mL,稀释浓度为1∶1 000,快速染色10 s,用蒸馏水冲洗;用防淬灭的封片剂封片,荧光显微镜高倍视野下观察。
1.5.4.4 蛋白质印迹(Western Blot)法检测PI3K、Akt蛋白表达 根据目的蛋白的分子量,配制10%分离胶,浓缩胶浓度为5%。待检测蛋白样品上样量:每孔28 μg。电泳条件:浓缩胶恒压90 V,约20 min;分离胶恒压120 V,通过预染蛋白marker来确定电泳停止时间。湿转法,转膜条件300 mA恒流;0.45 μm孔径聚偏氟乙烯(PVDF)膜,转膜时间90 min。转膜完成后应用丽春红染色试剂对膜进行染色,观察转膜效果。封闭:将膜完全浸没于5%牛血清白蛋白(BSA)-TBST中,水平摇床孵育1 h。一抗孵育:5% BSA-TBST稀释一抗(稀释比例1∶1 000),4 ℃水平摇床孵育过夜。次日,洗膜:TBST洗3次,每次10 min。二抗孵育:5% BSA-TBST稀释二抗,山羊抗兔、山羊抗鼠IgG(H+L)辣根过氧化物酶(HRP)1∶10 000,室温孵育40 min。洗膜:TBST洗膜3次,每次10 min。电化学发光(ECL)液滴加到膜的蛋白面,反应3 min;胶片曝光:10 s至5 min(曝光时间随不同光强度而调整),显影2 min,定影。图片扫描后,使用软件Gel Image ststem ver.4.00 (tanon,中国)对图像进行灰度分析。

2 结 果
2.1 大鼠下肢动脉硬化闭塞症模型建立情况 下肢动脉硬化闭塞症大鼠造模成功,分离、结扎效果明显,每组有1~2只死于术后感染。除空白组外,其余各组大鼠均有不同程度的下肢活动障碍,部分有下肢坏死。
2.2 各组给药后外周血、骨髓中CD133+细胞比例比较 与空白组比较,模型组及给药组CD133+细胞比例升高;与模型组比较,各给药组CD133+细胞比例均降低(P<0.05);其中,鹿茸高剂量组高于LY294002+鹿茸高剂量组,LY294002+鹿茸高剂量组高于鹿茸中剂量组,鹿茸中剂量组高于LY294002+鹿茸中剂量组,LY294002+鹿茸中剂量组高于鹿茸低剂量组,鹿茸低剂量组高于LY294002+鹿茸低剂量组,差异均有统计学意义(P<0.05);骨髓与外周血中CD133+细胞比例趋势基本相同。详见表1。
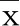
表1 各组外周血、骨髓中CD133+细胞比例比较(±s)
2.3 各组外周血VEGF、SDF-1α水平比较 与空白组比较,模型组及给药组VEGF、SDF-1α水平均降低,各给药组VEGF、SDF-1α水平均高于模型组,其中,鹿茸高剂量组高于LY294002+鹿茸高剂量组,LY294002+鹿茸高剂量组高于鹿茸中剂量组,鹿茸中剂量组高于LY294002+鹿茸中剂量组,LY294002+鹿茸中剂量组高于鹿茸低剂量组,鹿茸低剂量组高于LY294002+鹿茸低剂量组,差异均有统计学意义(P<0.05)。详见表2。
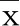
表2 各组外周血VEGF、SDF-1α水平比较(±s) 单位:pg/mL
2.4 各组腓肠肌中eNOS、CXCR4阳性表达比例比较 模型组及给药组eNOS、CXCR4阳性表达比例均明显低于空白组(P<0.05);与模型组比较,各给药组eNOS、CXCR4阳性表达比例明显升高(P<0.05);各给药组eNOS、CXCR4阳性表达比例为鹿茸高剂量组>LY294002+鹿茸高剂量组>鹿茸中剂量组>LY294002+鹿茸中剂量组>鹿茸低剂量组>LY294002+鹿茸低剂量组,组间比较差异均有统计学意义(P<0.05)。详见图1。
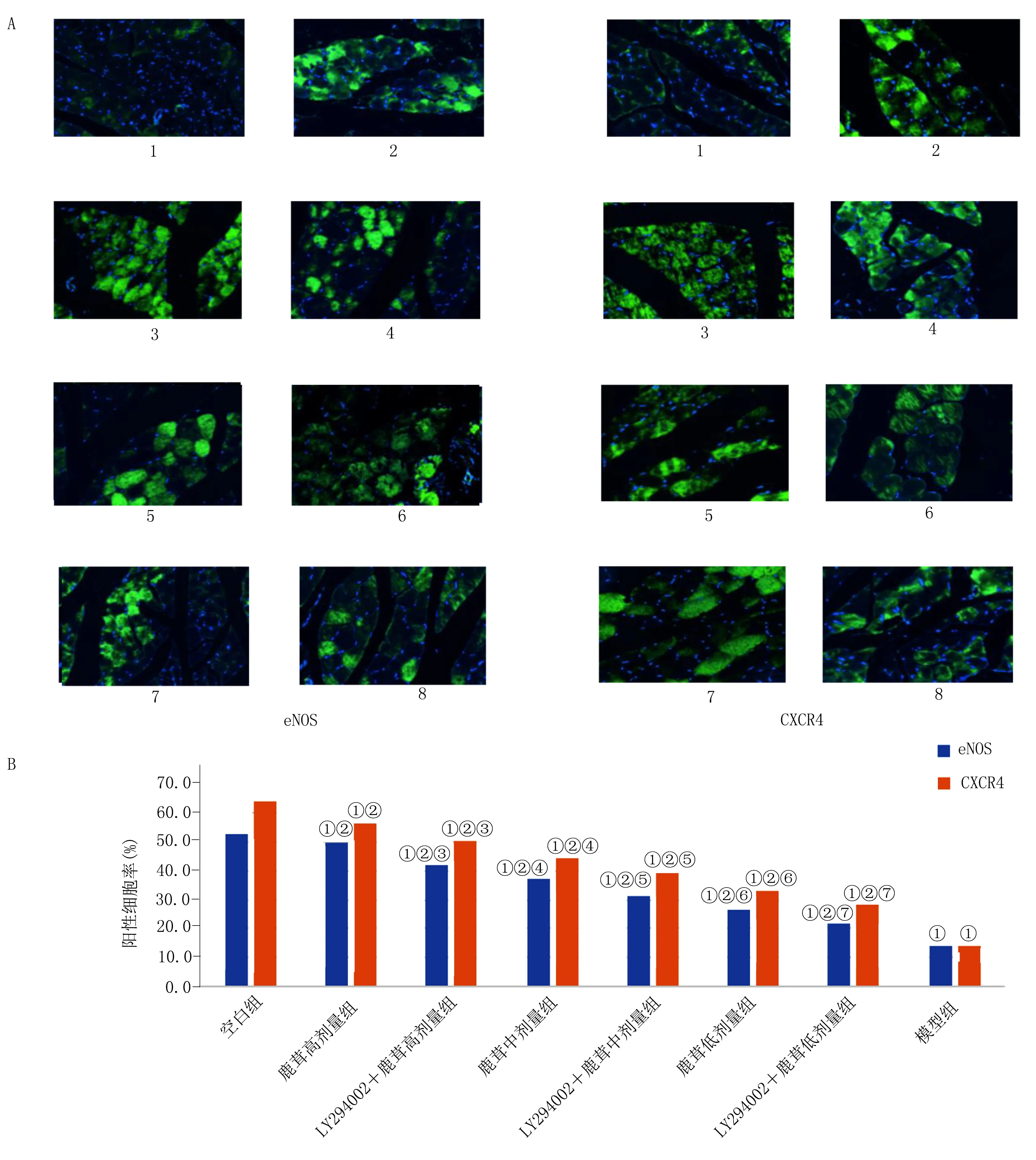
与空白组比较,① P<0.05;与模型组比较,② P<0.05;③ 与鹿茸高剂量组比较,P<0.05;④ 与LY294002+鹿茸高剂量组比较,P<0.05;⑤ 与鹿茸中剂量组比较,P<0.05;⑥ 与LY294002+鹿茸中剂量组比较,P<0.05;⑦ 与鹿茸低剂量组比较,P<0.05。
2.5 Western Blotting检测PI3K、Akt蛋白表达水平 与模型组比较,各给药组PI3K、Akt蛋白表达水平均升高(P<0.05);与各抑制剂组比较,各对应给药组PI3K、Akt蛋白表达水平均升高(P<0.05)。详见图2、图3。提示鹿茸对下肢动脉硬化闭塞大鼠的内皮祖细胞动员及归巢促进血管新生的作用可能与其上调PI3K/Akt信号通路活性有关。
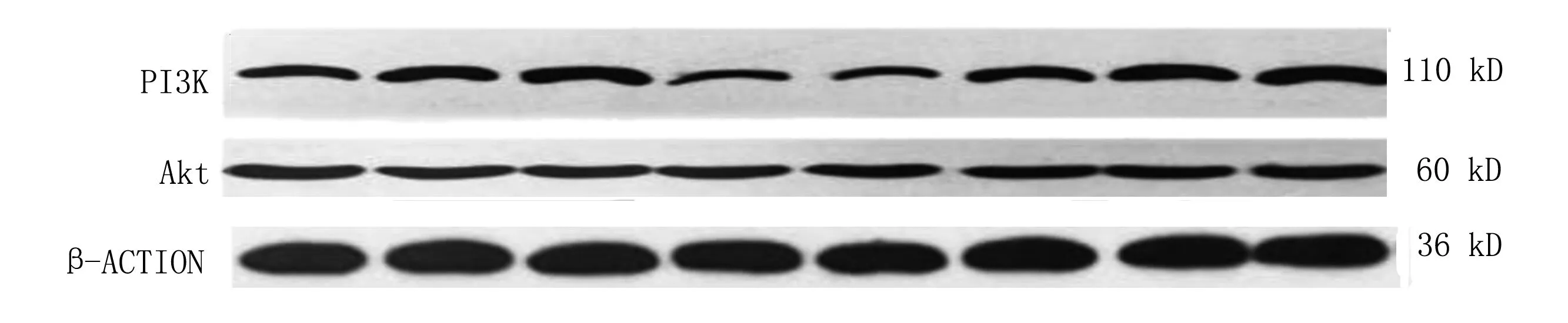
图2 各组大鼠腓肠肌中PI3K、Akt蛋白表达电泳图(1为鹿茸低剂量组;2为鹿茸中剂量组;3为LY294002+鹿茸高剂量组;4为模型组;5为空白组;6为LY294002+鹿茸低剂量组;7为LY294002+鹿茸中剂量组;8为鹿茸高剂量组)

* 与模型组比较,P<0.05;# 与鹿茸高剂量组比较,P<0.05;△ 与鹿茸中剂量组比较,P<0.05;▲ 与鹿茸低剂量组比较,P<0.05。
3 讨 论
周围血管疾病是继心脑血管疾病后又一严重危害健康的疾病,轻则导致病人肢体功能障碍,严重则导致残疾甚至危及生命。下肢动脉硬化闭塞症是动脉粥样硬化的进一步发展,当众多致病因素导致的血管内皮受损程度超过机体修复时,血管内皮细胞会减少,功能受损,使其外周血中EPCs功能明显下降[6]。EPCs是内皮细胞的前体内皮,主要来源于骨髓,具有较强的增殖能力,不仅可以从骨髓动员、迁移进入外周血,参与损伤血管内皮的修复,而且可以生成新的血管,在治疗心脑血管疾病、外周缺血性疾病、肿瘤血管病等中扮演着越来越重要的角色[7]。EPCs早期主要有其免疫表型:早期表型主要有CD34、CD133和VEGF受体(R)2,晚期表型主要有CD34+及VEGF+[8]。其中,CD133的表达是EPCs的一个标志,也是区分EPCs和成熟内皮细胞的主要指标。
鹿茸具有补肾、填精、益髓的功效[9],鹿茸主要成分鹿茸多肽对表皮细胞及成纤维细胞有显著的促进增殖作用,可以加速创面愈合,促进血管内皮细胞的增殖分化及迁移,促进病变部位的血管生成[10]。
PI3K/Akt信号通路广泛存在于各种正常细胞和肿瘤细胞中,是一条对细胞的生长、增殖、迁移及分化起重要调节作用的信号转导通路[11]。SDF-1α又称趋化因子CXCL12,是趋化因子家族重要成员之一,具有不可代替的生物学活性。SDF-1的唯一受体CXCR4在造血干细胞-祖细胞表面及EPCs表面高度表达。多项研究显示,SDF-1α/CXCR4轴对多种细胞的迁移起重要调节作用,内皮细胞膜表面CXCR4的功能性表达促使SDF-1α生成增加,后者可高效诱导内皮细胞迁移和胞浆内Ca2+浓度升高[12]。CXCL12和VEGF之间也存在反馈轴,起着共同调节EPCs增殖、迁移和生成血管的作用。SDF-1可促使多种细胞合成VEGF,而VEGF表达的增加又可上调SDF-1受体的表达。VEGF能靶向性作用于EPCs,促使其强烈增殖、分化,诱发体内生成血管[13]。
PI3K/Akt在VEGF等因子作用下,阻止内皮细胞凋亡,磷酸化后可激活eNOS,促进NO合成,促进新生血管形成[14]。eNOS不仅表达于成熟的内皮细胞,同时也表达于EPCs,生成NO,调节EPCs并发挥其生物学功能。另外,eNOS也作为EPCs的一个生物标志,用于EPCs的鉴定[15]。PI3K/Akt的激活及其下游eNOS的磷酸化是EPCs合成NO的重要途径,NO可促进EPCs的增殖、迁移及血管新生。本实验发现PI3K特异性抑制剂LY29400能够进一步抑制EPCs Akt磷酸化和eNOS的表达,同时几乎可以阻断SDF-1α诱导的EPCs迁移。
本研究结果表明,鹿茸能够促进EPCs活性,增强EPCs的增殖、迁移、黏附及成小管功能;而PI3K抑制剂能阻断鹿茸含药血清对EPCs功能的促进作用,减少EPCs分泌NO,降低EPCs表达eNOS的水平,表明鹿茸调控EPCs是通过PI3K/Akt信号通路。
