miR-16/15a-/-小鼠NK细胞功能及其对结肠癌移植瘤敏感度分析
2021-07-28魏莹莹胡翔宇祖丽皮耶艾尔肯龚卫娟贾筱琴
魏莹莹,胡翔宇,祖丽皮耶·艾尔肯,龚卫娟,贾筱琴
扬州大学医学院基础医学系,江苏 扬州 225001
microRNA(miRNA)是一类内生的、长度约为20~24个核苷酸的非编码RNA,不仅参与细胞增殖、发育、分化、凋亡等基本生理过程,还和肿瘤、炎症等病理过程有着密切关系[1]。miR-16和miR-15a基因复合体定位于人类基因组13q14,该位点基因的突变与慢性淋巴细胞性白血病以及黑色素瘤、结直肠癌、前列腺癌、乳腺癌、膀胱癌等多种实体肿瘤,有着密切的关系[2]。miR-16/miR-15a可以直接靶向多种致癌基因,也可以靶向抑制生长因子的分泌,从而发挥抗肿瘤活性[3-4]。
NKG2D 是表达于自然杀伤(natural killer,NK)和CD8+T细胞的重要活化性受体之一[5]。NKG2D转录后水平可受miRNA调控,如miR-182可与NKG2D的3′-非翻译区(3′-UTR)结合下调NKG2D 表达[6]。通过生物信息学分析,我们在小鼠NKG2D 基因3′-UTR 区发现了miR-16 结合的互补基因区(图1),然而miR-16 是否通过调节NK 细胞NKG2D 的表达进而参与肿瘤的调控,目前尚不清楚。

图1 miR-16与NKG2D 3′-UTR的互补序列Figure 1 Complementary sequence of miR-16 and NKG2D 3′-UTR
本研究观察了MC38 结肠癌移植瘤在8 周龄miR-16/15a-/-小鼠体内的生长情况,以及生理及荷瘤状态下NKG2D+NK 细胞和NKG2D-NK 细胞内miR-16表达的变化。同时利用miR-16/15a-/-小鼠研究生理及荷瘤后NK细胞的活性变化,为深入了解miR-16调节NK细胞生物学活性提供重要实验依据。
1 材料和方法
1.1 材料
1.1.1 实验动物及细胞系
miR-16/15a-/-小鼠为本实验室自美国Jackson实验室引进,并于扬州大学比较医学中心繁殖,C57BL/6 小鼠购自扬州大学比较医学中心,所有使用实验动物均为8 周龄。饲养环境为:温度20~25 ℃,湿度50%左右,正常昼夜更替,12 h 光照/12 h无光照交替进行的方式模拟,自由饮水进食。所有动物实验严格按照动物实验规范执行。饲养小鼠结肠癌细胞系MC38 细胞株和小鼠淋巴瘤细胞(YAC-1细胞)由本实验室常规保存。
1.1.2 主要试剂
RNA 逆转录试剂盒Mir-XTMmiRNA First-Strand Synthesis Kit、DNA 合成酶SYBR Premix Ex TaqTMⅡ(TaKaRa公司,日本);APC-NK1.1抗体(PK136)、PENKG2D抗体(6d5)、FITC-CD3抗体(17A2)、PE-IFNγ抗体(XMG12)(BioLegend公司,美国);PE-CD107a抗体(1D4B)(BD Biosciences 公司,美国);佛波脂醇和离子霉素刺激剂(eBioscience公司,美国),DMEM细胞培养基(Gibco 公司,美国);胰酶细胞消化液、红细胞裂解液(上海碧云天);胎牛血清(Biological Industries 公司,以色列);DNase Ⅰ(上海生工);DispaseⅡ(Roche Applied Science 公司,美国);胶原酶Ⅳ(Sigma公司,美国)。
1.2 方法
1.2.1 观察miR-16/15a-/-小鼠对结肠癌移植瘤的敏感性
收集对数期小鼠结肠癌MC-38细胞按2×106个/只皮下注射miR-16/15a-/-小鼠(KO)和同型对照C578L/6 小鼠(WT)。每天观察移植瘤生长情况和小鼠状态,体外测量移植瘤长、宽、高并计算体积。第21天时取出移植瘤和小鼠脾脏,进行下一步分析。
1.2.2 RT-PCR法检测小鼠NK细胞miR-16的表达
分离C57BL/6 小鼠脾脏并制备淋巴单细胞悬液,通过BD流式细胞仪分选NK1.1+NKG2D+细胞和NK1.1+NKG2D-细胞,用TRIzol 分别提取各组细胞总RNA,分光光度计测量其纯度及浓度,并取1 μg,采用Mir-XTMmiRNA First-Strand Synthesis Kit逆转录成cDNA,逆转录条件为37 ℃60 min,85 ℃5 min。然后,以cDNA 为模板,进行荧光定量PCR,反应条件为95 ℃10 s;95 ℃5 s,60 ℃20 s,40 个循环。荧光定量PCR 采用SYBR Premix Ex TaqTMⅡ试剂盒,设计上游引物miRNA-16-1 序列为5′-TAGCAGCACGTAAATATTGGCG-3′,下游引物为试剂盒的通用引物。以snRNA 中的U6 作为内参基因,其上下游通用PCR 引物均由试剂盒提供。结果采用相对定量方法对目的基因的表达量进行分析,实验重复3 次。
1.2.3 流式细胞术检测miR-16/15a-/-小鼠NK 细胞的表型和功能
分离8 周龄的miR-16/15a-/-小鼠和同型对照小鼠的脾脏并制备淋巴单细胞悬液,通过流式细胞术分别检测CD3-NK1.1+和CD3-NK1.1+NKG2D+细胞频率。用流式细胞术进行胞内染色时,用细胞刺激剂体外培养淋巴细胞4 h 后,Brefeldin A 阻断转运和释放,标记NK1.1 和IFN-γ抗体,检测NK 细胞分泌的IFN-γ。另外,用脾脏单细胞悬液按3∶1、1∶1、1∶3 的效-靶比例,分别与小鼠淋巴瘤细胞(YAC-1细胞)共孵育后,以CD107a 标记法检测NK 细胞的脱颗粒活性。
1.2.4 流式细胞术分析NK细胞在荷瘤小鼠组织中的分布
取脾脏淋巴单细胞悬液,流式细胞术分析脾脏中NK 细胞频率和NK 细胞及其受体NKG2D 的表达。对于分离的肿瘤组织,充分研磨后用0.5 mg/mL的胶原酶Ⅳ、0.5 mg/mL的DnaseⅠ和3 mg/mL的DispaseⅡ消化肿瘤组织,梯度离心法获得肿瘤浸润样淋巴细胞,流式分析肿瘤组织中NK 细胞频率及NKG2D表达。
1.3 统计学方法
采用GraphPad Prism 7 软件进行统计分析,计量资料以均值±标准差()表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-16/15a-/-小鼠对结肠癌移植瘤的敏感性
miR-16/15a-/-小鼠(KO)和对照小鼠(WT)经皮下注射MC38 细胞制备结肠癌移植瘤模型,观察两组小鼠皮下实体瘤生长情况。结果显示,与WT 小鼠比较,移植瘤的生长在KO小鼠受到显著抑制(图2A、B),KO 组小鼠肿瘤重量明显小于WT 小鼠(P<0.05,图2C)。

图2 miR-16/15a-/-小鼠对结肠癌移植瘤敏感性的检测Figure 2 Sensitivity of miR-16/15a-/-mice to colon cancer xenograft
2.2 生理及荷瘤状态下miR-16在NK1.1+NKG2D+细胞的表达
已知miRNA[7],包括miR-16/15a调节NK细胞的分化与功能[8],NK 细胞异常表达NKG2D 会影响肿瘤的发生发展[9],于是课题组研究miR-16 水平与NK 细胞NKG2D 表达的关系。分别取生理状态的C57BL/6 小鼠和荷瘤(MC38 皮下荷瘤)3 周的C57BL/6 小鼠的脾脏细胞,流式细胞术分选脾脏NK1.1+NKG2D+细胞和NK1.1+NKG2D-细胞,RT-PCR法检测miR-16的表达。结果显示,生理状态小鼠脾脏NK1.1+NKG2D+细胞中miR-16表达水平较NK1.1+NKG2D-细胞显著降低(P<0.01,图3A),荷瘤小鼠脾脏NK细胞miR-16的表达在NKG2D+和NKG2D-亚群中无明显变化(P>0.05,图3B),提示荷瘤状态下,miR-16对NK细胞NKG2D的表达无明显调控作用。
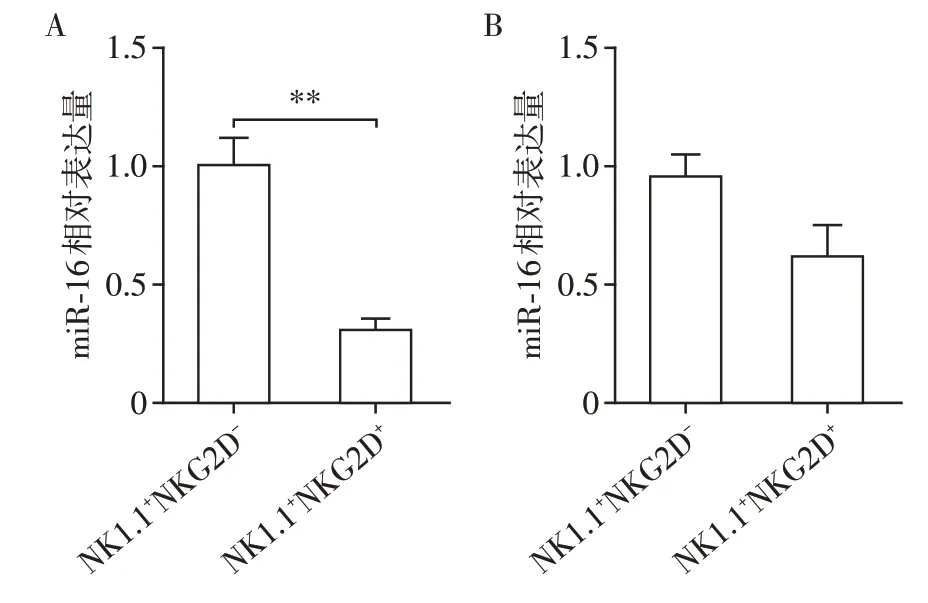
图3 生理或荷瘤小鼠NK1.1+NKG2D+和NK1.1+NKG2D-细胞miR-16的表达Figure 3 Expression of miR-16 in NK1.1+NKG2D+ and NK1.1+NKG2D- cells in physiological or tumorbearing conditions
2.3 miR-16/15a-/-小鼠NK 细胞频率及受体NKG2D的表达
接下来课题组研究miR-16/15a敲除后,NK细胞频率及NK细胞NKG2D的表达是否发生改变。流式细胞术分析生理状态下miR-16/15a-/-小鼠和对照小鼠脾脏NK细胞百分率,同时检测NK细胞NKG2D的表达情况。结果显示两组小鼠脾脏中NK细胞百分率和NK细胞NKG2D的表达均无显著差异(P>0.05,图4A、B)。进一步用IL-2(20 ng/mL)+IL-15(20 ng/mL)联合刺激NK 细胞活化72 h 后,两组小鼠NK 细胞NKG2D的表达亦无明显变化(P>0.05,图4C)。

图4 miR-16/15a-/-小鼠脾脏NK细胞频率及NKG2D的表达Figure 4 NK cell frequency and expression of NKG2D in the spleen of miR-16/15a-/-mice
2.4 miR-16/15a-/-小鼠NK细胞IFN-γ分泌和细胞毒活性的检测
流式细胞术分析生理状态的miR-16/15a-/-小鼠和同型对照小鼠脾脏NK细胞IFN-γ的产生能力,以及与靶细胞共孵育后的脱颗粒活性,以评估NK 细胞杀伤活性。结果表明,与WT 小鼠相比,KO 小鼠NK 细胞分泌IFN-γ的能力无显著变化(P>0.05,图5A);同时两组小鼠NK细胞脱颗粒能力(CD107a表达)无明显差异(P>0.05,图5B)。

图5 miR-16/15a-/-小鼠脾脏NK细胞IFN-γ产生和脱颗粒活性的检测Figure 5 IFN-γ production and degranulation activity of NK cells in the spleen of miR-16/15a-/-mice
2.5 miR-16/15a-/-小鼠荷瘤后体内NK 细胞活性的检测
以MC38 细胞皮下注射miR-16/15a-/-小鼠和C57BL/6小鼠,建立小鼠结肠癌移植瘤模型,对两组荷瘤小鼠用流式细胞术分析脾脏和移植瘤中NK细胞及NK1.1+NKG2D+细胞的百分率。结果表明,无论是NK 细胞的百分率,还是NK1.1+NKG2D+的百分率,在两组荷瘤小鼠的脾脏(P>0.05,图6A、B)和移植瘤中都没有明显的差异(P>0.05,图6C、D),提示荷瘤状态下miR-16对NK细胞表达NKG2D及NK细胞的生物学功能无明显调节作用。

图6 荷瘤小鼠脾脏和移植瘤组织NK细胞的检测Figure 6 Detection of NK cells in spleen and transplanted tumor of mice
3 讨论
miR-16/miR-15a功能下降和缺失不仅与慢性B淋巴细胞性白血病(约55%)密切相关,还与黑色素瘤、结直肠癌、前列腺癌、乳腺癌、膀胱癌等多种实体肿瘤有关[2]。miR-16/miR-15a 主要靶向抑制Bcl-2、WT-1、WNT3A、MCA1、MCL1、CCDN1等致癌基因的活性,进而促进肿瘤细胞的凋亡[3]。同时研究证实敲除miR-16/miR-15a 抑制肝癌(H22)移植瘤的生长[10],过表达miR-16/miR-15a会促进结肠癌(MC38)移植瘤的生长[11],miR-16或miR-15a在淋巴细胞中的表达以及其对淋巴细胞活性的影响还有待进一步研究。Sullivan等[8]发现在小鼠NK细胞中miR-16/15a可以直接靶向转录因子c-myb的3′-UTR区,从而影响NK 细胞的成熟和分化。本研究通过生物信息学分析发现NKG2D基因的3′-UTR区也存在miR-16的互补结合序列,而NKG2D是NK细胞表面重要的活化性受体,那么miR-16 是否参与调控NK 细胞NKG2D 的表达,以及其对NK 细胞介导的抗肿瘤免疫活性的影响如何,这对了解miR-16在不同状态NK细胞的表达特点及其活性调节具有重要意义,值得进一步研究。NKG2D 不仅是NK 细胞表面重要的活化性受体,也是CD4+T、CD8+、NKT、ɣδT以及部分巨噬细胞表面的活化性受体。当NKG2D与其配体MHC Ⅰ类相关分子(MICA 或MICB)结合后,激活NK 和CD8+T 淋巴细胞,成为机体发挥抗肿瘤和抗感染活性的关键免疫分子[5,12]。NKG2D+CD8+T、NKG2D+CD4+T细胞通常聚集肿瘤部位,发挥抗肿瘤作用[13],而miR-16/15a 能够影响NKG2D+CD8+T[14]、NKG2D+CD4+T[11]细胞的频率。提示miR-16/15a也可能通过影响CD4+T细胞、CD8+T细胞、NK细胞等NKG2D的表达发挥抗肿瘤作用。
为了进一步研究miR-16/15a 的生物学功能,课题组从美国Jackson 实验室引进了miR-16/15a 基因敲除小鼠。对比WT小鼠,miR-16/15a-/-小鼠的肝癌(H22)移植瘤生长速度变慢[11]。课题组对miR-16/15a-/-小鼠皮下注射MC38细胞,miR-16/15a-/-小鼠结肠癌移植瘤的生长速度较野生小鼠明显降低,提示miR-16/15a-/-小鼠抗肿瘤活性增强。生理状态下,与NK1.1+NKG2D-细胞相比,C57BL/6 小鼠NK1.1+NKG2D+细胞miR-16 表达明显下降,提示miR-16 可能调节NK 细胞NKG2D 的表达。然而在荷瘤小鼠中,miR-16 在小鼠脾脏2 组NK 细胞亚群间的表达差异消失,提示对于荷瘤小鼠的NK细胞,miR-16对其NKG2D表达没有核心调控作用。另外,生理状态的miR-16/15a-/-小鼠体内NK细胞百分率、活性和细胞毒性与对照小鼠无显著差异,与NK 细胞特异性缺乏miR-16/15a 的报道相一致。以上结果均提示尽管miR-16可能参与NK细胞NKG2D表达的调控,但对NK细胞的生物学活性无明显调节作用。
进一步分析发现,NK 细胞及NK1.1+NKG2D+细胞的百分率在荷瘤组织和脾脏内均无明显变化,说明NK细胞在miR-16/15a基因敲除小鼠体内的肿瘤监视作用改变不明显,可能是其他免疫细胞介导了抗肿瘤活性。课题组前期研究提示,miR-16/15a-/-小鼠荷瘤后,其肿瘤微环境中M1 型巨噬细胞的百分率明显增加,其M1 细胞的分化主要依赖NF-κB 和STAT3通路的共同激活[10]。另外,活化的小鼠CD8+T细胞表达NKG2D,且miR-16在初始CD8+T细胞中高表达,CD8+T细胞活化后表达下调[15]。因此,miR-16缺陷是否直接导致CD8+T细胞、M1型巨噬细胞活性上调,进而发挥抗肿瘤作用,需要后续进一步的实验证实。
综上所述,miR-16/15a-/-小鼠抑制MC38 结肠癌移植瘤生长。尽管生理状态下miR-16在NKG2D+和NKG2D-NK 细胞表达存在明显差异,但是正常和荷瘤状态下miR-16/15a-/-小鼠的NK 细胞却无明显区别。因此miR-16/15a-/-小鼠抑制MC38 结肠癌移植瘤生长,并非通过NK 细胞发挥作用,miR-16/15a-/-抑制MC38结肠癌移植瘤生长的机制仍需要进一步研究。
