TLR/NF-κB 信号通路在甲基苯丙胺诱导的原代小胶质细胞炎性反应中的作用
2021-07-28王胜婵王易欣臧松松
肖 逸,王胜婵,王易欣,臧松松,张 炜
1南京医科大学第一附属医院泌尿外科,江苏 南京 210029;2南京医科大学附属逸夫医院泌尿外科,江苏 南京 211100;3 南京医科大学附属老年医院泌尿外科,江苏 南京 210024;4 南京医科大学公共卫生学院卫生毒理系,江苏 南京211166
甲基苯丙胺(methamphetamine,METH)是一种具有强烈神经毒性的苯丙胺类兴奋剂[1]。研究表明,METH的神经毒性与小胶质细胞的激活有关[2]。小胶质细胞是中枢神经系统(central nervous system,CNS)中最重要的免疫细胞,正常情况下,小胶质细胞处于静息状态,而受到有害刺激后,小胶质细胞被激活,释放出肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1β(interleukin-1β,IL-1β)、白介素-6(interleukin-6,IL-6)等炎症因子[3]。小胶质细胞发生持续的激活,可导致其周边神经组织的炎症损伤。Toll样受体(Toll like receptor,TLR)在小胶质细胞中广泛表达,该受体家族激活后作用于下游炎性信号分子,促使编码炎症的相关分子及细胞因子的基因转录[4-5]。然而,TLR是否参与METH引起的神经炎性反应尚不清楚。
本研究通过建立原代小胶质细胞METH染毒模型,旨在探讨TLR及其下游炎性信号及因子介导的炎性反应,从而为METH的干预提供潜在靶点。
1 材料和方法
1.1 材料
METH(中国食品药品检定研究院,纯度:99.9%),PrimeScriptTMRT Reagent Kit 反转录试剂盒(TaKaRa 公司,日本),小鼠IBA-1 单克隆抗体(Proteintech 公司,美国),小鼠Phospho-NF-κB p65(Ser536)单克隆抗体、兔NF-κB p65(D14E12)单克隆抗体(Cell Signaling Technology 公司,美国),HRP标记的羊抗兔IgG(H+L)及HRP 标记的羊抗小鼠IgG(H+L)(Jackson Immuno 公司,美国),磷酸酶抑制剂(Roche 公司,瑞士),细胞裂解液、蛋白酶抑制剂、小鼠β-actin 单克隆抗体(Sigma 公司,美国),PVDF膜、ECL发光液(Millipore公司,美国)。
1.2 方法
1.2.1 原代小胶质细胞培养
孕18 d SD大鼠(购买于南京医科大学实验动物中心),麻醉后断头,无菌条件下取出腹中胎鼠,分离出两侧的大脑半球皮质,去除脑膜后置于HBSS液,胰酶消化后依次经100 μm 和40 μm 网筛过滤,将3×107个细胞接种于含18 mL DMEM 培养液(内含10%胎牛血清、1%双抗、0.04 mg/mL 巨噬细胞集落刺激因子)的75 cm2培养瓶中,接种4 d 后半量更换培养液,以后每隔3 d 换1 次培养液。本研究南京医科大学实验动物福利伦理审查委员会批准(批准号:IACUC-1801008)。
1.2.2 免疫荧光染色
4%多聚甲醛固定原代小胶质细胞30 min,1%的Triton X-100 冰上透化5 min,10%山羊血清37 ℃封闭30 min,一抗4 ℃孵育过夜,二抗37 ℃避光孵育2 h,加入含防荧光淬灭液的DAPI复染,激光共聚焦显微镜下扫描。所有结果至少重复3次。
1.2.3 蛋白免疫印迹实验
用蛋白裂解液(内含磷酸酶抑制剂和蛋白酶抑制剂)裂解原代小胶质细胞,提取总蛋白,采用BCA法测定蛋白质浓度。电泳(浓缩胶电泳40 V,分离胶电泳90 V),转膜(200 V,1 h),封闭(5%脱脂奶粉溶液,2 h),一抗4 ℃孵育过夜,二抗室温孵育2 h,将PVDF膜与ECL发光液A液和B液(1∶1)混合,置于化学发光成像系统进行曝光。所有结果至少重复3次。
1.2.4 Real-time PCR
提取原代小胶质细胞的mRNA 后,按照Prime-ScriptTMRT Reagent Kit 反转录试剂盒说明书,将mRNA 逆转录成cDNA,设计引物(引物序列见表1),冰上配制反应体系,设置ABI7300荧光定量PCR仪反应程序(两步法):96 ℃30 s 预变性,95 ℃5 s,60 ℃34 s,40次循环。每个样品4个复孔,利用熔解曲线确定PCR产物是否单一,根据标准曲线得出扩增效率。以β-actin作内参,用2-ΔΔCT法对结果进行计算和分析。ΔΔCT=(CT1-CT2)-(CT3-CT4),CT1:处理样品待测基因的临界循环数,CT2:处理样品管家基因的临界循环数,CT3:对照样品待测基因的临界循环数,CT4:对照样品管家基因的临界循环数,所有结果至少重复3次。

表1 大鼠源引物序列Table 1 Sequence of rat derived primers
1.3 统计学方法
利用SPSS20.0 软件对实验结果进行统计学分析,各组数据用均数±标准差()表示,多组定量资料比较采用单因素方差分析(one-way ANOVA)检验,多组间数据两两比较用Dunnettt检验,两组定量数据比较用Student’st检验,用Graphpad Prism5 软件进行作图。P<0.05为差异具有统计学意义。
2 结果
2.1 小胶质细胞的鉴定与纯度分析
小胶质细胞培养至第10~14 天,在恒温水平摇床上37 ℃,260 r/min 摇晃2 h,收集悬浮细胞,放入CO2恒温培养箱培养2~3 d后,利用免疫荧光方法对原代培养细胞进行鉴定与纯度分析。如图1 所示,红色荧光显示的是IBA-1阳性细胞,IBA-1是小胶质细胞的特异性激活标志蛋白,主要分布于细胞体。DAPI 染核,显示蓝色荧光。Merge 为两者的合并图。小胶质细胞的纯度=IBA-1阳性细胞/DAPI核染细胞×100%。随机计数10个视野下的IBA-1标记小胶质细胞数与DAPI 标记总细胞数,结果显示,按照本实验室分离培养小胶质细胞的方法,小胶质细胞纯度达到95%以上,符合后续实验要求。

图1 小胶质细胞的鉴定与纯度分析(×200)Figure 1 Microglial identification and purity analysis(×200)
2.2 METH对小胶质细胞的激活作用
为探究METH 对小胶质细胞的激活作用,用300 μmol/L 的METH 处理原代小胶质细胞15 min、30 min、1 h、3 h、6 h、12 h和24 h,观察原代小胶质特异性激活标志蛋白IBA-1的表达情况。如图2所示,IBA-1表达在METH处理30 min后开始上升,并在1 h达到高峰,差异有统计学意义(P<0.05),提示METH明显激活原代小胶质细胞。

图2 METH对原代小胶质细胞的激活情况Figure 2 Activation of primary microglia induced by METH
2.3 METH对小胶质细胞炎性因子表达的影响
在300 μmol/L的METH分别处理原代小胶质细胞12 h、24 h 后,使用real-time PCR 检测炎性因子TNF-α、IL-1β和IL-6 的mRNA 表达。如图3 所示,TNF-α、IL-1β和IL-6 mRNA 在METH孵育24 h 后表达均显著上升,差异具有统计学意义(P<0.05,P<0.001,P<0.01)。
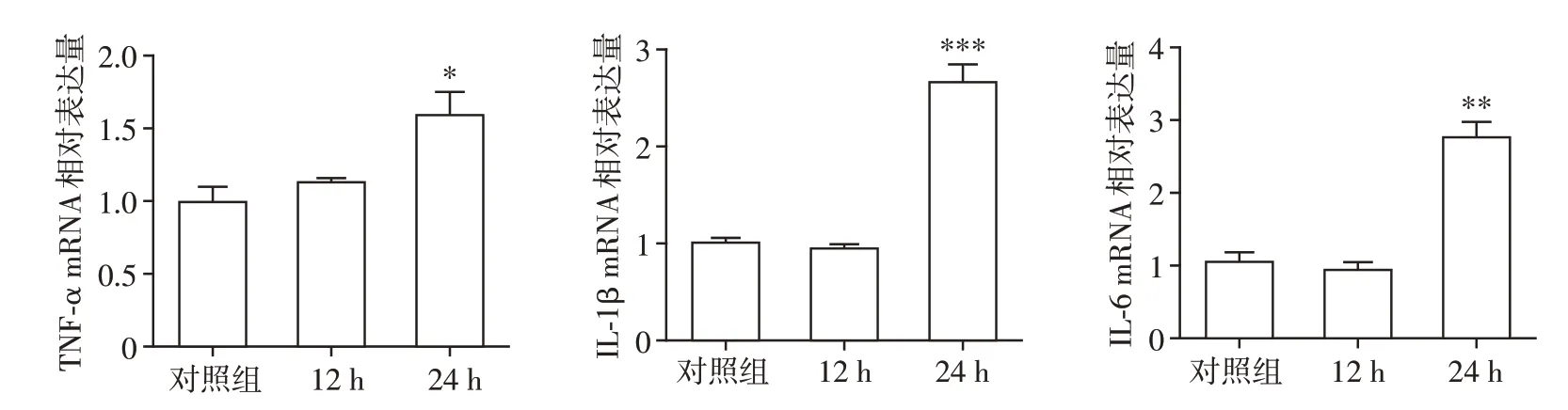
图3 METH对小胶质细胞炎症因子表达的改变Figure 3 Effects of METH on the expression of inflammatory factors in microglia
2.4 METH 对小胶质细胞TLR 家族mRNA 水平的影响
文献报道,TLR 家族参与小胶质细胞的炎性反应作用。用300 μmol/L的METH与原代小胶质细胞孵育24 h,检测TLR 1~9、11的mRNA表达情况。结果显示,与对照组相比,METH 处理后TLR1 的mRNA在原代小胶质细胞表达下降,TLR2、4~5、7~9和11的mRNA表达均显著上升,差异具有统计学意义(图4),而TLR3 和TLR6 的mRNA 水平无明显变化。

图4 METH对原代小胶质细胞TLR1~9、11的mRNA水平的影响Figure 4 Effects of METH on mRNA expression of TLR 1-9 and TLR11
2.5 METH对NF-κB通路激活的影响
转录因子NF-κB 是TLR 信号的下游,参与调节炎性因子转录和表达[6]。300 μmol/L 的METH 处理原代小胶质细胞15 min、30 min、1 h、3 h、6 h、12 h和24 h后,在15 min时NF-κB的磷酸化水平开始升高,在30 min 时达到高峰,与对照组比较,差异具有统计学意义,随后下降,但仍高于对照组(图5)。

图5 METH对NF-κB通路激活的影响Figure 5 Effects of METH on NF-κB activation
3 讨论
METH 属于苯丙胺类物质,是一种新型毒品。因为制造工艺简单,价格低廉,METH的滥用日益严重,给全世界带来严重的公共卫生问题[1]。动物和人群实验都显示,METH 滥用可导致严重的神经系统毒性[7-8]。METH的神经毒性作用机制十分复杂,主要包括兴奋性毒性、线粒体损伤、氧化应激、小胶质细胞炎症反应等[9]。目前,METH 诱导的小胶质细胞炎性反应是METH神经毒性的研究热点。小胶质细胞是中枢神经系统的主要炎性细胞,在保护大脑的完整性和维持大脑平衡中发挥重要作用。正常情况下,小胶质细胞处于静止状态,但当受到损伤或感染时,小胶质细胞被激活。持续激活的小胶质细胞会释放各种促炎细胞因子,如TNF-α、IL-1β、IL-6,导致神经元细胞死亡[10]。本实验结果显示,原代小胶质细胞暴露在METH 30 min 后,IBA-1 蛋白的表达明显升高;处理24 h后,炎性因子TNF-α、IL-1β、IL-6 的mRNA 水平明显升高,上述结果提示,METH 暴露明显激活小胶质细胞,且促进小胶质细胞中炎性因子TNF-α、IL-1β、IL-6 mRNA 的高表达。然而,目前METH 诱导小胶质细胞炎症反应的机制并不完全明了。因而,本研究探讨METH 激活小胶质细胞可能的上游信号通路。
TLR 是模式识别受体,在生物体中广泛存在。哺乳动物中至少存在13个TLR基因,TLR1~9在小鼠和人类中均表达,而TLR10~13仅在小鼠中表达[11]。研究表明,TLR 在神经元、小胶质细胞、星形胶质细胞、少突胶质细胞和神经干细胞中都有表达[12]。小胶质细胞表达多种TLR,该家族受体在小胶质细胞的免疫反应中发挥重要作用,是识别细菌或病毒感染的第一道防线,并促进各种炎症介质的产生。在静止的小胶质细胞中几乎无法检测到TLR的表达,但一旦小胶质细胞被激活,就会迅速表达多种TLR[11]。本实验中,通过real-time PCR 检测METH 激活的小胶质细胞内TLR 家族成员mRNA 的水平变化,我们发现TLR2~5、7~9、11 的mRNA 表达显著增加。提示小胶质细胞可能通过上调多种TLR来响应METH的刺激,TLR 表达的增加随后通过信号转导来上调炎性因子mRNA的表达。NF-κB作为炎性反应中的关键转录因子,在小胶质细胞激活导致的神经炎性的发生过程中发挥重要作用。因而,本研究探讨了参与TLR 诱导炎性因子表达的下游信号通路NF-κB的激活情况。在中枢神经系统中,NF-κB 信号通路可参与多种神经退行性疾病进程。一些研究表明,NF-κB的激活是促炎性细胞因子表达调控的关键步骤,活化后的NF-κB 转移到核内与其相关DNA 基序结合以诱导炎性因子基因的转录[13-14]。这些结果支持了本研究中METH暴露激活原代小胶质细胞内NF-κB的结果,提示NF-κB参与了TLR 诱导炎性因子的表达。
本研究揭示了TLR/NF-κB信号通路参与METH诱导的原代小胶质细胞的激活及其炎性因子表达的过程,后续将进一步对TLR/NF-κB信号通路之间的信号传递蛋白进行深入研究,以期为METH 神经毒性的干预提供潜在靶点。
