利用双引导RNA的CRISPR/Cas9技术构建Nudt3基因敲除小鼠
2021-07-28朱浩然祁俊侠闫丽红赖娅娜李聚学
朱浩然,张 鑫,祁俊侠,闫丽红,赖娅娜,李聚学*
1南京医科大学生物化学与分子生物学系,2医药实验动物中心,江苏 南京 211166
Nudix 水解酶家族成员核苷二磷酸连接的部分X 基 序3[Nudix(nucleotide diphosphate linked moiety X)-type motif 3,NUDT3]属于Nudix 水解酶家族成员,参与多种代谢调控过程[1-3],目前已知该家族共有21个成员[4],该家庭中的许多成员在代谢调控方面有重要作用。但是,NUDT3在肥胖发生和发展中的作用尚不清楚。一项关于日本肥胖人群的全基因组关联分析(genome-wide associaotion study,GWAS)发现,单核苷酸多态性(single nucleotide polymorphism,SNP)rs206936 位点与肥胖密切相关,且NUDT3 基因位于该SNP 位点附近[5]。在果蝇上敲降Nudt3基因,导致果蝇的体重显著改变[6]。另外一项研究显示,NUDT3 与女性体脂率增加有关,而与男性体脂率无关[5]。NUDT3导致的脂肪积累可能与PI3K-AKT 信号有关[7-8]。我们前期研究发现,Nudt3基因在小鼠下丘脑的弓状核中有较高的表达水平,推测其可能在下丘脑介导的能量调控中发挥重要作用。然而,目前尚缺乏可进行相关研究的Nudt3 基因敲除小鼠。鉴于此,我们利用CRISPR/Cas9技术进行Nudt3基因编辑小鼠的构建[9-11]。
按照CRISPR/Cas9 的技术原理,我们设计了相应的引导RNA(guide RNA,gRNA),在南京医科大学实验动物中心进行了gRNA和Cas9 mRNA的胚胎显微注射,并获得了小鼠。小鼠的基因测序结果显示,在Nudt3 基因第2 个外显子有一段98 bp 长度的序列缺失;Western blot结果也显示,Nudt3基因在多个组织(如肝脏、下丘脑等)中均不表达,表明基因敲除小鼠构建成功,可为我们后续肥胖机制研究提供理想的动物模型。
1 材料和方法
1.1 材料
1.1.1 实验动物
CRISPR/Cas9 基因编辑技术构建Nudt3 基因敲除小鼠的设计和胚胎注射工作由南京医科大学医药实验动物中心完成[实验动物生产许可证号:SYXK(苏)2015-0015]。所有实验小鼠均饲养于无特定病原体(specific pathogen free,SPF)屏障设施中,7:00—19:00 提供光照(光/暗循环12 h),温度(22±3)℃,饲料与饮水随意采食,全部动物实验均严格按照南京医科大学动物实验福利伦理审查委员会(IACUC-1811031)批准的程序开展。
1.1.2 主要试剂
2×Taq Plus MasterMix、2×SYBR Green MasterMix(南京诺唯赞生物科技有限公司);TRIzol(北京宝日医生物技术有限公司);蛋白酶K、RIPA 蛋白裂解液、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)电泳上样缓冲液(上海翊圣生物科技有限公司);DNA Maker DL2000(北京天根生化科技有限公司);蛋白酶和磷酸酶抑制剂(MCE 公司,美国);二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、Kinase-BeyoECL Plus 超敏ECL化学发光试剂盒、鼠抗小鼠GAPDH 抗体(上海碧云天生物技术有限公司);兔抗小鼠NUDT3抗体(武汉三鹰生物技术有限公司);聚偏氟乙烯(poly vinylidene fluoride,PVDF)膜(Millipore 公司,美国)。Nudt3 基因敲除小鼠DNA 鉴定引物序列信息及RT-PCR 引物序列见表1,所有引物合成以及测序结果均来自南京擎科生物技术有限公司。
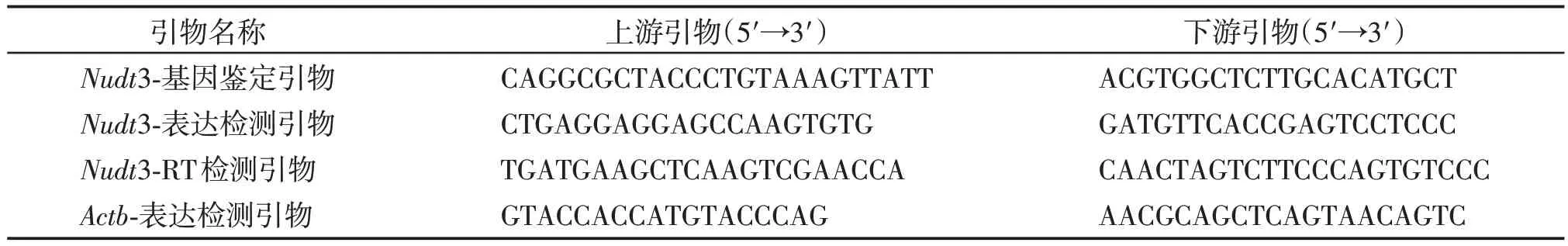
表1 小鼠DNA鉴定及RT-PCR引物序列Table 1 The primer sequences for mice genotyping and RT-PCR
1.2 方法
1.2.1 基因编辑小鼠的构建
在C57BL/6 小鼠Nudt3 基因的第2 个外显子上选择gRNA 靶点,设计2 条gRNA,分别是gRNA-1:5′-GTAGCCGCCATCCAGACCGA-3′,gRNA-2:5′-GTTCTCAGTTACATTGCGGA-3′。合成相应的gRNA后,对收集到的受精卵进行显微注射(Cas9 mRNA 注射浓度为20 ng/μL,gRNA注射浓度为50 ng/μL),得到的胚胎分别移植到假孕小鼠中,经过正常妊娠分娩后,得到F0 代小鼠,并进行基因突变分析。将F0代基因突变小鼠与野生型小鼠交配获得后代F1,并对F1 代小鼠进行基因突变分析。选择发生基因移码突变的F1 代杂合雌鼠和雄鼠交配获得F2 代小鼠,并对F2 代小鼠进行基因突变分析。对F2 代中纯合小鼠进行配繁,获得基因纯合敲除小鼠品系。
1.2.2 基因敲除小鼠的筛选
提取鼠尾基因组DNA,通过PCR 检测目的片段。反应体系:2×Taq Plus MasterMix 10 μL、上游引物0.8 μL、下游引物0.8 μL、DNA 模板2 μL、无菌水6.4 μL。反应条件:95 ℃变性5 min;95 ℃30 s、60 ℃30 s、72 ℃30 s,循环35 次;72 ℃延伸10 min。根据PCR 扩增数据进行测序分析,选择非3 的倍数缺失碱基的个体作为突变的阳性小鼠。
1.2.3 基因敲除脱靶位点预测与脱靶效应检测
利用在线软件https://cm.jefferson.edu/Off -Spotter/进行脱靶位点预测,筛选出与gRNA 序列同源性较高的脱靶位点,随后在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)的C57BL/6 小鼠基因组(https://www.ncbi.nlm.nih.gov/genome/gdv/browser/genome/?
id=GCF_000001635.27,物种taxid:10090)中找到该位点附近的核酸序列,设计测序引物(表2)以测定预测脱靶位点的基因组。

表2 脱靶预测位点测序引物序列Table 2 The primer sequences for the predicted off -target site sequences
1.2.4 实时荧光定量PCR(quantitative real-time PCR,qPCR)检测小鼠Nudt3基因mRNA表达
采用TRIzol 法提取组织总RNA,根据PrimeScriptTMRT Reagent Kit 逆转录试剂盒说明制备cDNA 样品。按如下步骤进行qPCR,反应体系如下(20 μL):2×SYBR Green MasterMix 10 μL、cDNA模板2 μL、上游引物0.8 μL、下游引物0.8 μL、无菌水6.4 μL。反应条件:50 ℃2 min,1 个循环;95 ℃10 min,1 个循环;95 ℃15 s,60 ℃1 min,40 个循环。每个样品均做3 个重复反应,以Actb为内参基因根据公式2-ΔΔCT计算Nudt3 mRNA 在各组织中的表达量。
1.2.5 PCR检测Nudt3-/-小鼠Nudt3基因mRNA表达
按上述方法提取组织总RNA 并制备cDNA 样品。按如下步骤进行PCR。反应体系如下(20 μL):2×Taq Plus MasterMix 10 μL、cDNA 模板3 μL、上游引物0.8 μL、下游引物0.8 μL、无菌水5.4 μL。反应条件:50 ℃2 min,1 个循环;95 ℃10 min,1 个循环;95 ℃15 s,60 ℃1 min,40 个循环。PCR 产物进行琼脂糖凝胶电泳,分析检测mRNA 的表达情况。
1.2.6 Western blot 检测Nudt3-/-小鼠各组织蛋白水平的表达
脱臼法处死F2 代纯合Nudt3 基因敲除小鼠和对照组野生型小鼠,依次取各部分组织,加预冷的适量蛋白裂解液(内含蛋白酶和磷酸酶抑制剂)。用组织匀浆机将组织充分研磨后,冰浴1 h,13 000 r/min 4 ℃离心30 min,取上清。用BCA 试剂盒测定组织蛋白质浓度,并按照测定的浓度适当稀释蛋白质样品。加入蛋白上样缓冲液混合,95 ℃煮沸5 min后,-20 ℃保存。取40 μg 蛋白样本进行10%SDSPAGE 凝胶电泳,转膜,5%脱脂奶粉溶液封闭1 h,加入一抗(兔抗小鼠NUDT3,鼠抗小鼠GAPDH,均1∶1 000 稀释),4 ℃孵育过夜,次日TBST 洗涤3 次,每次5 min,加入山羊抗兔二抗及山羊抗鼠二抗(1∶1 000 稀释)室温孵育1 h,TBST 洗涤5 min,共洗3 次。根据ECL说明书显影,使用凝胶成像系统拍照。
1.3 统计学方法
采用GraphPad Prism 9.0、SPSS22.0 软件进行统计学分析,数据以均数±标准误()表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Nudt3基因在各组织中的表达以及在高脂饲料饲喂下的表达变化
用定量PCR 检测Nudt3 基因的mRNA 表达谱,结果显示,Nudt3在中枢神经系统高表达(图1A)。
为了进一步探究NUDT3与代谢的关系,我们检测了在60%高脂饲料诱导下Nudt3 基因表达的变化。结果显示,在高脂饲料的诱导下,下丘脑、肾、肝的Nudt3基因表达显著下调,白色脂肪、棕色脂肪中Nudt3基因表达显著上调(P<0.05,图1B)。从这些结果中可以看出,Nudt3 基因在重要代谢调控组织中的表达会受到高脂饲料诱导的调控,提示NUDT3在能量代谢中可能发挥重要作用。

图1 Nudt3 mRNA的转录水平Figure 1 The relative expression of Nudt3 mRNA
2.2 针对Nudt3基因的gRNA序列设计
为了进一步研究Nudt3基因在能量调控中的作用机制,我们拟利用CRISPR/Cas9 技术构建Nudt3基因敲除小鼠。使用CRISPR/Cas9 技术进行基因敲除时,合理的gRNA设计十分重要。根据经验,一般将gRNA 设计在目的基因编码区域的2 号外显子(Exon 2),或编码区域的前1/3 处,在此区域切割使DNA 双链断裂,通过非同源性末端结合(nonhomologous end joining,NHEJ)修复,产生移码突变。本研究将2 条gRNA 分别设计在Nudt3 基因Exon 2(gRNA1)与Exon 2和Exon 3间的区域(gRNA2)(图2),使用在线设计软件(http://crispr.mit.edu/)进行设计。序列分别为gRNA-1:5′-GTAGCCGCCATCCAGACCGA-3′,gRNA-2:5′-GTTCTCAGTTACATTGCGGA-3′。
2.3 Nudt3基因敲除小鼠的测序鉴定结果
合成相应的gRNA后,对116枚受精卵进行显微注射,随后将得到的112 枚胚胎分别移植到5 只假孕小鼠中,经过正常妊娠分娩后,共获得17只F0 代小鼠,DNA测序鉴定结果显示14只小鼠均为敲除嵌合体。
获得F0 代嵌合体小鼠后,将F0 代小鼠与C57BL/6 野生型小鼠杂交配繁,获取F1 代杂合小鼠。针对Nudt3基因的敲除靶点两端设计PCR鉴定引物,经PCR扩增测序,鉴定出3种基因型,分别为:①Nudt3-KO1:394 bp碱基片段缺失,末端碱基G突变为C;②Nudt3-KO2:在2号外显子区域出现4 bp碱基片段缺失;③Nudt3-KO3:383 bp 碱基片段缺失(图2)。后续实验选取敲除片段最多(394 bp 的序列缺失)且突变位点靠近5′端的Nudt3-KO1小鼠进行鉴定,发现在Nudt3基因蛋白编码区出现98 bp碱基缺失。
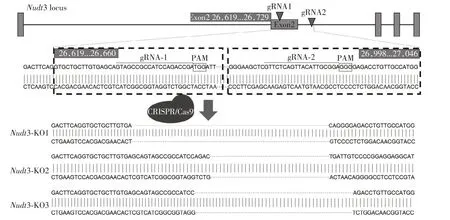
图2 Nudt3基因敲除小鼠的CRISPR/Cas9 gRNA靶点设计示意图Figure 2 The design of CRISPR/Cas9 gRNA for the generation of Nudt3-knockout mice
使用该基因型(Nudt3-KO1)F1代杂合小鼠进行交配,建立稳定的Nudt3 基因敲除小鼠品系。根据我们设计的引物,基因型鉴定标准为:电泳结果只出现672 bp 条带的样本为野生型,电泳结果同时出现672 bp和279 bp 条带的样本为杂合子,电泳结果只出现279 bp 条带的样本为敲除鼠(图3A、B)。

图3 部分F2代小鼠基因鉴定结果Figure 3 The genotyping results of F2-generation mice
2.4 Nudt3基因敲除小鼠的预测脱靶位点检测
由于gRNA 可能会有一定的脱靶效应,与基因组同源序列形成非特异结合,可能最终导致Cas9错误切割[12-13,15]。因此我们通过在线软件Off-Spotter进行脱靶位点预测,分别选取2 个脱靶概率最大的位点进行后续检测(表3)。随后我们针对筛选后的脱靶预测位点设计引物以进行测序分析,结果显示所有预测位点测序结果正确(图4),未发生脱靶效应造成的基因突变。

图4 脱靶预测位点测序结果Figure 4 The sequencing results of the predicted off-target sites

表3 小鼠基因组脱靶预测位点序列Table 3 The predicted off-target site DNA sequences in mice
2.5 Nudt3基因敲除小鼠的NUDT3表达水平检测
为了进一步确认Nudt3 基因敲除小鼠的可靠性,选取经PCR 鉴定获得的野生型和基因敲除纯合小鼠,用RT-PCR 和Western blot 检测其mRNA 和蛋白水平的表达情况。提取野生型和敲除小鼠不同组织(嗅球、下丘脑、海马、丘脑、中脑、小脑、脑桥、胰腺、肾、睾丸、肌肉、棕色脂肪和白色脂肪等)的总RNA,在敲除位点两侧设计引物(表1),通过RTPCR 鉴定不同组织中的基因表达情况。Nudt3基因敲除小鼠各组织的mRNA RT-PCR 产物电泳条带显示,Nudt3 基因敲除小鼠电泳条带与野生型电泳条带相比缺失100 bp 左右,测序比对后发现Nudt3基因敲除小鼠mRNA RT-PCR 产物比野生型缺失112 bp,表明Nudt3 基因在多个组织敲除成功(图5A)。
提取野生型和敲除小鼠不同组织(下丘脑、大脑皮层、肝脏和心脏)的蛋白后,通过Western blot鉴定不同组织中的表达情况。结果显示,基因敲除小鼠的多个组织中无NUDT3蛋白表达(图5B)。该结果与RT-PCR的结果一致,验证了Nudt3基因的敲除效果,证明Nudt3基因全身敲除小鼠模型构建成功。

图5 小鼠Nudt3 mRNA和NUDT3蛋白表达水平Figure 5 The expression of Nudt3 mRNA and NUDT3 in mice
3 讨论
本研究对Nudt3基因在小鼠脑组织和外周代谢器官的表达进行了检测,结果显示该基因在机体各组织中广泛表达,提示Nudt3 基因可能在多个组织中发挥作用。中枢神经系统中的下丘脑是调控全身能量代谢的总中枢,因此是本研究重点关注的对象。相对于其他脑组织,Nudt3 基因的表达在下丘脑中的表达并不是最高。但是在高脂饮食诱导下,Nudt3基因的表达显著下降,提示Nudt3基因在下丘脑中可能发挥着重要作用。此外,我们在肾脏、肝脏和脂肪组中,均发现Nudt3 基因在高脂肪诱导下有显著的表达差异,提示其可能在能量代谢中发挥重要作用,值得进一步研究。因此,构建Nudt3基因敲除小鼠具有重要的学术研究价值。
CRISPR/Cas9 技术是目前发展迅速,并广泛应用的基因编辑技术[10]。相对于锌指核酸酶(zincfinger nucleases,ZFN)和转录激活因子样效应物核酸酶(transcription activator-like effector nucleases,TALEN),CRISPR/Cas9技术设计简单且脱靶效应相对较小[11],已经成为了最常用的基因编辑技术,目前已被广泛应用于构建基因编辑小鼠模型[16-19]。本研究利用CRISPR/Cas9 技术设计原理,在Nudt3 基因的第2个外显子区域设计了2对gRNA,该设计有利于增加基因的编辑效率。通过向小鼠受精卵中显微注射Cas9蛋白和gRNA,并进行胚胎移植后,我们获得了多个新生小鼠。基因测序结果显示靶位点有多个缺失或者插入等基因编辑现象。该结果是典型的基因编辑后多种基因型细胞嵌合的现象。由于基因编辑发生在胚胎发育的早期,生殖细胞有类似的嵌合现象,通过进一步育种可以获得单一基因型的基因编辑动物。后续的检测证实了这一点,本研究获得了单个基因编辑型的小鼠。CRISPR/Cas9技术存在的一个问题是脱靶效应导致的错误位置基因编辑[12-15],我们对可能的2 个脱靶区域进行了测序分析,没有发现脱靶现象,表明脱靶效应在本研究构建的小鼠中概率较低。按照遗传学理论,移码突变可以导致蛋白质氨基酸序列改变,氨基酸序列错误的蛋白可以导致蛋白功能丧失。因此,我们选择发生移码突变的基因编辑动物作为基因敲除小鼠模型,并在后续实验中,对Nudt3基因移码突变的基因敲除小鼠进行Nudt3基因表达检测。结果显示,Nudt3 基因敲除鼠的多个组织中Nudt3 基因的mRNA 转录和剪切产生了变异,Western blot结果显示Nudt3基因敲除鼠的多个组织中均检测不到NUDT3 表达,表明Nudt3 基因已被成功敲除。目前国内外对该基因在肥胖中的作用以及调控机制研究较少,本研究成功构建的Nudt3 基因敲除小鼠为后续的Nudt3基因在肥胖发生中的功能和机制研究提供了理想的动物模型。
