炎性指标对非小细胞肺癌PD-1抗体疗效预测及预后评估的初步探讨*
2021-07-06魏熙胤张翠翠臧凤琳陈鹏
魏熙胤 张翠翠 臧凤琳 陈鹏
原发性肺癌依据其生物学行为分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(nonsmall cell lung cancer, NSCLC),其中NSCLC约占所有肺癌患者的85%,且约半数以上的NSCLC患者在确诊时已处于局部进展期或晚期,丧失了根治性手术的机会,5年生存率较低[1]。近年来,免疫检查点抑制剂已成为晚期NSCLC重要的治疗药物,主要机理是通过抑制免疫检查点,重新激活患者自身的免疫细胞和免疫功能,进而起到抗肿瘤的作用。帕博利珠单抗作为PD-1抑制剂,在晚期NSCLC治疗中已取得了较好的效果,该药联合化疗已被批准用于晚期NSCLC的一线治疗[2-3],并且其一线适应证已由PD-L1表达>50%扩展到PD-L1表达≥1%的人群[4-5]。在临床实践中,也观察到晚期NSCLC患者整体均能够从帕博利珠单抗联合化疗中获益,且不同PD-L1表达水平的患者获益程度相近,提示PD-L1表达水平可能无法全面或准确预测NSCLC的免疫治疗效果,有待发现其他更为有效的分子生物学标志物。
炎性指标是指包括粒细胞/淋巴细胞比值(ne utrophil-to-lymphocyte ratio,NLR)、单核细胞/淋巴细胞比值(monocyte-to-lymphocyte ratio, MLR)、血小板/淋巴细胞比值(platelet-to-lymphocyte ratio, PLR)及全身免疫炎症指数(systemic immune inflammation index,SII)(粒细胞×血小板/淋巴细胞)在内的一系列衡量外周血不同细胞成分动态平衡的细胞学指标,能够反映机体的炎性反应和免疫功能,已被证实与喉癌、结直肠癌、胶质母细胞瘤等多种恶性肿瘤预后密切关系[6-8]。在原发性肺癌中,Xiong等[9]报道在SCLC治疗开始后6周,NLR能够预测患者PD-1/PD-L1二线或末线治疗效果,且NLR≥3的NSCLC患者接受免疫检查点抑制剂单药治疗需警惕出现超进展[10]。基于上述研究,本研究进一步探讨包括SII在内的炎性指标对晚期NSCLC患者PD-1抗体治疗的疗效预测及预后价值,以期从常规血液学检测指标中筛选出免疫治疗可能更为获益的人群,为NSCLC的个体治疗和精准治疗提供有意义的生物标志物。
1 材料与方法
1.1 病例资料
回顾性分析2018年1月至2020年10月在天津医科大学肿瘤医院接受帕博利珠单抗治疗的64例Ⅲb~Ⅳ期NSCLC患者(男性53例,女性11例)的临床资料。纳入标准:1)组织学或细胞学确诊为原发性NSCLC;2)根据第8版肺癌TNM分期为Ⅲb~Ⅳ期;3)美国东部肿瘤协作组制定的体能状态评分(ECOG评分)为0~2分;4)接受帕博利珠单抗单药或帕博利珠单抗联合化疗;5)具有完整的临床、血液学结果和随访记录。排除标准:1)具有其他恶性肿瘤和慢性炎性疾病的病史;2)接受免疫治疗前2周内有急性感染或炎症的临床证据;3)临床及实验室检查资料不完整者。本研究通过天津医科大学肿瘤医院伦理委员会批准,所有患者均签署知情同意书。
1.2 方法
1.2.1 数据采集 采用天津医科大学肿瘤医院电子病历系统收集患者的临床病理特征,包括年龄、性别、病理类型、TNM分期、吸烟史、家族史、治疗史、治疗方式(单药或联合治疗)及无进展生存期(progressionfree survival,PFS)等。收集患者接受免疫治疗前1周内、取得最佳疗效时及病情进展时的血液学指标。其中,最佳疗效时为影像学检查显示患者肿瘤最小时,若肿瘤大小无变化则选择肿瘤标志物最低时;血液学指标包括中性粒细胞计数、淋巴细胞计数、单核细胞计数、血小板计数,以及血清中炎症相关因子γ-谷氨酰转肽酶(γ-glutamyl transferase, γ-GGT)、乳酸脱氢酶(lactate dehydrogenase,LDH)、纤维蛋白原(fibrin ogen,Fbg)和D-二聚体(D-dimer),并计算NLR、MLR、PLR和SII。
1.2.2 随访 根据实体瘤疗效评价标准(RECIST 1.1)进行评价,治疗效果包括完全缓解(complete remission,CR)、部分缓解(portion remission,PR)和疾病稳定(stable disease,SD);若患者在接受免疫治疗后第一次评估时即出现疾病进展(progressive disease,PD),则最佳疗效时的血液学数据为缺失。PFS为从诊断时间(一线治疗)或开始接受帕博利珠单抗治疗时间(二线及以上治疗)至疾病进展时间或死亡时间。最终随访时间为2020年12月22日。截止到最终随访时间患者仍未出现疾病进展,则将最终随访时间作为截点。
1.3 统计学分析
采用SPSS 21.0软件进行统计学分析。通过受试者工作曲线特征曲线(receiver operating characteristic curve, ROC)计算SII等炎症相关指标的最佳临界值。获得曲线坐标数据表,计算约登指数(灵敏度+特异度−1),约登指数的最大值即为最佳临界值。采用Kaplan-Meier法进行生存分析,Log-rank法比较生存曲线之间的差异。采用Cox比例风险回归模型分析影响SCLC患者预后的风险因素。以P<0.05为差异具有统计学意义。
2 结果
2.1 炎性相关指标的最佳临界值
收集并计算经帕博利珠单抗治疗的NSCLC患者的SII、NLR、PLR、MLR、γ-GGT、LDH、Fbg、D-dimer,依据患者生存状态,分别绘制ROC曲线,通过约登指数(Youden index)确定上述指标的最佳临界值分别为822.39、4.20、269.85、0.58、55.00和255.00 U/L,3.94 g/L和1 513.19 ng/mL。SII、NLR、PLR、MLR、γ-GGT、LDH、Fbg、D-dimer的ROC曲线下面积(area under curve,AUC)分别为0.559、0.589、0.522、0.575、0.764、0.677、0.554和0.612(图1)。根据ROC曲线获得曲线坐标数据表,计算约登指数(灵敏度+特异度-1),约登指数的最大值即为最佳临界值。

图1 炎性相关指标最佳临界值的ROC曲线
2.2 外周血各炎性指标与NSCLC患者PD-1近期疗效的相关性
NSCLC患者外周血中炎性指标SII、NLR、γ-GGT、LDH、D-dimer和Fbg水平在帕博利珠单抗取得最佳疗效时显著降低,但随着疾病的进展再次上升,差异具有统计学意义(均P<0.05,表1)。
表1 NSCLC患者PD-1治疗前、最佳疗效时及疾病进展时的炎性指标比较 (±s)
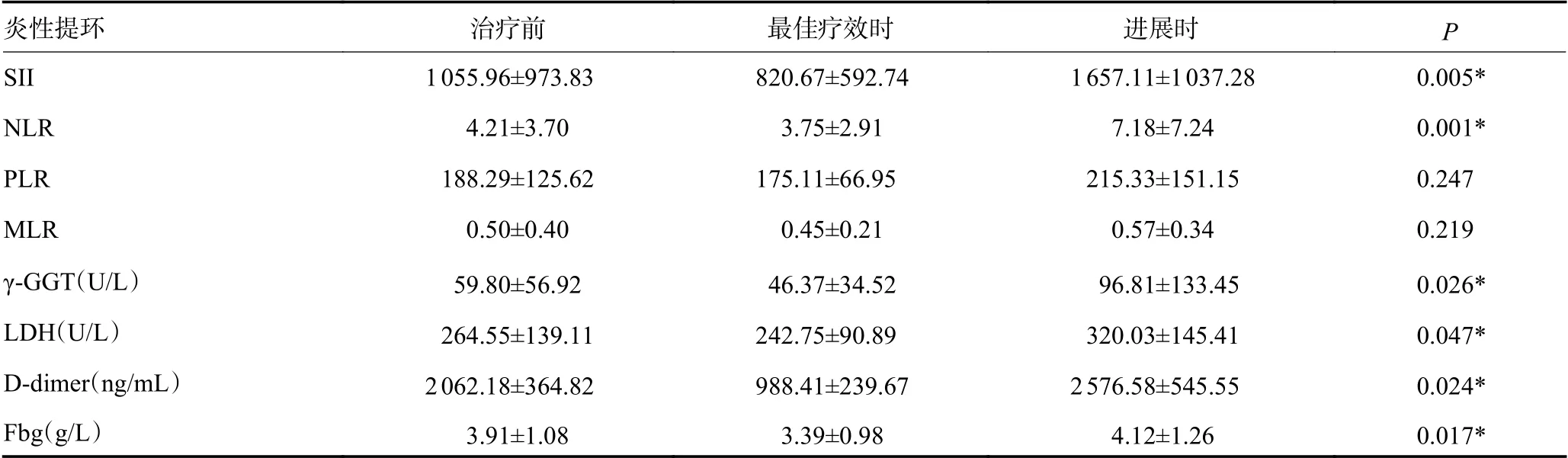
表1 NSCLC患者PD-1治疗前、最佳疗效时及疾病进展时的炎性指标比较 (±s)
*:P<0.05(单因素方差分析中组间比较)
炎性提环治疗前最佳疗效时进展时P SII1 055.96±973.83820.67±592.741 657.11±1 037.280.005*NLR4.21±3.703.75±2.917.18±7.240.001*PLR188.29±125.62175.11±66.95215.33±151.150.247 MLR0.50±0.400.45±0.210.57±0.340.219 γ-GGT(U/L)59.80±56.9246.37±34.5296.81±133.450.026*LDH(U/L)264.55±139.11242.75±90.89320.03±145.410.047*D-dimer(ng/mL)2 062.18±364.82988.41±239.672 576.58±545.550.024*Fbg(g/L)3.91±1.083.39±0.984.12±1.260.017*
2.3 炎性指标与NSCLC患者PFS的相关性
应用Kaplan-Meier分析上述炎性指标及临床病理参数与Ⅲb-Ⅳ期NSCLC患者预后的相关性,其中各炎性指标比较的分组标准为其最佳临界值。单因素分析显示:PLR、SII、LDH、Fbg及D-dimer是影响接受帕博利珠单抗治疗的NSCLC患者PFS的重要预后因素(P<0.05);而性别、年龄、吸烟史、病理类型、家族史、临床分期、治疗线数、治疗方式等与PFS无显著相关性(表2,图2)。多因素分析结果显示:基线LDH是PFS的独立风险因素(P=0.016,表3)。
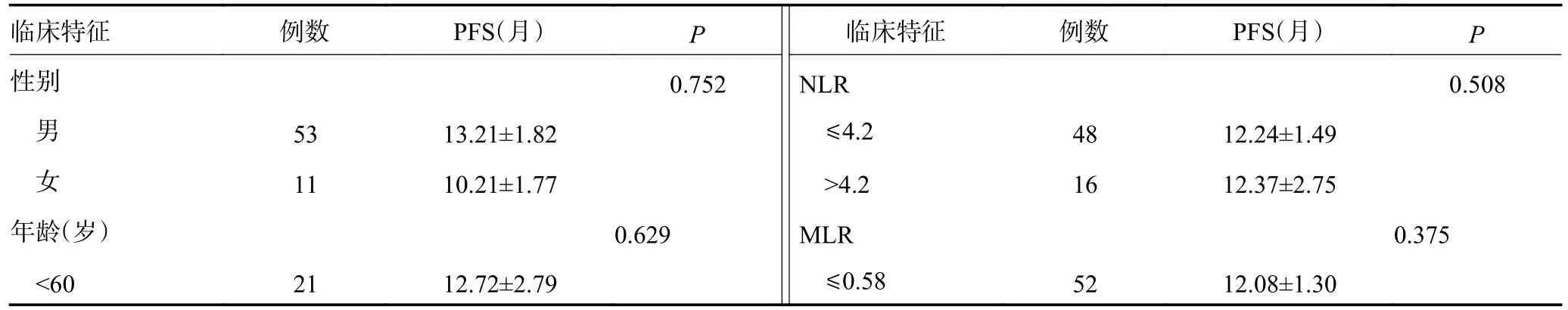
表2 64例经PD-1治疗的晚期NSCLC患者PFS的单因素分析

表2 64例经PD-1治疗的晚期NSCLC患者PFS的单因素分析 (续表2)

表3 64例经PD-1治疗的晚期NSCLC患者PFS的Cox多因素回归分析
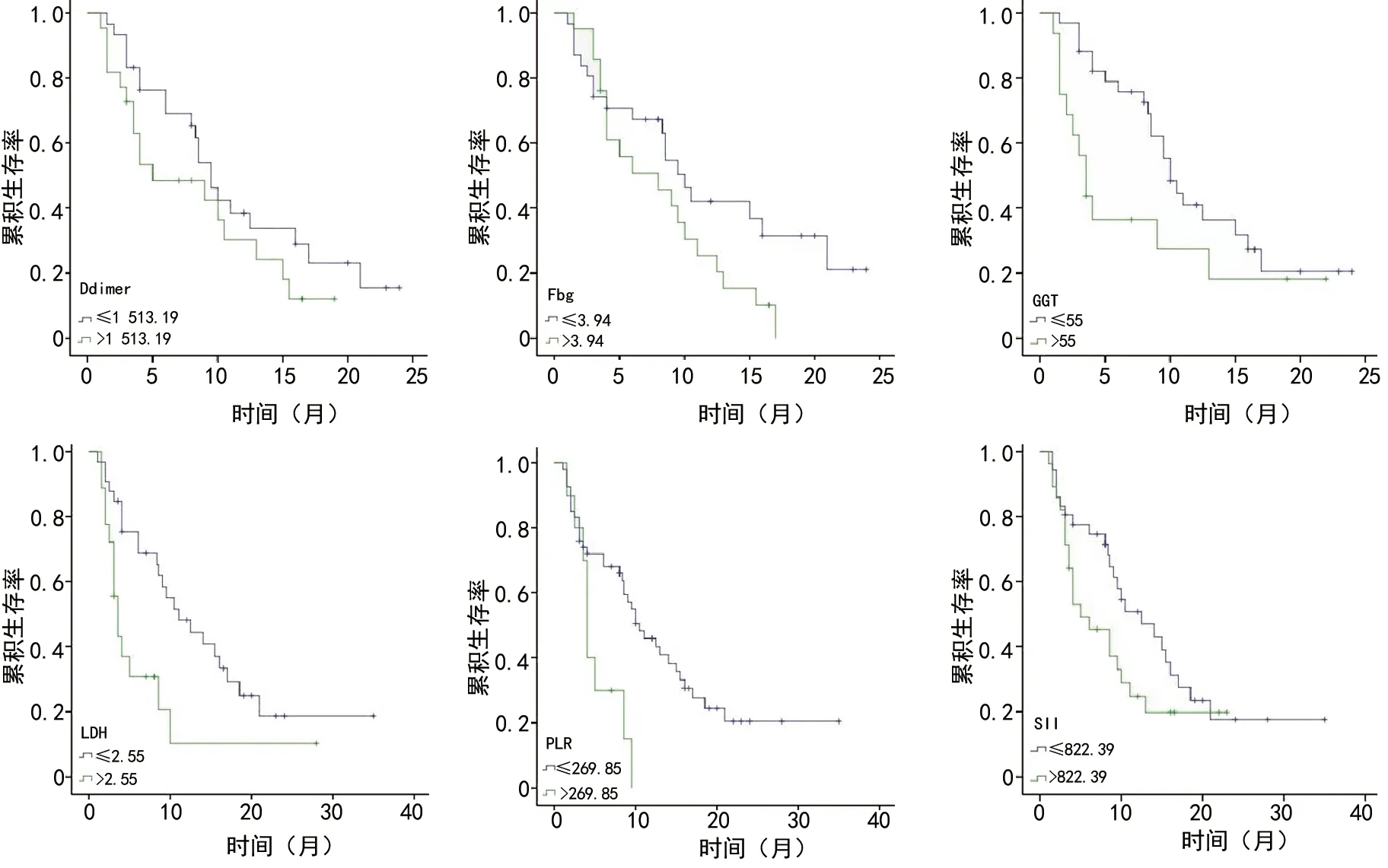
图2 各炎性指标对经PD-1治疗Ⅲb~Ⅳ期NSCLC患者PFS的影响
3 讨论
依据组织来源,炎性标志物主要分为两类:一类来源于C-反应蛋白和白蛋白;另一类来源于白细胞,包括SII、MLR、NLR和PLR等指标,后者可用来辅助评估多种恶性肿瘤的快速进展与预后[11-12],其中SII是基于外周血淋巴细胞、中性粒细胞和血小板计数衍生出的炎症标志物,可以反映机体免疫状态,已被证实与包括早期NSCLC在内的多种恶性肿瘤的预后和临床病理因素密切相关[13-15]。其分子机制包括:1)中性粒细胞能够分泌细胞因子和趋化因子,如血管内皮生长因子,促进肿瘤血管生成及循环肿瘤细胞黏附,造成远处转移[16];2)血小板可以与肿瘤细胞结合,进而保护后者免受身体免疫系统的攻击,促进转移灶的形成[17];3)淋巴细胞参与机体获得性免疫,介导适应性免疫应答而抑制恶性细胞增殖,进而减缓肿瘤进展[18]。Fbg能增强血小板与肿瘤细胞的粘附,血小板又能释放凝血酶,促进Fbg的聚集。Fbg可以作为支架结合血管内皮生长因子和成纤维细胞生长因子-2,增强其增殖和血管生成作用[19-20]。D-dimer是纤维蛋白原的降解产物,在NSCLC中具有预后提示意义。有氧糖酵解是肿瘤细胞能量代谢的重要特征,LDH 是糖酵解途径中一种重要的酶类,催化丙酮酸生成乳酸。当肿瘤细胞负荷增大、氧气含量不足时,肿瘤细胞通过缺氧诱导因子上调糖酵解,引起 LDH 水平升高,帮助细胞产生足够的能量[21]。血 LDH 含量升高提示实体瘤组织缺氧和不良预后[22]。值得注意的是,SII是基于三种类型的循环免疫细胞的衍生结果,与其它全身性炎症指标(NLR、PLR、MLR)相比,更能反映机体炎症和免疫状态的信息,可能具有更为重要的临床意义。
免疫检查点抑制剂作为新型治疗手段,与传统的抗肿瘤药物不同,并非直接杀伤肿瘤细胞,而是以调节机体自身免疫功能为目的,通过改变免疫细胞与肿瘤细胞的固有关系,改变肿瘤微环境,进而激发免疫细胞攻击肿瘤细胞的潜能,借助自身免疫细胞来杀伤肿瘤。包括淋巴细胞在内的外周血细胞在机体免疫中起着非常重要的作用,可以推测由血细胞计数衍生出的炎性指标与免疫治疗疗效存在一定的相关性。在原发性肺癌中,Mezquita等[23]观察到LDH及NLR与晚期NSCLC患者免疫检查点抑制剂治疗效果密切相关;此外,NLR能够预测SCLC患者PD-1/PD-L1二线或末线治疗效果[9],MLR也是早期可手术的NSCLC患者预后不良的独立危险因素[24]。本研究结果同样显示,晚期NSCLC患者接受帕博利珠单抗治疗后取得最佳疗效时其炎性指标(SII、NLR、GGT、LDH、Fbg、D-dimer)均较治疗前明显降低,而在疾病进展时这些指标再次升高。单因素分析结果显示,基线PLR≤269.85、SII≤822.39、LDH≤255 U/L、GGT≤55 U/L、Fbg≤3.94 g/L、D-dimer≤1 513.19 ng/mL的患者PFS显著延长。多因素分析结果显示,基线LDH是PFS的独立风险因素(P=0.016),与既往研究结果一致[25]。但NLR和MLR与PFS无显著相关性,这与既往研究结果不一致[9,24],推测可能与本研究观察的病例数较少存在偏倚有关,此外也可能与本研究纳入的患者均为接受免疫治疗,与既往研究分析病例的治疗方式不同有关。而其他临床病理特征(如年龄、性别、病理类型等)与预后无显著相关性,提示患者治疗接受免疫治疗前的炎性指标不仅可以预测预后,而且有助于辅助筛选免疫治疗的优势人群,动态检测相应的炎性指标可以监测免疫治疗疗效。此外,由于上述炎性指标均是在抗肿瘤治疗过程中根据常规检测的中性粒细胞计数、淋巴细胞计数、单核细胞计数、血小板计数等计算,是一种经济、便捷、创伤小的方法,在临床具有较大的应用价值。
需要关注的是,本研究仍存在局限性。首先,本研究是一项单中心回顾性临床研究,仅纳入64例患者,样本量相对较少,组间的不平衡可能造成结果偏差;其次,纳入的患者中接受联合治疗者联合的化疗方案不一,混杂因素多,在一定程度上可能会影响对患者预后的评估;最后,PD-L1等免疫相关指标检测率较低,无法进行分组分析。本研究结果需要通过大样本、多中心、前瞻性的研究加以证实,以期得到更为可靠的结论,并为免疫检查点抑制剂治疗NSCLC提供更有价值的参考依据。
