中华小香菇的生物学特性研究*
2021-05-08刘元涛刘一鹏张志豪王建瑞
刘元涛,刘一鹏,张志豪,王建瑞,刘 宇
(鲁东大学农学院,山东烟台264025)
小香菇属(Lentinellus P.Karst.)隶属于担子菌门 (Basidiomycota) 伞菌纲 (Agaricomycetes) 红菇目 (Russulales) 耳匙菌科 (Auriscalpiaceae)[1-2]。该种的主要特征是子实体呈扇形或贝壳形,菌柄短、侧生,菌褶延生、边缘撕裂或锯齿状,菌肉稍有辛辣味;担孢子近球形,表面具疣突,淀粉质,孢子印白色;侧生囊状体稀少,披针形至纺锤形。菌髓组织具有胶质菌丝和生殖菌丝,部分有骨架菌丝;生殖菌丝具有锁状联合,骨架菌丝细胞壁上有淀粉质的凸起[3]。小香菇属有3个种为食用菌[4],1个种为药用菌[5],且含有多种挥发性物质[6-8]及多种活性成分,具有抑制肿瘤细胞的药用价值[9]。
中华小香菇(Lentinellus sinensis R.H.Petersen)是小香菇属中个体中到大型的一个种。具侧生柄或无柄,非木质化[1],孢子长约5 μm,宽椭圆型至近球型,菌盖或菌柄表面生有厚垣孢子。该种可食用[4],但野生资源分布较少,主要分布于我国的长白山地区,常生于腐木上[12]。关于该物种开发利用方面的研究数据尚未见报道。
研究物种生物学特性的方法很多,如响应面法[13]、单因素试验法[14]、正交试验法[15]和字母标记法[16]等。在食用菌相关研究中,邹莉等[17]利用单因素试验的方法研究了亚侧耳的生物学特性;王航等[18]利用字母表法和单因素试验法研究了羊肚菌的生物学特性;彭智华等[19]利用单因素试验法研究了大杯蕈的生物学特性;汤洪敏等[20]利用单因素试验法和显微镜观察研究了大白口蘑的生物学特性。因此,通过采用单因素试验法和正交试验法,对中华小香菇的生物学特性进行研究,以确定中华小香菇菌丝体生长所需要的营养条件和环境条件,以期为未来中华小香菇药用价值和生防药剂的开发奠定基础。
1 材料与方法
1.1 供试菌株
供试菌株采自吉林省长白山自然保护区,组织分离纯化后获得纯菌种,提取并扩增其ITS序列,将结果通过GenBank进行比对,最后鉴定该菌株为中华小香菇。菌株编号为20140827-27,现保存于鲁东大学农学院菌种保藏库。
1.2 培养基
1)温度试验和pH试验均使用PDA培养基,配方参照参考文献[21]的方法。
2) 不同碳源、氮源的培养基配方:在PDA培养基的基础上,调整碳氮源的种类,其他成分保持不变。其中,碳源分别为葡萄糖、果糖、麦芽糖、乳糖、蔗糖和淀粉,氮源分别为蛋白胨、酵母浸膏、硫酸铵、牛肉膏、脲素和硝酸钠。
3)正交试验培养基配方根据四因素五水平配方进行方案设计。
1.3 试验方法
1.3.1 碳氮源试验
碳氮源试验方法参照参考文献[14]的方法进行。将纯化后的中华小香菇菌株接入含有PDA培养基的培养皿中,置于避光、22℃的环境下进行活化。待菌丝长满培养基表面后,用直径5 mm的打孔器打孔,得到大小相同的圆形菌块,然后分别接种到不同的碳氮源培养基上,置于22℃培养箱中避光培养。每个处理组进行5次重复。
菌丝测量方法参照参考文献[22]的方法进行。菌丝开始萌发的时间记作第1天,用画线法每隔2 d测量一次菌丝长度;测量时菌块中心画十字,随后于菌丝生长到的地方作标记,待有菌丝最先长满平板,则试验结束。同时在培养过程中观察菌丝的生长状况。
1.3.2 pH试验
pH试验参照参考文献[23]的方法进行。将PDA培养基的pH分别调至4、5、6、7、8、9、10、11、12,共设9个梯度,后进行高温灭菌。接种、培养、测量方法同1.3.1,每个处理组进行5次重复。
1.3.3 温度试验
温度试验参照参考文献[24]的方法进行。将接种后的培养基,分别放置于10℃、15℃、20℃、25℃、28℃、32℃共6个梯度的恒温培养箱中。接种、培养、测量方法同1.3.1,每个处理重复5次。
1.3.4 正交试验
正交试验参照参考文献[15]的方法进行。根据4组单因素试验结果,选出菌丝生长状况较好的5组条件,依据正交试验4因素5水平的组合进行试验。培养、接种、测量方法同1.3.1,每个处理组进行5次重复。
1.3.5 数据分析
单因素试验和正交试验中的各处理组的重复数据,均采用DPS软件进行方差分析,最后统计结果中处理组的差异显著性比较,采用字母标记法表示。
2 结果与分析
2.1 单因素试验分析
2.1.1 不同碳源处理对中华小香菇菌丝生长的影响
中华小香菇的菌丝长度随时间变化的生长曲线见图1。

图1 中华小香菇菌丝在不同碳源培养基中的生长曲线Fig.1 The mycelial growth curve of Lentinellus sinensis in different carbon source medium
如图1所示,中华小香菇菌丝在以乳糖为碳源的培养基上不能萌发,在其他碳源培养基上均能够正常生长。在菌丝测量前6天,菌丝萌发初期,菌丝生长长度差异较小。葡萄糖组、麦芽糖组、果糖组和淀粉组菌丝生长速度随着时间的增长而变快,这四组与蔗糖组和乳糖组相比差异显著。生长28 d后,麦芽糖培养基上菌丝基本长满。中华小香菇菌丝在6种碳源培养基上的生长由快到慢为:麦芽糖=果糖=葡萄糖>蔗糖>乳糖(不萌发)。
根据菌丝长度统计结果进行方差分析,不同处理组菌丝生长长度的差异显著性采用字母标记法进行分析,试验结果如表1所示。
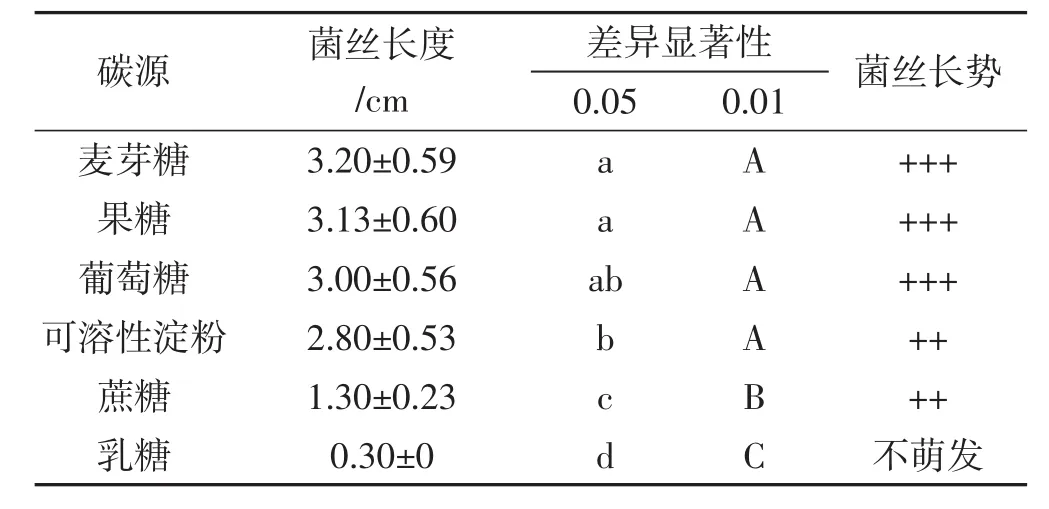
表1 不同碳源处理组菌丝长度的差异显著性Tab.1 Significant difference of mycelial growth length between different carbon sources groups
如表1所示,在0.05水平上,麦芽糖、果糖、葡萄糖和可溶性淀粉4组之间无极显著差异,麦芽糖、果糖和可溶性淀粉组之间呈显著差异;蔗糖处理组的菌丝萌发晚,与其他各组形成极显著差异。在0.01水平上,麦芽糖组、果糖组、葡萄糖组和可溶性淀粉组4组之间无显著差异;蔗糖组与其他组之间差异显著。根据菌丝生长势情况,菌丝生长洁白、浓密且均匀的是麦芽糖、果糖、葡萄糖3个处理组,生长情况最优;可溶性淀粉和蔗糖处理组菌丝较白且不均匀,长势稍差。菌丝在麦芽糖、果糖、葡萄糖3种碳源培养基上的生长情况均最好,差异不大。结合菌丝长度和生长势来看,在单因素试验中,最适中华小香菇菌丝生长的碳源为葡萄糖、果糖和麦芽糖,蔗糖和乳糖最差。
2.1.2 氮源对中华小香菇菌丝生长的影响
在不同氮源下中华小香菇菌丝长度随时间变化的生长曲线见图2。
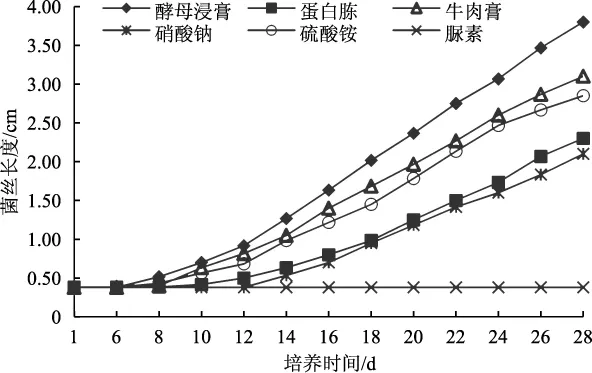
图2 中华小香菇菌丝在不同氮源培养基中的生长曲线Fig.2 The mycelial growth curve of Lentinellus sinensis in different nitrogen source medium
如图2所示,中华小香菇菌丝在酵母浸膏、牛肉膏、硫酸铵、蛋白胨、硝酸钠等氮源培养基上均能够正常生长;在脲素培养基上不能生长。菌丝在酵母浸膏培养基上最先萌发,且生长最快,明显优于其他各组。28 d后,菌丝在酵母浸膏培养基上基本长满培养皿。
将菌丝长度统计结果进行方差分析,不同处理组菌丝长度的差异显著性采用字母标记法进行分析,试验结果见表2。
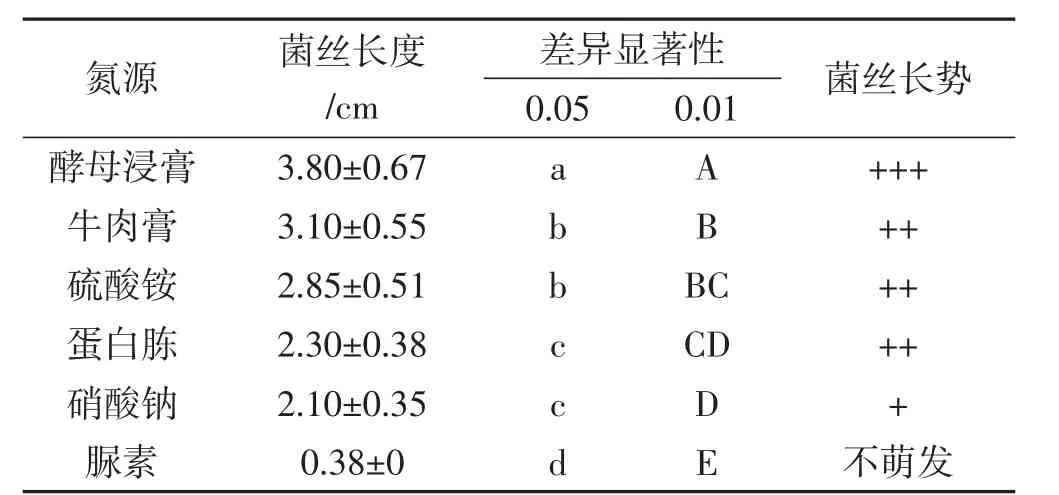
表2 不同氮源处理组菌丝长度的差异显著性Tab.2 Significant difference of mycelial growth length between different nitrogen sources groups
如表2所示,菌丝在6种氮源培养基上的生长快慢顺序大致为:酵母浸膏>牛肉膏>硫酸铵>蛋白胨>硝酸钠>脲素(不萌发)。差异性分析得出,0.05水平和0.01水平上,酵母浸膏组与其他5组相比均有极显著差异;牛肉膏组和硫酸铵组之间无显著差异;蛋白胨组和硝酸钠组之间无显著差异;硫酸铵组和蛋白胨组之间呈显著差异。菌丝生长势分析,酵母浸膏处理组上菌丝浓密、均匀、长势最好,牛肉膏、硫酸铵、蛋白胨3个组菌丝粗壮且不均匀,长势稍差。菌丝在酵母浸膏培养基上的生长状况最优。
2.1.3 不同pH对于菌丝生长的影响
不同pH下中华小香菇菌丝长度随时间变化的生长曲线见图3。

图3 中华小香菇菌丝在不同pH条件中的生长曲线Fig.3 The mycelial growth curve of Lentinellus sinensis in different pH conditions
如图3所示,菌丝在不同pH的培养基上均能够正常生长。当pH为6时,菌丝最早萌发,生长最快,菌丝浓密、较厚;当pH在6~8时,随pH增大,菌丝生长逐渐缓慢,生长势变弱;当pH为5和9~12时,菌丝生长和生长势随之递减,生长势差异不明显。当pH为4时,菌丝在培养基上萌发最晚且稀疏,气生菌丝增多,生长势最差。分析试验结果得出,菌丝在9种pH培养基上的生长快慢顺序大致为:pH 6>pH 7>pH 8>pH 9>pH 5>pH 10>pH 11>pH 12>pH 4。
将第28天菌丝长度统计结果进行方差分析,不同处理组菌丝长度的差异显著性采用字母标记法进行分析,结果见表3。
由表3可知,0.05水平和0.01水平的结果大致相同,pH为6和7的2组与其他各组相比均有显著差异,但无极显著差异;pH为7和8的2组与其他各组相比均有显著差异,但无极显著差异;pH为8和9的2组间无显著差异;pH为 5、10、11、12的4组间无显著差异;pH 4与其他各组相比均有极显著差异。综合菌丝长度和生长势来看,在pH 6~7时,菌丝生长情况最好。
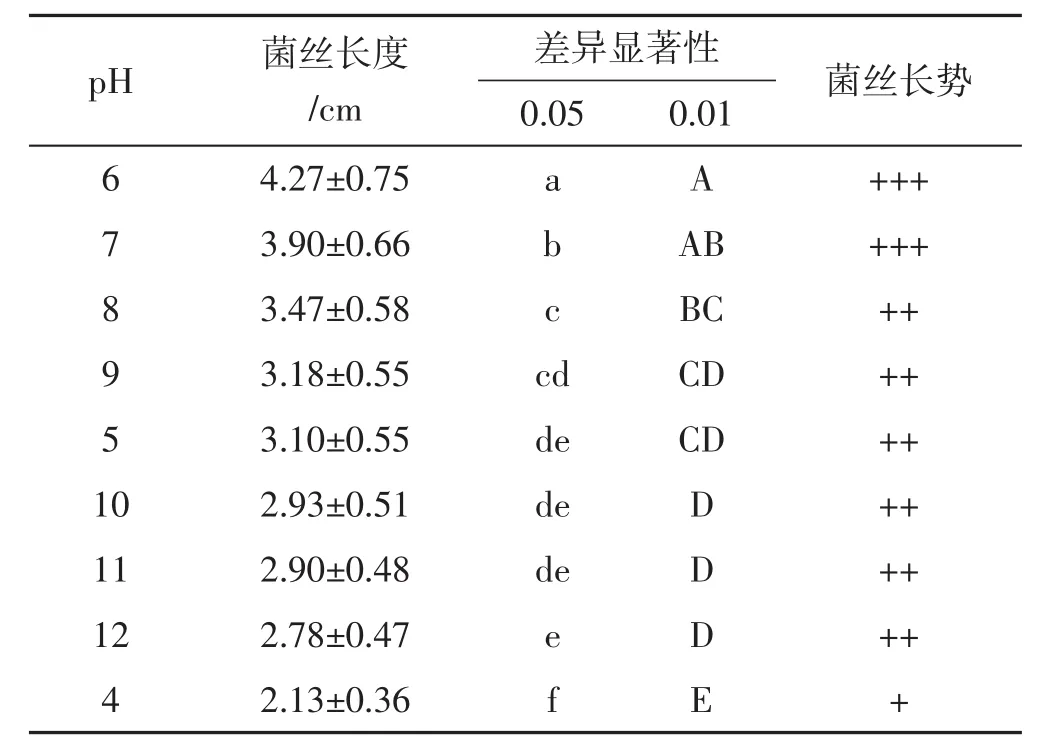
表3 不同pH条件下菌丝长度的差异显著性Tab.3 Significant difference of mycelial growth length in the different pH conditions groups
2.1.4 不同温度对于菌丝萌发的影响
中华小香菇菌丝在不同温度条件下随时间变化的生长曲线见图4。

图4 中华小香菇菌丝在不同温度条件下的生长曲线Fig.4 The mycelial growth curve of Lentinellus sinensis in different temperature condition
如图4所示,中华小香菇菌丝在25℃下生长最快,菌丝洁白、浓密,生长势最好;其次为20℃,且2组之间菌丝生长情况差异不显著;10℃~20℃之间时,随温度升高,菌丝生长渐渐变快,菌丝稀疏,气生菌丝增多;32℃时,菌丝生长缓慢,温度对其生长抑制作用更加明显;在温度过高或过低的情况下中华小香菇菌丝生长都受到影响。菌丝在6种温度下的生长快慢顺序大致为:25℃>20℃>28℃>15℃>10℃>32℃ (不萌发)。
将第26天菌丝长度统计结果进行方差分析,不同处理组菌丝长度的差异显著性采用字母标记法进行分析,结果见表4。
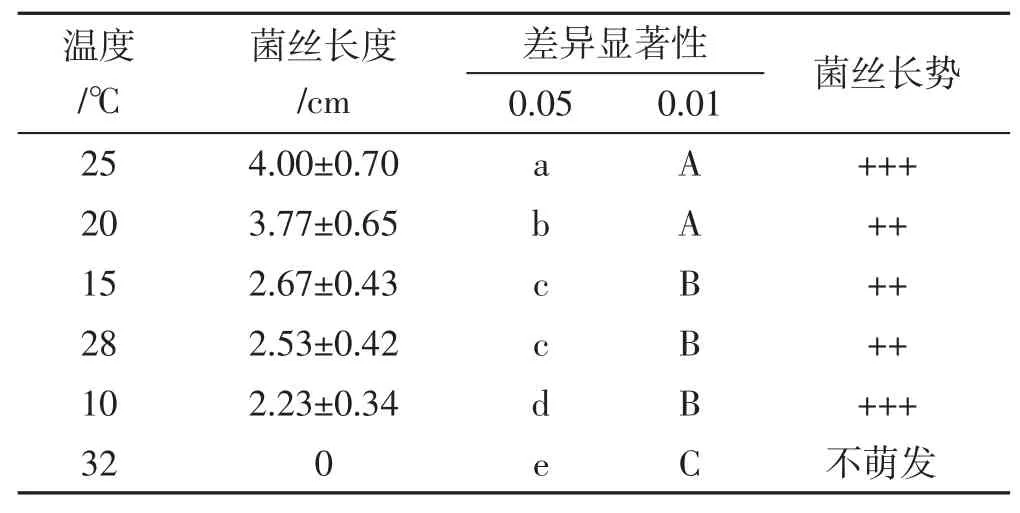
表4 不同温度条件下菌丝长度的差异显著性Tab.4 Significant difference of mycelial growth length in the different temperature conditions groups
由表4可知,在0.05水平上,25℃与其他处理组之间有显著差异;20℃与其他处理组之间有显著差异;28℃和15℃两组之间无显著差异,与其他各组相比呈显著差异;10℃和32℃两组之间差异显著,与其他各组相比呈显著差异。在0.01水平上,20℃和25℃两组之间无显著差异,与其他各组相比呈显著差异;28℃、15℃和10℃三组之间无显著差异;32℃与其他组之间呈显著差异。综合菌丝生长势和长度来看,20℃~28℃是中华小香菇菌丝生长的最佳温度。
2.2 正交试验
结合以上单因素试验结果,从中分别挑选出较适合中华小香菇菌丝生长的4个条件,设计4因素5水平的正交试验,共计25组。4因素5水平表见表5。

表5 正交试验4因素5水平表Tab.5 The orthogonal test table of 4 factors and 5 levels
培养26 d后,不同培养基上培养中华小香菇菌丝生长状况的正交试验结果直观分析见表6。

表6 不同培养基培养菌丝生长的正交试验结果直观分析Tab.6 The results of direct-viewing analysis of mycelial growth in the different culture medium
由表6可知,菌丝在25组处理的培养基上均可以正常生长,但菌丝长度和生长势上各有不同,第3组、第8组、第13组的菌丝长度均大于4 cm,其中第8组菌丝长度最长,其次是第13组和第3组,这三组间的菌丝长度差异不显著。根据生长势观察,这三组菌丝洁白浓密,长势最好。正交试验直观分析结果得出,中华小香菇菌丝培养最适条件为:碳源为果糖,氮源为酵母浸膏,温度为25℃,pH 6。通过极差值可知,4种因素对于菌丝生长的影响从大到小依次为:氮源>温度>pH>碳源。
3 结论
结合单因素试验和正交试验的直观分析以及极差比较得出,中华小香菇菌丝培养的最适条件为:碳源为麦芽糖、果糖和葡萄糖,氮源为酵母浸膏,pH为6.5,温度为20℃~28℃。
中华小香菇主要分布于长白山地区,是一种典型的木腐菌。在生物学特性研究试验中,中华小香菇菌丝体呈现出具有较广泛的碳源、氮源营养适应性和酸碱环境适应性。然而在开发利用菌丝体生产时还需选择最佳的条件组合。到目前为止,中华小香菇的生物学特性研究目前还仅限于其菌丝体在固体培养基中生长发育的研究,还需进一步开展其菌丝体发酵培养以及出菇栽培等条件优化研究。
