二次杀菌对贮藏期间酱卤羊肚肌原纤维蛋白氧化、特性及结构的影响
2021-01-20卢士玲艾延文
侯 然,赵 伟,卢士玲,韩 平,刘 璐,艾延文,董 娟,*
(1.石河子大学食品学院,新疆 石河子 832000;2.江南大学食品学院,江苏 无锡 214000)
低温肉制品在肉制品市场中占据主导地位[1]。其中,酱卤肉制品是选用鲜(冻)畜禽肉和可食副产品与香辛料一起经预煮、浸泡、烧煮、卤制等工艺加工而成的肉制品[2]。酱卤羊肚因其具有较好的口感和风味,深受消费者的喜爱,该产品经过二次杀菌后,可有效延长其贮藏期。目前,热处理是最常使用的杀菌方式,可通过杀死致病菌和腐败菌而延长贮藏期。热处理主要分为商业杀菌和巴氏杀菌,其中巴氏杀菌较为温和,因能较好地保存蛋白等营养物质及风味而被广泛应用[3]。热处理会导致食物中蛋白质的氧化变性,同时也会导致蛋白质二级结构改变[4]。Zhang Lili等[5]研究表明100 ℃和120 ℃会导致鳕鱼鱼糜凝胶蛋白无规卷曲结构受损,并且随着处理温度的升高,无规卷曲结构被破坏程度越高,导致蛋白质聚集,使网络结构的框架变得更加脆弱,孔洞变大,从而减少了蛋白质和水之间的水合作用,导致鱼糜凝胶的质地特性遭到破坏。但也有研究表明无论生鲜肉的特性如何,适当的时间和温度组合下,热诱导的结缔组织和肌原纤维蛋白质结构变性与蛋白水解之间相互作用会增加肉的嫩度[6],从而改善产品品质。随着科技的进步,非热处理技术现被认为是热处理的替代技术或补充[7],而超高压是一种新型的非热处理技术。超高压处理可以改变微生物群[8],同时也会引起蛋白质发生氧化,使其构象发生改变,改善肉的品质[9-10]。Rakotondramavo等[11]研究表明,高压处理(500 MPa、20 ℃、5 min)高级法国熟火腿可通过巯基反应诱导蛋白质氧化,并且导致蛋白变性和聚集,使产品硬度增加。Xue Siwen等[12]的研究表明,静态高压条件对肌原纤维蛋白产生了一定的作用,使其暴露出一些掩埋基团,从而改善了蛋白凝胶化,提高了产品品质。综上所述,超高压和热处理对改善肉品品质、延长贮藏期具有一定的优势,但目前对处理后酱卤羊肚贮藏期间肌原纤维蛋白的影响还鲜见报道。
鉴于此,本研究采用超高压和热处理技术对酱卤羊肚进行二次杀菌,通过分析二次杀菌后贮藏期间肌原纤维蛋白氧化、理化特性和结构的变化,探讨两种二次杀菌方式对贮藏期间酱卤羊肚蛋白的影响,阐明肌原纤维蛋白氧化状态、特性与蛋白质二级结构的相关性,揭示酱卤羊肚品质变化的微观机理。
1 材料与方法
1.1 材料与试剂
新鲜绵羊羊肚购于新疆西部牧业股份有限公司,购买后将其装入保鲜袋内快速运回实验室,去除羊肚表面的污物及油脂后清洗干净。
磷酸氢二钠、磷酸二氢钠、硫代巴比妥酸5,5'-二硫代双(2-硝基苯甲酸)(5,5'-dithiobis(2-nitrobenzoic acid),DTNB)、2,4-二硝基苯肼、氢氧化钠 北京博奥拓达科技有限公司;标准蛋白Marker 北京索莱宝科技有限公司。
1.2 仪器与设备
DZ-400/2C真空包装机 上海青浦食品包装机械厂;Multifuge X1R高速冷冻离心机 赛默飞世尔科技(中国)有限公司;T25 digital ULTRA-TURRAX高速分散器 艾卡(广州)仪器设备有限公司;EONC酶标仪美国伯腾仪器有限公司;DYY-8C电泳仪 北京六一生物科技有限公司;970CRT荧光分光光度计 上海精密仪器仪表有限公司;Senterra拉曼光谱仪 德国布鲁克公司。
1.3 方法
1.3.1 样品处理
根据刘杨铭等[13]的方法对羊肚进行酱卤。真空包装好的酱卤羊肚经处理后分为3 组,分别为未经二次杀菌处理的空白羊肚(CN组)、经过超高压处理的酱卤羊肚(UHPT组)、经过热处理的酱卤羊肚(HT组)。超高压处理条件为:温度25 ℃、压力400 MPa、保压时间15 min;热处理条件为:85 ℃水浴40 min。取出经超高压和热处理的样品并迅速置于冰水中冷却,取出后与CN组共同置于4 ℃冰箱中贮藏24 d,每3 d取一次样品进行各项指标的测定,并取第0、12、24天的紫外吸收光谱、内源荧光光谱、拉曼光谱进行分析。
1.3.2 肌原纤维蛋白提取
取一定量的酱卤羊肚,剔除可见脂肪和结缔组织,切碎后称取10 g于离心管中,按1∶2(m/V)的比例向上述所得沉淀中加入0.7 mol/L pH 6.5的磷酸盐缓冲液,12 000 r/min匀浆15 s。匀浆液在4 ℃、5 000×g离心15 min,收集上清液,此步骤重复2 次,上清液即为肌原纤维蛋白溶液[13]。蛋白含量用双缩脲法测定,用牛血清白蛋白作标准曲线。
1.3.3 羰基含量的测定
参考Levine等[14]的方法测定羰基含量,在50 mL的聚乙烯离心管中,取1.3.2节中提取的肌原纤维蛋白溶液稀释为1 mg/mL,并取出1 mL与5 mL 10 mmol/L 2,4-二硝基苯肼溶液混合,在25 ℃下避光反应40 min(空白反应不含2,4-二硝基苯肼)。加入5 mL质量分数20%的三氯乙酸溶液,振荡后离心(5 000×g、5 min),弃去上清液。蛋白沉淀用1 mL乙醇-乙酸乙酯溶液(1∶1,V/V)洗涤3 次。待溶剂完全挥发后,将蛋白质悬浮于1 mL 6 mol/L盐酸胍溶液中,在37 ℃条件下水浴保温30 min。测定在370 nm波长处的吸光度,羰基含量计算时摩尔吸光系数取22 000 L/(mol·cm),结果以蛋白质量计。
1.3.4 总巯基含量的测定
总巯基含量参照Yongsawatdigul等[15]的方法进行测定。取1 mL 1 mg/mL的蛋白样品溶液,加入8 mL的Tris-甘氨酸溶液(pH 8,每升该溶液中含有10.4 g Tris、6.9 g甘氨酸、1.2 g乙二胺四乙酸、480 g尿素)。溶液经均质后5 000×g离心15 min,在上清液中加入0.5 mL 10 mmol/L Ellman试剂反应0.5 h。用酶标仪测定412 nm波长处的吸光度,使用摩尔吸光系数13 600 L/(mol·cm)计算总巯基含量。CN组除不加Ellman试剂,其他处理方法均如上所述。
1.3.5 蛋白组成的测定
将肌原纤维蛋白溶液稀释至质量浓度为2 mg/mL,加入等体积的2×样品缓冲液,混合1 min后,在100 ℃条件下水浴4 min,冷却至室温备用,随后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)。电泳凝胶选用质量分数10%的分离胶和质量分数5%的浓缩胶,上样量为10 µL,电压80 V,当样品进入分离胶时将电压调至160 V。电泳结束后,将电泳胶片剥出,用考马斯亮蓝染色30 min后用脱色液进行多次脱色,直至胶片透明,利用凝胶成像仪进行成像。
1.3.6 浊度及溶解度的测定
浊度及溶解度的测定参考Xiong Youling L.等[16]的方法。将肌原纤维蛋白溶液稀释至质量浓度为1 mg/mL,40 ℃保温30 min,快速冷却后测定肌原纤维蛋白溶液在320 nm波长处的吸光度,根据吸光度的大小作为判断浊度的依据。1 mg/mL肌原纤维蛋白溶液经过5 000×g离心20 min后,取上清液,测定离心后上清液蛋白质量浓度。蛋白的溶解度按下式进行计算。

1.3.7 紫外吸收光谱的测定
用酶标仪进行紫外吸收光谱测定[17]。取1 mg/mL的肌原纤维蛋白溶液经7 000×g离心30 min后,用0.7 mol/L pH 6.5的磷酸盐缓冲液将上清液稀释至0.5 mg/mL。利用酶标仪进行扫描,扫描波长范围为220~400 nm,扫描速率中速,数据间隔为0.5 nm。
1.3.8 内源荧光光谱的测定
内源荧光光谱的测定参考Xu Yanshun等[18]的方法并稍作修改,将肌原纤维蛋白溶液(1 mg/mL)用0.6 mol/L磷酸盐缓冲液稀释到0.5 mg/mL,以0.6 mol/L磷酸盐缓冲液作为空白,利用荧光分光光度计进行光谱扫描时,设置激发波长为295 nm,发射光谱范围为300~400 nm,扫描范围设置为300~600 nm,扫描速率设为10 nm/s,激发和发射狭缝为 5 nm,扫描5 次。
1.3.9 拉曼光谱的测定
将肌原纤维蛋白溶液进行真空冷冻干燥后,采用拉曼光谱仪进行扫描,选用50 倍显微镜,分辨率为5~9 cm-1,激光器波长为785 nm,激光功率为100 mW,保持15~20 ℃恒温,累计扫描2 次,每个样品扫描3 遍,记录位移范围在100~3 000 cm-1的拉曼光谱。
1.4 数据统计分析
实验进行3 次重复,使用Excel 2010软件统计数据,使用SPSS 24.0软件进行单因素方差分析和皮尔逊相关性分析,结果以平均值±标准差表示,P<0.05表示差异显著,使用Origin 2018软件作图。拉曼光谱数据利用PeakFit 4.12软件进行寻峰、拟合,并计算峰面积,通过峰面积计算蛋白质二级结构的相对含量。
2 结果与分析
2.1 二次杀菌方式对贮藏过程中肌原纤维蛋白氧化的影响
2.1.1 对肌原纤维蛋白羰基含量的影响

图1 二次杀菌后酱卤羊肚肌原纤维蛋白的羰基含量变化Fig.1 Changes in carbonyl content of myofibrillar protein in sauced sheep tripe after secondary sterilization
如图1所示,相比CN组,贮藏初期经过超高压和热处理后的肌原纤维蛋白羰基含量均上升更快;因此,两种二次杀菌方式均使蛋白发生氧化,其中UHPT组的羰基含量始终高于CN组和HT组。有研究表明高压处理后自由基在肌浆和肌原纤维部分以及非可溶性蛋白质部分中形成[19]。因此,UHPT组的羰基含量高于HT组可能是非蛋白质来源的自由基导致的。当贮藏时间为0~15 d时,HT组的羰基含量高于CN组,但当贮藏时间为15~24 d时,HT组的羰基含量变化趋于平稳并显著低于CN组(P<0.05)。有研究表明热处理会增加蛋白表面疏水性、羰基含量、蛋白质聚集体和席夫碱以及硫代巴比妥酸反应物值[20-21],从而使蛋白质的氧化程度增加。因此,HT组羰基含量低于CN组可能是贮藏后期形成了蛋白质聚集体,使羰基作用位点被包埋导致的。
2.1.2 对肌原纤维蛋白总巯基含量的影响

图2 二次杀菌后酱卤羊肚肌原纤维蛋白的总巯基含量变化Fig.2 Changes in total sulfhydryl content of myofibrillar protein in sauced sheep tripe after secondary sterilization
巯基含量是反映蛋白氧化程度的指标之一[22]。如图2所示,各组总巯基含量在贮藏初期(0~15 d)整体呈现下降的趋势,且HT组和UHPT组下降速率更快,说明二次杀菌处理使蛋白质的氧化程度增高。HT组第0天的总巯基含量高于CN组,这可能是由于热处理使蛋白质变性后导致被包埋的巯基暴露。有研究报道,巯基氧化过程可能是自由基、活性氧或其他硫基基团引发二硫键的形成,促进其氧化[23];因此,UHPT组的总巯基含量整体显著低于CN组和HT组(P<0.05),可能是由于超高压处理引起了自由基、活性氧和巯基基团共同作用,形成了二硫键,使蛋白发生氧化。贮藏后期(15~24 d)总巯基含量上升,可能是由于贮藏后期细胞损伤时,还原酶被释放并接近底物,从而改变自然氧化机制,有效地将暴露和氧化的硫基还原[23]。
2.1.3 肌原纤维蛋白的SDS-PAGE分析结果

图3 二次杀菌后酱卤羊肚肌原纤维蛋白的SDS-PAGE图Fig.3 SDS-PAGE profile of myofibrillar protein in sauced sheep tripe after secondary sterilization
图3为3 组样品肌原纤维蛋白的SDS-PAGE分析图,蛋白特征条带的识别参照Chapleau等[24]的方法。经过二次杀菌后,主要受到影响的蛋白为肌动蛋白(44.3 kDa)和原肌球蛋白(34~36 kDa)。3 组样品在贮藏期间的肌动蛋白和原肌球蛋白的电泳条带颜色逐渐变浅,并且在30 kDa左右出现新条带,说明贮藏期间蛋白发生降解,产生了小分子蛋白。在新出现的条带中,热处理的条带颜色逐渐加深,而CN组和UHPT组的条带变化不稳定,可能是因为热处理加剧了蛋白质聚集体的形成[25]。贮藏期间,UHPT组的条带颜色变化最为明显,其次为HT组,说明超高压处理和热处理均破坏了蛋白之间的相互作用,促使肌原纤维蛋白的氧化降解,且压力作用更明显。
2.2 二次杀菌方式对贮藏过程中肌原纤维蛋白特性的影响
蛋白质的溶解度是通过排斥力和吸引力之间的作用力来控制的,它也受到变性蛋白质的数量和聚集程度的影响[26]。由表1可知,第0天的UHPT处理组的溶解度较HT组和CN组低,而HT组和UHPT组的浊度较CN组高(P<0.05)。有研究表明超高压能引起肌原纤维蛋白溶解度降低,并认为不溶性聚集体是由氢键的形成引起的[27]。因此,超高压处理可能导致了肌原纤维蛋白离子键和疏水作用力的改变,形成聚集体,而使溶解度下降、浊度上升。高温会导致蛋白质部分变性和聚集体形成[28],使HT组的浊度上升。在贮藏期间,随着贮藏时间的延长,HT组和UHPT组的浊度也呈显著下降趋势(P<0.05)。这可能是贮藏期间蛋白质发生氧化降解,使小片段的难溶蛋白形成较大的聚集体沉淀而导致的。超高压处理和热处理都导致了蛋白质的聚集,显著改变了肌原纤维蛋白的浊度(P<0.05),但超高压处理对肌原纤维蛋白的浊度影响较小。

表1 二次杀菌后酱卤羊肚肌原纤维蛋白溶解度与浊度的变化Table 1 Changes in solubility and turbidity of myofibrillar protein in sauced sheep tripe after secondary sterilization
2.3 二次杀菌方式对贮藏期间肌原纤维蛋白结构的影响
2.3.1 肌原纤维蛋白紫外吸收光谱
蛋白质紫外吸收光谱的特征峰在270 nm波长处。如图4所示,在270 nm波长处的特征吸收峰紫外吸收强度第0天由高到低依次为HT组>UHPT组>CN组,该结果表明二次杀菌导致色氨酸和酪氨酸残基暴露于蛋白质表面,使紫外吸收强度增加。在第12、24天,270 nm波长处的特征吸收峰紫外吸收强度由高到低依次为CN组>UHPT组>HT组。随着贮藏时间的延长,HT组和UHPT组的紫外吸收强度均低于CN组。贮藏期间,经过二次杀菌处理的肌原纤维蛋白的紫外吸收强度下降,可能是生色基团发生氧化导致的[29]。
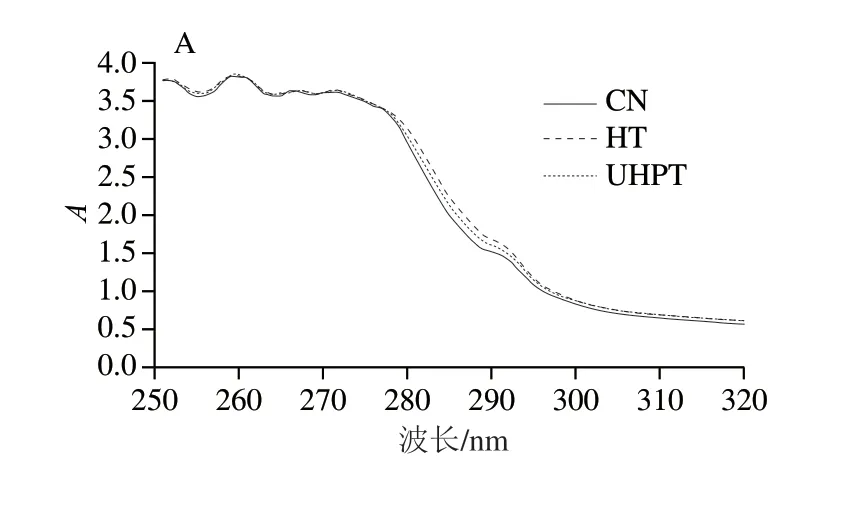
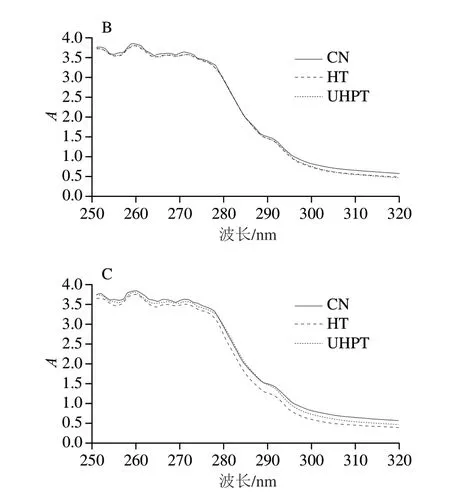
图4 二次杀菌后酱卤羊肚肌原纤维蛋白的紫外吸收光谱Fig.4 Ultraviolet absorption spectra of myofibrillar protein from sauced sheep tripe after secondary sterilization
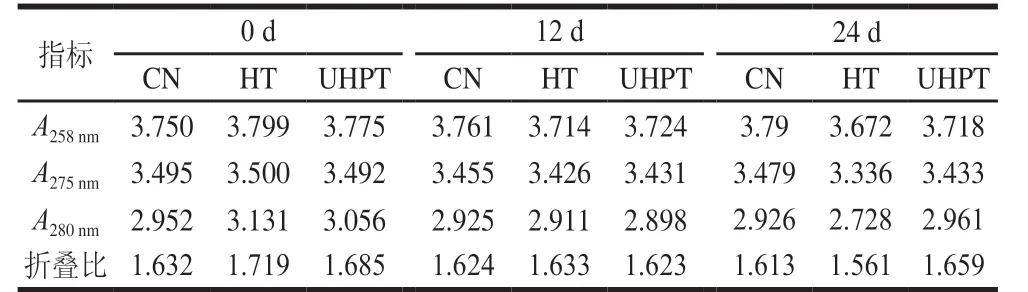
表2 二次杀菌后酱卤羊肚肌原纤维蛋白的折叠比Table 2 Folding ratios of myofibrillar protein in sauced sheep tripe after secondary sterilization
折叠比是评估蛋白质折叠性的信息指标,可以用来研究蛋白质的展开、重新折叠、还原,甚至是蛋白质之间的相互作用,折叠比增加意味着色氨酸或酪氨酸的暴露,折叠比下降可能是蛋白质相互作用后吸收率损失造成的[30]。如表2所示,经过二次杀菌后,折叠比上升,并且热处理的折叠比更大。说明热处理导致肌原纤维蛋白的展开程度更高,使色氨酸和酪氨酸暴露,而超高压处理的蛋白结构相比热处理的结构更紧密。随着贮藏时间的延长,HT组折叠比下降,可能是蛋白质之间的相互作用导致的。UHPT组折叠比先下降后升高,可能是蛋白之间的相互作用与蛋白质展开的共同作用导致的,但具体的作用机制还有待研究。
2.3.2 肌原纤维蛋白内源荧光光谱
通常,如果λmax小于330 nm,色氨酸处于“非极性”环境;如果λmax大于330 nm,色氨酸处于“极性”环境[31]。如图5所示,超高压和热处理后第0天的肌原纤维蛋白的λmax发生蓝移(CN组:338.5 nm;HT组:336 nm;UHPT组:333 nm),并且随着贮藏时间的延长,蓝移更加明显,这说明超高压和热处理会使色氨酸残基从极性环境向非极性环境转移。还有研究指出,一些色氨酸残基暴露于极性环境,与疏水性基团相互作用导致的蛋白聚集体形成有关[32]。通过λmax可知,HT组中色氨酸残基相比UHPT组极性环境更强。因此,热处理使肌原纤维蛋白的聚集程度高于超高压处理组,并导致HT组浊度高于UHPT组,该结果与浊度结果相互印证。有研究表明·OH氧化会导致肌原纤维蛋白内源荧光强度的降低[33]。在贮藏初期,热处理使蛋白质发生氧化变性,色氨酸残基暴露而使荧光强度高于CN组,但随着时间的延长,蛋白氧化程度加剧,可能使色氨酸残基荧光猝灭,导致荧光强度下降。经过超高压处理后,肌原纤维蛋白受到压力的影响发生蛋白质的折叠与聚集,结构发生改变,使色氨酸残基被包埋在内部导致荧光强度低于CN组,但随着贮藏时间的延长,肌原纤维蛋白产生断裂,导致色氨酸残基暴露,使荧光强度迅速上升,到贮藏后期,由于荧光猝灭加剧而导致荧光强度上升缓慢。综上所述,超高压和热处理可以通过改变肌原纤维蛋白所处的极性环境和蛋白结构,而使蛋白氧化程度和特性发生改变。
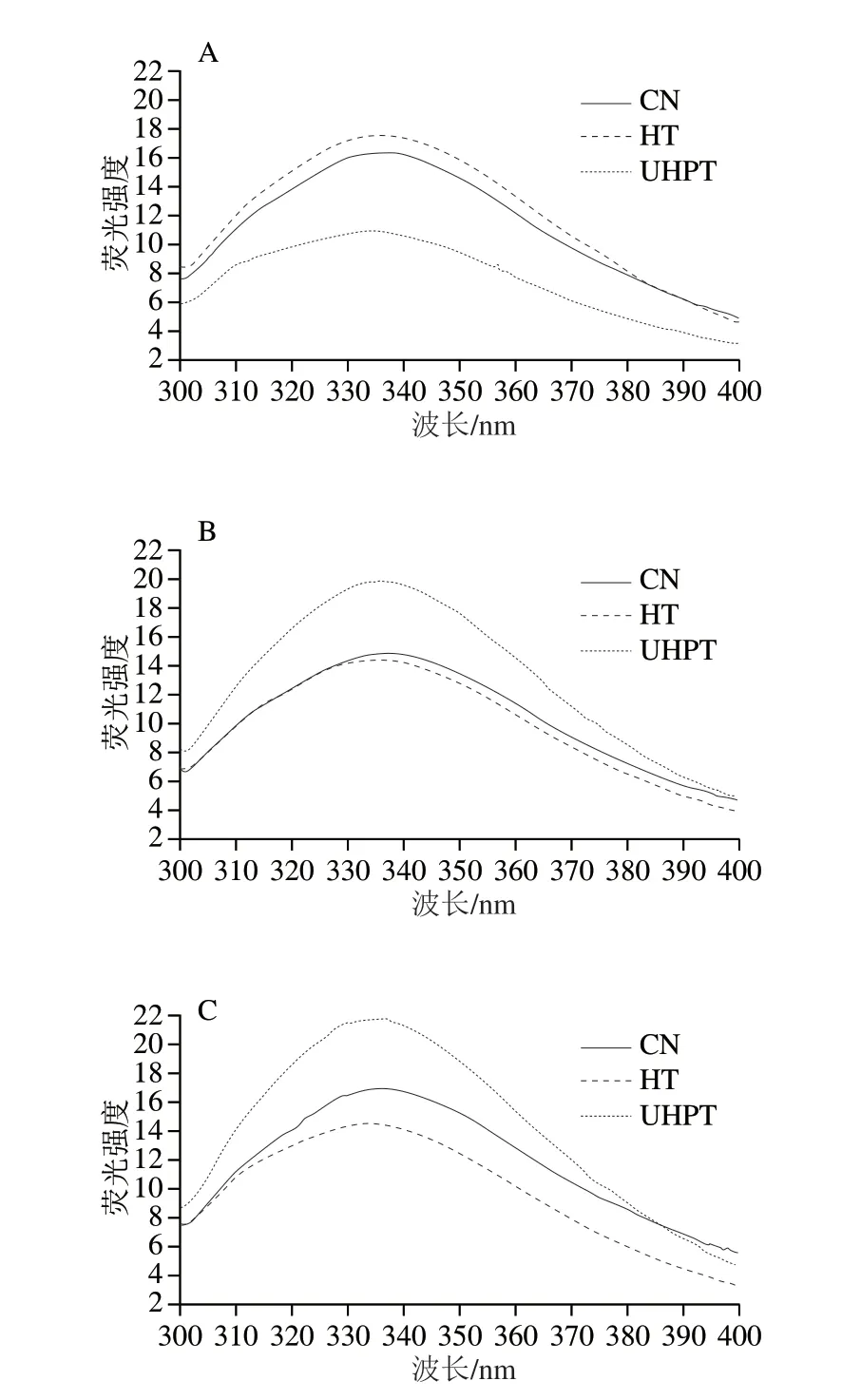
图5 二次杀菌后酱卤羊肚肌原纤维蛋白的内源荧光光谱Fig.5 Endogenous fluorescence spectra of myofibrillar protein in sauced sheep tripe after secondary sterilization
2.3.3 肌原纤维蛋白拉曼光谱分析结果

图6 二次杀菌后酱卤羊肚肌原纤维蛋白的二级结构Fig.6 Secondary structures of myofibrillar protein in sauceed sheep tripe after secondary sterilization
拉曼光谱是研究二级结构的方法之一,光谱中酰胺I带在1 600~1 700 cm-1处由蛋白质二级结构成分叠加形成的,其中1 640~1 645 cm-1和1 680~1 690 cm-1处为β-转角形成的吸收峰,1 645~1 660 cm-1处为α-螺旋形成的吸收峰,1 660~1 670 cm-1和1 670~1 680 cm-1处分别为无规卷曲和β-折叠形成的吸收峰[34]。如图6所示,贮藏0 d时,热处理组肌原纤维蛋白的α-螺旋相对含量减少了12%,同时β-转角、无规卷曲和β-折叠相对含量分别增加了6%、4%和2%。有研究表明α-螺旋相对含量主要与蛋白质之间的氢键含量呈正相关[35];因此,热处理可能会破坏肌原纤维蛋白的氢键,使蛋白质的α-螺旋相对含量减少。超高压处理组的α-螺旋和β-折叠相对含量分别减少了5%和9%,而β-转角和无规卷曲的相对含量分别增加了10%和4%,说明超高压对α-螺旋的影响比热处理组小,并且β-折叠和β-转角之间可能发生相互转化[36]。有研究表明β-折叠相对含量的减少说明具有疏水作用的蛋白位点暴露,导致蛋白表面疏水性增加[37]。因此,超高压处理可能使蛋白氢键断裂,同时疏水作用位点暴露使蛋白质疏水性增加,结构变得紧密。随贮藏时间延长,超高压处理组α-螺旋相对含量减少,无规卷曲相对含量增加,说明贮藏期间肌原纤维蛋白发生了氢键的断裂,并且α-螺旋结构向无规卷曲结构转变,使蛋白结构产生了有序到无序的转变,这与Sheng Long等[38]报道的结果相似。而热处理后,贮藏期间肌原纤维蛋白的α-螺旋相对含量先上升后下降可能与蛋白的热变性有关。相比热处理,超高压处理对贮藏前期的蛋白氢键破坏较小,保证了蛋白质结构的相对稳定,但在贮藏后期,蛋白结构的改变较为明显。
2.4 二次杀菌后酱卤羊肚肌原纤维蛋白氧化状态、特性和二级结构的相关关系
由表3可知,贮藏时间与羰基含量、无规卷曲相对含量呈极显著正相关,与浊度和α-螺旋相对含量呈极显著负相关(P<0.01),与总巯基含量呈显著负相关(P<0.05),说明贮藏时间的延长会显著促进肌原纤维蛋白的氧化,改变蛋白特性,并使蛋白质结构产生有序到无序的转变。肌原纤维蛋白的羰基含量与总巯基含量、浊度、α-螺旋相对含量、无规卷曲相对含量呈极显著负相关(P<0.01),与溶解度呈显著负相关(P<0.05)。总巯基含量与浊度、溶解度呈极显著正相关(P<0.01)。说明蛋白氧化与蛋白特性和结构之间存在一定的相关性。溶解度和浊度与蛋白结构之间并不具有显著相关性,说明蛋白结构与特性之间并不存在直接相关性,但可能存在间接的相关性。在二级结构中,β-转角相对含量与其他3 种结构相对含量均具有显著相关性,而稳定的α-螺旋、β-折叠相对含量与不稳定的无规卷曲相对含量之间不存在相关性,因此结构由有序到无序状态转化可能是通过β-转角完成的。

表3 二次杀菌后肌原纤维蛋白贮藏时间、氧化、特性和二级结构的相关关系Table 3 Correlation between storage time and oxidation properties and secondary structures of myofibrillar protein after secondary sterilization
3 结 论
本研究表明,酱卤羊肚在贮藏期间经超高压和热处理后肌原纤维蛋白中肌动蛋白和原肌球蛋白的结构发生变化。二次杀菌后使蛋白质的氧化程度增高,而UHPT组的羰基含量高于HT组,可能是非蛋白质来源的自由基导致的。从蛋白特性上来看,超高压处理和热处理都导致了蛋白质的聚集,显著改变了肌原纤维蛋白的浊度(P<0.05),但超高压处理对肌原纤维蛋白的浊度影响较小。蛋白质结构分析表明,超高压与热处理对酱卤羊肚中肌原纤维蛋白的结构均具有显著影响(P<0.05),但相比热处理,超高压处理对贮藏前期的蛋白氢键破坏较小,保证了蛋白质结构的相对稳定,但在贮藏后期蛋白结构的改变较为明显。皮尔逊相关性分析表明,贮藏时间对蛋白氧化状态、蛋白特性和二级结构具有显著影响,并且蛋白质的二级结构与蛋白氧化之间存在显著相关性,而蛋白氧化与蛋白溶解度和浊度之间也具有一定的相关性。综上,超高压导致更严重的蛋白氧化,但对贮藏期间的蛋白结构维持较好,保证了酱卤羊肚的品质。因此,相比热处理,超高压是更具有优势的二次杀菌方式。
