超声处理对鲈鱼肌原纤维蛋白结构和功能特性的影响
2022-08-27冯佳雯郑云芳汪少芸
冯佳雯,郑云芳,张 芳,汪少芸
(福州大学生物科学与工程学院,福建福州 350108)
海鲈鱼()学名为日本真鲈,又称花鲈、七星鲈、寨花、鲈子等,以鱼虾为食。海鲈鱼属于硬骨鱼纲,鲈形目、花鲈属,主要分布于我国、日本、朝鲜沿海,属浅海近岸中下层经济鱼类。鲈鱼肉质鲜美,口感爽滑,滋味醇香,营养丰富,富含多种维生素和DHA、EPA 等不饱和脂肪酸以及各种人体所需的氨基酸,有健脾胃、补肝肾、止咳化痰等作用。我国养殖的鲈鱼产销模式较为传统,一般是活产活销,但经过加工后的鱼糜制品符合现代人高蛋白、方便的饮食需求,故对鲈鱼的深加工进行研究是有必要的。其中肌原纤维蛋白在鲈鱼中的总蛋白含量最高,而且它会显著影响鱼糜制品的品质。
肌原纤维蛋白的组成成分有粗丝和细丝两种,粗丝的主要成分是肌球蛋白,细丝是肌动蛋白,而肌动球蛋白是肌动蛋白和肌球蛋白交联和聚合所形成的。目前国内外对肌原纤维蛋白改性的研究,有以下四种方式,通过加热、冷冻和高压等处理的物理方法,酸法、碱法和糖基化等处理的化学方法,酶法和微生物法的生物工程技术手段,以及超声和辐射等的新型技术。其中超声处理因有高效、易控制和操作简单的优点,在乳化、消泡、微结构以及脂肪产品的质地特性的调节和食物蛋白功能特性的改变中具有广泛的应用。Amiri 等研究发现超声处理可以成功地改善肌原纤维蛋白的功能特性和理化特性,并影响其流变特性。Li 等研究表明,鸡肌原纤维蛋白在超声后,乳化活性指数和乳化稳定性指数显著提高,并且由该肌原纤维蛋白制备可得到更加稳定的乳液。目前,国内外对加工过程中的处理方法对鲈鱼肌原纤维蛋白的影响以及鱼糜制品的加工研究较少,主要集中在解冻方式和鸡肉、猪肉等肌原纤维蛋白上。
本实验通过设置不同的超声时间和超声功率,测定巯基、浊度、紫外吸收光谱、粒度、拉曼光谱、溶解度、流变特性等指标来反映蛋白结构和功能特性的变化,并利用相关性、主成分和聚类分析等初步建立构象变化与功能特性之间的联系。通过本实验的研究,构建肌原纤维蛋白之间的构效关系,旨在为使用超声处理蛋白类食品的工业化生产和鲈鱼精深加工成鱼糜制品提供理论参考。
1 材料与方法
1.1 材料与仪器
鲜活珠海鲈鱼() 购于永辉超市;EGTA 美国Sigma 公司;五水合硫酸铜、乙二胺四乙酸、二甲基硅油、十二烷基硫酸钠西陇科学股份有限公司;5,5'-二硫代双(2-硝基苯甲酸) 麦克林生化科技公司;酒石酸钾钠 广东光华化学厂;其他药品与试剂均为分析纯。
TG16W-S 高速冷冻离心机 湘智离心机有限公司;JY92-IID 超声波细胞粉碎机 宁波新芝生物科技股份有限公司;ZEN3600 Zetasizer 激光粒度分析仪 英国马尔文公司;GEN10S-UV-Vis 紫外可见分光光度计 美国赛默飞公司;SpectraMax i3x 多功能酶标仪 美谷分子仪器上海有限公司;InVia Reflex激光显微拉曼光谱仪 英国Renishaw 公司;MCR302旋转流变仪 奥地利安东帕有限公司。
1.2 实验方法
1.2.1 肌原纤维蛋白的提取 鲈鱼肌原纤维蛋白的提取是参照Park 等的方法,略作修改。将新鲜的鲈鱼清洗、剖杀后,采肉,用料理机将鱼肉搅碎。往鱼肉中添加4 倍体积(m:v)的0.01 mol/L pH7.0 的磷酸盐缓冲液(含有0.1 mol/L NaCl,2 mmol/L MgCl,1 mmol/L EGTA),5000 r/min 均质2 min,均质30 s,间歇20 s,防止过热。10000 r/min 离心15 min,弃去上清液,取沉淀物。往沉淀中继续添加4 倍体积(m:v)的0.01 mol/L pH7.0 的磷酸盐缓冲液(含有0.1 mol/L NaCl,2 mmol/L MgCl,1 mmol/L EGTA),重复上述操作2 次。
往得到的沉淀物中添加4 倍体积(m:v)的0.1 mol/L NaCl,5000 r/min 均质2 min,10000 r/min离心15 min,弃去上清液,取沉淀物。往沉淀中继续添加4 倍体积(m:v)的0.1 mol/L NaCl,重复洗涤2 次后得到粗肌原纤维蛋白沉淀。
向肌原纤维蛋白沉淀物中添加0.02 mol/L pH7.0的磷酸盐缓冲液(含0.6 mol/L NaCl),在冰浴条件下,磁力搅拌1 h。将制得的悬浮液用冷冻离心机以8000 r/min 的速度离心15 min,得到的上清液即为肌原纤维蛋白溶液。用双缩脲法测蛋白浓度。
1.2.2 超声处理
1.2.2.1 不同超声功率处理肌原纤维蛋白 利用超声波细胞粉碎仪处理肌原纤维蛋白。在冰浴条件下,将超声波细胞粉碎机的探头伸入蛋白溶液中,使肌原纤维蛋白溶液没过细胞粉碎机的探头。分别设置超声功率0、180、270、360、450、540 W,超声处理3 min。
1.2.2.2 不同超声时间处理肌原纤维蛋白 在冰浴条件下,将超声波细胞粉碎机的探头伸入蛋白溶液中,使肌原纤维蛋白溶液没过细胞粉碎机的探头。设置超声功率为360 W,超声时间为0、3、6、9、12 min。
1.2.3 巯基含量测定 利用Ellman 法测定肌原纤维蛋白的总巯基和活性巯基的含量。
总巯基:取0.5 mL 肌原纤维蛋白溶液,加入4.5 mL 0.2 mol/L 磷 酸 盐 缓 冲 液(pH6.8,含10 mmol/L EDTA,8 mol/L 尿素),再加入0.5 mL DTNB 充分振荡反应,40 ℃水浴加热25 min,测定A。
活性巯基:取0.5 mL 肌原纤维蛋白溶液,加入4.5 mL 0.2 mol/L 磷酸盐缓冲液(pH6.8,含10 mmol/L EDTA),再加入0.5 mL DTNB 充分振荡反应,40 ℃水浴加热25 min,测定A。每个样品均重复测定3 次。
根据公式(1)计算肌原纤维蛋白的总巯基和活性巯基的含量:

式中:SH 为巯基含量(mol/g);A 为样品在412 nm 处的吸光值;D 为稀释倍数;为摩尔吸光系数13600 L/(mol·cm);c 为肌原纤维蛋白的质量浓度(mg/mL)。
1.2.4 紫外吸收光谱分析 根据Wang 等的方法,略作修改。将超声处理后的肌原纤维蛋白溶液用磷酸盐缓冲液稀释至0.5 mg/mL,用紫外可见分光光度计进行肌原纤维蛋白紫外吸收光谱的测定,扫描范围为255~360 nm。每个样品重复测定5 次。
1.2.5 粒径测定 用磷酸盐缓冲液将蛋白稀释为1 mg/mL,用马尔文粒度仪测定粒径。每个样品重复测定3 次。
1.2.6 拉曼光谱分析 采用InVia Reflex 激光显微拉曼光谱仪测定超声处理后肌原纤维蛋白的二级结构,设置激光波长为785 nm,扫描范围3600~400 cm,光谱分辨率为1 cm。每个样品重复测定3 次。
1.2.7 浊度测定 参照韩敏义等的方法测定超声处理前后的浊度。将蛋白浓度调整为1 mg/mL。测定处理前后的样品在340 nm 处的吸光度,以磷酸盐缓冲液作为空白。每个样品重复测定3 次。
1.2.8 溶解度测定 参照Guo 等的方法测定超声处理前后肌原纤维蛋白的溶解度。测定经过超声处理后肌原纤维蛋白的浓度,记为C。将超声处理后的肌原纤维蛋白,10000 r/min 离心15 min,取上清液,测定蛋白质的浓度,记为C。每个样品重复测定3 次。根据公式(2)计算肌原纤维蛋白的溶解度。
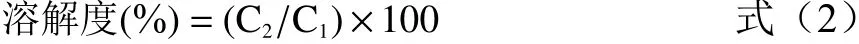
式中:C为蛋白离心前的浓度(mg/mL);C为蛋白离心后的浓度(mg/mL)。
1.2.9 流变特性分析 参考Zhang 等的研究方法并稍作修改,采用PP50 平行板,利用正弦振荡模式对肌原纤维蛋白溶胶进行温度扫描测试。控制升温速率为5 ℃/min,将样品从25 ℃加热到80 ℃,80 ℃保温3 min,再从80 ℃降温到25 ℃。用硅油将平板的夹缝密封,防止样品蒸干。设置流变仪的应变为2%,振荡频率为1 Hz,平板狭缝间距为1 mm,研究升温过程和降温过程中弹性模量和粘性模量的变化。
1.3 数据处理
采用SPSS 软件进行相关性和显著性分析,采用Origin 8.0 软件进行作图。利用SIMCA 14.1 多元变量统计分析软件进行主成分和聚类分析。
2 结果与分析
2.1 超声处理对鲈鱼肌原纤维蛋白巯基含量的影响
肌原纤维蛋白中含有大量巯基,超声会使肌原纤维蛋白变性,表现在巯基氧化成二硫键,因而巯基含量可以反映肌原纤维蛋白构象的变化。由图1A可知,随着超声功率的增大,总巯基先减少后增加,最后又减少;活性巯基含量逐渐减少。对照组肌原纤维蛋白总巯基含量为9.064 mol/g。经过180 W 和270 W的超声处理后,肌原纤维蛋白的总巯基含量分别下降了5.68%和5.08%。继续增大超声功率到360 W,肌原纤维蛋白的总巯基含量又逐渐增加。当超声功率达到540 W 时,肌原纤维蛋白的总巯基含量又开始下降。与对照组相比,经过540 W 超声处理的肌原纤维蛋白的活性巯基含量为5.136 mol/g,下降了31.18%。超声引起巯基变化的可能原因是超声产生的高剪切能波和湍流会打断分子之间的化学键,导致更多的反应位点暴露,从而加速反应;即超声处理使肌原纤维蛋白内部的巯基暴露,导致巯基含量增加。继续增大超声功率,蛋白变性聚集,掩盖了部分巯基,同时暴露出的巯基被氧化,导致巯基含量减少。
随着超声时间的增加,总巯基和活性巯基的含量都随之减少(图1B)。这与Hu 等的研究一致,由于超声时间的变长,肌原纤维蛋白的构象发生改变,使内部巯基暴露,进而发生了氧化反应,从而导致其含量的减少。同时,巯基氧化后生成的二硫键有利于凝胶网络结构的形成,增加鱼糜制品的凝胶强度,从而提高其品质。

图1 超声功率(A)和超声时间(B)对巯基含量的影响Fig.1 The effect of ultrasonic power (A) and ultrasonic time(B) on sulfhydryl content
2.2 超声处理对鲈鱼肌原纤维蛋白紫外吸收光谱的影响
肌原纤维蛋白中含有酪氨酸、色氨酸等芳香环氨基酸,它们在紫外吸收光谱中的变化与其微环境的改变密切相关,所以常用紫外吸收光谱的变化来表征蛋白质的构象变化。由图2 肌原纤维蛋白的紫外吸收光谱可得,肌原纤维蛋白的紫外吸收强度随超声功率和时间的增大而增大。但超声处理不会影响肌原纤维蛋白紫外吸收光谱中最大吸收峰的位置。引起肌原纤维蛋白紫外吸收强度增大的原因可能是蛋白在超声的空化作用下,发生交变振动,蛋白的螺旋结构伸展,色氨酸、酪氨酸等发色基团从内部疏水区域转移至极性的溶剂环境中,进而增大了蛋白的紫外吸收强度。
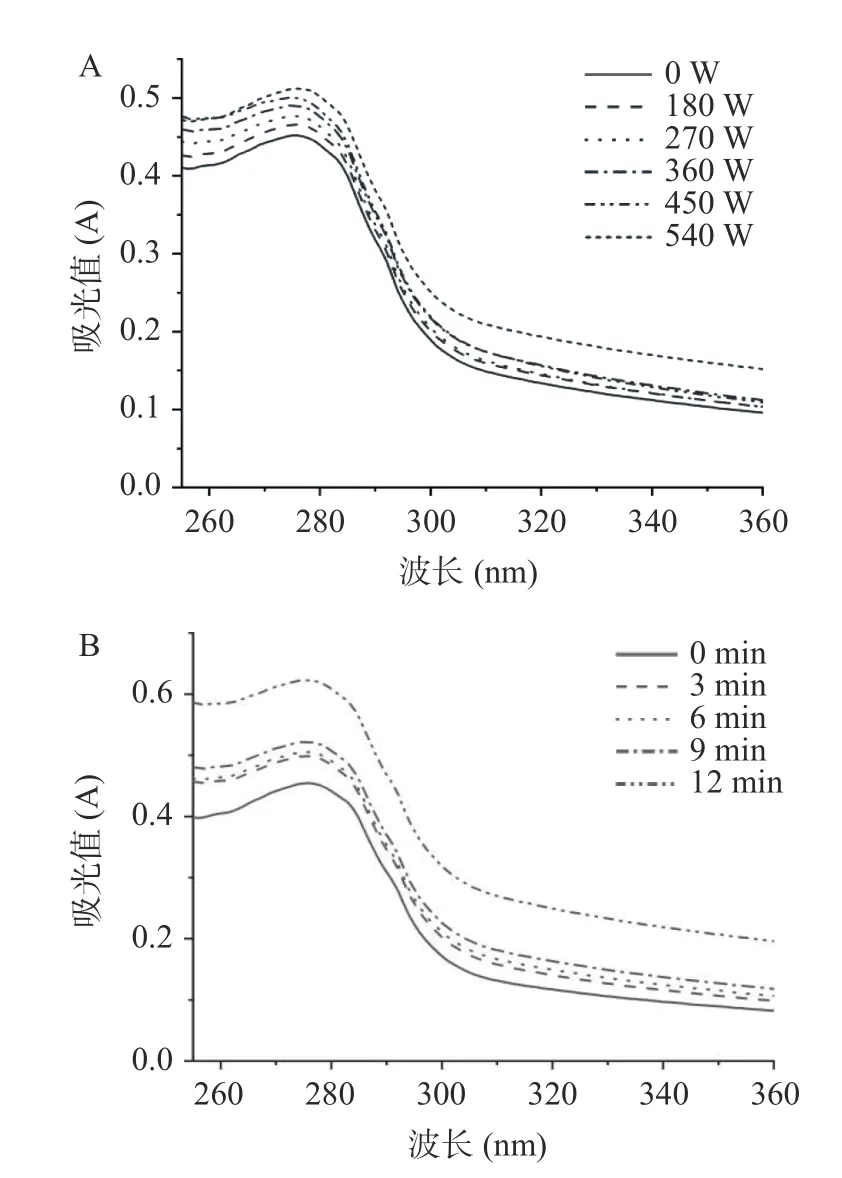
图2 超声功率(A)和超声时间(B)对紫外吸收光谱的影响Fig.2 The effect of ultrasonic power (A) and ultrasonic time(B) on ultraviolet absorption spectra
2.3 超声处理对鲈鱼肌原纤维蛋白粒径的影响
粒径可用来表示物质的大小以及聚集情况。图3A 结果显示经过180~450 W 超声处理显著(<0.05)降低了蛋白的平均粒径。但超声功率到540 W时,肌原纤维蛋白的平均粒径又开始增大。与对照组相比,经过450 W 的超声处理,肌原纤维蛋白的平均粒径减小至200.63 nm,减少了72.91%。当超声功率为540 W 时,肌原纤维蛋白的平均粒径增加至879.97 nm,增加了18.8%。肌原纤维蛋白的平均粒径发生先减后增的原因是:超声功率较低时,蛋白质溶液受到空化效应和机械剪切效应的作用,转化为小片段的亚基,导致粒径降低。而超声功率的继续上升,导致肌原纤维蛋白聚集,表现为粒径的增加。
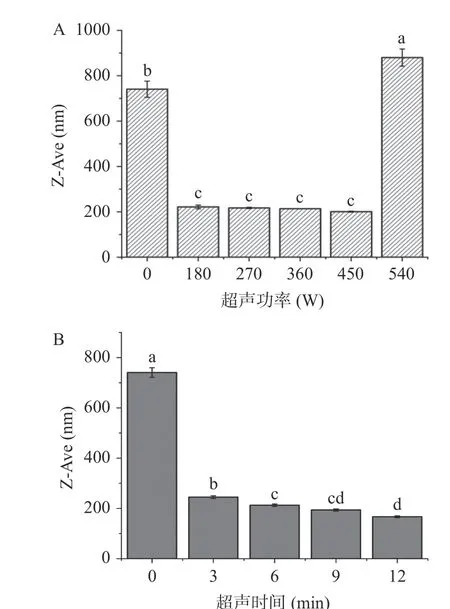
图3 超声功率(A)和超声时间(B)对粒径的影响Fig.3 The effect of ultrasonic power (A) and ultrasonic time(B) on particle size
超声时间的延长显著(<0.05)降低了肌原纤维蛋白的平均粒径(图3B)。对照组的平均粒径为740.7 nm,当超声时间为12 min 时,肌原纤维蛋白的平均粒径降至166.93 nm,减小了77.46%。超声处理导致肌原纤维蛋白平均粒径减小的原因是超声处理的空化效应和机械效应,对蛋白质产生剪切作用,导致粒径减小。Hu 等研究发现超声处理的蛋白质分散体具有单峰分布和窄尺寸分布。由于非共价相互作用的破坏,超声处理还能够减小蛋白质聚集体的大小,从而导致蛋白质聚集和变性。
2.4 超声处理对鲈鱼肌原纤维蛋白二级结构的影响
拉曼光谱常用来分析蛋白质的二级结构,肌原纤维蛋白的二级结构包括-螺旋、-折叠、-转角和无规卷曲。由图4 可知经过超声处理的鲈鱼肌原纤维蛋白-螺旋含量减少,-折叠、-转角和无规卷曲含量增多,其他学者也有类似的研究结果,Li 等和Wang 等报道经过超声处理的金线鱼肌原纤维蛋白和大豆分离蛋白,-螺旋和-折叠减少、-转角和无规卷曲增加;Yang 等研究发现超声处理后使大豆分离蛋白中-折叠均有显著增加,而-螺旋、-转角和无规卷曲的含量显著减少。-螺旋是蛋白质中维持氢键的有序结构,-螺旋含量下降,说明超声改变了氢键稳定性,从而影响了鲈鱼肌原纤维蛋白的构象;同时无规卷曲含量增大,表明超声使鲈鱼肌原纤维蛋白的二级结构从有序状态向不稳定状态转变,这会提高肌原纤维蛋白的凝胶特性,有利于鱼糜制品的生产。

图4 超声功率(A)和超声时间(B)对二级结构的影响Fig.4 The effect of ultrasonic power (A) and ultrasonic time(B) on secondary structure
2.5 超声处理对鲈鱼肌原纤维蛋白浊度的影响
通过对浊度的测量,可以直观地反映物质在水溶液的聚集情况。随着超声功率的增加,肌原纤维蛋白的浊度先减小后增加(图5A)。180~450 W 时,肌原纤维蛋白的浊度相比于对照组显著减小(<0.05)。与未经超声处理的肌原纤维蛋白相比,当超声功率为450 W 时,肌原纤维蛋白的浊度减小了35.43%。继续增大超声功率,肌原纤维蛋白的浊度又增加。超声功率为540 W 时,肌原纤维蛋白的浊度增加了31.44%。超声处理造成肌原纤维蛋白浊度变化的原因可能是由于超声的空化效应和机械效应使蛋白颗粒破碎,导致浊度降低。功率过高时,肌原纤维蛋白变性聚集,导致浊度增大。这与前面粒径的结果相一致。

图5 超声功率(A)和超声时间(B)对浊度的影响Fig.5 The effect of ultrasonic power (A) and ultrasonic time(B) on turbidity
肌原纤维蛋白的浊度随超声时间延长而递减(图5B)。3~6 min 时,浊度快速下降,继续延长超声时间,肌原纤维蛋白的浊度缓慢减小。与对照组相比,当超声时间为3 min 和12 min 时,肌原纤维蛋白的浊度分别减小了29.96%和41.87%。这是因为超声处理会形成空化气泡,气泡会在几个周期内增长,然后破裂,从而在空化区域中形成高温、压力、高剪切能波和湍流,从而导致蛋白质的变化。超声处理可以看作是高频振动的一种形式,它可以在微观尺度上产生流体混合和剪切力。剪切力会破坏分子键,导致聚集体和团簇碎裂,使蛋白质颗粒变小,从而导致浊度降低。但当随超声时间继续增大时,浊度变化不明显可能是在超声时间达到6 min 后,蛋白质颗粒尺寸已经达到最小,不能再被破碎,有利于其功能特性。
2.6 超声处理对鲈鱼肌原纤维蛋白溶解度的影响
溶解度是肌原纤维蛋白最重要的功能性质之一,溶解度越高代表肌原纤维蛋白在体系中分散越好,越有利于发挥其功能性质。超声波对液体系统的影响主要是空化的结果。它会产生相当大的能量,有可能改变蛋白质的溶解度。空化气泡在超声处理期间迅速形成并立即崩溃,这是溶解度变化的原因之一。如图6A 所示,随着超声功率增大,肌原纤维蛋白的溶解度呈现先增加后减小的趋势。180~450 W时,肌原纤维蛋白的溶解度显著增大(<0.05)。超声功率为180 W 时,肌原纤维蛋白的溶解度达到最大,为80.7%,增加了67.92%。经过超声处理,肌原纤维蛋白的粗丝和细丝折叠形成的螺旋结构被降解为亚基小片段,大量的小片段具有更大表面积和更多的极性基团,从而增加了与溶剂分子相互作用的机会,因而提高了蛋白的溶解度。继续增大超声功率,肌原纤维蛋白的溶解度有所下降,但仍然高于对照组。超声功率为540 W时,肌原纤维蛋白的溶解度急剧下降。肌原纤维蛋白溶解度先增后减的原因是由于超声的空化效应和机械效应,促进了蛋白质的溶解。超声功率过大,导致蛋白质的变性聚集,溶解度下降。

图6 超声功率(A)和超声时间(B)对溶解度的影响Fig.6 The effect of ultrasonic power (A) and ultrasonic time(B) on solubility
图6B 显示随着超声时间的延长,肌原纤维蛋白的溶解度先是快速提高,后缓慢增加。肌原纤维蛋白经过超声波处理后,由于空化作用产生较高的局部温度和机械断键作用,导致蛋白质被分解成分子量小的亚基,破坏了蛋白质的空间结构,增加了蛋白质与水之间的相互作用导致溶解度的增加。此外,较小的粒径使肌原纤维蛋白具有更大的表面积和数量更多的电荷,增强了蛋白与水之间的相互作用,促进了蛋白的溶解。Tian 等研究也表明了相同的实验结果,超声促使大豆分离蛋白水解物溶解度显著提高,最高可达到18.33%。但当超声时间超过6 min 后,其溶解度变化不明显的原因可能是:超声超过一定时间后,其蛋白质结构已被完全破坏,与水之间的相互作用不明显。超声处理肌原纤维蛋白有助于提高其溶解度,从而减少盐的使用,有利于制作出少盐健康的鱼糜制品。
2.7 超声处理对鲈鱼肌原纤维蛋白流变特性的影响
储能模量G’又可称为弹性模量,损耗模量G”也叫做粘性模量,测量储能模量G’和损耗模量G”随温度的变化趋势可用来表示凝胶的形成过程。由图7可知在升温过程中,对照组和实验组的G’和G”都呈现先增加后减小,最后又急剧增大的趋势。随着温度的上升,肌原纤维蛋白的G’在48 ℃时达到第一个峰值,这说明凝胶开始形成,是因为肌原纤维蛋白的部分展开,肌球蛋白通过形成二硫键发生不可逆的头部聚合;随后下降,这一阶段为凝胶裂化阶段,主要是因肌球蛋白尾部随着温度的升高逐渐展开,导致肌球蛋白的头部结合瓦解;为当温度超过55 ℃时,G’又开始快速增加,反映了稳定的凝胶网络结构的强化,这是由于发生连续的蛋白质聚集过程,形成稳定的结构,以及肌原纤维蛋白的变性程度增大,蛋白之间形成更多的二硫键促进凝胶的网络交联,使得G’持续增加。在升温过程中,G’和G”具有相似的变化趋势,而且G’一直高于G”,说明肌原纤维蛋白以不易流动的的溶胶存在。在降温过程中,G’和G”逐渐增加,表明了凝胶网络结构的增强。
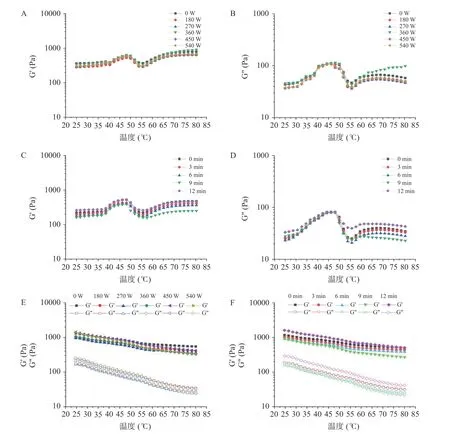
图7 超声处理对流变特性的影响Fig.7 The effect of ultrasonic treatment on rheological properties
超声功率为360 W 和超声时间为12 min 时,肌原纤维蛋白的G’和G”均达到最大值,说明经过超声处理的肌原纤维蛋白形成凝胶的能力较强,这可能是因为超声后的肌原纤维蛋白颗粒较小,有利于形成有序的网络结构。但Zhang 等的研究发现有相反的结果,当超声强度增加时,由于较大程度的蛋白质变性,热诱导凝胶化过程中肌原纤维蛋白的G’和G”降低。
2.8 主成分分析
对不同超声功率处理后的肌原纤维蛋白理化指标进行主成分分析,分解得到2 个主成分(图8)。第一主成分的解释率为0.528,第二主成分的解释率为0.277。评分图显示不同超声功率下的样品明显分开,表示不同超声功率对肌原纤维蛋白的理化性质有较大的影响。0 W 和180 W 样品的位置接近,差别较小。270 W 和360 W 样品的位置接近,差别较小。
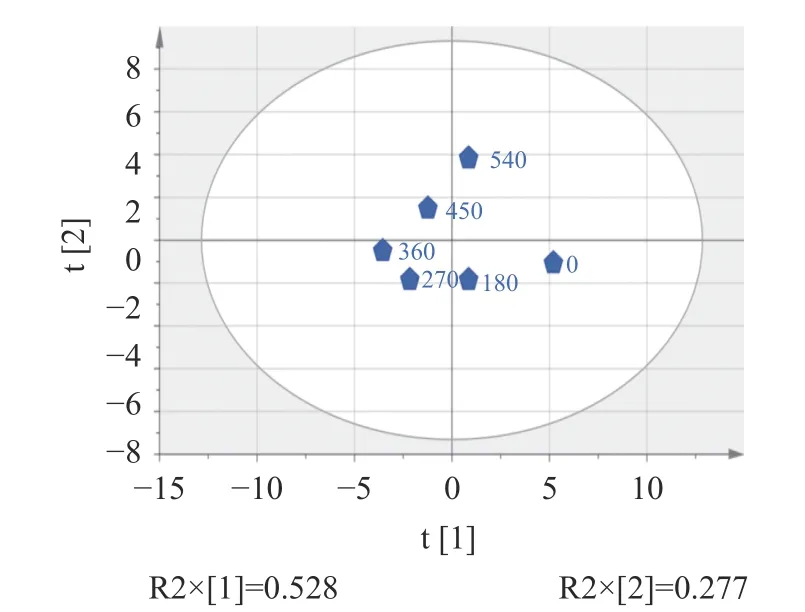
图8 不同超声功率的主成分得分图Fig.8 Principal component score chart with different ultrasonic power
对不同超声时间处理后的肌原纤维蛋白理化指标进行主成分分析,分解得到2 个主成分(图9)。第一主成分的解释率为0.67,第二主成分的解释率为0.27。评分图显示不同超声时间下的样品明显分开,表示不同超声时间对肌原纤维蛋白的理化性质有较大的影响。6 min 和9 min 处理的样品的位置接近,差别较小。
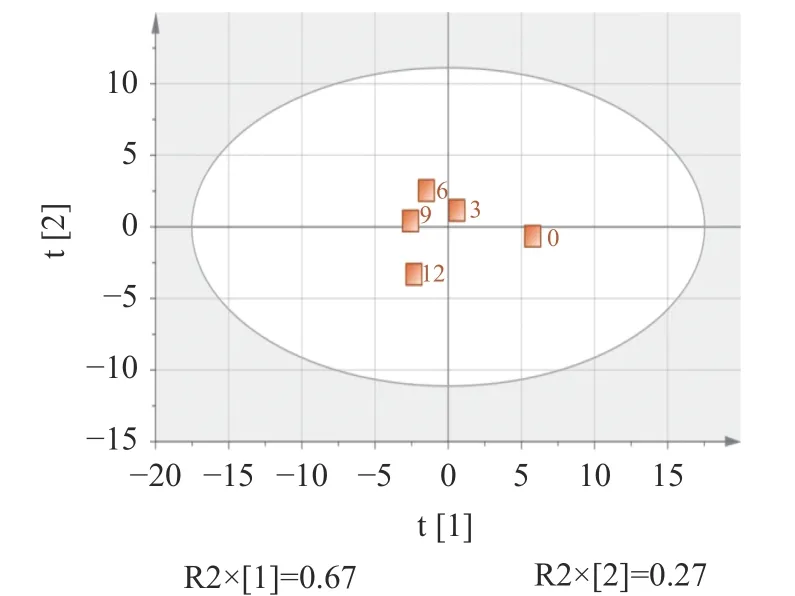
图9 不同超声时间的主成分得分图Fig.9 Principal component score chart with different ultrasonic time
2.9 聚类分析
PCA 聚类分析可以更加直观表示超声功率和时间与粒径、总巯基、溶解度和二级结构等指标的关系,以所有样品的测定指标为评价标准,进行聚类分析。观察聚类图10,得到0 W 被聚为Ⅰ类,540 W被聚为Ⅰ类,180、270、360、450 W 聚为Ⅰ类。观察聚类图11 发现,0 min 为Ⅰ类,3 min 为Ⅰ类,6、9、12 min 被聚为Ⅰ类。这表明超声功率和时间与这些指标之间存在较强的联系。
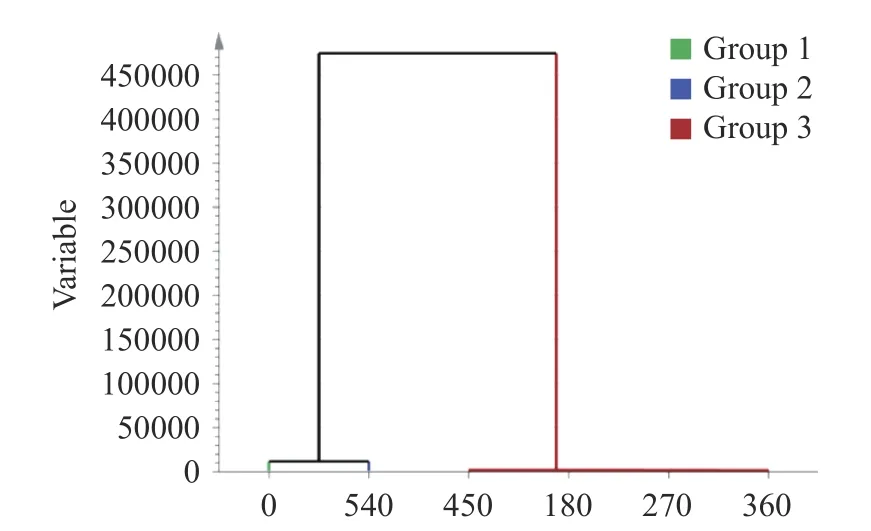
图10 不同超声功率组的聚类分析Fig.10 Cluster analysis of groups with different ultrasonic power
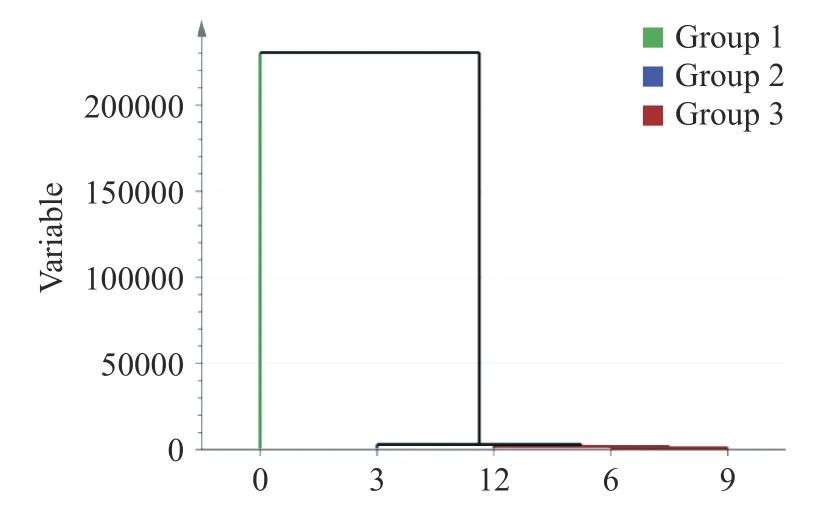
图11 不同超声时间组的聚类分析Fig.11 Cluster analysis of groups with different ultrasonic time
3 结论
随着超声功率和时间的增加,肌原纤维蛋白的巯基含量总体减少,紫外吸光度增大,其-螺旋含量减少,-折叠、-转角和无规卷曲的含量增加。180~450 W 的超声处理使肌原纤维蛋白的粒径和浊度减小,溶解度提高。超声处理改善了肌原纤维蛋白的流变特性,提高了热诱导凝胶过程的G’和G”。主成分和聚类分析表明不同超声功率和时间对肌原纤维蛋白的理化性质有较大的影响。超声处理会使鲈鱼肌原纤维蛋白的结构发生改变,使其凝胶性能提升,将有利于鱼糜制品的生产。将超声协同其他多糖添加剂处理,其减盐效果可能更加好。因此,在生产过程中合理安排超声工艺的功率和时间,可以设计出含肌原纤维蛋白类特性优异和健康的食品。
