栓塞微球在原发性肝癌中的研究进展
2021-01-06闫歌周学素程玉莹秦若梦田启威杨仕平
闫歌 周学素 程玉莹 秦若梦 田启威 杨仕平

摘 要: 原发性肝癌是目前致死率较高的癌症,如何在治疗过程中减轻癌症患者的痛苦,且提高治疗效果是各国学者研究的热点.经导管动脉栓塞(TAE)被认为是一种微创的、目的性强的且风险低的治疗方法,已成为非手术治疗原发性肝癌的首选方法.TAE治疗是通过微导管将栓塞材料堵塞实体瘤的肝动脉,从而阻碍了肿瘤的氧气和营养的供给,达到杀死肿瘤细胞的目的.介入栓塞治疗效果的好坏归因于栓塞材料,即栓塞材料的设计及使用.文章基于不同种类的栓塞材料展开综述,归纳了栓塞微球在原发性肝癌中的研究进展,并对开发新型的栓塞材料提供了可借鉴的思路.
关键词: 原发性肝癌; 经导管动脉栓塞(TAE); 栓塞微球; 靶向治疗
中图分类号: TQ 460.1 文献标志码: A 文章编号: 1000-5137(2021)06-0714-07
Abstract: Primary liver cancer is currently a cancer with a high fatality rate, which has always been a difficult problem for people to overcome. How to reduce the pain of cancer patients and improve the treatment effect during the treatment process is a hot spot for scholars from all over the world. Transcatheter arterial embolization(TAE) is considered as a minimally invasive, purposeful and low-risk treatment, and has become the first choice for non-surgical treatment of primary liver cancer. TAE kills the tumor cells via blocking the hepatic artery of the solid tumor through microcatheter, which can hinder the supply of oxygen and nutrition to the tumor. The effect of interventional embolization is attributed to the design and use of embolic materials.Therefore, based on embolic materials, this paper reviews different kinds of embolic materials, summarizes the research progress of embolic microspheres in primary liver cancer, and provides ideas for the development of new embolic materials.
Key words: primary liver cancer; transcatheter arterial embolization(TAE); embolic microsphere; targeted therapy
0 引 言
癌癥一直是人们努力攻克的难关之一,由于环境污染日益加重、不健康的生活方式、人口老龄化等问题,导致癌症的发病率大幅度增加,严重危害了人们的健康[1-2].肝癌是最常见的肿瘤之一,传统的治疗方法有外科手术切除、化学药物治疗、放射治疗和介入治疗等[3-5].目前,外科手术切除是治疗肝癌的重要手段,但是大多数肿瘤具有侵袭性,难以通过手术完全切除病变区域,所以需要考虑和使用有效的非手术治疗手段.
近些年来,栓塞治疗在临床医学上异军突起,已成为了热门话题,且不断地被人们提及和应用.经导管动脉栓塞(TAE)是一项微创治疗手段[6-7],能够借助导管选择性地将栓塞材料注入到肿瘤的供血动脉中,将实体瘤的肝动脉堵塞,切断肿瘤供血,使其无法获取生存所需的氧气和营养,从而有效地抑制了肿瘤生长.TAE具有微创、目的性强、风险低等优点,已成为非手术治疗肝癌的首选方法.经过人们在临床中的不断摸索和实践,TAE技术已被公认为是可以有效改善癌症患者病情、能明显提高癌症患者生存率的有效介入治疗方法,且栓塞材料是TAE治疗的关键所在[8].本文作者就目前已研发的栓塞材料在肝癌治疗中的现状和进展作一综述.
1 栓塞材料
在TAE技术中,栓塞材料的选择决定了介入栓塞的治疗效果.近年来,微球在生物医学领域受到了广泛的关注,理想的栓塞材料应具有以下特征:1) 良好的生物相容性;2) 原料简单,易于制备;3) 材料粒径达到栓塞要求,可通过微导管进行递送;4) 无黏连,能在血管中均匀分散.基于此,以下将主要综述目前医学治疗中使用的栓塞微球.
1.1 传统栓塞微球
传统的栓塞微球与其他不规则栓塞颗粒相比,具有均一且规则的形貌,在微导管中具有良好的流动性,不易在体内与周围组织发生反应,具有其他不规则形状材料所没有的优良性能.
传统的栓塞微球按照材料性质分为两种:一种是非生物可降解材料,在体内具有良好的生物相容性,能够长期栓塞肝动脉,例如聚乙烯醇(PVA)微球、海藻酸盐(SAL)微球[9-10];一种是生物可降解的高分子材料,天然获取没有毒性,可以降低长期栓塞对血管的伤害性,这类微球有聚乳酸(PLA)、聚丙交酯-乙交酯(PLGA)、淀粉微球和明胶微球[11-12].栓塞微球能够利用微导管准确递送到肝动脉,使血管栓塞不能给肿瘤细胞提供氧气和营养,抑制肿瘤细胞的增殖,从而提高了抗肿瘤性能.
1.2 载药微球
化学药物治疗,即利用化疗药物进行消除腫瘤的治疗,能够快速被细胞摄取,阻碍细胞的复制和增殖,在低浓度和短时间内便可表现出强烈的细胞毒性[13-14].化疗药物在肿瘤部位的停留时间和药物浓度决定了其治疗效果,但是化疗药物在体内对细胞缺乏了选择性,在杀伤肿瘤细胞的同时,对正常组织细胞和免疫细胞也会一同进行损伤.如何提高化疗药物在肿瘤部位的停留时间和药物浓度,是目前研究的热点.由于栓塞微球具有较大比表面积,可以装载大量的化疗药物,将化疗与血管栓塞进行结合,借助微导管准确地将材料靶向递送到肿瘤部位,实现化疗药物的原位控制释放,明显提高了肿瘤部位的药物浓度,实现化疗性栓塞肿瘤,产生协同治疗作用,可以极大地提高治疗肿瘤的效率.
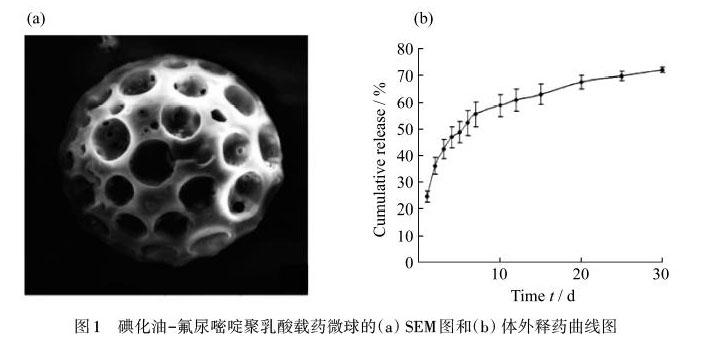
王新霞等[15]采用具有良好生物相容性的聚乳酸(PLA)作为载体,加入了阳性造影剂碘化油,利用复乳法制备了微球,将化学药物氟尿嘧啶(5-Fu)装载到可显影的碘化油-氟尿嘧啶聚乳酸微球中,研制了具有显影和治疗双重效果的碘化油-氟尿嘧啶聚乳酸载药微球.所合成的碘化油-氟尿嘧啶聚乳酸载药微球如图1所示,表面有孔且球形圆整,平均粒径约100 μm,通过微导管选择性地将载药微球注入肿瘤供血动脉,通过阻断血管将微球固定在肿瘤部位,使肝动脉血流减少了80%~100%,使病灶组织缺血、缺氧坏死;并且该微球具有一定的药物缓释作用,在栓塞的同时能缓慢释放5-Fu,使化疗药物能够长期作用于病灶部位,有利于治疗效果的提高;通过增强纳米载体的渗透性和滞留(EPR)效应,以及纳米材料的持续释放来延长药物的药理时间和药效,达到杀伤肿瘤的目的.说明了碘化油-氟尿嘧啶聚乳酸载药微球具有诱导栓塞、显影和缓释化疗等多种功能,在栓塞动脉肿瘤血管的同时释放并积累药物,可以达到良好的治疗效果.
1.3 智能响应微球
智能响应性材料是指具有根据环境的变化使自身结构或者功能快速发生变化的一类载体[16-17].近年来,智能响应性载体因具有优异的稳定性、对外界刺激快速智能响应且有优异生物治疗能力等特点,对其在治疗和诊断领域的研究显得十分活跃.由于栓塞微球为高分子材料,具有优异的可修饰性,可以与不同类型的刺激响应性官能团修饰而进行改性,同时有些智能响应性材料也可以在不同环境进行响应,开发成智能响应性微球[18].智能响应微球载体的构建,提高了载体的安全性和靶向性,能够在肿瘤部位进行聚集,根据不同的微环境的刺激做出响应,达到增强疗效的目的.根据智能响应微球在肿瘤部位对不同刺激的响应,可以将其分为pH响应性微球、温度响应性微球和多重刺激响应性微球.
1.3.1 pH响应性微球
pH响应性材料含有可电离的基团或者酸致断裂的化学键,可以在低pH环境下发生材料的构象变化,表现出溶胀或者坍塌的现象[19].由于肿瘤细胞繁殖能力强,代谢旺盛,导致大量乳酸的生成,使肿瘤具有微酸环境,所以利用肿瘤组织和正常组织中不同的pH梯度,将pH响应性材料接枝在微球表面,当微球达到低pH环境时,可通过基团结构变化或化学键断裂来响应,以此制备pH响应性微球载体.
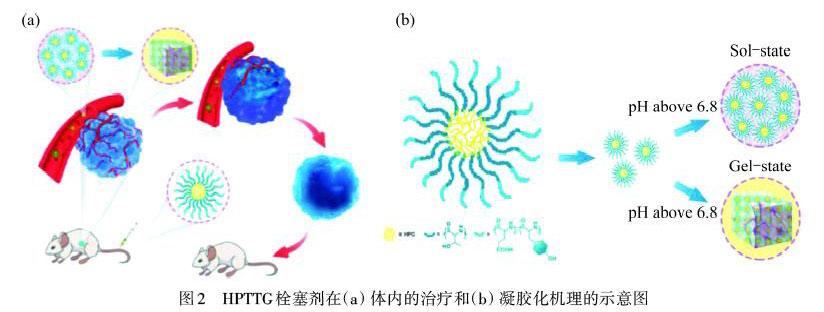
LU等[20]受pH响应性药物传递系统的启发,开发了一种新的无创、靶向静脉注射栓塞治疗方法.该方法基于一种酸性微环境响应性超支化聚(氨基酸)(HPTTG),通过L-氨基酸N-羧酸酐(NCA)的开环聚合,制备了具有pH响应性的栓塞微球,简化了栓塞治疗程序,提高了栓塞治疗的依从性和普适性.通过调节共聚物中酸性氨基酸的比例,控制溶胶-凝胶相变的pH值,降低HPTTG的pH值.如图2所示,当HPTTG到达肿瘤部位时,由于酸性的微环境,它会转化为水凝胶,并停留在肿瘤部位.通过荷瘤动物实验结果表明:HPTTG具有良好的靶向性和栓塞能力,注射后8 h在肿瘤部位蓄积最多,肿瘤血管闭塞;20 d左右肿瘤被抑制坏死.因此,HPTTG不仅可以作为新型栓塞材料用于多种实体肿瘤的有效无创栓塞治疗,而且为设计pH响应性微球载体提供了很好的范例.
1.3.2 温度响应性微球
温敏性材料具有较低的临界溶解温度(LCST)[21-22],在LCST附近温敏性材料会快速响应温度的变化而发生结构改变,并进行降解.同时,由于肿瘤组织病变或者外界环境的改变都能引起其温度局部升高,所以将温敏性材料修饰在微球表面,使栓塞微球具有温度敏感性,以此制备温度响应性微球载体.
JEONG等[23]运用了微流控技术以水包油(W/O/W)双乳液滴作为模板,制备了具有核壳结构且粒径均匀的PVA微球.聚N-异丙基丙烯酰胺(PNIPAAm)是温度敏感性聚合物,含有热响应性,以PNIPAAm为载体,将金纳米棒包裹其中,形成了一种生物相容性良好的乙基纤维素壳层.如图3所示,金纳米棒吸收了近红外光,提高了水凝胶颗粒的温度,当高于聚合物的LCST时,水凝胶颗粒收缩,导致了颗粒和壳层基质之间形成宏观间隙,相对较大的分子可以通过这些间隙,这种结构的结合可以通过近红外光远程控制膜的通透性.
由于PNIPAAm的相变行为是高度可逆的,通过去除激光照射足够的时间让金纳米棒冷却,这种光触发的渗透性可以被重复地打开和关闭.因此,将所开发的微球和温敏性材料进行结合具有巨大的应用潜力,特别是对于基于植入的高分子量药物的释放.
1.3.3 多重刺激响应性微球
仅有单一响应性的微球载体已经难以满足多元化应用的需求,多种响应性微球随之应运而生,受到了人们越来越多的关注.多重响应性微球通常装载了2个或者2个以上的单体聚合物,可以针对不同的刺激进行多重响应[24],达到更好的治疗效果,成为了多功能、多方式诊疗癌症的重要方法.
MU等[25]利用聚苯乙烯磺酸盐(PSS)、壳聚糖(CS)和SAL层层组装技术形成PSS@(CS/SAL)4微球,运用硝酸铈铵作为氧化还原引发剂,与N-异丙基丙烯酰胺(NIPAm)接枝聚合,成功制备了具有pH/离子强度/温度多响应壳结构的PSS@(CS/SAL)4-g-PNIPAm微球.如图4所示,当聚N-异丙基丙烯酰胺(PNIPAm)聚合物在LCST约为32 ℃时,稀水溶液中会发生从盘绕到球状的相变,而且pH值的降低会削弱SAL和CS之间的盐键强度,使微球壳层之间没有离子交联.所以在pH/离子强度双响应型微球壳层中引入PNIPAm刷子,不仅实现了药物分子在溶液pH和温度双重控制下的可控释放,而且防止了多响应型微球在较高盐浓度溶液中的絮凝.与采用层层组装法制备的普通聚电解质微球或微胶囊相比,多响应微球具有结构稳定、独特的双重控制(pH和温度)等特点,可作为优良的智能药物微球载体应用于临床.
2 总结与展望
近年来,伴随着人们对肝癌的病理基礎与临床治疗的深入研究,TAE技术慢慢出现在人们的视野中,逐渐突破了肝癌的治疗瓶颈,并在临床上具有广阔的应用前景.本文作者着重讨论了微球介入治疗技术的发展进程:1) 栓塞微球能够通过微导管精准地进行物理靶向,能够有效地栓塞肝动脉;2) 将药物与栓塞进行结合,具有物理靶向栓塞和药物打击作用的联合治疗效果;3) 将不同的刺激响应性基团与微球载体进行修饰,进一步给予了微球载体不同的响应能力.栓塞微球技术在国内应用比较晚,单一的治疗方式往往难以达到预期的效果,亟需开发新型高效、精准靶向且具有良好生物相容性的栓塞微球.应不局限于栓塞与药疗的结合,在后续的研究中将其与综合疗法进行结合,可以落实到多学科交叉治疗,合理地构建多功能的栓塞治疗平台,经导管介入的栓塞治疗领域必将取得重大突破.
参考文献:
[1] ARBYN M, WEIDERPASS E, BRUNI L, et al. Estimates of incidence and mortality of cervical cancer in 2018: a worldwide analysis [J]. Lancet Global Health,2020,8(2):E191-E203.
[2] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA:A Cancer Journal for Clinicians,2021,71(3):209-249.
[3] WANG Z, PENG Y F, HU J W, et al. Associating liver partition and portal vein ligation for staged hepatectomy for unresectable hepatitis B virus-related hepatocellular carcinoma A single center study of 45 patients [J]. Annals of Surgery,2020,271(3):534-541.
[4] SUN J Y, YIN T, ZHANG X Y, et al. Therapeutic advances for patients with intermediate hepatocellular carcinoma [J]. Journal of Cellular Physiology,2019,234(8):12116-12121.
[5] LIU D, LIU F, XIE X Y, et al. Accurate prediction of responses to transarterial chemoembolization for patients with hepatocellular carcinoma by using artificial intelligence in contrast-enhanced ultrasound [J]. European Radiology,2020,30(4):2365-2376.
[6] ZHU Y X, FENG B, MEI L, et al. Clinical efficacy of TACE combined with apatinib in the treatment of advanced hepatocellular carcinoma [J]. Journal of Buon,2019,24(2):608-614.
[7] KIM W, CHO S K, SHIN S W, et al. Combination therapy of transarterial chemoembolization (TACE) and radiofrequency ablation (RFA) for small hepatocellular carcinoma: comparison with TACE or RFA monotherapy [J]. Abdominal Radiology,2019,44 (6):2283-2292.
[8] BAIK S H, PARK H J, KIM J H, et al. Mechanical thrombectomy in subtypes of basilar artery occlusion: relationship to recanalization rate and clinical outcome [J]. Radiology,2019,291(3):730-737.
[9] WANG Q, XIAO A, LIU Y M, et al. One-step preparation of nano-in-micro poly(vinyl alcohol) embolic microspheres and used for dual-modal T-1/T-2-weighted magnetic resonance imaging [J]. Nanomedicine:Nanotechnology Biology and Medicine,2018,14(8):2551-2561.
[10] HOU F L, ZHU Y H, ZOU Q, et al. One-step preparation of multifunctional alginate microspheres loaded with in situ-formed gold nanostars as a photothermal agent [J]. Materials Chemistry Frontiers,2019,3(10):2018-2024.
[11] SOMMER C M, DO T D, SCHLETT C L, et al. In vivo characterization of a new type of biodegradable starch microsphere for transarterial embolization [J]. Journal of Biomaterials Applications,2018,32(7):932-944.
[12] ZHANG L P, LIU M, QI T, et al. Preparations and properties of drug-eluting embolization microspheres based on modified gelatin [J]. Soft Materials,2018,16(2):117-125.
[13] KASHYAP D, TULI H S, YERER M B, et al. Natural product-based nanoformulations for cancer therapy:opportunities and challenges [J]. Seminars in Cancer Biology,2021,69:5-23.
[14] CUI D, HUANG J G, ZHEN X, et al. A semiconducting polymer nano-prodrug for hypoxia-activated photodynamic cancer therapy [J]. Angewandte Chemie International Edition,2019,58(18):5920-5924.
[15] 王新霞, 张丽, 周闺臣, 等. 可显影碘化油-氟尿嘧啶聚乳酸微球的研制 [J]. 第二军医大学学报,2010,31(10):1100-1103.
WANG X X,ZHANG L,ZHOU G C,et al. Preparation of visualized iodized oil-5-fluorouracil loaded polylactic acid microspheres [J]. Academic Journal of Second Military Medical University,2010,31(10):1100-1103.
[16] GAO S T, TANG G S, HUA D W, et al. Stimuli-responsive bio-based polymeric systems and their applications [J]. Journal of Materials Chemistry B,2019,7(5):709-729.
[17] SUN H, KABB C P, SIMS M B, et al. Architecture-transformable polymers: reshaping the future of stimuli-responsive polymers [J]. Progress in Polymer Science,2019,89:61-75.
[18] BI Y G, LIN Z T, DENG S T. Fabrication and characterization of hydroxyapatite/sodium alginate/chitosan composite microspheres for drug delivery and bone tissue engineering [J]. Materials Science and Engineering C,2019,100:576-583.
[19] LIANG Y P, ZHAO X, MA P X, et al. pH-responsive injectable hydrogels with mucosal adhesiveness based on chitosan-grafted-dihydrocaffeic acid and oxidized pullulan for localized drug delivery [J]. Journal of Colloid and Interface Science,2019,536:224-234.
[20] LU D D, WANG J C, LI Y F, et al. Tumor noninvasive and target embolization therapy platform by intravenous injection based on acidic microenvironment-responsive hyperbranched poly(amino acid)s [J]. ACS Central Science,2020,6(11): 1977-1986.
[21] SPONCHIONI M, PALMIERO U C, MOSCATELLI D. Thermo-responsive polymers: applications of smart materials in drug delivery and tissue engineering [J]. Materials Science and Engineering C,2019,102:589-605.
[22] BORDAT A, BOISSENOT T, NICOLAS J, et al. Thermoresponsive polymer nanocarriers for biomedical applications [J]. Advanced Drug Delivery Reviews,2019,138:167-192.
[23] JEONG W C, KIM S H, YANG S M. Photothermal control of membrane permeability of microcapsules for on-demand release [J]. ACS Applied Materials and Interfaces,2014,6(2):826-832.
[24] WANG S M, YANG Y, SHI X Y, et al. Multiple stimuli-responsiveness fluorescent probe derived from cyclopolymers and pyrene-ended ammonium salts [J]. ACS Applied Polymer Materials,2020,2(6):2246-2251.
[25] MU B, LIU P, LI X R, et al. Fabrication of flocculation-resistant pH/ionic strength/temperature multiresponsive hollow microspheres and their controlled release [J]. Molecular Pharmaceutics,2012,9(1):91-101.
(責任编辑:郁慧,冯珍珍)
