基于Pd纳米粒子/聚苯胺的葡萄糖电化学传感器研究
2021-01-06黄新花王琳惠文颖杨海峰
黄新花 王琳惠 文颖 杨海峰

摘 要: 采用静电纺丝技术结合化学原位还原沉积方法构建钯纳米粒子(Pd NPs)修饰的聚苯胺(PANI)空心管复合材料(Pd/PANI/GCE).首先通过静电纺丝法制备聚苯乙烯(PS)纤维膜基底,然后在纤维膜基底上修饰苯胺单体,并进行原位聚合,获得磺化聚苯乙烯@聚苯胺(SPS@PANI)复合纤维膜.采用四氢呋喃(THF)溶解去除磺化聚苯乙烯(SPS)内芯后获得高导电性、高比表面积的PANI空心管材料,再通过化学原位还原法在PANI空心管表面均匀沉积Pd NPs,并由此构建了无酶葡萄糖传感器.实验结果表明:该传感器对葡萄糖检测的线性范围包括0.1~44.0 μmol·L-1和44.0~3 423.0 μmol·L-1两段线性,最低检测限为0.06 μmol·L-1.该传感器能够直接应用于实际唾液样品中对于葡萄糖的检测.
关键词: 静电纺丝; 聚苯乙烯(PS); 聚苯胺(PANI); 钯纳米粒子(Pd NPs); 电化学传感器; 葡萄糖
中图分类号: O 647.3 文献标志码: A 文章编号: 1000-5137(2021)06-0653-10
Abstract: In this work, palladium nanoparticles(Pd NPs) modified polyaniline(PANI) tubes(Pd/PANI/GCE) were prepared by using the in-situ chemical deposition and the electrospinning technology for glucose detection. The PANI was firstly modified on the surface of sulfonated polystyrene fiber membrane through the charge interaction between the positively charged aniline monomers and the sulfonatedunits, and the following polymerization. The polystyrene was extracted from the polystyrene@polyaniline composite fiber (SPS@PANI) by using the tetrahydrofuran (THF) to thus form the PANI hollow tube, which was then deposited with palladium nanoparticles (Pd NPs) to form the catalytic composite membrane for the sensor fabrication. The linear range of the sensor for glucose detection includes 0.1-44.0 μmol·L-1 and 44.0-3 423.0 μmol·L-1, and the detection limit of 0.06 μmol·L-1. The sensor has been applied to determine the concentration of glucose in saliva samples.
Key words: electrospinning; polystyrene(PS); polyaniline(PANI); palladium nanoparticles(Pd NPs); electrochemical sensors; glucose
0 引 言
糖尿病是一種代谢性疾病,人体中由于血糖异常引起的糖尿病是现代最具挑战性的健康问题之一,慢性高血糖症会导致严重疾病发生风险的增加,例如肾衰竭、肥胖、中风、冠心病和神经性疾病等并发疾病的发生.为了人们的身体健康,人体中的葡萄糖的分析测定对于糖尿病和它引起的相关并发症的诊断和治疗是非常重要的,并且具有重要的实际意义.
在过去的几十年中,许多技术已用于检测葡萄糖,包括电化学发光法、傅里叶变换红外光谱法、微透析法、超声渗析法、反离子电渗疗法和荧光法[1-2].然而,这些技术通常受到以下问题的制约,包括成本高、抗干扰性弱、制造工艺复杂、保质期短和再现性低.因此,为了解决这些问题,已经进行了许多尝试来构建便宜、灵敏,且选择性高的非酶葡萄糖传感器[3-4].电化学技术因其响应速度快、可靠性高、检测实时、检测限低、操作简便、选择性出色、可行性良好、响应灵敏、成本低、特异性强等特点,在葡萄糖传感领域引起了广泛关注,并已成为一种非常有前途的检测方法[5].值得注意的是,高质量的电化学葡萄糖传感器在很大程度上取决于电极上修饰的材料,这些材料在确定葡萄糖传感器的传感性能中起着关键作用.近年来,在葡萄糖生物传感器的研发中,已经广泛研究了贵金属基纳米材料,例如铂(Pt)、金(Au)、钯(Pd)和银(Ag)纳米粒子(NPs),以及金属合金NPs复合材料、金属氧化物NPs和氢氧化物.这些传感器具有出色的电化学性能,已被广泛用作无酶葡萄糖检测的传感材料[6].其中Pd纳米粒子(Pd NPs)是金属Pt族的一部分,在可用的过渡金属中,经常选择Pd来修饰电极,它们在电极修饰过程中具有特殊的性能、出色的电催化活性和防污性,并且相对便宜,Pd NPs修饰的电极已用于各种类型的电化学传感器[7-8].为解决Pd分散性的问题,经常向电化学传感器中加入导电聚合物,如聚苯胺(PANI).与传统的PANI相比,纳米结构的PANI具有比表面积大、反应能力高以及纳米纤维之间存在许多微间隙的独特优点.随着PANI纳米纤维的引入,基于PANI的电化学传感器可以显示出出色的灵敏度和选择性[9-10].基于以上考虑,本工作采用静电纺丝工艺结合原位聚合法和原位还原法,构建了Pd NPs修饰的PANI空心管复合材料(Pd/PANI/GCE)修饰电极(其中GCE为玻碳电极).把对葡萄糖有优异催化氧化作用的贵金属Pd NPs均匀修饰在PANI微管上,成功制备了性能优异的无酶葡萄糖传感器,同时在实际应用中探讨了传感器在唾液中检测较低浓度的葡萄糖的可行性.
1 实 验
1.1 实验仪器与试剂
实验仪器:场发射扫描电子显微镜(FE-SEM),JEOL,JSM-6700F;能量色散X射线光谱仪(EDX),Hitachi,S-4800;透射电子显微镜(TEM),JEOL,分析型透射电子显微镜,JEM-2000 FX;恒温磁力搅拌器,上海梅颖浦仪器仪表制造有限公司,H01-1B;超声清洗器,上海科导超声仪器有限公司,SK2200H.
实验药品:盐酸(HCl)、苯胺(ANi)、四氯钯酸钠(Na2PdCl4)、抗坏血酸(AA)和过硫酸铵(APS)均购自于国药集团化学试剂有限公司.
实验中所涉及的化学试剂没有任何的纯化处理,均是直接使用的.实验过程中用到的水都是去离子水(DI),为电阻率18.25 MΩ·cm的超纯水.唾液实际样品取自于上海师范大学校医院.
1.2 制备纤维膜
1.2.1 静电纺丝PS纤维
1) 配制前驱液:首先将2.25 g的聚苯乙烯(PS)试剂放在8 mL N,N-二甲基甲酰胺(DMF)和2 mL四氢呋喃(THF)组成的混合溶液中.THF和DMF混合溶液在室温下,用650 r·min-1转速搅拌,一边搅拌一边缓慢加入PS,加入完成后搅拌约2 h.直至形成了均一稳定且有一定黏性的电纺前驱液.
2) 电纺:注射器流速0.05 mL·h-1,电纺正负极工作电压分别为10 kV正电压和-10 kV负电压,在15 cm的工作距离(接收装置与针头的距离)条件下进行电纺,采用长宽为10 cm×10 cm的铝箔纸来接收电纺的PS纤维.
1.2.2 制备磺化聚苯乙烯(SPS)纤维
首先在2 mL 98%(质量分数)浓硫酸中放入长宽为6 cm×6 cm左右的PS纤维膜,然后在室温条件下用超声清洗仪超声处置20 s,可得到纤维表面带负电荷的SPS纤维膜.最后将制得的SPS纤维膜用去离子水漂洗3次,并在空气中自然晾干.在SPS纤维原位聚合修饰PANI,得到磺化聚苯乙烯@聚苯胺(SPS@PANI)复合纤维.制备过程如下:将SPS磺化纤维膜放入用1.0 mol·L-1 HCl配成的0.25 mol·L-1 ANi溶液中2 h,让带正电的ANi与带负电的磺化纤维膜静电吸附,然后加入同样用1.0 mol·L-1 HCl配成的引发剂APS来引发ANi聚合,5 min后可以看到纤维膜慢慢由白色透明变成紫红色,最终变成具有光泽的墨绿色,说明SPS纤维外已修饰上了PANI,然后取出纤维膜用蒸馏水漂洗3次,室温下自然晾干,得到SPS@PANI复合纤维.晾干后用THF浸泡12 h,去除SPS@PANI复合纤维的内芯部分SPS,然后离心3次,用去离子水漂洗,分散定容得到PANI微管备用.
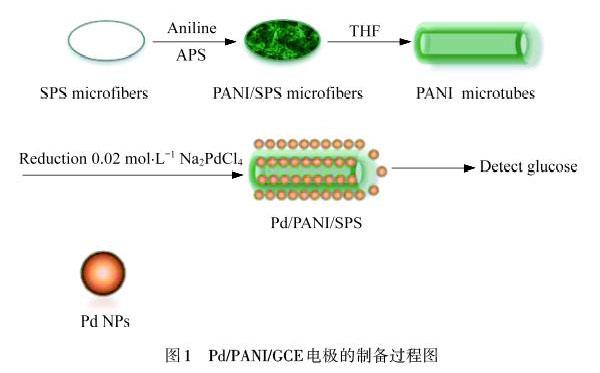
1.3 Pd/PANI/GCE传感器的构建
取一定量PANI微管转移到20 mL 0.02 mol·L-1 Na2PdCl4的溶液中.溶液持续搅拌加热到60 ℃,保持10 min,然后再加入一定量的物质的量浓度为0.1 μmol·L-1的还原剂AA溶液.持续加热30 min,待充分还原成Pd NPs后,冷却到室温,将制备的Pd/PANI溶液用蒸馏水洗涤,在转速为6 000 r·min-1 条件下离心6 min,离心3次,洗涤定容到1 mL,超声10 min后得到均一的Pd/PANI溶液,取10 μL溶液滴在打磨好洗干净的GCE上,在室温下自然晾干,得到最终Pd/PANI/GCE修饰电极.以上制备过程如图1所示.
2 结果与讨论
2.1 Pd/PANI的形貌表征
PANI管和Pd/PANI的FE-SEM图如图2所示.由图2(a)可以清楚地看到PANI微米管材料粗细较为均匀,平均直径在1~2 μm左右,表面粗糙呈空心管状结构.由图2(b)的Pd/PANI的FE-SEM图可以看出,PANI管表面附着均匀分散的NPs,证明Pd NPs的合成成功,Pd NPs的修饰让复合材料产生了更大的比表面积和更多的活性位点,从而改善了材料的催化活性.
2.2 不同修饰电极的电化学表征
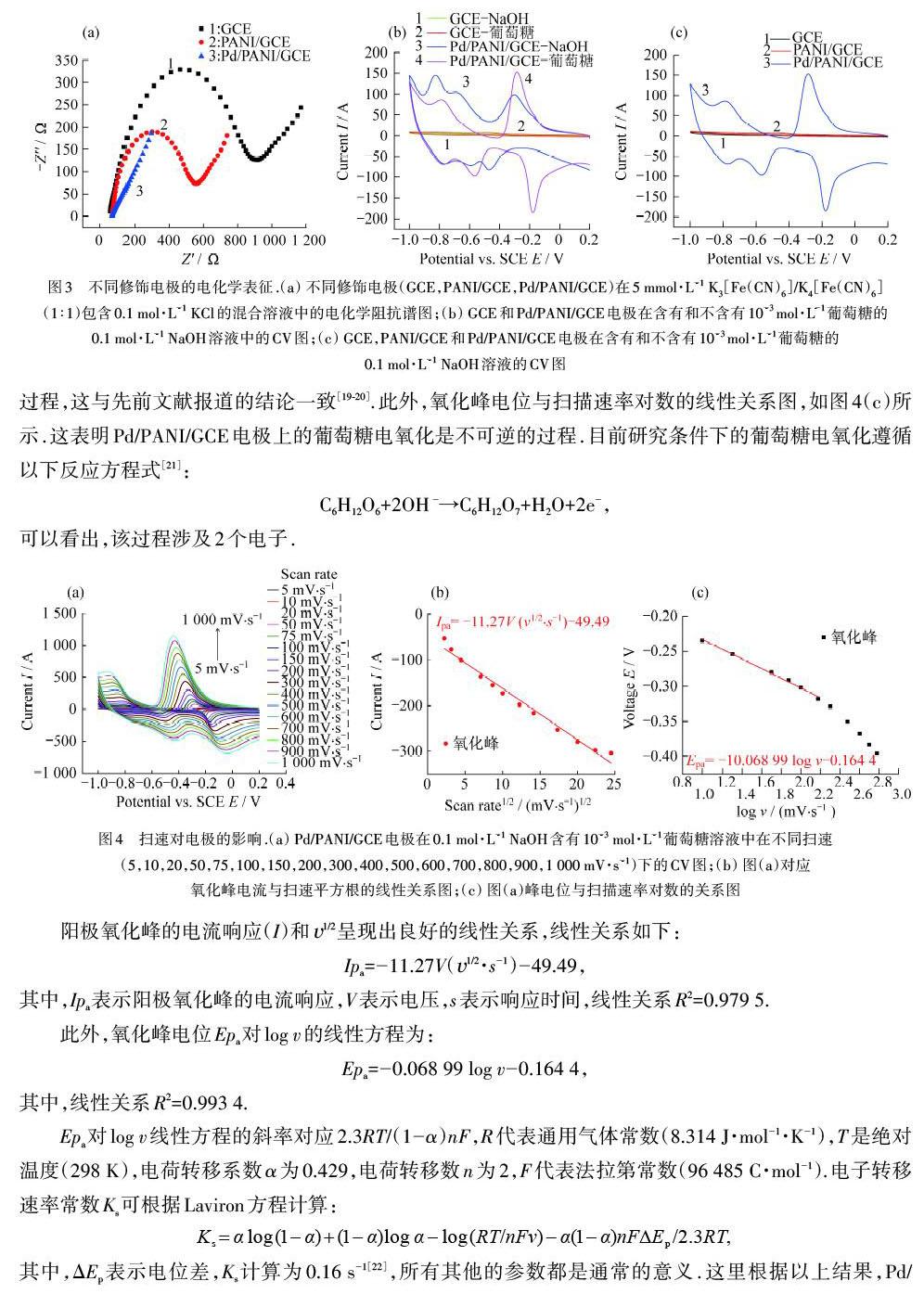
在奈奎斯特(EIS)图中,高频区域中的典型半圆图对应于一个动态过程,而低频区域中的下降线对应于一个扩散过程,半圆越大表明界面电子传递阻力也越大[11].如图3(a)所示,在5 mmol·L-1 K3[Fe(CN)6] / K4[Fe(CN)6](1∶1)包含0.1 mol·L-1 KCl的混合溶液中测量不同修饰电极(GCE,PANI/GCE,Pd/PANI/GCE)的电化学阻抗谱图结果.裸GCE的半圆最大,电子传递阻力最大,随着电极层层修饰,电极阻抗逐渐减小,导电的PANI管的加入使电阻变小,在PANI管上修饰了Pd NPs的电极材料,使阻值达到最小,加速了电子转移,产生了最小的電子传递阻力,这有可能是两者的协同作用促成的[12-13].图3(b)显示了GCE和Pd/PANI/GCE电极在0.1 mol·L-1 NaOH含有10-3 mol·L-1葡萄糖的溶液以及在不含葡萄糖的0.1 mol·L-1 NaOH溶液中的循环伏安(CV)曲线图.由图3(b)可以看出在加入葡萄糖前后,裸GCE的CV响应基本没有变化,说明GCE电极对葡萄糖没有电催化性能.最终修饰电极(Pd/PANI/GCE)在不含葡萄糖的NaOH溶液中的CV曲线,在-0.3 V附近的峰可归因于Pd氧化物的形成,而-0.55 V附近的峰则归因于Pd氧化物的剥离[14-15];当加入10-3 mol·L-1葡萄糖后,可在-0.2 V处观察到一个新的氧化峰,这归因于电极表面葡萄糖的氧化[16].同时,-0.3和-0.55 V处的峰电流值都增加了,这些现象表明葡萄糖不可逆的电化学氧化过程[17].图3(c)表示了不同电极(GCE,PANI/GCE,Pd/PANI/GCE)在0.1 mol·L-1 NaOH含有10-3 mol·L-1葡萄糖溶液中的CV图,可以看出Pd/PANI/GCE对于葡萄糖氧化有电催化作用,而PANI管和GCE电极对葡萄糖氧化没有明显的催化作用,证明了Pd NPs和PANI材料的协同作用可以大大提高复合材料对葡萄糖的电催化氧化活性[18].
2.3 掃速的影响
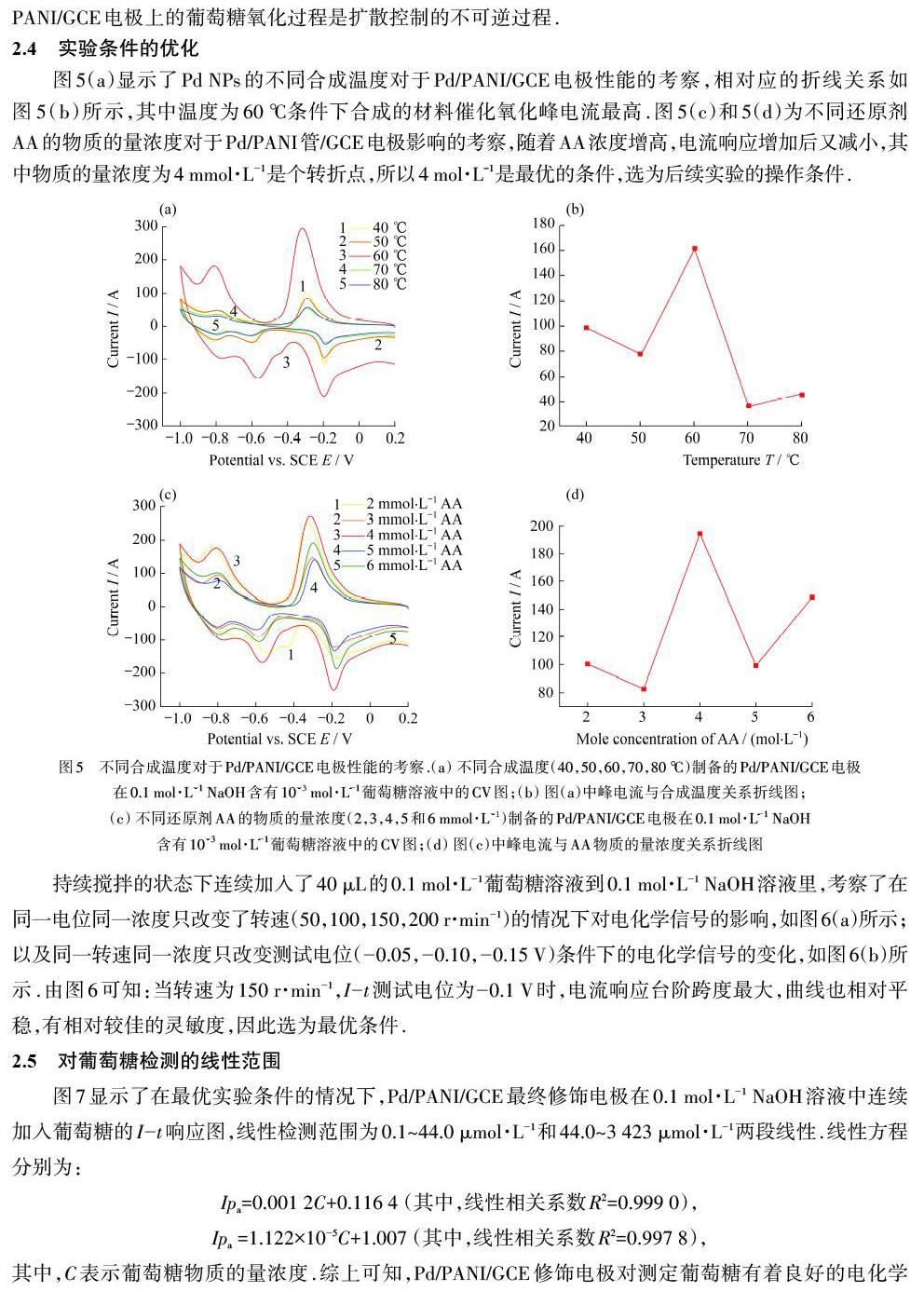
为了考察最终修饰电极反应过程的动力学,测定了在0.1 mol·L-1 NaOH含有10-3 mol·L-1葡萄糖溶液中不同扫描速率(v)下的CV曲线.从图4(a)中可以看出氧化峰电流随着扫速的增加而逐渐增大,阳极峰电位发生正移.当扫描速率的平方根(v1/2)在5~600 mV·s-1之间时,其氧化峰电流与扫描速率的平方根呈现良好的线性关系,如图4(b)所示,说明在电极表面发生的是一个典型的受扩散控制的过程,这与先前文献报道的结论一致[19-20].此外,氧化峰电位与扫描速率对数的线性关系图,如图4(c)所示.这表明Pd/PANI/GCE电极上的葡萄糖电氧化是不可逆的过程.目前研究条件下的葡萄糖电氧化遵循以下反应方程式[21]:
其中,C表示葡萄糖物质的量浓度.综上可知,Pd/PANI/GCE修饰电极对测定葡萄糖有着良好的电化学催化氧化活性.
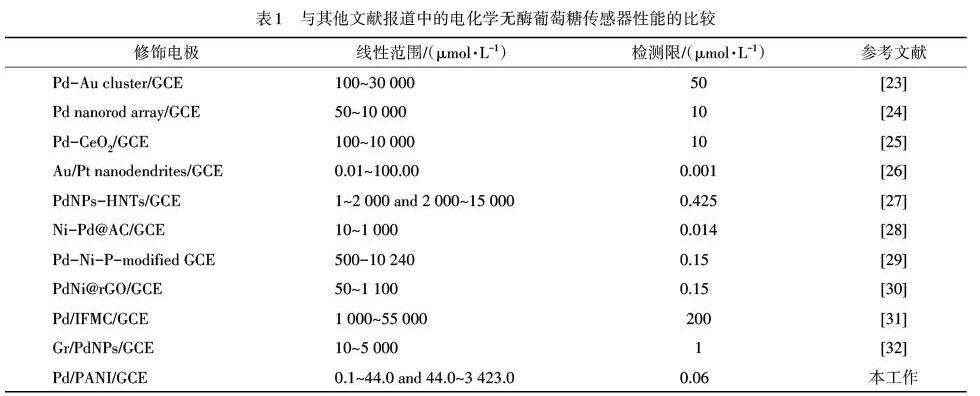
表1中的数据表明,构建的传感器对葡萄糖的检测具有较宽的线性范围和相对较低的检测限,这意味着Pd/PANI/GCE葡萄糖传感器在实际葡萄糖检测中有着潜在的应用价值.
2.6 传感器的抗干扰性、重现性和稳定性考察
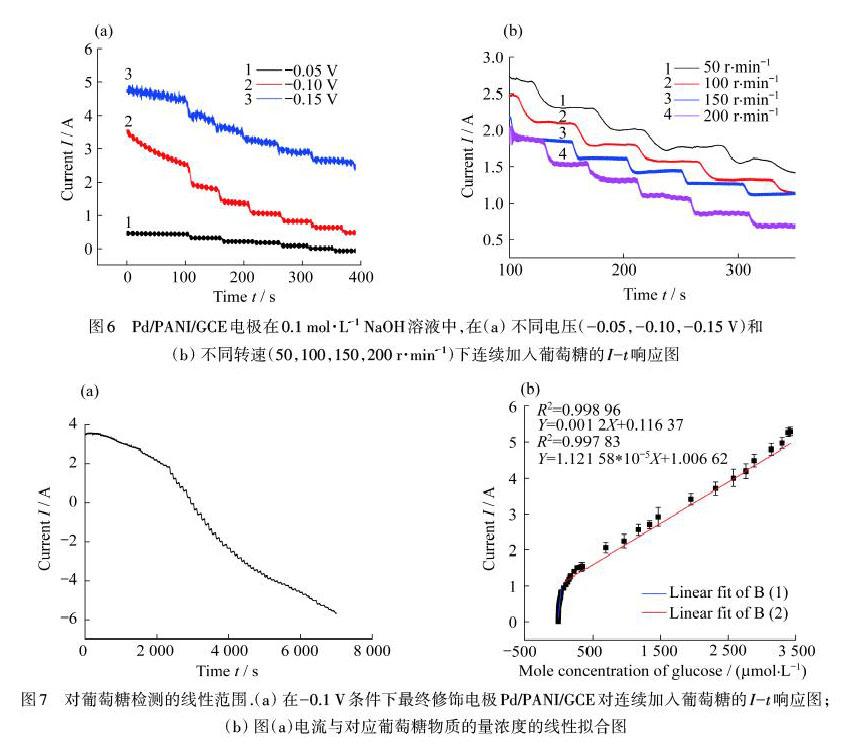
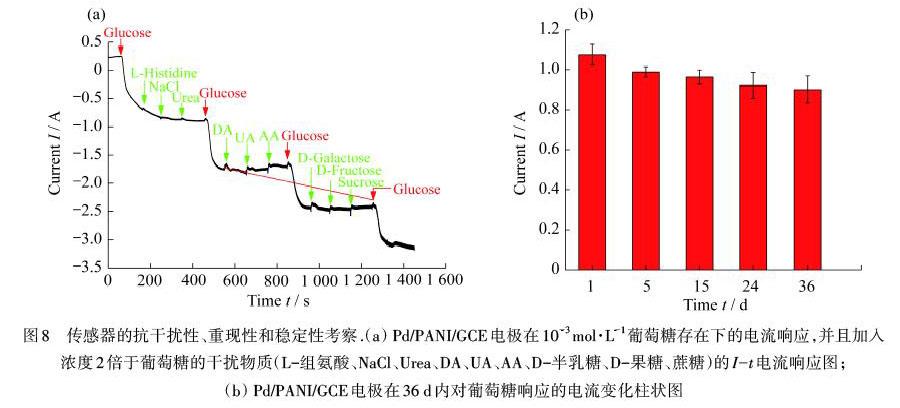
Pd/PANI/GCE的电化学干扰分析,在检测实际唾液样品里的葡萄糖时,可能会存在产生干扰的生物分子,例如氨基酸、尿酸(UA)、多巴胺(DA)和AA,及其他具有电活性的物质.因此为了探究电极对葡萄糖测定的选择性,在物质的量浓度为10-3 mol·L-1的葡萄糖溶液中陆续添加2×10-3 mol·L-1的L-组氨酸、氯化钠(NaCl)、尿素(Urea)、DA、UA、AA、D-半乳糖、D-果糖和蔗糖,测定相应的I-t响应,结果如图8(a)所示.由图8(a)可知:以上干扰物对检测结果的影响可以忽略不计,说明Pd/PANI/GCE葡萄糖传感器抗干扰能力强,具有良好的选择性.
同时,还研究了电极对葡萄糖检测长期稳定性的影响.将电极保存在4 ℃的冰箱里,在36 d的时间内,隔一段时间记录一次电极对葡萄糖的安培响应.3根Pd/PANI/GCE电极在保存36 d内的电流信号,如图8(b)所示.结果表明:电极在36 d后仍保持其原始电流信号的83.8%左右,相对标准偏差(RSD)为1.73%.由此可见,Pd/PANI/GCE葡萄糖传感器有着可接受的稳定性和重现性.
2.7 实际样品的检测
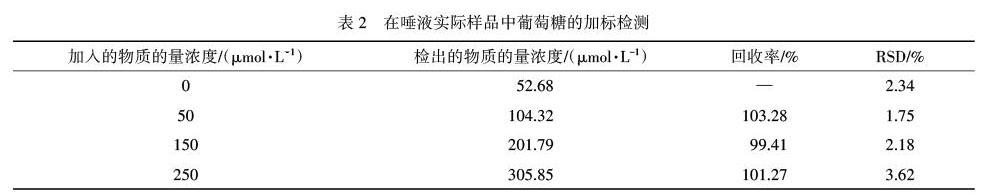
为了探究所构建的Pd/PANI/GCE无酶电化学葡萄糖传感器在实际唾液样品中的实际应用,将1 mL离心处理后的唾液用0.1 mol·L-1 NaOH溶液稀释5倍,并进行加标检测.表2是在唾液中测定出的实际实验结果,唾液来自于上海师范大学校医院,可以得出在唾液中检测葡萄糖的回收率范围是99.41%~103.28%.样品中检测出的唾液中的葡萄糖物质的量浓度为0.26 mmol·L-1,人体唾液中的葡萄糖生理水平范围为27.8 μmol·L-1~1.11 mmol·L-1之间,检测结果在此范围之内.如上所述,证明制备的Pd/PANI/GCE修饰电极可以成功地在唾液里检测出葡萄糖含量.
3 结 论
本工作通过静电纺丝法、原位聚合法和原位还原法等合成Pd NPs的方法,构建了Pd/PANI/GCE电化学无酶葡萄糖传感器,展示了对葡萄糖优异的电化学催化氧化活性.此传感器的线性范围包括0.1~44.0 μmol·L-1和44.0~3 423.0 μmol·L-1两段线性,检测限为0.06 μmol·L-1,同时还具备良好的时间稳定性,且能够运用于实际唾液样品中的葡萄糖检测,具有良好的应用前景.
参考文献:
[1] ZHANG C M, ZHANG Z W, YANG Q, et al. Graphene-based electrochemical glucose sensors: fabrication and sensing properties [J]. Electroanalysis,2018,30(11):2504-2524.
[2] XIONG Z G, LI J P, TANG L, et al. A novel electrochemiluminescence biosensor based on glucose oxidase immobilized on magnetic nanoparticles [J]. Chinese Journal of Analytical Chemistry,2010,38(6):800-804.
[3] ZHANG J J, WANG C Y, CHEN S H, et al. Amperometric glucose biosensor based on glucose oxidase-lectin biospecific interaction [J]. Enzyme and Microbial Technology,2013,52(3):134-140.
[4] WANG D D, CAI D P, HUANG H, et al. Non-enzymatic electrochemical glucose sensor based on NiMoO4 nanorods [J]. Nanotechnology,2015,26(14):87-103.
[5] HOVANCOVA J, SISOLAKOVA I, ORINAKOVA R, et al. Nanomaterial-based electrochemical sensors for detection of glucose and insulin [J]. Journal of Solid State Electrochemistry,2017,21(8):2147-2166.
[6] WANG F X, NIU X B, WANG W, et al. Green synthesis of Pd nanoparticles via extracted polysaccharide applied to glucose detection [J]. Journal of the Taiwan Institute of Chemical Engineers,2018,93(7):87-93.
[7] XUAN H P, CHENG A L, GI H S, et al. Electrochemical patterning of palladium nanoparticles on a single-walled carbon nanotube platform and its application to glucose detection [J]. Electroanalysis,2011,23(9):2087-2093.
[8] THIAGARAJAN S, YANG R F, CHEN S M, et al. Palladium nanoparticles modified electrode for the selective detection of catecholamine neurotransmitters in presence of ascorbic acid [J]. Bioelectrochemistry,2009,75(2):163-169.
[9] ZHAI D Y, WANG Y Q, ZHANG R, et al. Highly sensitive glucose sensor based on Pt nanoparticle/polyaniline hydrogel heterostructures [J]. ACS Nano,2013,7(4):3540-3546.
[10] LI S J, ZHAO G Y, ZHANG R X, et al. A sensitive and selective nitrite sensor based on a glassy carbon electrode modified with gold nanoparticles and sulfonated graphene [J]. Microchimica Acta,2013,180(9/10): 821-827.
[11] LI X Y, DU X Z, Molybdenum disulfide nanosheets supported Au-Pd bimetallic nanoparticles for non-enzymatic electrochemical sensing of hydrogen peroxide and glucose [J]. Sensors and Actuators B: Chemical,2017,239(3):536-543.
[12] MENG L, JIN J, ZHANG H, et al. Nonenzymatic electrochemical detection of glucose based on palladium-single-walled carbon nanotube hybrid nanostructures [J]. Analytical Chemistry,2009,81(17):7271-7280.
[13] SHEN C C, SU J, LI X Z, et al. Electrochemical sensing platform based on Pd-Au bimetallic cluster for non-enzymatic detection of glucose [J]. Sensors and Actuators B: Chemical,2015,209(6):695-700.
[14] CAI Z X, CHEN X M, CHEN X, et al. Palladium nanoparticles deposit on multi-walled carbon nanotubes and their catalytic applications for electrooxidation of ethanol and glucose [J]. Electrochimica Acta,2013,112(12):756-762.
[15] GULER M, DILMAC Y. Palladium nanoparticles decorated (3-aminopropyl)triethoxysilane functionalized reduced graphene oxide for electrochemical determination of glucose and hydrogen peroxide [J]. Journal of Electroanalytical Chemistry,2019,834:49-55.
[16] CHAI D, WANG W, WANG F X, et al. A facile precipitation procedure for synthesis of binary Sn-Co oxide promoting Pd catalyst towards glucose electrooxidation [J]. Electrochimica Acta,2016,189(4):295-302.
[17] HASAN M M, EHSAN M A, ISLAM T, et al. Selective detection of dopamine at the AACVD synthesized palladium nanoparticles and understanding the sensing mechanism through electrochemical and computational study [J]. Journal of the Electrochemical Society,2019,166(15):B1528-B1542.
[18] SHEN C C, SU J, LI X Z, et al. Electrochemical sensing platform based on Pd-Au bimetallic cluster for non-enzymatic detection of glucose [J]. Sensors and Actuators B: Chemical,2015,209(23):695-700.
[19] QU F L, SUN H Y, ZHANG Y, et al. Electrochemically deposited Pd nanorod array/sol-gel silica thin film for the fabrication of electrochemical sensors [J]. Sensors and Actuators B: Chemical,2012,166(38):837-841.
[20] QU F L, SUN H Y, ZHANG S F, et al. Electrochemical sensing platform based on palladium modified ceria nanoparticles [J]. Electrochimica Acta,2012,61(78):173-178.
[21] SONG Y, ZHU C Z, LI H, et al. A nonenzymatic electrochemical glucose sensor based on mesoporous Au/Pt nanodendrites [J]. RSC Advances,2015,5(100):82617-82622.
[22] WU Q, SHENG Q L, ZHENG J B. Nonenzymatic sensing of glucose using a glassy carbon electrode modified with halloysite nanotubes heavily loaded with palladium nanoparticles [J]. Journal of Electroanalytical Chemistry,2016,762(13):51-58.
[23] KOSKUN Y, SAVK A, SEN B, et al. Highly sensitive glucose sensor based on monodisperse palladium nickel/activated carbon nanocomposites [J]. Analytica Chimica Acta,2018,1010(3):37-43.
[24] MA J W, CHEN Y G, CHEN L, et al. Ternary Pd-Ni-P nanoparticle-based nonenzymatic glucose sensor with greatly enhanced sensitivity achieved through active-site engineering [J]. Nano Research,2017,10(8):2712-2720.
[25] SAVK A, CELLAT K, ARIKEN K, et al. Highly monodisperse Pd-Ni nanoparticles supported on rGO as a rapid, sensitive, reusable and selective enzyme-free glucose sensor [J]. Scientific Reports,2019,9(5):313-321.
[26] HAGHIGHI B, KARIMI B, TAVAHODI M, et al. Fabrication of a nonenzymatic glucose sensor using Pd-nanoparticles decorated ionic liquid derived fibrillated mesoporous carbon [J]. Materials Science and Engineering: C,2015,52(15): 219-224.
[27] LU L M, LI H B, ZHANG X B, et al. In situ synthesis of palladium nanoparticle-graphene nanohybrids and their application in nonenzymatic glucose biosensors [J]. Biosensors and Bioelectronics,2011,26(8):3500-3504.
[28] HAJIAN A, GHODSI J, AFRAZ A, et al. Development of a novel biosensor for nanomolar detection of methylparaben[J]. Procedia Engineering,2015,120(11):552-555.
[29] ZHANG S, ZHENG J B. Synthesis of single-crystal alpha-MnO2 nanotubes-loaded Ag@C core-shell matrix and their application for electrochemical sensing of nonenzymatic hydrogen peroxide [J]. Talanta,2016,159(27):231-237.
[30] PENG Y, YAN Z R, WU Y, et al. AgAuPt nanocages for highly sensitive detection of hydrogen peroxide [J]. RSC Advances,2015,5(11):7854-7859.
[31] ZHAO W, WANG H C, WANG X S, et al. A novel nonenzymatic hydrogen peroxide sensor based on multi-wall carbon nanotube/silver nanoparticle nanohybrids modified gold electrode [J]. Talanta,2009,80(2):1029-1033.
[32] ZHANG S, ZHENG J B. Synthesis of single-crystal alpha-MnO2 nanotubes-loaded Ag@C core-shell matrix and their application for electrochemical sensing of nonenzymatic hydrogen peroxide [J]. Talanta,2016,159(13):231-237.
(責任编辑:郁慧,顾浩然)
