光动力疗法诱导的免疫原性细胞死亡的研究进展
2021-01-06钟蒙杨红
钟蒙 杨红
摘 要: 光动力疗法(PDT)已被证明可以诱导免疫原性细胞死亡(ICD).但是由于PDT本身的局限性以及肿瘤部位的免疫原性差和免疫抑制环境的原因,单独的PDT在癌症免疫治疗中难以获得强大而持久的适应性抗肿瘤功效,往往需要采用不同的策略来提高肿瘤的免疫应答效果.因此,文章简述了光动力学机理、ICD原理,以及对PDT诱导的ICD的各种不同策略进行了总结和讨论,策略包括增加氧气(O2)和靶向性提高PDT效果,PDT联合光热疗法(PTT)和化疗等治疗方式,PDT结合免疫检查点以及免疫佐剂抑制来提高ICD效应,以此为研究人员提供更多的癌症免疫治疗方面的参考.
关键词: 光动力疗法(PDT); 免疫原性细胞死亡(ICD); 多模式联合治疗
中图分类号: O 613.3 文献标志码: A 文章编号: 1000-5137(2021)06-0774-10
Abstract: Photodynamic therapy (PDT) has been proved to induce immunogenic cell death(ICD). However, due to the limitations of photodynamic therapy itself, the poor immunogenicity of the tumor site, and the limitation of the immunosuppressive environment, PDT alone is difficult to obtain strong and long-lasting adaptive anti-tumor efficacy in cancer immunotherapy. Different strategies have been reported to improve tumor immune response using PDT and the combination methods. In this review, we briefly described the mechanism of PDT and the principle of immunogenic cell death, and summarized the various strategies of PDT-induced ICD. These strategies include improving the targeting effect of PDT and oxygen content, the combination of PDT and photothermal therapy(PTT), chemotherapy, immune checkpoints, and immune adjuvant. This review will provide more inspiration for scientists working in the field of cancer immunotherapy.
Key words: photodynamic therapy(PDT); immunogenic cell death(ICD); multimodal combination therapy
0 引 言
目前,癌癥仍旧是危害人类健康的主要因素之一,科学家们一直在致力于研究治疗癌症的各种方法.近年来免疫疗法越来越受到关注,2018年的诺贝尔生理学/医学奖授予了美国的詹姆斯·艾利森和日本的本庶佑两位科学家,以表彰他们在癌症免疫治疗方面所作出的杰出贡献[1].现已证明免疫系统的正常功能在预防癌症的发生、发展和治疗方面具有举足轻重的作用,免疫治疗已成为抑制癌症复发和转移的一种有前途的方法.
化疗、放疗、光动力疗法(PDT)等都可引起免疫原性细胞死亡(ICD)[2-3].相对于传统的化疗和放疗,PDT具有无毒、微创等诸多优点.PDT是一种冷光化学反应,治疗过程中需要三要素:光敏剂(PS)、特定波长的光源和氧气(O2)[4-5].PS在特定波长的照射下,被激活产生活性氧(ROS),最终导致细胞的凋亡.而PDT诱导小鼠产生ICD主要是通过产生的ROS引起内质网(ER)氧化应激反应,从而引起大量ER钙网蛋白(CRT)转运到细胞膜表面,释放出其他相关的损伤相关分子模式(DAMPs),最终导致肿瘤细胞的免疫原性死亡[6].但是单独的PDT还不能引起显著的免疫应答,需要采用不同的手段来扩大肿瘤的免疫应答,增强肿瘤的ICD效果.文章主要介绍了PDT诱发ICD不同模式的研究现状.
1 PDT
PDT是美国食品药品监督管理局(FDA)批准的用于治疗几种恶性和非恶性疾病的临床方案[7].PDT利用可见光、PS和组织分子氧之间的相互作用,通过光物理/光化学反应产生的ROS,引发癌细胞凋亡.
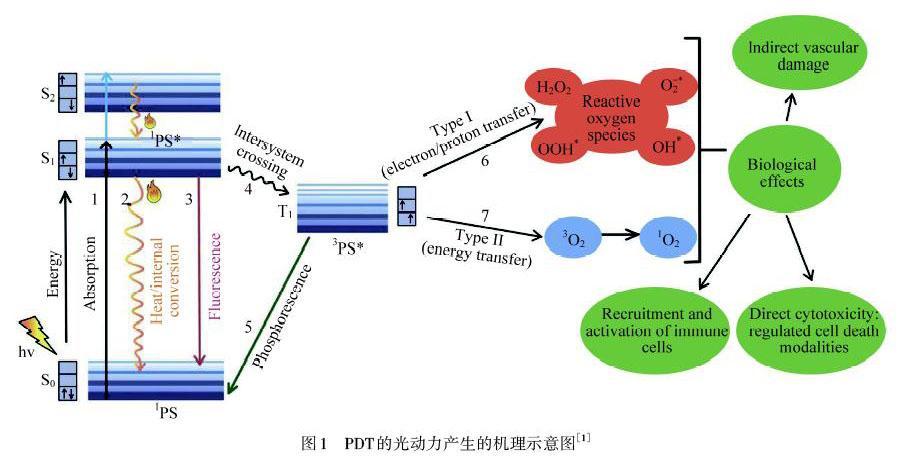
PDT的光动力产生机理如图1所示,光动力反应主要基于光物理和光化学两个过程[8].吸收光子后,处于基态的PS被激活为短寿命(ns)激发的单重态1PS·,此后它通过发射荧光或内部转换为热量而失去能量.激发单重态1PS·也可以经历系间跨越的过程,以形成寿命较长(μs)的激发三重态3PS·,其可以与周围的分子发生2种反应.在I型光化学反应中,3PS·直接与底物发生反应,例如细胞膜脂质中的多不饱和脂肪酸,并转移电子或质子,从而导致有机自由基的形成.这些自由基可能会进一步与细胞氧发生反应,生成ROS,例如超氧阴离子(O2- ·)、氢过氧化物自由基(HOO·)、过氧化物(过氧化氢(H2O2),有机过氧化物(ROOH))和羟基自由基(HO·),并引发自由基链反应.HO·主要通过过氧化物与亚铁离子(Fe2+)发生芬顿反应生成.HO·是最活泼的氧自由基,寿命不超过数百纳秒,几乎可以氧化任何有机分子[8].而在II型光化学反应中,3PS·可以经历三重态到三重态能量转移到分子氧(基态的三重态),形成激发态单重态氧(1O2),这是一种极强的氧化剂,具有生物介质的寿命,从几纳秒到几百纳秒.I型和II型光化学反应可以同时发生,它们之间的比例主要取决于PS的类型、底物浓度和氧的可用性.并且1O2被认为是PDT介导的细胞毒性中最重要的ROS[9].1O2与生物分子(包括脂质、蛋白质和核酸)相互作用的主要产物是氢过氧化物和环状内过氧化物,它们的分解(与I型光动力反应一样)能引发自由基过氧化的链反应.
PDT介导对肿瘤的破坏是多因素的,包括:1) 直接细胞毒性,调节细胞死亡方式;2) 间接的血管损伤;3) 募集和激活免疫细胞[10-11].
2 ICD
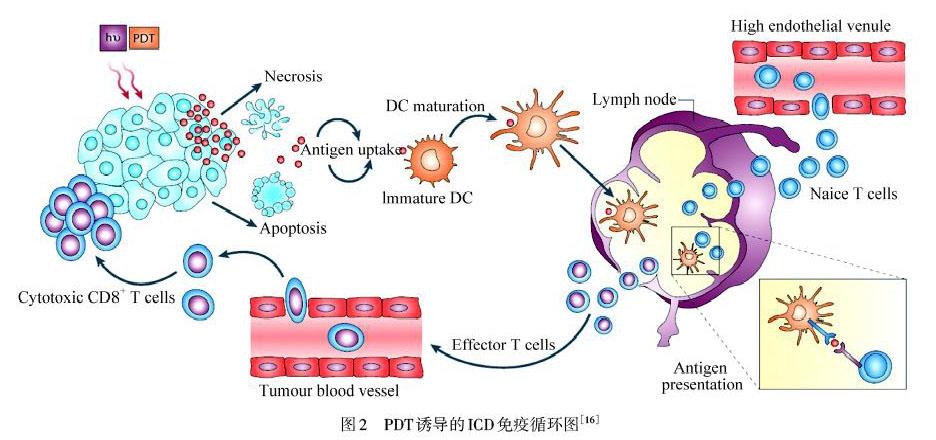
ICD最初由CASARES等[12]于2005年引入,用于描述阿霉素攻击小鼠的结直肠癌细胞(CT26),使其具有免疫原性,可抑制随后接种的CT26活细胞的生长,具有长期免疫功能.从概念理解上来说,ICD是指细胞在发生凋亡时,由非免疫原性的细胞转化免疫原性细胞,并在机体内激发肿瘤免疫效应的一种细胞死亡形式.发生ICD时,垂死的肿瘤细胞会释放免疫信号分子,这些免疫信号分子统称为DAMPs.其中包括细胞表面暴露的CRT、分泌到细胞外空间的三磷酸腺苷(ATP)以及细胞核外释放的高迁移率族蛋白1(HMGB‒1)等其他免疫信号分子.CRT是一种伴侣蛋白,主要參与钙信号的调节和内环境稳态.当产生ER应激时,CRT会从ER外翻到细胞膜表面上,并向树突状细胞(DC)发出“吃我”的信号[13],刺激幼稚的DC成熟,并诱导增强的免疫反应.CRT的暴露是发生ICD的标志性事件,并且在ICD的前期发生.ATP的释放会促进肿瘤细胞免疫反应,是一种“找到我”的信号,可以快速募集包括DC在内的髓系细胞到达肿瘤床.HMGB‒1是一种普遍存在的蛋白质,在核小体稳定性、转录调控和DNA修复中起着重要作用.HMGB‒1由巨噬细胞、DC和自然杀伤(NK)细胞分泌,以应对感染或伤害,HMGB‒1的释放会损伤细胞核和质膜(PM),在ICD晚期其暴露在凋亡细胞表面,与抗原提呈细胞(APC)上很多受体结合,激活炎症通路反应[14].
PDT诱导的ICD循环过程如图2所示.首先PS在光照的条件下产生ROS,触发ER应激反应,导致肿瘤细胞凋亡或者坏死.垂死的肿瘤细胞释放肿瘤抗原,并呈递给DC,同时从胞内释放DAMPs,促进未成熟的DC成熟,增强DC识别呈递抗原的能力.成熟的DC进入淋巴结,把肿瘤抗原呈递给T淋巴细胞并激活T细胞,活化的T淋巴细胞成为效应T细胞(如CD4+T细胞、CD8+T细胞),效应T细胞被趋化因子吸引移至肿瘤床,并杀死肿瘤细胞,从而引起机体全身的抗肿瘤免疫反应,实现原位和远位的肿瘤治疗[15].
3 PDT诱发ICD的研究
3.1 增强PDT效应诱发ICD
PDT诱导ICD的主要原理是通过产生的ROS引起ER氧化应激导致肿瘤细胞ICD.然而,实体肿瘤微环境中经常面临乏氧情况,这会导致PDT中不能产生足量的ROS,进而无法引起有效的ER应激,产生免疫应答.所以PDT的性能直接影响了诱导针对肿瘤转移的免疫反应[17].已有大量研究采取了各种方法来提高PDT效应.一些研究从缓解肿瘤缺氧方面改善PDT的功效:如利用氟化聚合物的高氧溶解能力,可以轻松缓解肿瘤微环境中的缺氧,从而激发强大的PDT功效[18];或者采用O2释放剂在肿瘤内原位产生O2 .当前使用的O2释放剂包括:1) 可以与肿瘤内的水(H2O)反应生成O2的高反应性纳米颗粒,例如氧化钙(CaO2)[19];2) 金属有机骨架[20]和过氧化氢酶,它们也可能降解H2O2以释放O2[21];3) 可以降解H2O2的芬顿(Fenton)和类Fenton纳米催化剂,例如铜(Cu)基纳米剂是常见的类Fenton反应纳米催化剂.WANG等[22]合成了一种超小型的β‒环糊精修饰的铜基纳米粒子(Cu2-xSe‒CD‒Ce6),亚铜离子(Cu+)发生类似于Fenton反应的Haber‒Weiss反应,可有效降解肿瘤内的H2O2,从而释放出·OH和O2.这为肿瘤乏氧环境提供了O2,在近红外(NIR)辐射下产生的大量ROS不仅杀死了原发性肿瘤细胞,还引发了ICD以释放DAMPs,并诱导了炎症性M1巨噬细胞的极化,强烈引发了针对乳腺癌转移的抗肿瘤免疫应答.也有通过抑制线粒体呼吸来增加O2的研究[23].
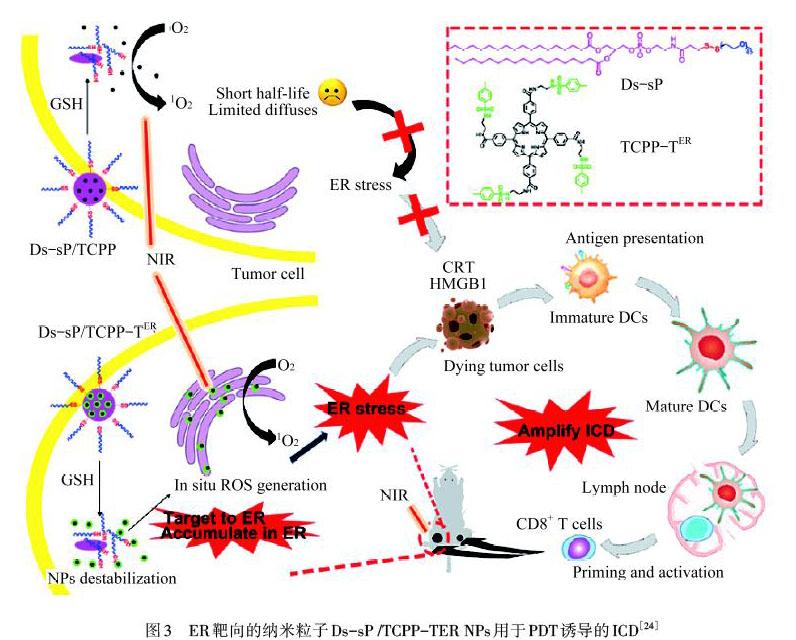
除上述方法之外,还有一些从增强靶向性方面研究如何改善PDT的功效.由于PDT中产生的ROS半衰期非常短,并且其在细胞内扩散深度也会受到很大限制,这就无法引起有效的ER氧化应激.基于这一点,DENG等[24]考虑到利用靶向ER来改善这一缺点,让产生的ROS直接位于ER上,避免了ROS在细胞内扩散深度浅以及半衰期短的问题而无法引起有效的PDT.该课题组设计的一种还原敏感且负载了高效的ER靶向的卟啉类纳米粒子(Ds‒sP/TCPP‒TER NPs),如图3所示.制备的Ds‒sP/TCPP‒TERNPs可以选择性地积聚在ER中,并在NIR激光照射下局部产生ROS,从而诱导ER应激、放大ICD和激活免疫细胞,增强免疫治疗效果.
3.2 PDT联合其他疗法诱发ICD
目前基于PDT诱发的免疫治疗的研究已从单一的PDT模式转向光动力学联合其他疗法的多治疗模式诱导ICD,如PDT与光热疗法(PTT)的联合、PDT与化学疗法的联合等,进一步优化癌症免疫应答的治疗效果.
3.2.1 PDT和PTT的联合
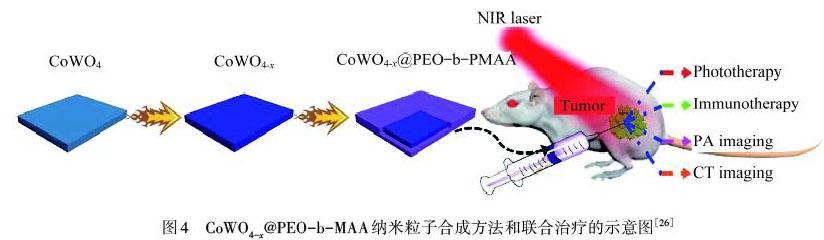
对于PDT联合PTT诱发ICD,无论是PDT还是PTT,都需要光照,所以波长的选择至关重要.ZHANG等[25]设计聚乙二醇(PEG)透明质酸(HA)修饰的靶向多功能黑磷(BP)纳米颗粒(HA‒BP)用于光热/光动力的免疫疗法,体外和体内研究表明:PDT联合PTT诱导的免疫疗法不仅可以显著抑制原始肿瘤,还可以诱导ICD.该研究中PDT选择635 nm波长的光,而PTT选择808 nm波长的光.尽管上述研究中两者的联合能引起有效的肿瘤细胞ICD,但是如果选择一个合适的波长,在相同激光照射下,PS和光热试剂可以同时被激发,能更有效地提高肿瘤免疫治疗的效果.LIU等[26]利用钴钨氧化物(CoWO4-x)在200~2 500 nm范围内全光谱吸收的特点,同时兼有光热和光动力特性的优点,制备了聚环氧乙烷‒b‒甲基丙烯酸官能化的非化学计量的CoWO4-x的纳米粒子(CoWO4-x@PEO‒b‒MAA)平台,用于免疫响应治疗.如图4所示,CoWO4-x@PEO‒b‒MAA在808 nm同一波长的激光照射下,同时产生热量和ROS,实现了PTT联合PDT诱导的HMGB‒1的释放、免疫应答.
3.2.2 PDT和化学疗法的联合
PDT联合化学治疗的双模式疗法诱发的ICD已经被证明比单独的PDT效果更为突出.一方面,PDT和化学治疗的联合可以降低给药剂量,降低化疗药物其对正常组织的毒性;另一面,当化疗药物和PS同时负载在同一纳米载体上被动靶向于肿瘤部位时,在特定波长的照射下,PS产生ROS能杀死肿瘤细胞,而对于深度肿瘤,此时化疗药物可以发挥作用,摆脱了PDT穿透深度的限制而无法杀死深度肿瘤的缺点.
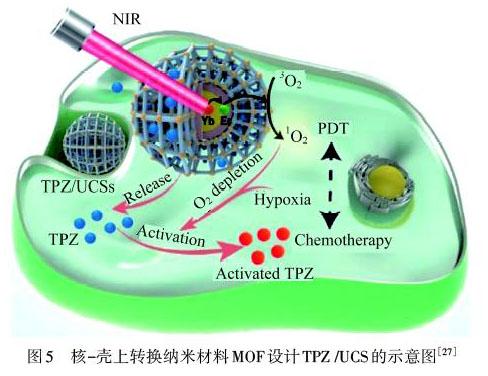
SHAO等[27]设计的核‒壳上转换纳米材料金属有机框架(MOF),将低氧激活的前药替拉帕明(TPZ)封装在异质结构的MOF壳的纳米孔中,形成最终的上转换纳米构建体(TPZ/UCS),如图5所示.通过NIR光诱导的PDT和缺氧激活的化学疗法相结合,在体外和体内实现改善的癌症治疗.但是,现在大部分研究将PS和化学治疗药物封装到常规纳米载体中只能实现简单的组合,而没有协同作用.而WU等[28]设计的由PEG和聚磷酸酯(PPE)的两亲性二嵌段共聚物与硫醚侧基组成的基于氧化敏感的PPE的纳米载体,作为二氢卟酚e6(Ce6)和多西紫杉醇(Dtxl)的共同递送系统用于协同喉癌治疗.在接受660 nm光照射后,封装在PPE核心中的Ce6有效地产生了ROS,这不仅能诱导细胞凋亡,而且还通过氧化敏感性PPE核心的疏水性到亲水性的转变触发了Dtxl的释放.这种级联PDT/化学疗法通过ICD效应引发了有效的抗肿瘤免疫应答.
3.3 PDT联合免疫查点抑制剂诱发ICD
尽管单独的PDT以及PDT联合其他疗法可以诱导ICD,引发有效的抗肿瘤免疫响应.但是由于肿瘤部位的免疫原性差和强烈的免疫抑制环境,利用免疫系统进行癌症治疗常常无法获得持久的应答率.近年来,有研究表明选择将免疫检查点抑制剂和PDT联合治疗,能改善光动力诱导免疫治疗的应答率.免疫检查点抑制剂是通过阻断细胞表面的免疫抑制受体来破坏肿瘤的免疫耐受性,从而恢复肿瘤特异性T细胞的细胞毒性功能[29].目前,主要的免疫检查点抑制剂包括CTLA‒4抗体、PD‒1/PD‒L1抗体以及IDO抑制剂.
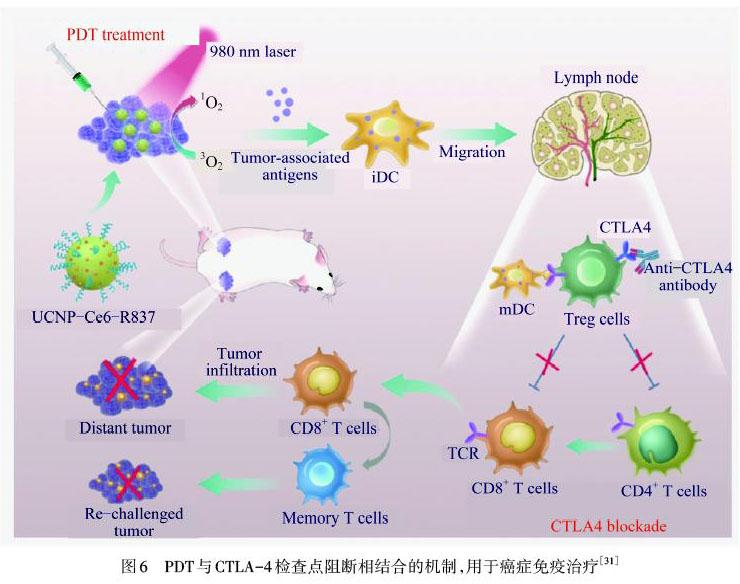
CTLA‒4是一种细胞表面跨膜受体,受T细胞受体结合诱导,并充当抗原特异性T细胞活化的负调节剂.抗CTLA‒4抗体与Treg细胞上的CTLA‒4受体结合可逃避该免疫检查点,从而减少T细胞激活的免疫抑制作用.JIN等[30]合成的棒状的金/银(Au/Ag)纳米粒子在1 064 nm光照射下诱导肿瘤ICD,特别是与CTLA‒4抗体组合使用时,Au/Ag纳米棒显示出与CTLA‒4抗体的协同作用,可有效抑制远处的肿瘤生长.XU等[31]合成的载有光敏剂Ce6和Tolllike‒受体7(TLR‒7)的免疫佐剂,涂在聚合物包被的上转换纳米粒子(UCNP‒Ce6‒R837)上,在980 nm NIR激光激发下,UCNP‒Ce6‒R837纳米颗粒可能触发对小鼠生长的原发肿瘤的光动力破坏.如图6所示,UCNP‒Ce6‒R837纳米颗粒在光照下释放的肿瘤相关抗原能触发抗肿瘤免疫反应,通过抗CTLA‒4检查点抑制剂进一步促进该反应,从而有效消除原位和远位肿瘤细胞.
PD‒1是表达在T细胞表面的另一种重要的免疫抑制跨膜蛋白,其最初是从凋亡的小鼠T细胞杂交瘤克降出来的.PD‒1有2个配体:PD‒L1和PD‒L2.PD‒L1比PD‒L2表达更为广泛,主要在造血和非造血细胞(包括上皮细胞、血管上皮细胞、基质细胞等)中,由促炎症细胞因子诱导表达.在肿瘤的微环境中, 肿瘤细胞能够表达PD‒L1或者PD‒L2,这2个配体与PD‒1的结合会抑制T细胞的激活和细胞因子的生成,因此PD‒1通路的抑制会加强自身免疫.已经有研究选择PD‒1抗体与PD‒1结合,或者PD‒L1抗体与PD‒L1结合来干扰PD‒1和PD‒L1的结合.ZHANG等[32]设计的蛋白质法尼基转移酶(PFTase)驱动的PM靶向的嵌合肽纳米粒子(PCPK)与PD‒1抗体组合后表现出高效的抗肿瘤潜力. 而YU等[33]合成的透明质酸酶响应的尺寸可调的仿生纳米颗粒(mCAuNCs@HA),其中负载了光敏性脱镁叶绿酸A和ROS响应的紫杉醇二聚体前药(PXTK),最后加载抗PD‒L1肽(dPPA)以减轻肿瘤的免疫抑制环境,并增强由PDT诱导的ICD激活的细胞毒性T淋巴细胞功能.负载dPPA后,肿瘤抑制率提高到了84.2%.这表明了PDT和PD‒L1抑制剂均可诱导增强免疫反应,并且通过联合治疗进一步促进了特异性反应.
吲哚胺2,3双加氧酶(IDO)是一种具有免疫抑制作用的限制酶,通过催化色氨酸降解为犬尿氨酸发挥免疫逃逸.具体过程为IDO通过消耗色氨酸来阻断T淋巴细胞的增殖,而降解产生的犬尿氨酸可直接抑制效应T细胞的功能,并促进调节性T细胞(tregs)分化,通过多种途径发挥免疫抑制作用,从而保护癌细胞免受免疫系统的识别和攻击.现在已经有很多研究把IDO抑制剂作为增强肿瘤免疫的一种方法.XING等[18]设计的一种氟化聚合物纳米粒子,同时装载光敏剂Ce6和IDO抑制剂(NLG919).利用氟化聚合物的高氧溶解能力来缓解肿瘤微环境中的缺氧情况,从而激发强大的PDT功效.PDT后从坏死细胞释放的肿瘤相关抗原将在NLG919的帮助下产生增强的免疫反应,从而阻断IDO的抑制功能,同时提高T细胞的活性,进而可以通过全身免疫力消除严重的肿瘤.最终在缺氧缓解诱导的PDT和IDO抑制剂的联合作用下,获得优异的抗肿瘤效果.
3.4 PDT联合免疫佐剂诱发ICD
尽管PDT联合其他疗法的多模式治疗可有效地激活免疫系统,但为了在癌症免疫治疗中获得强大而持久的适应性抗肿瘤功效,合适的佐剂既能达到抗原递送又能增强免疫功能.免疫佐剂又称免疫调节剂或免疫增强剂,起源于拉丁文“Adjuvare”,是辅助或者增强的意思.佐剂是疫苗的一种添加剂,当它先于抗原或与抗原混合注入机体后,能够增强机体对抗原的免疫应答或者改变免疫反应的类型,属于非特异性的免疫增强剂,而其本身无抗原性.理想的佐剂不仅能够增强免疫反应,还能使机体获得最佳的保护性免疫,多种免疫佐剂已与PDT结合使用,例如卡介苗杆菌(BCG)、分枝杆菌细胞壁提取物(MCWE)[34]以及裂褶菌多糖(SPG)[35].用SPG治疗带有鳞状细胞癌(SCCVII)的小鼠模型中,体外的菌落形成试验表明,SPG预处理组的肿瘤细胞杀伤力更大.除此之外,最近胞嘧啶‒磷酸‒鸟嘌呤(CpG)已被证明是针对实体癌的优秀免疫治疗剂和免疫佐剂.CAI等[36]设计的基于MOF的纳米颗粒,将CpG佐剂负载在纳米框架中,用于提高PDT后的宿主抗癌反应.如在DC成熟实验中,治疗组中DC成熟的百分比(70.68%)顯着高于对照组(PCN‒ACF@HA+Laser)的(58.65%),可见CpG免疫佐剂增强了在肿瘤部位进行PDT后的抗肿瘤免疫反应.
4 总结与展望
PDT诱导的ICD由于其在免疫治疗中的前景而备受关注,文章总结了PDT诱导的ICD的不同策略,包括从缓解缺氧以及靶向性提高PDT效果的单一模式治疗、PDT联合其他疗法的多模式治疗、 PDT联合免疫检查点抑制剂以及免疫佐剂提高ICD效应.尽管文章中把PDT诱导的免疫原性细胞死亡的研究方法分成几个不同板块来讨论,以便于为后续的研究人员提供癌症治疗的参考,但是研究者往往倾向于把多种方法联合来引起更强的免疫应答.如:有的研究者将PDT和PTT进行联合治疗来诱导有效的免疫原性细胞死亡,最后再联合PD‒1检查点抑制剂治疗放大免疫功效,最终达到令人满意的治疗效果.
尽管PDT这种治疗方式具有副作用小,肿瘤复发性以及转移性概率低等优点,但是由于PDT本身穿透深度的局限性,限制了光动力学对深度肿瘤的治疗效果.随着科研技术的发展及科研者的努力,PDT诱导的ICD治疗将有很好的临床应用前景.
参考文献:
[1] ALZEIBAK R, MISHCHENKO T A, SHILYAGINA N Y, et al. Targeting immunogenic cancer cell death by photodynamic therapy: past, present and future [J]. Journal for Immuno Therapy of Cancer,2021,9:e001926.
[2] SWEENEY E E, CANO-MEJIA J, FERNANDES R. Photothermal therapy generates a thermal window of immunogenic cell death in neuroblastoma [J]. Small,2018,14(20):e1800678.
[3] SLOVAK R, LUDWIG J M, GETTINGER S N, et al. Immuno-thermal ablations-boosting the anticancer immune response [J]. Journal Immunotherapy Cancer,2017,5(1):78?92.
[4] YANG N, XIAO W, SONG X, et al. Recent advances in tumor microenvironment hydrogen peroxide-responsive materials for cancer photodynamic therapy [J]. Nano-Micro Letters,2020,12(1):15‒41.
[5] LI W, ZHENG C, PAN Z, et al.Smart hyaluronidase-actived theranostic micelles for dual-modal imaging guided photodynamic therapy [J]. Biomaterials,2016,101:10‒19.
[6] GALLUZZI L, KEPP O, KROEMER G. Enlightening the impact of immunogenic cell death in photodynamic cancer therapy [J]. The European Molecular Biology Organization Journal,2012,31(5):1055‒1057.
[7] GARG A D, NOWIS D, GOLAB J, et al. Photodynamic therapy: illuminating the road from cell death towards anti-tumour immunity [J]. Apoptosis,2010,15(9):1050‒1071.
[8] PLAETZER K, KRAMMER B, BERLANDA J, et al. Photophysics and photochemistry of photodynamic therapy: fundamental aspects [J]. Lasers in Medical Science,2009,24(2):259‒268.
[9] GREER A. Christopher foote’s discovery of the role of singlet oxygen [1O2(1Δg)] in photosensitized oxidation reactions [J]. Accounts of Chemical Research,2006,39(11):797‒804.
[10] KORBELIK M. PDT-associated host response and its role in the therapy outcome [J]. Lasers in Surgery and Medicine, 2006,38(5):500‒508.
[11] CASTANO A P, MROZ P, HAMBLIN M R. Photodynamic therapy and anti-tumour immunity [J]. Nature Reviews Cancer,2006,6(7):535‒545.
[12] CASARES N, PEQUIGNOT M O, TESNIERE A, et al. Caspase-dependent immunogenicity of doxorubicin-induced tumor cell death [J]. Journal of Experimental Medicine,2005,202(12):1691‒1701.
[13] CHAPUT N, DE BOTTON S, OBEID M, et al. Molecular determinants of immunogenic cell death: surface exposure of calreticulin makes the difference [J]. Journal of Molecular Medicine (Berlin, Germany),2007,85(10):1069‒1076.
[14] XIE Y, YU N, CHEN Y, et al. HMGB1 regulates p-glycoprotein expression in status epilepticus rat brains via the RAGE/NF-κB signaling pathway [J]. Molecular Medicine Reports,2017,16(2):1691‒1700.
[15] VACCHELLI E, GALLUZZI L, FRIDMAN W H, et al. Trial watch: chemotherapy with immunogenic cell death inducers [J]. Oncoimmunology,2012,1(2):179‒188.
[16] CASTANO A P, MROZ P, HAMBLIN M R. Photodynamic therapy and anti-tumour immunity [J]. Nature Reviews Cancer,2006,6(7):535?545.
[17] CASTANO A P, MROZ P, WU M X, et al. Photodynamic therapy plus low-dose cyclophosphamide generates antitumor immunity in a mouse model [J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(14):5495‒5500.
[18] XING L, GONG J H, WANG Y, et al. Hypoxia alleviation-triggered enhanced photodynamic therapy in combination with IDO inhibitor for preferable cancer therapy [J]. Biomaterials,2019,206:170‒182.
[19] LIU L H, ZHANG Y H, QIU W X, et al. Dual-stage light amplified photodynamic therapy against hypoxic tumor based on an O2 self-sufficient nanoplatform [J]. Small,2017,13(37):1701621.
[20] ZHANG Y, WANG F, LIU C, et al. Nanozyme decorated metal-organic frameworks for enhanced photodynamic therapy [J]. ACS Nano,2018,12(1):651‒661.
[21] LIU T, ZHANG N, WANG Z, et al. Endogenous catalytic generation of O2 bubbles for in situ ultrasound-guided high intensity focused ultrasound ablation [J]. ACS Nano,2017,11(9):9093‒9102.
[22] WANG T T, ZHANG H, HAN Y, et al. Light-enhanced O2-evolving nanoparticles boost photodynamic therapy to elicit anti-tumor immunity [J]. ACS Applied Materials and Interfaces,2019,11(18):16367‒16379.
[23] MAI X, ZHANG Y, FAN H, et al. Integration of immunogenic activation and immunosuppressive reversion using mitochondrial-respiration-inhibited platelet-mimicking nanoparticles [J]. Biomaterials,2020,232:119699‒119712.
[24] DENG H, ZHOU Z, YANG W, et al. Endoplasmic reticulum targeting to amplify immunogenic cell death for cancer immunotherapy [J]. Nano Letters,2020,20(3):1928‒1933.
[25] ZHANG X, TANG J, LI C, et al. A targeting black phosphorus nanoparticle based immune cells nano-regulator for photodynamic/photothermal and photo-immunotherapy [J]. Bioactive Materials,2021,6(2):472‒489.
[26] LIU H, YANG Q, GUO W, et al. CoWO4-x‒based nanoplatform for multimode imaging and enhanced photothermal/photodynamic therapy [J]. Chemical Engineering Journal,2020,385:123979‒123990.
[27] SHAO Y, LIU B, DI Z, et al. Engineering of upconverted metal-organic frameworks for near-infrared light-triggered combinational photodynamic/chemo-/immunotherapy against hypoxic tumors [J]. Journal of the American Chemical Society,2020,142(8):3939‒3946.
[28] WU D, FAN Y, YAN H, et al. Oxidation-sensitive polymeric nanocarrier-mediated cascade PDT chemotherapy for synergistic cancer therapy and potentiated checkpoint blockade immunotherapy [J]. Chemical Engineering Journal,2021,404:126481‒126492.
[29] RIBAS A, WOLCHOK J D. Cancer immunotherapy using checkpoint blockade [J]. Science,2018,359(6382):1350‒1355.
[30] JIN L, SHEN S, HUANG Y, et al. Corn-like Au/Ag nanorod-mediated NIR-Ⅱ photothermal/photodynamic therapy potentiates immune checkpoint antibody efficacy by reprogramming the cold tumor microenvironment [J]. Biomaterials,2021,268:120582‒120591.
[31] XU J, XU L, WANG C, et al. Near-infrared-triggered photodynamic therapy with multitasking upconversion nanoparticles in combination with checkpoint blockade for immunotherapy of colorectal cancer [J]. ACS Nano,2017,11(5):4463‒4474.
[32] ZHANG C, GAO F, WU W, et al. Enzyme-driven membrane-targeted chimeric peptide for enhanced tumor photodynamic immunotherapy [J]. ACS Nano,2019,13(10):11249‒11262.
[33] YU W, HE X, YANG Z, et al. Sequentially responsive biomimetic nanoparticles with optimal size in combination with checkpoint blockade for cascade synergetic treatment of breast cancer and lung metastasis [J]. Biomaterials,2019,217:119309?119323.
[34] KWITNIEWSKI M, JUZENIENE A, GLOSNICKA R, et al. Immunotherapy: a way to improve the therapeutic outcome of photodynamic therapy? [J]. Photochemical and Photobiological Sciences,2008,7(9):1011‒1017.
[35] LI X S, HODE T, GUERRA M C, et al. Combined effects of selective photothermal therapy and immunoadjuvant against stage iv breast cancer [J]. Journal of Innovative Optical Health Sciences,2010,3(4):279‒284.
[36] CAI Z, XIN F, WEI Z, et al. Photodynamic therapy combined with antihypoxic signaling and CpG adjuvant as an in situ tumor vaccine based on metal-organic framework nanoparticles to boost cancer immunotherapy [J]. Advanced Healthcare Materials,2020,9(1):e1900996.
(责任编辑:郁慧,包震宇)
