间歇性低氧对膀胱逼尿肌细胞凋亡的影响及益智仁调节机制*
2021-01-06苏苗赏薛思忱任锡凯唐祝亲徐漫欢
苏苗赏,薛思忱,徐 莉,任锡凯,黄 楠,唐祝亲,徐漫欢
(1温州医科大学附属第二医院育英儿童医院、第二临床医学院,浙江温州 325027;2温州医科大学检验医学院、生命科学学院,浙江温州 325035)
临床流行病学调查显示,阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syn⁃drome,OSAHS)患儿夜遗尿发病率明显增高,尤其是女性OSAHS 患儿,夜遗尿发生率增高达4倍以上,严重影响患儿的身心健康[1-2]。既往研究已证实,间歇性低氧(intermittent hypoxia,IH)是OSAHS 的主要病理生理学机制,OSAHS 可导致全身多系统功能损害[3]。IH 可导致肾损害和夜间遗尿,前期的研究已经成功建立OSAHS 大鼠的遗尿模型[4]。儿茶酚雌激素在氧化应激作用下,通过膀胱神经受体信号转导,可诱发OSAHS 大鼠的遗尿反射[4]。中药益智仁(Al⁃piniae oxyphyllaeFructus,AOF)在OSAHS 大鼠的氧化应激反应中起重要调节作用[5],但其作用机制尚不清楚。为进一步观察OSAHS 对逼尿肌细胞凋亡的影响及AOF 的调节机制,本研究通过建立模拟OSAHS 的逼尿肌细胞模型,观察IH 环境对人逼尿肌细胞凋亡及其钙离子通道的影响,探讨不同浓度AOF对逼尿肌细胞钙离子通道的调节机制。
材料和方法
1 主要试剂和仪器
特异性抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单抗(bs-10169R,Bioss)和即用型DA⁃PI 染液(KGA215-50,江苏凯基生物技术股份有限公司);Annexin V-FITC/PI Apoptosis Kit(AP101-100-kit,杭州联科生物技术股份有限公司);P2X3受体拮抗剂(Proteintech);β3受体拮抗剂(Abcam);M3受体拮抗剂(Abcam);益智仁提取物(AOF,澳门万生堂药材公司);取不同剂量AOF 溶解于PBS 缓冲液,调节至干预浓度为10 mg/L、50 mg/L 和100 mg/L 备用。PBS 缓冲液:秤取NaCl 8.0 g,KCl 0.2 g,Na2HPO4·2H2O 2.85 g 和KH2PO40.24 g,加双蒸水900 mL 溶解,调pH 值至7.4,量筒定容至I L,高温高压灭菌后使用;0.5% Triton X-100:取50 μL Triton X-100 加入10 mL PBS 中,然后放入37℃水浴锅溶解。使用仪器包括:热恒温培养箱(DHP-9054,山东博科生物产业有限公司);药品冷藏柜(BYC-310,山东博科生物产业有限公司);电热鼓风干燥箱(DHG-9070A,上海一恒科学仪器有限公司);荧光显微镜(CKX53,OLYM⁃PUS,奥林巴斯中国有限公司);NovoCyte™流式细胞仪(艾森生物杭州有限公司,型号:NovoCyte 2060R)。
2 细胞培养和分组干预
2.1 细胞培养 人膀胱逼尿肌细胞株购自上海中科院细胞生物研究所。细胞株复苏后接种至底面积为25 cm2的培养瓶,加入含10%胎牛血清、1×105U/L青霉素和1×105U/L 链霉素的RPMI-1640 培养液,置于5% CO2、37℃培养箱内生长。每隔2 d 传代1 次。取传代2~3 代后稳定对数期生长细胞,消化后吹打成单细胞悬液,调整细胞浓度为3×109/L,按每孔2 mL 接种于6孔板,48 h后用于实验,实验前更换无血清培养液。光镜下观察各组细胞形态、密度变化情况。细胞图像通过显微镜(×200)摄取。每组独立的实验均采集超过30个区域的细胞。
2.2 分组干预 将逼尿肌细胞随机分为6 组,每组设8 个复孔,共进行8 次独立实验:P2X3受体拮抗剂+IH 组(A 组)、M3受体拮抗剂+IH 组(B 组)、β3受体拮抗剂+IH 组(C 组)、AOF+IH 组(D 组)、生理盐水+IH对照组[阴性对照(negative control,NC)组]和空气模拟对照(AC)组。根据前期预实验结果,P2X3、M3和β3受体拮抗剂的最佳干预浓度均为100 nmol/L,AOF干预的最佳干预浓度为50 mg/L。
3 方法
3.1 IH 细胞模型 通过预实验确定IH 模式为5%O260 min 和20% O230 min,6 个循环。IH 环境下细胞造模参考蔡晓红等[4]的方法:(1)氧舱主要由以下部分组成:实验舱、空气模拟对照舱、PLC 及电脑控制系统、氧气管道、氮气管道、二氧化碳管道、空气输注管道、气体减压阀、气体流量控制阀和溶解氧电极。实验舱侧壁设有氧气、氮气和二氧化碳进气单向阀门,空气模拟对照舱设有空气和二氧化碳单向阀门,均由程序控制电磁阀开关,舱内压力始终保持常压。通过PLC 及电脑控制系统编程不同程序,调控舱内氧气浓度,模拟不同的IH 环境。利用氧气和二氧化碳浓度检测仪检测实验箱和对比箱中的氧气和二氧化碳浓度。采用溶解氧电极监测细胞层面上方1 mm 处培养液中溶解氧浓度。(2)间歇性低氧模式设定:维持实验舱和对照舱温度为37℃,CO2含量为5%。6 孔板每孔添加3 mL 培养液,将舱内氧浓度从20%迅速降至5%,监测培养液中氧分压变化,绘制氧分压-时间曲线。根据曲线特点,当培养液中氧分压降至(56±4)mmHg 时维持(10~40)s,统计所需时间。再将舱内氧浓度从5%升至20%,记录培养液中氧分压达到正常所需时间。根据记录的低氧和复氧时间,结合人体OSAHS 疾病特点,设定该模型间歇性低氧的循环频率和时间。
3.2 免疫荧光法检测α-SMA 表达 免疫组化荧光染色光镜下观察逼尿肌细胞形态及α-SMA 表达情况。实验流程如下:(1)细胞的固定:在培养板中将已爬好细胞的培养皿用PBS浸洗3次,每次3 min;用4%的多聚甲醛固定15 min,PBS浸洗培养皿3次,每次3 min;(2)细胞的通透、打孔:0.5% Triton X-100(PBS配制)室温通透20 min;(3)封闭:PBS浸洗培养皿3 次,每次5 min,移液器吸干PBS,在培养皿内滴加5%BSA,37°C 封闭30 min;(4)免疫反应:加Ⅰ抗移液器吸掉封闭液,不洗,培养皿内滴加足够量的稀释好的Ⅰ抗(α-SMA,1∶200),37℃孵育3 h;(5)加荧光Ⅱ抗:PBS 浸洗培养皿3 次,每次3 min,移液器吸干培养皿内多余液体后滴加稀释好的荧光Ⅱ抗CY3(1∶200),37℃孵育30 min,PBS 浸洗培养皿3 次,每次3 min;注意:从加荧光Ⅱ抗起,后面所有操作步骤都尽量在较暗处进行;(6)复染和封片:滴加DAPI避光孵育5 min,对标本进行染核,用PBS 冲洗多余的DAPI;用50%甘油封闭培养皿。然后在荧光显微镜下观察采集图像。每张切片随机选择5 个视野(×200),相同条件下拍摄,利用Image-Pro Plus 5.0软件测定阳性部位的吸光度值(IA)和面积(mean ar⁃ea),通过计算得到的平均吸光度值(MA)。
3.3 流式细胞术检测细胞凋亡 收集(1~3)×106个细胞,加1 mL PBS,200×g离心3 min,洗两遍;用双蒸水将5×Binding Buffer 稀释为1×Binding Buffer;取300 μL 预冷的1×Binding Buffer 重悬细胞;每管各加入3 μL Annexin V-FITC 和5 μL PI-PE;轻微混匀后,室温避光孵育10 min;再向每管中加入200 μL 预冷的1×Binding Buffer;混匀后上流式仪检测。
3.4 膜片钳法检测钙离子通道 以微弱电流信号测量为基础,利用玻璃微电极与细胞膜高阻封接技术,测量钙离子通道产生的电流,其值达到pA 量级。实验分为3 组,选择人膀胱逼尿肌细胞密度在50%~60%时,根据前期预实验结果,加入不同浓度的AOF,分别为10 mg/L、50 mg/L 和100 mg/L。AOF 孵育24 h 后记录离子通道。每组记录10 个膀胱逼尿肌细胞,细胞膜钳制电压为-80 mV,通过去极化脉冲使膜去极至−90 mV,时程为2 ms,通过积分计算得到单个膀胱逼尿肌细胞的膜电容。膜片钳数据的采集及分析由计算机软件(pCLAMP 6.02,Axon),经数/模转换成电压信号,控制细胞膜电位。将记录到的细胞膜电流信号通过500 M 探头,输入膜片钳放大器(Axonpatch-200B)经膜片钳放大器的电流-电压转换后,输入到模/数转换卡,存入硬盘以便进一步分析处理,其采样频率为1 kHz,低通滤波器滤波频率为3 kHz。
4 统计学处理
各组正态计量资料数据,以均数±标准差(Mean±SD)表示,用SPSS 21.0 统计软件处理,多组间的资料比较采用单因素方差分析,组与组之间的两两比较,若方差齐则用LSD 检验,方差不齐则用Dunnett´s T3 检验。各组计数资料的比较采用χ2检验。以P<0.05为差异有统计学意义。
结 果
1 各组细胞密度及形态学改变
如图1、2 显示,与AC 组细胞比较,NC 组细胞密度增高、反应活跃,部分细胞出现突起、变圆,细胞边界模糊;A 组和D 组细胞密度较NC 组有显著减低;B组和C 组的细胞未见明显异常反应。进一步用计数板法比较各组人逼尿肌细胞密度。结果如表1 显示,与AC 组比较;NC 组的细胞密度显著增高(P<0.05);而A 组、D 组(与NC 组比较,细胞密度有不同程度降低(P<0.05)。
2 各组细胞α-SMA蛋白表达情况
如图2、表1 显示,与AC 组细胞比较;NC 组细胞α-SMA蛋白表达的MA显著增高(F=3.25,P<0.05);而A 组和D 组细胞分别与NC 组细胞比较,其α-SMA蛋白表达的MA均有显著降低(P<0.05)。
3 各组细胞凋亡率的比较

Figure 1.Cell density and morphological changes of human bladder detrusor cells in each group under light microscope.Scale bar=100 μm.图1 普通光镜下各组人膀胱逼尿肌细胞学鉴定
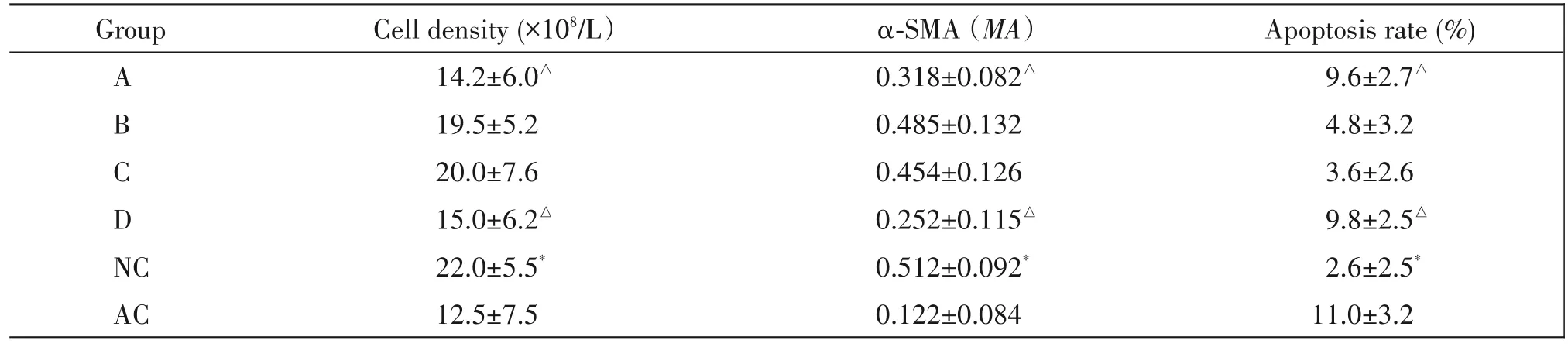
表1 各组人膀胱逼尿肌细胞密度及凋亡情况Table 1.Cell density and apoptosis rates of human bladder detrusor cells in each group under light microscope(Mean±SD. n=8)
结果如表1、图3 显示,与AC 组细胞比较,NC 组细胞凋亡率显著减低(P<0.05);A 组与D 组的细胞凋亡率分别与NC比较有显著增高(P<0.05)。
4 各组细胞钙离子通道表达改变
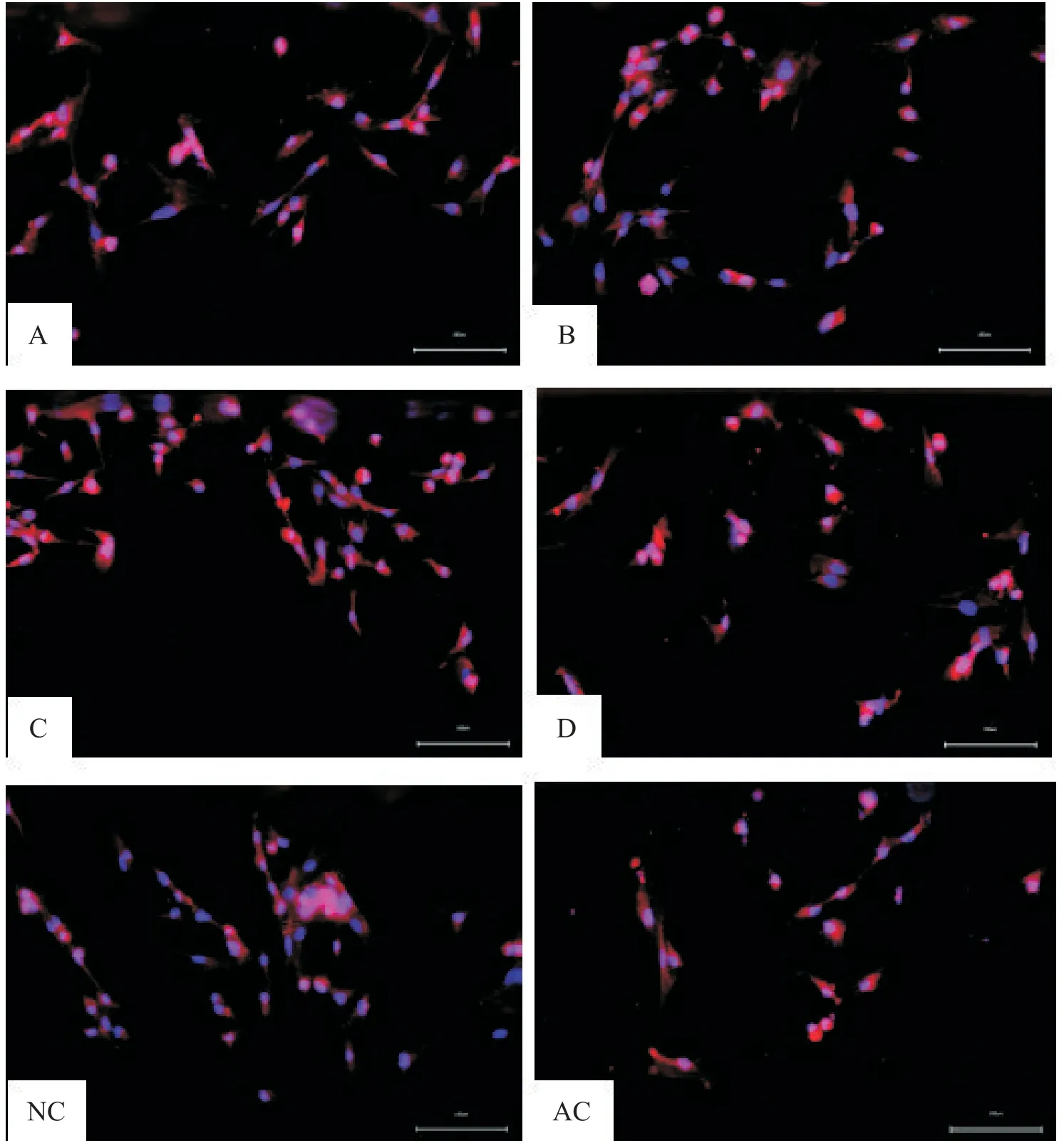
Figure 2.Cytological identification of human bladder detrusor cells in each group under immunofluorescence staining light micro⁃scope.Scale bar=100 μm.图2 免疫荧光染色光镜下各组人膀胱逼尿肌细胞学鉴定
记录AC 组和IH 干预组逼尿肌细胞孵育24 h 后的钙通道电流,保持电压控制在−80 mV,指令电压为−80 mV~+80 mV,阶跃命令为+10 mV,持续时间200 ms,频率1 Hz,得到各个测试电压的钙通道电流值,绘制电流-电压关系曲线。AC组细胞钙通道在去极化至大约−20 mV 时被激活,最大内向峰值电流在+20 mV~+30 mV[(268.00±25.56)pA];IH 干预组细胞内向电流显著减低[(163.83±31.40)pA],表明IH 干预可抑制钙离子内流,见图4。记录经不同浓度(10 mg/L、50 mg/L 和100 mg/L)AOF 干预孵育24 h 后人逼尿肌细胞的钙通道电流,在10 个细胞有8 个可记录出内向钙电流。用测试电位在+20 mV 时的钙通道电流值为峰值,并以细胞膜电容标化。结果表明,100 mg/L 和50 mg/L AOF 干预组钙离子通道电流与IH 对照组比较均显著增高(P<0.05),而小剂量组(10 mg/L)干预与IH对照组比较无显著增高(P>0.05),见图5。
讨 论
既往临床研究已证实OSAHS 患儿可导致夜间遗尿,OSAHS 对肾脏的影响主要表现为夜间多尿、肾功能改变、蛋白尿和肾小管功能受损等[6-10]。本研究在前期动物模型[3]基础上建立OSAHS 诱导膀胱逼尿肌细胞功能改变的IH 细胞模型,探讨IH 对膀胱逼尿肌细胞凋亡的影响及其调节机制。研究结果显示,IH 可通过P2X3神经受体调节逼尿肌细胞增殖和凋亡,中、高剂量AOF 可改变钙离子通道并对IH 诱导的细胞损害起保护作用。
关于IH 细胞模型的建立:前期研究已经应用人肺腺癌细胞A549 建立一种改良的IH 细胞模型[4],并验证:5%O260 min 和20%O230 min 的IH 和复氧细胞模式,能模拟OSAHS 的病理生理过程,是研究OSAHS较理想的细胞模型[6]。本研究在前期IH细胞模型基础上改进并建立一种IH 环境下的人膀胱逼尿肌细胞模型,旨在探讨OSAHS 诱导遗尿的作用及AOF的调节机制。
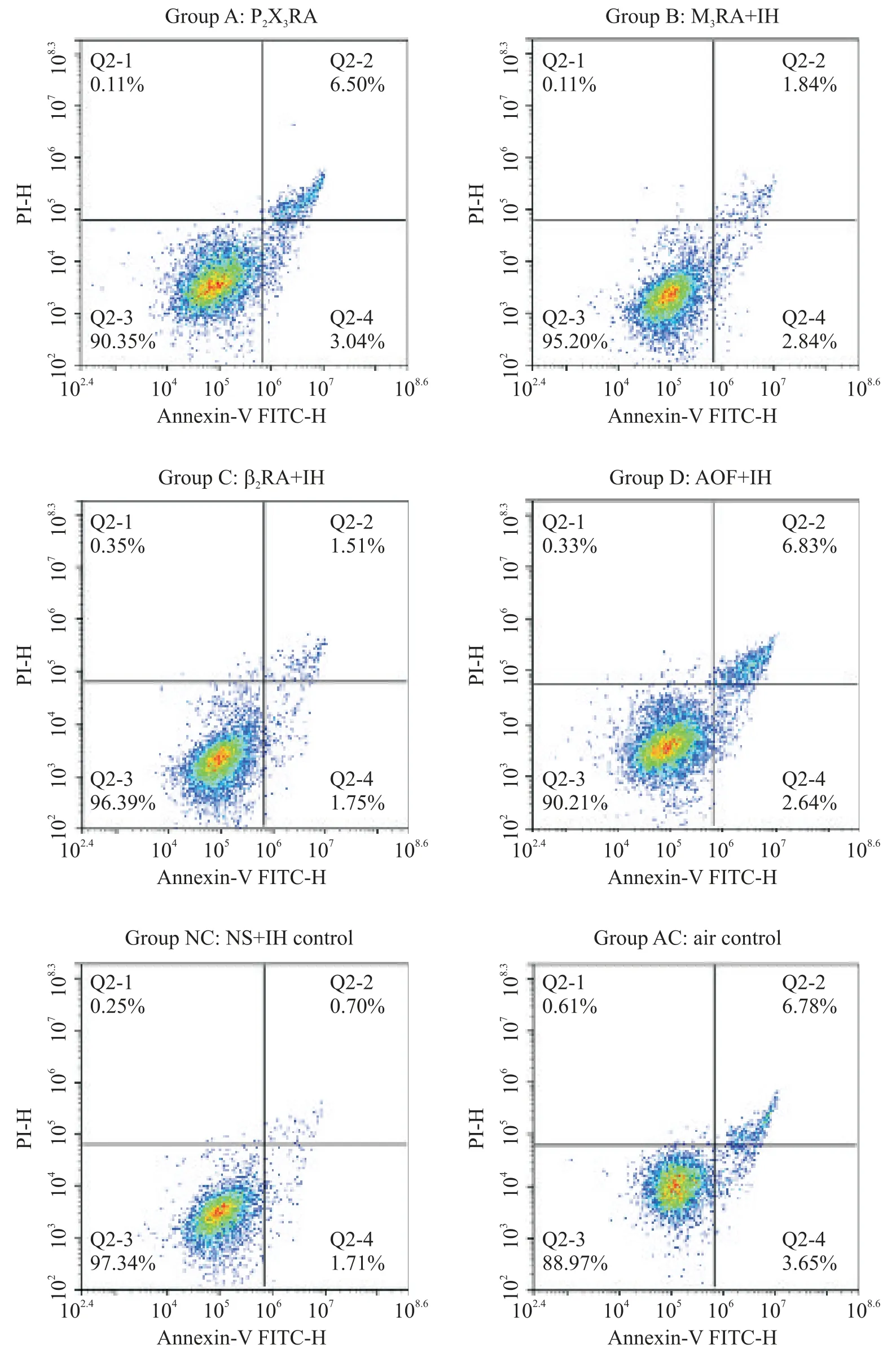
Figure 3.Comparison of bladder detrusor cell apoptosis rates in each group(n=8).图3 各组人膀胱逼尿肌细胞凋亡率的比较
本研究通过普通光镜和荧光染色后观察膀胱逼尿肌细胞的密度及形态改变,结果显示与空气对照组比较,IH 组的细胞密度增高、反应活跃,部分细胞出现突起、变圆,细胞边界模糊,提示IH 可改变人膀胱逼尿肌细胞的结构形态和生理功能;通过阻断P2X3膀胱受体信号和AOF干预后可显著缓解IH对人膀胱逼尿肌的病理损害。免疫荧光检测细胞α-SMA表达情况,结果显示,与空气对照组比较,IH 组的细胞MA数值显著增高,提示IH 可促进人膀胱逼尿肌细胞增殖,这可能是IH 引起膀胱不稳定导致夜遗尿的重要原因;通过阻断P2X3膀胱受体信号和AOF 干预后可显著缓解逼尿肌的过度增殖;为进一步观察IH对逼尿肌细胞增殖和凋亡的作用机制及益智仁的调节作用,本研究通过流式细胞术检测各组细胞的凋亡率,结果显示,IH组膀胱逼尿肌细胞的凋亡率显著减低;通过阻断P2X3膀胱受体信号和AOF 干预后,逼尿肌细胞的凋亡率均有显著增高。这提示IH 主要是通过P2X3膀胱受体信号转导发挥作用;而AOF对膀胱细胞损害具有一定保护作用。
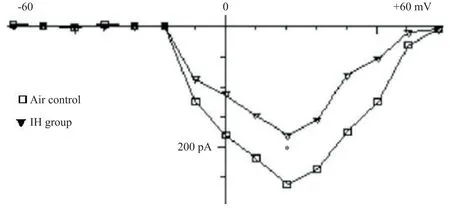
Figure 4.I/V curve of calcium channel current and voltage in human bladder detrusor in air control group and IH intervention group.Mean±SD. n=8.*P<0.05 vs air control group.图4 人膀胱逼尿肌空气对照组和IH干预组钙通道电流电压I/V曲线图
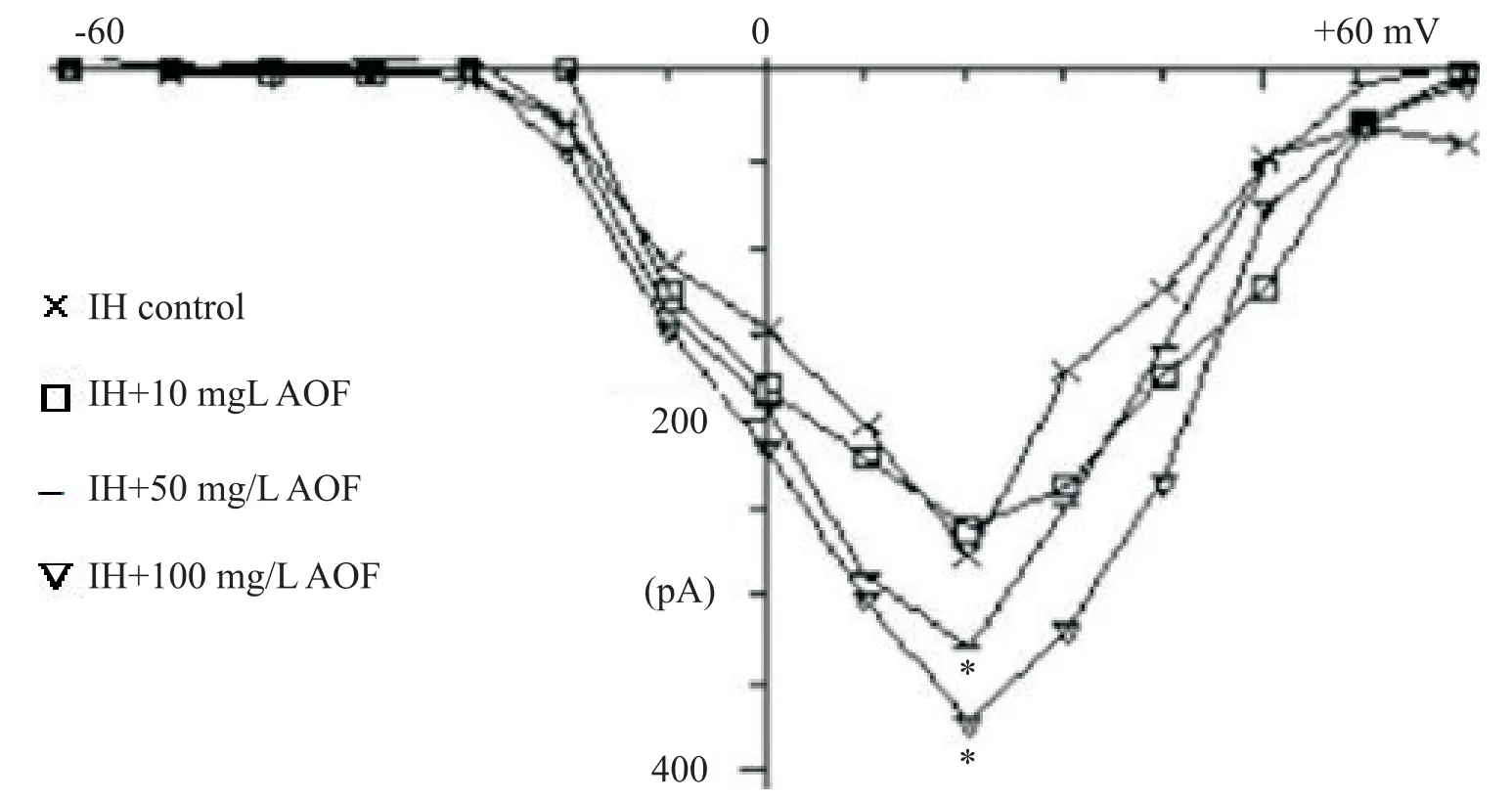
Figure 5.Effect of different concentrations of AOF on calcium channels in human bladder detrusor cells.Mean±SD. n=8.*P<0.05 vs IH control group.图5 不同浓度AOF对人膀胱逼尿肌钙离子通道的调节作用
既往研究表明[11-12],P2X3在膀胱上皮和逼尿肌上均有表达,P2X3mRNA 介导大多数中枢和外周感觉神经元生理性或机械性刺激,并且睡眠状态时尿感敏感度与膀胱不稳定相关[13-15]。钙离子能使肌肉舒张,低氧导致钙离子内流受阻可导致肌肉不自主收缩,推测IH 神经受体P2X3对钙离子通道的影响可能是引发遗尿的关键因素,而Ca2+通道与膀胱不稳定相关机制目前研究甚少。本研究通过膜片钳检测结果显示,与空气对照组细胞比较,IH组细胞钙离子通道表达显著减低;提示IH 可抑制钙离子内流减少膀胱细胞凋亡。为进一步揭示AOF调节逼尿肌细胞增殖和凋亡的作用机制,本研究用不同浓度AOF 对IH 逼尿肌细胞模型进行干预试验。结果表明,大剂量(100 mg/L)和中剂量(50 mg/L)细胞钙离子通道电流与IH 组比较均有显著增高,而小剂量AOF 干预组细胞与IH 组比较无显著变化,提示AOF 对膀胱不稳定的保护作用具有一定的剂量-效应关系。AOF 是祖国传统中药材,来源于姜科植物益智的干燥成熟果实。《本草备要》中记载AOF能燥脾肾,补心肾。温中进食可缩小便,肾与膀胱相表里,益智辛温固肾。盐水炒,同乌药等分,酒煮,山药糊丸,盐汤下,名缩泉丸。因此AOF 醇提物具有稳定膀胱和调节内分泌功能[16-17]。
