花青素通过促进线粒体融合减轻压力超负荷小鼠心脏重构*
2021-01-06曾静静徐肖肖施涵青徐光宇金其可阮永雪任芳芳谢作益
曾静静,徐肖肖,施涵青,徐光宇,金其可,阮永雪,任芳芳,谢作益,李 磊△
(1温州医科大学附属第二医院,育英儿童医院心血管内科,浙江温州 325027;2台州恩泽医疗中心集团恩泽医院,浙江台州 318050)
心力衰竭是一种由功能性或结构性的心脏疾病引起的,通常因为长期病理性应激导致心脏收缩功能和(或)舒张功能发生障碍,以一系列症状(下肢水肿、呼吸困难)和体征(肺水肿、颈静脉压升高)为特征的临床综合征[1]。心室重构是各原发病导致慢性心力衰竭的共同病理基础,表现为心肌细胞的肥大和凋亡、血管内皮细胞和血管平滑肌细胞的功能障碍以及成纤维细胞的分化和增殖[2]。主动脉缩窄(transverse aortic constriction,TAC)是慢性心室肥大最为常用的疾病模型,可用于模拟高血压或室内压增高而引起的肥厚型心肌病,在临床前药物研究、基础医学研究和生物学研究中广泛应用[3]。心脏负荷过重会通过多种机制导致心力衰竭,包括炎症、细胞凋亡与坏死、氧化应激、钙稳态改变、肾上腺素能信号传导以及线粒体功能障碍[4-5]。
近年来,发动蛋白相关蛋白(dynamin-related protein,Drp)、线粒体融合蛋白(mitofusin,Mfn)和视神经萎缩蛋白1(optic atrophy protein 1,OPA1)等的研究揭示,线粒体的形态和分布一直处于动态变化之中,线粒体通过分裂和融合过程不断改变形态,参与心衰的发展进程[6-7]。随着心力衰竭的进展,线粒体过度分裂,数量增加且体积减小,氧化磷酸化能力降低,形态与功能的紊乱进一步影响心脏重构与心力衰竭[7-8]。因此,如何改善线粒体功能将是心力衰竭治疗的潜在靶点。
从自然资源中寻找新的药物来治疗心力衰竭具有重要价值。花色素(anthocyanidins)属于生物类黄酮物质,是自然界一类广泛存在于植物中的水溶性天然色素,具有很强的抗氧化作用,可通过清除自由基和保护线粒体途径保护心脏[9]。花青素(cyani⁃din,Cyn)是浆果、地瓜和许多其他水果和蔬菜中花色素的主要成分之一,具有来源范围广、生产成本低、毒副作用小的优点,并且Cyn 在血浆中不易降解,生物利用度高[10],可以预防过氧亚硝酸盐诱导的内皮功能障碍和血管衰竭[11]。Cyn 在阿霉素诱导的心脏毒性中显示出心脏保护作用[12],但是Cyn 对压力超负荷所致的慢性心力衰竭是否起作用及其具体机制仍有待进一步研究。
本项工作通过TAC 构建压力超负荷慢性心力衰竭动物模型,研究Cyn 对心力衰竭和心脏重构的治疗作用,探讨其是否通过调节线粒体功能对心肌起保护作用,为心力衰竭的药物开发提供参考资料。
材料和方法
1 实验动物
6 周龄无特定病原体(specific pathogen free,SPF)级雄性C57BL/6J 小鼠购自北京维通利华实验动物技术有限公司,体重18~22 g。放置于温州医科大学附属第二医院科研中心SPF 级动物房中饲料喂养。自由进食、饮水,12 h 光/黑循环,室内恒温[(24±1)℃]、恒湿[(45±10)%]。实验前至少适应环境1周。
2 主要材料、药物和试剂
Cyn(≥95%)购于Sigma;异氟烷购自于瑞沃德;丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superonide dismutase,SOD)检测试剂盒购于南京建成生物工程研究所;重组人心肌肌钙蛋白I(cardiac troponin I,cTnI)ELISA 检测试剂盒购买于上海西塘生物科技有限公司;TUNEL 试剂购于Roche;抗OPA1 抗体和抗GAPDH 抗体购自Abcam;抗Drp1 抗体购自CST;麦胚凝集素(wheat germ agglutinin,WGA)购自于Invitrogen;苏木素-伊红(hematoxylineosin,HE)染色试剂盒购自北京索莱宝科技有限公司。
3 主要方法
3.1 动物实验模型建立和分组 小鼠TAC 模型构建参照本课题组之前的文献[3]。简而言之,用异氟烷麻醉小鼠,气管插管,暴露小鼠左侧胸腔,在第2~3肋水平寻找降主动脉,将7-0 尼龙缝合线下穿血管,使用27 号针头结扎降主动脉,拔出针头后直径缩小0.4 mm。将120 只6 周龄雄性C57BL/6J 小鼠随机分为4 组:假手术(sham)组(n=20)、sham+Cyn 组(n=20)、TAC组(n=40)和TAC+Cyn组(n=40)。TAC组和TAC+Cyn组采用TAC法制备压力超负荷心衰小鼠模型;sham 组和sham+Cyn 组只行主动脉穿线,不缩窄。为模拟Cyn 的自然摄入量,例如吃浆果或番薯,我们将Cyn 溶于含1% DMSO 的无菌生理盐水中,TAC造模当天记为第0天,提前5 d对sham+Cyn组和TAC+Cyn 组每日灌胃给予Cyn(5 mg/kg),连续4 周,而sham 组和TAC 组每日灌胃给予同等剂量含1%DMSO的无菌生理盐水。
3.2 超声心动图检测 在TAC 术后4 周,使用30 MHz超声探头(Vevo 1100,VisualSonics)对麻醉过的小鼠(2%异氟烷)进行超声心动图检查。在M-模式下,从乳头肌水平跟踪测量左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)和左心室舒张期后壁厚度(left ventricular posterior wall thickness in diastole,LVPWd),并计算左心室射血分数(left ventricular ejection fraction,LVEF)和左心室短轴缩短率(left ventricular fractional shortening,LVFS)。在TAC 术后1 周,使用30 MHz 超声探头对麻醉过的小鼠(2%异氟烷)进行主动脉弓部超声检测。调节超声探头部位以获取主动脉弓缩窄处脉冲多普勒图像。在主动脉弓缩窄处测得峰值血流速度(Vmax;m/s),并计算出压力梯度(PW;mmHg),以保证接受TAC术的小鼠经受等效的压力。
3.3 组织取材 TAC 术后4 周,记录小鼠体重。异氟烷麻醉后,取小鼠下腔静脉血3 mL,4℃、865.3×g离心15 min,分离血浆,150 μL每管,−80℃保存。通过颈椎脱臼对小鼠实施安乐死,取出心脏,挤压排出血液,置于滤纸上吸干液体,称量心脏重量。分离肺,称重并比较组间的心重/体重比(heart weight/body weight,HW/BW;mg/g)和肺重/体重比(lung weight/body weight,LW/BW;mg/g)。部分心脏存于4%多聚甲醛中进行石蜡包埋,部分心脏置于OCT 包埋剂中用于制作冰冻切片,部分心脏存于液氮中用于后续检测。
3.4 透射电子显微镜观察心肌线粒体形态 异氟烷麻醉小鼠后,迅速取出心脏,分离离出左心室并切下约1 mm×1 mm×2 mm 置于预冷的6%戊二醛(pH 7.3)中1 h。4℃冰箱放置24 h 以上,PBS 洗涤12 h,含1%四氧化锇的预冷乙酸纤维素1 h,并用磷钨酸染色10 min。用Ciba 502 包埋组织,35℃下聚合12 h,45℃下聚合8 h,60℃下聚合12 h。Porter-Blum 超薄切片机将组织切成1 mm 切片,甲苯胺蓝染色后置于碳涂布的200 目网格上,用TALOS F200S 透射电子显微镜(Thermo Fisher)在200 kV 下检测样品。使用Image-Pro Plus 6.0软件分析线粒体数目及面积。
3.5 血浆cTnI 的测定 按照说明使用ELISA 试剂盒测量小鼠血浆中的cTnI水平。
3.6 心肌中的氧化应激检测 进行二氢乙啶(dihy⁃droethidium,DHE)染色,用于检测心肌中积累的活性氧(reactive oxygen species,ROS)。将包埋于OCT包埋剂中的心脏切成约5 μm 厚的切片,滴加DHE(5 μmol/L)在37℃的培养箱中孵育30 min,然后用PBS 洗涤5 min 以去除未结合的染料。将冻存的心脏组织匀浆,根据试剂盒说明书,检测小鼠心脏中的MDA水平和SOD活性。
3.7 HE 染色 取小鼠心脏组织,常规4%多聚甲醛固定,二甲苯透明、脱水,浸蜡、包埋,以5 μm 为厚度进行切片。选取切片,常规烤片、脱蜡,复水。苏木素染色液染色7 min,浸自来水中冲洗去多余的染色液,1%盐酸乙醇分化3 s,自来水中反蓝1 min,伊红染色液染色2 min,浸自来水中冲洗去多余的染色液。再脱水、透明、封片、镜下观察。ECLIPSE Ti 显微镜(Nikon)下观察拍摄,利用Image-Pro Plus 6.0 软件分析处理图片数据。
3.8 WGA 染色 将WGA 滴在心脏组织冰冻切片上,室温孵育10 min,进行染色,使用ECLIPSE Ti 显微镜拍摄。
3.9 TUNEL 染色 将包埋于OCT 包埋剂中的心脏切成约5 μm 厚的切片。然后根据试剂盒手册进行TUNEL 染色,以检测心肌细胞的凋亡。图像由ECLIPSE Ti显微镜拍摄。
3.10 总RNA 提取和RT-qPCR 使用Trizol 试剂提取心脏组织总RNA。根据说明书,采用全式公司的AT311 逆转录试剂盒合成cDNA,使用Bio-Rad 公司的IQ SYBR Green Supermix 试剂盒进行qPCR,以GAPDH 为内参照,采用2−ΔΔCt法计算基因的相对表达。引物序列如下:GAPDH 正向引物序列为5′-AGTGGCAAAGTGGAGATT-3′,反向引物序列为5′-GTGGAGTCATACTGGAACA-3′;心房钠尿肽(atrial natriuretic peptide,ANP)正向引物序列为5′-TCG⁃GAGCCTACGAAGATCCA-3´,反向引物序列为5′-GTGGCAATGTGACCAAGCTG-3´;脑钠肽(brain na⁃triuretic peptide,BNP)正向引物序列为5′-AAAGTC⁃GGAGGAAATGGCCC-3´,反向引物序列为5′-GC⁃CAGGAGGTCTTCCTACAAC-3´;β-肌球蛋白重链(βmyosin heavy chain,β-MHC)正向引物序列为5′-AT⁃GCTTGTGCCGTAGGAATGT-3´,反向引物序列为5′-CTCCTTCTCAGACTTCCGCAG-3´。
3.11 Western blot 取适量心肌组织剪碎、匀浆、离心、超声裂解后取上清然后通过BCA 蛋白测定试剂盒(Beyotime)确定浓度。用10%的凝胶分离50 μg蛋白质,然后转移到PVDF 膜上(Thermo Fisher)。将膜与相关的Ⅰ抗(Bax 抗体1∶1 000 稀释,Bcl-2 抗体1∶1 000稀释,OPA1抗体1∶1 000稀释,Drp1抗体1∶1 000 稀释,GAPDH 抗体1∶10 000 稀释)4℃孵育过夜,然后与相应的II 抗(小鼠或兔抗体,1∶5 000;CST)室温孵育2 h。在Bio-Rad 凝胶成像仪上曝光,使用Image-Pro Plus分析图像。
4 统计学处理
使用SPSS 22.0 软件进行统计分析。所有数据均表示为均数±标准误(mean±SEM)。计量资料需对数据进行正态性检验和方差齐性检验,随后多组间比较使用单因素方差分析(one-way ANOVA),进一步两两比较采用Dunnett´s 多重比较检验。以P<0.05为差异有统计学意义。
结 果
1 花青素提高TAC小鼠生存率
与sham 组相比,在1~2 周时TAC 组小鼠死亡率较高,且主要集中在TAC 术后1~3 d;术后第4周时,sham 组与sham+Cyn 组小鼠各死亡1 例,总体生存率为95%(19/20),TAC组的总体生存率为37.5%(15/40),TAC+Cyn 组生存率为57.5%(23/40),与TAC组相比,TAC+Cyn 组小鼠的生存率显著提高(P<0.05),见图1。
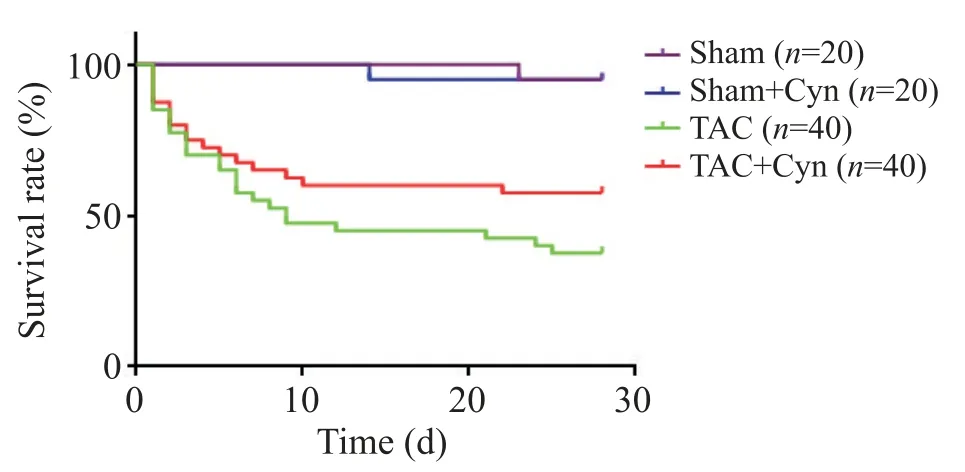
Figure 1.The survival rate of the mice in 28 d.图1 各组小鼠28 d生存率
2 花青素改善TAC术后小鼠心脏功能
sham 组与sham+Cyn 组小鼠主动脉弓结构和血流正常,差异无统计学意义;与sham 组相比,TAC 组和TAC+Cyn 组小鼠主动脉弓部缩窄,使用彩色多普勒显示在缩窄处血流呈现五彩镶嵌湍流现象,连续多普勒的血流频谱高速实填,血流峰值与血压显著高于sham组(P<0.05),且TAC组和TAC+Cyn组缩窄处血压无显著差异,见图2A。TAC 术后4 周各组心脏M型超声结果显示,sham 组与sham+Cyn 组小鼠收缩幅度和室壁厚度无显著差异;与sham 组相比,TAC 组小鼠LVEF 和LVFS 显著降低(P<0.05),LVEDD 和LVPWd显著增加(P<0.05);在给予Cyn治疗后,TAC+Cyn 组LVEF 和LVFS 与TAC 组相比显著升高,LVEDD与LVPWd与TAC组相比显著降低(P<0.05),见图2B。
3 花青素减轻改善TAC术后小鼠心脏重构
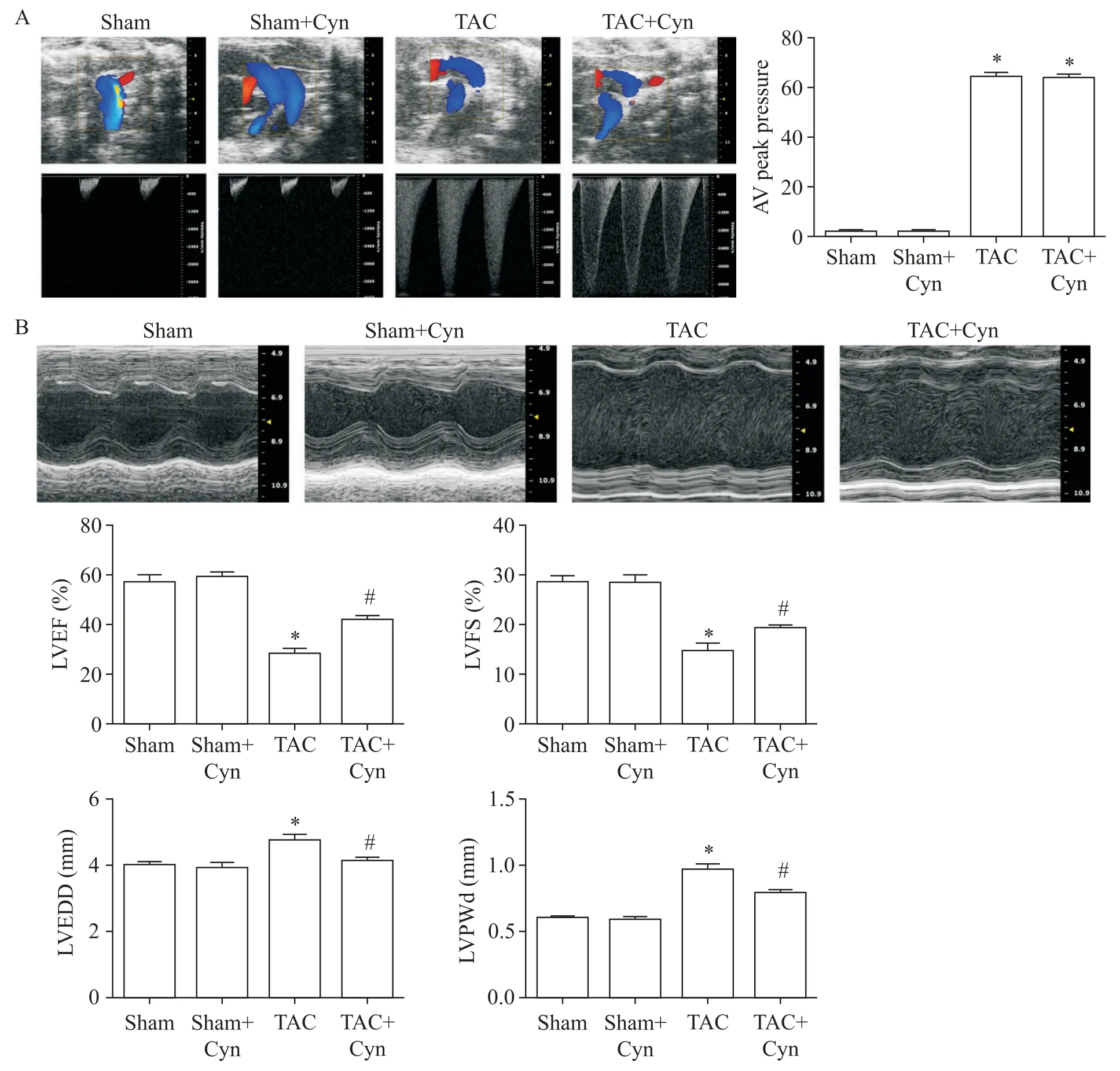
Figure 2.The effects of cyanidin(Cyn)on TAC-induced myocardial dysfunction.A:two-dimensional color Doppler and continued wave Doppler echocardiography of aortic arch view;B:M-mode echocardiography in the parasternal short-axis view of mice,and the quantitative analysis of left ventricular ejection fraction(LVEF),left ventricular fractional shortening(LVFS),left ventricular end-diastolic diameter(LVEDD)and left ventricular posterior wall thickness in diastole(LVPWd).Mean±SEM. n=6.*P<0.05 vs sham group;#P<0.05 vs TAC group.图2 花青素改善TAC术后小鼠的心功能
HE 与WGA 染色结果表明,与sham 组相比,TAC 组小鼠心腔扩大,室壁肥厚,心脏横截面积显著增大(P<0.05),且心肌肌丝排列疏松,细胞体积显著增加(P<0.05),心脏发生显著重构;给予Cyn 治疗后,TAC+Cyn 组小鼠心脏体积和心肌细胞横截面积与TAC 组相比均显著减小(P<0.05),心脏重构与肥大显著减轻(P<0.05),见图3A、B。与sham 组相比,TAC 组HW/BW 和HW/BW 显著增加(P<0.05);给予Cyn 后,TAC+Cyn 组HW/BW 和HW/BW 较TAC 组显著减小(P<0.05),见图3C、D。RT-qPCR 结果表明,与sham 组相比,TAC 组心肌组织增生性标志物ANP、BNP 和β-MHC 的mRNA 表达显著升高(P<0.05),而TAC+Cyn 组ANP、BNP 和β-MHC 的mRNA表达较TAC组显著降低(P<0.05),见图3E~G。
4 花青素抑制TAC术后小鼠心肌细胞调亡与损伤
TUNEL 法结果表明,与sham 组相比,TAC 组心肌细胞凋亡数目显著增加(P<0.05),而给予Cyn 后TAC+Cyn 组心肌细胞凋亡数目显著低于TAC 组(P<0.05),见图4A、B。各组小鼠血浆中cTnI 检测结果显示,与sham 组相比,sham+Cyn 组血浆cTnI 水平无显著差异,TAC 组小鼠血浆cTNI 水平显著升高(P<0.05);而给予Cyn 后,TAC+Cyn 组血浆cTnI 水平较TAC 组显著降低(P<0.05),见图4C。Western blot 结果显示,与sham 组相比,TAC 组Bax 表达水平显著升高,Bcl-2 表达水平显著降低(P<0.05),且Bcl-2/Bax比值显著降低(P<0.05);而给予Cyn后TAC+Cyn组Bax 表达水平较TAC 组降低,Bcl-2 表达水平显著升高(P<0.05),且Bcl-2/Bax 比值显著升高(P<0.05),见图4D。
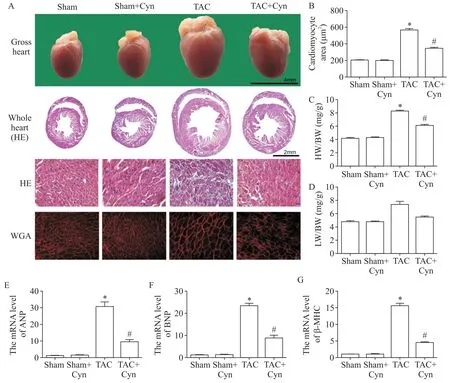
Figure 3.Cyanidin(Cyn)alleviated cardiac pathological remodeling and hypertrophy progression after TAC.A:the morphological changes of the heart in each group,including gross appearance(scale bar=4 mm),HE staining of short-axis sections(scale bar=2 mm),and WGA and HE staining of sections(scale bar=100 μm);B:quantification of the average cardio⁃myocyte cross-sectional areas in different groups;C,D:the ratios of heart weight/body weight(HW/BW)and lung weight/body weight(LW/BW)in different groups;E~G:the mRNA expression levels of hypertrophic markers atrial natriuretic peptide(ANP),brain natriuretic peptide(BNP)and β-myosin heavy chain(β-MHC)in different groups.Mean±SEM. n=6.*P<0.05 vs sham group;#P<0.05 vs TAC group.图3 花青素减轻TAC术后小鼠心脏病理性重塑
5 花青素减轻压力负荷所致的氧化应激
DHE 染色结果显示,与sham 组相比,TAC 组心脏中ROS 显著升高;给予Cyn 治疗后,TAC+Cyn 组心脏中ROS显著低于TAC组(P<0.05),见图5A、B。各组心脏中MDA 含量与SOD 活性检测结果显示,与sham 组相比,TAC 组心脏中MDA 的含量显著升高(P<0.05),SOD 的活性显著降低(P<0.05);TAC+Cyn 组心脏中MDA 的含量较TAC 组显著降低(P<0.05),SOD 的活性较TAC 组显著升高(P<0.05),见图5C、D。
6 花青素调节TAC 术后心肌细胞线粒体融合与分裂
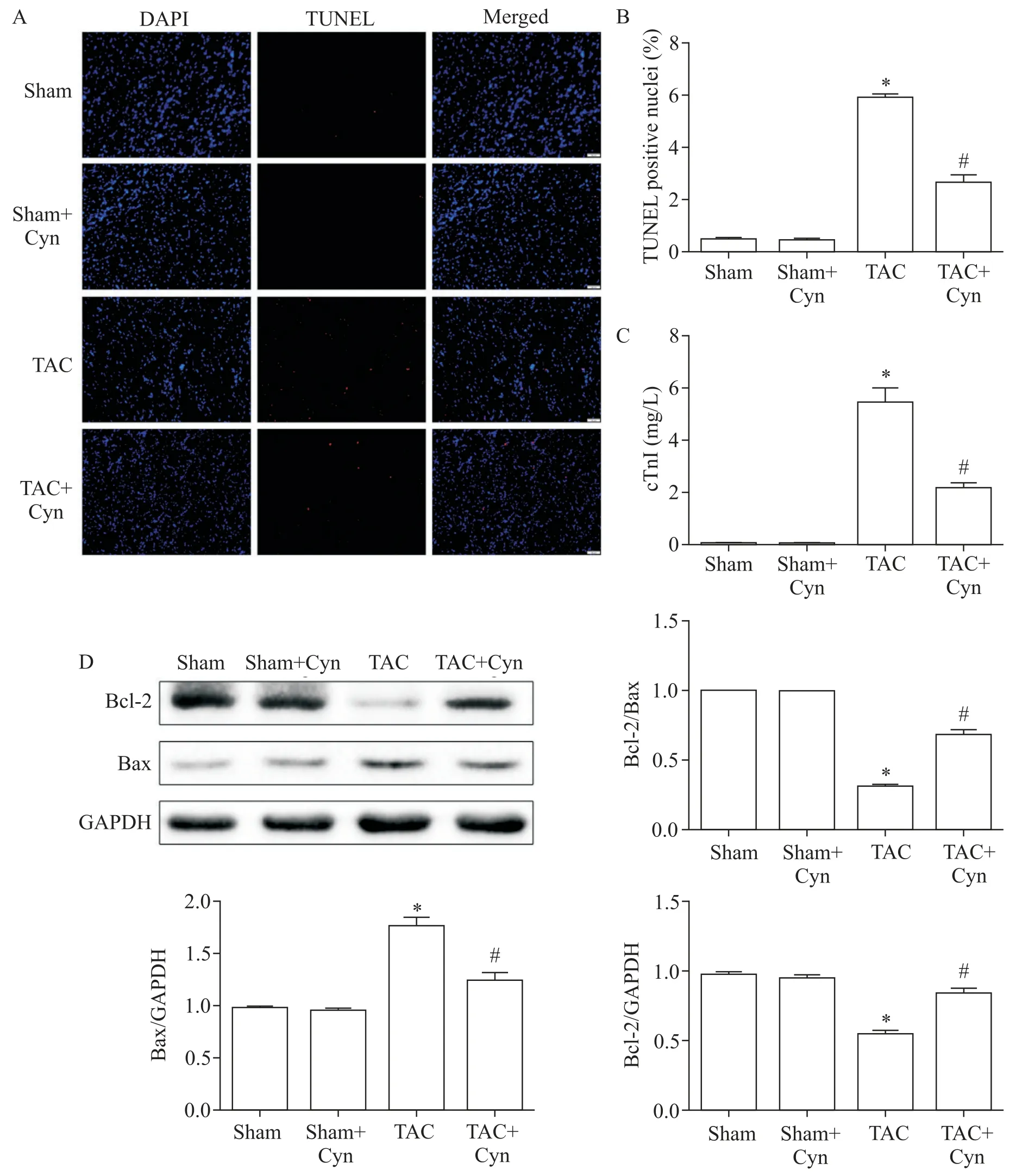
Figure 4.Cyanidin(Cyn)alleviated TAC-induced cardiac apoptosis and injury.A:representative images of cardiac TUNEL staining(red)to reveal cardiac apoptosis(scale bar=50 μm);B:the apoptosis index(TUNEL positive)in cardiac sections,quan⁃tification of A;C:cardiac troponin I(cTnI)level in the plasma of the mice;D:the protein expression levels of Bax and Bcl-2 in the myocardium detected by Western blot.Mean±SEM. n=6.*P<0.05 vs sham group;#P<0.05 vs TAC group.图4 花青素抑制TAC术后小鼠心肌细胞凋亡
透射电子显微镜检测心肌细胞线粒体形态的结果表明,sham 组心肌细胞细胞质中充满肌原纤维,对齐的肌原纤维之中有丰富的线粒体,大多数线粒体呈圆形或椭圆形,内有密集的嵴;与sham 组相比,TAC 组部分肌原纤维分解,线粒体数量增加且面积减小(P<0.05),见图6A;与TAC 组相比,TAC+Cyn组表现为肌原纤维分解减少,线粒体数目减少且线粒体表面积增加,见图6B、C。Western blot 结果显示,与sham 组相比,TAC 组小鼠心脏中与线粒体分裂相关的分子Drp1 蛋白水平显著升高,且小鼠心脏中与线粒体融合相关的分子OPA1变化显著,表现为OPA1 和长型OPA1(long OPA1,L-OPA1)蛋白水平显著降低(P<0.05),短型OPA1(short OPA1,SOPA1)蛋白水平无显著变化,L-OPA1/S-OPA1 比值降低(P<0.05);与TAC 组相比,TAC+Cyn 组Drp1 水平无显著差异,L-OPA1 蛋白水平显著升高(P<0.05),L-OPA1/S-OPA1 比值升高(P<0.05),见图6D。
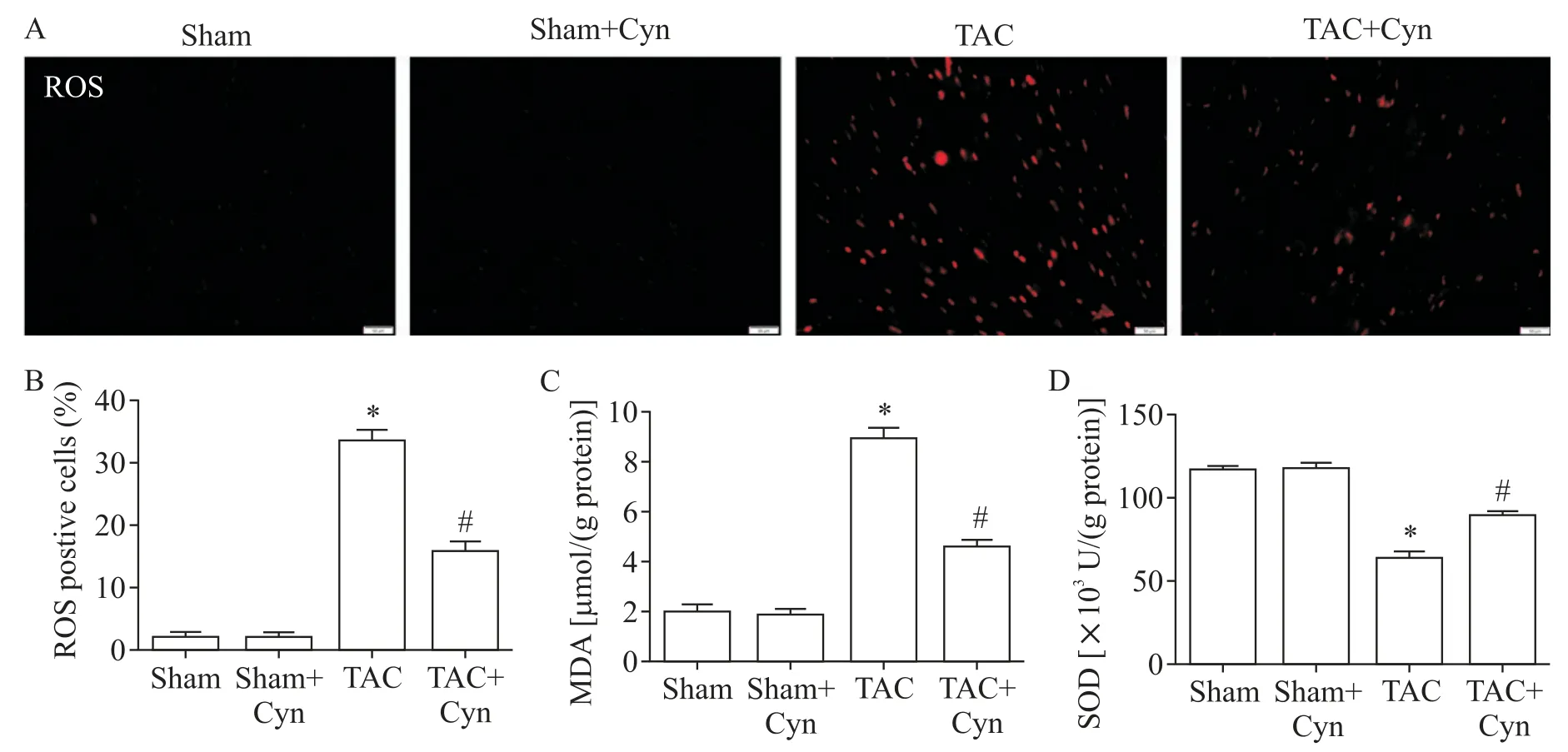
Figure 5.Cyanidin(Cyn)mitigated TAC-induced oxidative stress.A,B:dihydroethidium(DHE)staining to evaluate the amount of ROS in cardiac tissues(scale bar=50 μm);C,D:the content of malondialdehyde(MDA)and the activity of superoxide dismutase(SOD)in the myocardium.Mean±SEM. n=6.*P<0.05 vs sham group;#P<0.05 vs TAC group.图5 花青素减轻TAC术后心脏氧化应激
讨 论
心力衰竭是一种由结构性或功能性的心脏疾病引起的损害心脏泵血能力的复杂临床综合征[13]。在病理状态中,压力超负荷是引起心脏重构及心力衰竭的主要病因,心脏在压力超负荷的刺激下,早期产生适应性心肌重构,以应对增加的室壁应力,常表现为心肌肥大、血管新生、纤维组织增生等;但如果压力超负荷持续存在,心脏将逐渐进入失代偿期,心脏重构加剧,最终发展为心力衰竭[2-3]。Cyn 具有抗氧化及清除自由基的作用,可通过消除自由基与线粒体途径保护心脏,且在心肌缺血再灌注损伤中显示出心脏保护作用[9],而本实验证明,给予Cyn 可减轻压力超负荷引起的小鼠心脏重构,此保护作用表现为抑制心肌线粒体OPA1 的剪切从而促进线粒体融合,进而减轻心肌氧化应激损伤与心肌凋亡。
本实验采用小鼠TAC 模型模拟压力超负荷引起的慢性心力衰竭,在造模4 周后,TAC 组小鼠LVEF和LVFS 显著下降,HW/BW 增加,心脏横切面可见明显心肌肥厚与心腔扩大,提示后负荷增加引起显著心功能障碍与心脏重构。给予Cyn 干预可以显著提高TAC术后小鼠生存率,增加LVEF与LVFS,降低HW/BW,且减轻心脏肥大,表明Cyn 可改善心脏功能,抑制心脏重构。同时,sham 与sham+Cyn 组小鼠的生存率和心脏功能无显著差异,说明Cyn 是一种安全、可口服且不影响机体心脏正常基线水平的小分子药物。
心肌细胞凋亡是心力衰竭过程中一个重要标志[14]。我们随后检测了Bax 和Bcl-2 蛋白表达水平,结果表明Cyn 可显著抑制TAC 所致的心肌细胞凋亡。TUNEL 的实验结果与Western blot 检测结果相同,进一步证实Cyn 可以减少压力负荷引起的小鼠心脏凋亡。在心力衰竭过程中,机体产生过量的ROS,而抗氧化酶的性能并未发生明显变化,随着ROS 不断积累会引起一系列心衰反应[14]。近年来,有研究报道花青素或其代谢产物能够通过多种途径清除ROS[14-15],从而降低氧化应激损伤。我们同时检测了各组心脏中ROS、MDA 和SOD 水平,结果显示,给予Cyn 干预可清除TAC 后机体产生的过量ROS 和MDA,同时激活SOD。这说明Cyn 能抑制压力负荷引起的小鼠心脏氧化应激。
线粒体的形态和分布常常处于动态的变化之中,影响心肌离子稳态与能量代谢,在心肌细胞凋亡、自噬及代谢等诸多生命进程中发挥关键作用[7,15]。越来越多的研究表明,线粒体分裂与融合的异常参与肥厚型心肌病、缺血再灌注损伤等心血管疾病的进程[16]。在脓毒症小鼠中,花青素可通过增加OPA1的表达促进线粒体融合,进而改善小鼠心功能[17]。为探究Cyn 缓解压力超负荷导致的慢性心力衰竭的机制是否与线粒体融合和分裂有关,我们通过透射电镜观察细胞线粒体的形态并检测Drp1 和OPA1蛋白表达。在TAC 术后4周,TAC 组小鼠心肌细胞线粒体数量增多,表面积减少,L-OPA1 蛋白表达显著降低且Drp1 蛋白表达显著升高,提示线粒体分裂增多且功能下降。给予Cyn 干预后可显著增加心肌线粒体面积且降低线粒体数量,提示Cyn 可抑制TAC 术后心肌线粒体分裂,促进线粒体融合,并改善线粒体功能。此外,Cyn 干预可显著增加TAC 术后心肌线粒体L-OPA1 蛋白的表达水平,使L-OPA1/S-OPA1 上升,但是对Drp1 的表达无显著影响,提示Cyn 可能是通过调节OPA1 的剪切进而抑制线粒体分裂,促进线粒体融合,从而缓解心脏重构。
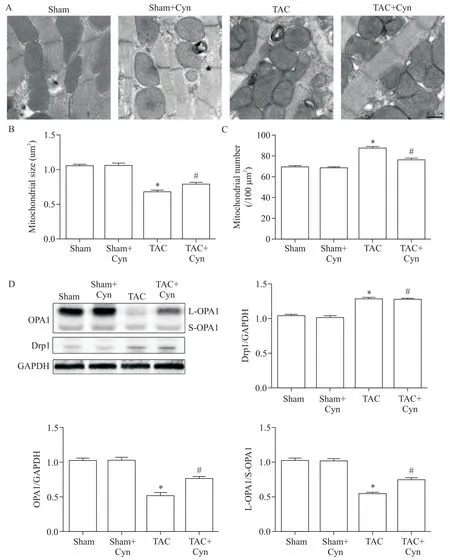
Figure 6.Cyanidin(Cyn)inhibited myocardial mitochondrial division in TAC mice.A:transmission electron microscopic results of myocardial tissues(scale bar=0.5 μm);B,C:mitochondrial area and mitochondrial number of each heart tissue;D:the protein expression levels of Drp1 and OPA1 in the myocardium detected by Western blot.Mean±SEM. n=6.*P<0.05 vs sham group;#P<0.05 vs TAC group.图6 花青素抑制后TAC术后心肌线粒体分裂
综上所述,本研究证实在动物体内实验中,花青素可以提高压力超负荷所致慢性心力衰竭小鼠的生存率,改善心脏功能,抑制心脏重构、心肌损伤和氧化应激,其作用可能依赖于花青素对心肌线粒体OPA1 剪切的抑制,促进线粒体融合,进而抑制线粒体过度分裂,其具体机制以及临床运用的可行性还有待进一步研究。
