NF-κB-iNOS/COX-2信号通路在高糖损伤血管内皮依赖性舒张中的作用*
2021-01-06邱红梅蒋青松
阳 创,薛 莱,吴 阳,邱红梅,蒋青松△
(1重庆医科大学药学院药理教研室,重庆市生物化学与分子药理学重点实验室,重庆 400016;2江油市人民医院临床医学部,四川江油 621700;3中山大学附属第七医院心血管中心,广东深圳 518107)
糖尿病是全球高发的慢性疾病之一。2019年全球糖尿病患者已达4 亿多人;据国际糖尿病联盟估计,至2045 年,这个数字会上升到7 亿[1]。血管病变是糖尿病及其并发症发生发展的关键因素,也是导致糖尿病患者死亡的首要因素之一[2]。糖尿病血管并发症包括微血管并发症如糖尿病视网膜病、糖尿病心肌病和糖尿病肾病等,大血管并发症有中风、冠心病和外周血管疾病等[3]。糖尿病血管病变的参与因素众多,血管内皮结构损伤从而导致内皮功能障碍是其关键的病理生理基础[4]。
乙酰胆碱(acetylcholine,ACh)引起的内皮依赖性血管舒张是检测血管内皮功能的重要指标,其功能障碍是血管内皮损伤的初始表现之一[5]。现有研究认为,长期全身慢性低水平炎症是促进糖尿病发生发展的重要因素。通过不同信号通路,炎症反应促进内皮细胞损伤,引起内皮功能障碍[6]。核因子κB(nuclear factor-κB,NF-κB)是细胞内重要的核转录因子,参与机体的炎症反应、免疫应答及肿瘤形成等多种过程。NF-κB 调控与炎症有关的基因,在糖尿病及其并发症中有重要作用[7]。内皮细胞分泌多种血管活性物质以维持正常的血管功能,包括舒血管物质如一氧化氮(nitric oxide,NO)、前列环素(prostacyclin,PGI2)和内皮衍生超极化因子等,及缩血管物质如内皮素-1、血管紧张素Ⅱ和血栓烷A2(thromboxane A2,TXA2)等[8]。其中,NO 和PGI2/TXA2是最为重要的调控因素之一。诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和环氧合酶2(cyclooxygenase,COX-2)是NF-κB 的重要下游因子,也是NO 水平和PGI2/TXA2平衡调节的关键酶。目前对NF-κB-iNOS/COX-2 信号通路的研究主要集中在炎症和肿瘤等方面[9],对于其在糖尿病内皮损伤的研究较少,对高糖条件下内皮依赖性血管舒张中的作用目前国内外未见报道。
本研究拟采用高糖孵育大鼠胸主动脉环建立糖尿病血管内皮损伤模型[10],分别给予NF-κB、iNOS和COX-2 抑制剂,观察ACh 诱导内皮依赖性血管舒张作用的变化,以探讨NF-κB-iNOS/COX-2 信号通路在糖尿病内皮损伤早期的作用。
材料和方法
1 动物
SD 大鼠,SPF 级,体重250~260 g,雌雄各半,由重庆医科大学实验动物中心提供,许可证号为SYXK(渝)2012-0001。
2 主要试剂
苯肾上腺素(phenylephrine,PE)购自上海禾丰制药有限公司(批号H31021175);ACh、二硫代氨基甲酸吡咯烷(pyrrolidine dithiocarbamate,PDTC)、S-甲基异硫脲硫酸盐(S-methylisothiourea sulfate,SMT)和BCA 蛋白浓度测定试剂盒均购自江苏省碧云天生物技术研究所;美洛昔康(meloxicam)购自大连美仑生物技术有限公司;Trizol、逆转录试剂盒、SYBR Green Supermix 和PCR 引物购自TaKaRa;兔抗大鼠phospho-NF-κB p65 单克隆抗体购自Cell Signal⁃ing Technology;兔抗大鼠iNOS 多克隆抗体购自Ab⁃cam;兔抗大鼠COX-2 多克隆抗体购自Proteintech;兔抗大鼠β-actin多克隆抗体购自博奥森生物科技公司;ECL 化学发光试剂盒购自Thermo。其余试剂为国产分析纯。
3 方法
3.1 内皮依赖性血管舒张功能的检测[10]将SD 大鼠脱颈处死后立即取出胸主动脉,制成长3~4 mm的血管环,置于含20 mL Krebs 液[成分(mmol/L):NaCl 119,CaCl22.5,KCl 4.7,MgSO41.2,KH2PO41.2,NaHCO325,glucose 11,pH 7.4]的浴槽中37℃保温,持续通以0.95 O2+0.05 CO2混合气体。血管张力经张力传感器(5 g,中国北京航天医学工程研究所)连接于BL-420S 生物信号处理系统(成都泰盟科技有限公司),静息负荷1 g。每隔15 min 更换Krebs液1次,平衡60 min后加入PE 1 μmol/L 预收缩血管,达到坪值并稳定后,加入ACh 30 μmol/L 验证内皮的完整性(舒张率大于60%认为内皮功能完好)。换液,平衡30 min 后,再次用PE 预收缩血管。达到相似收缩坪值后,移除PE。然后将血管环置于不同条件(见实验分组)的Krebs液中孵育6 h后,Krebs液清洗移去药物,再次给予PE 收缩血管,达到孵育前相似收缩坪值并稳定后,按浓度梯度法给予ACh(0.5对数单位递增,0.001~30 μmol/L),观察血管环的舒张作用,计算血管最大舒张效应(Emax,血管最大舒张作用与PE 收缩力的百分比)和pD2(ACh 产生50%Emax浓度的负对数)。
实验共分为5 组:正常糖(normal glucose,NG)组:葡萄糖11 mmol/L,加入甘露醇44 mmol/L 调节渗透压;高糖(high glucose,HG)组:葡萄糖55 mmol/L;NF-κB 抑制剂PDTC(1 μmol/L)组、iNOS 抑制剂SMT(10 μmol/L)组和COX-2 抑制剂美洛昔康(100 μmol/L)组:高糖培养并加入相应抑制剂。每组重复6次。
3.2 HE 染色和电镜观察 将不同条件孵育血管环4 %多聚甲醛固定24 h,梯度浓度乙醇和二甲苯脱水,石蜡包埋,作3~5 μm冠状切片,HE染色,于高倍镜下观察血管组织形态学变化。
或戊二醛固定2 h,磷酸液漂洗,锇酸液固定后,用不同浓度乙醇和丙酮脱水、包埋,烘箱过夜。用超薄切片机作50~60 nm 切片,3%醋酸铀-枸橼酸铅双染色,透射电镜下观察血管超微结构变化。
3.3 RT-qPCR 检测mRNA 的表达 取液氮冻存血管组织,按照RNAiso Plus Total RNA 提取试剂说明书的操作程序提取总RNA。参照GenBank 中大鼠基因序列,由重庆医科大学生物化学与分子药理学重点实验室设计引物,经TaKaRa 生物技术公司合成并验证(引物序列见表1)。按照TaKaRa Prime ScriptTMRT Reagent Kit with gDNA Eraser 试剂盒说明书操作,逆转录合成cDNA。反应条件为:95℃30 s;95℃5 s,60℃30 s,40 个循环。以β-actin 为内参照,对荧光强度达到阈值时的循环数(即Ct值)进行统计。根据相对定量公式进行计算。每组重复3次。
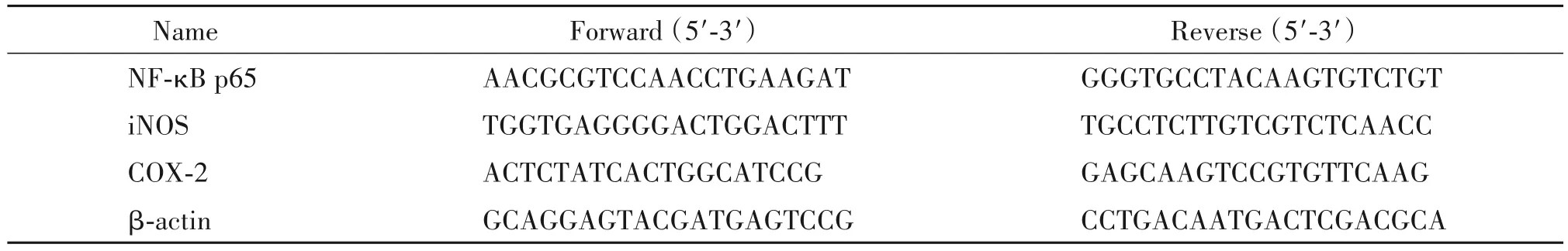
表1 RT-qPCR引物序列Table 1.The sequences of the primers for RT-qPCR
3.4 Western blot 检测蛋白表达 血管组织液氮冷冻后匀浆提取总蛋白,BCA 法检测蛋白浓度。取30 μg 蛋白进行SDS-PAGE 分离,转膜,封闭,加入Ⅰ抗[β-actin(1∶5 000)、phospho-NF-κB p65(1∶1 000)、COX-2(1∶500)和iNOS(1∶500)],4℃过夜;洗膜,加入辣根过氧化物酶标记的Ⅱ抗(1∶3 000),洗膜后用ECL 发光试剂显影,用Image Lab 软件进行图像分析。以目标蛋白与β-actin条带的灰度比值表示蛋白表达的相对水平。每组重复3次。
4 统计学处理
采用SPSS 20.0 软件进行统计学分析,用Excel和GraphPad Prism 5.01 等软件作图。实验数据以均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 高糖对大鼠胸主动脉组织形态学的损伤及PDTC的作用
HE 染色和电镜观察结果显示,正常组的血管结构清晰完整,血管平滑肌细胞排列整齐,内皮细胞完整平坦,内外弹力层连接紧密;高糖组孵育6 h后,血管结构破坏,内皮细胞受损、肿胀,内弹性膜断裂,内层平滑肌细胞排列疏松紊乱;给予PDTC(1 μmol/L)后,血管形态显著改善,平滑肌细胞排列较整齐,内皮细胞损伤减轻,见图1。
2 不同抑制剂对高糖损伤ACh 血管内皮依赖性舒张作用的影响
高糖孵育6 h 后,HG 组血管环的PE 收缩力与NG 组相比差异无统计学显著性(P>0.05);但在高糖环境下,ACh诱导的血管内皮依赖性舒张明显减弱,其Emax和pD2均显著降低(P<0.01),见图2、表2。
不同抑制剂与高糖共孵育后,PE 的收缩力亦无明显变化(P>0.05);但PDTC(1 μmol/L)、SMT(10 μmol/L)和美洛昔康(100 μmol/L)均明显改善高糖损伤的血管内皮依赖性舒张功能,其Emax和pD2均显著升高(P<0.01),见图3、表2。
3 PDTC 对高糖条件下大鼠胸主动脉NF-κB p65、iNOS和COX-2 mRNA和蛋白表达的影响
与NG 组比较,高糖孵育后NF-κB p65、iNOS 和COX-2 的mRNA 和蛋白水平均显著上调(P<0.01);给予PDTC(1 μmol/L)后,与HG 组比较,NF-κB p65、iNOS和COX-2的mRNA和蛋白表达水平则显著下降(P<0.01),见图4、5。
讨 论
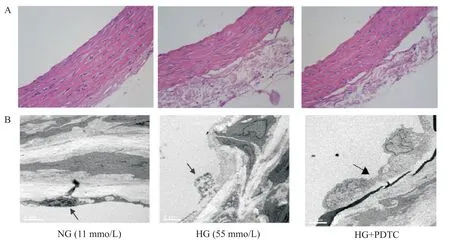
Figure 1.The histopathological changes of rat aortic ring.A:HE staining(×400);B:electron microscope(×7 000).The black ar⁃rows indicated endothelium.图1 大鼠胸主动脉组织的病理变化
由于胰岛素分泌绝对/相对不足,高糖血症是糖尿病患者的主要特征,常伴特异性大血管和微血管并发症。血管病变在糖尿病及其并发症的发生发展中具有重要意义。研究已经表明,持续高糖状态会损伤血管内皮,出现血管内皮功能障碍[11]。本研究中,与相同渗透压的正常浓度(11 mmol/L)葡萄糖组相比,高浓度(55 mmol/L)葡萄糖使ACh 诱导的血管内皮依赖性舒张功能明显下降至(16.73±6.81)%水平,远低于内皮完整的60%的标准,提示血管内皮功能严重受损,且该损伤作用不是由于渗透压增加引起。同时,病理观察也证实高糖破坏了血管内皮的正常结构;另外,高糖对PE 所诱导的血管收缩没有明显影响,提示本实验条件下,高糖可能未损伤血管的收缩功能。大量研究认为,内皮功能紊乱和缺失是糖尿病血管病变的主要危险因素。因此,深入研究高糖条件下血管内皮损伤的参与因素和相关信号通路的作用,对于糖尿病及其并发症的防治具有重要意义。
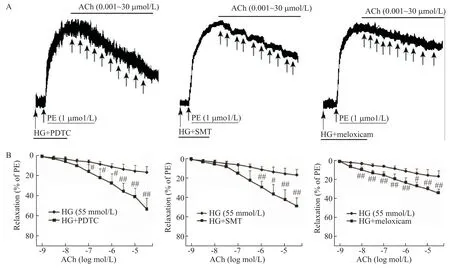
Figure 3.The effects of different inhibitors on the impaired endothelium-dependent relaxation induced by acetylcholine(ACh)under high glucose(HG)condition.A:the typical traces of the dose-response relationship for ACh-induced relaxation of rat aor⁃ta;B:the dose-response curves of ACh on aortic rings.Mean±SD. n=6.#P<0.05,##P<0.01 vs HG group.图3 不同抑制剂对高糖损伤乙酰胆碱内皮依赖性舒张血管作用的影响
表2 不同抑制剂对高糖损伤内皮依赖性血管舒张的影响Table 2.The effects of different inhibitors on Emax and pD2 of acetylcholine-induced endothelium-dependent relaxation under high glu⁃cose(HG)condition(Mean±SD. n=6)
现有研究发现,炎症是引起血管壁改变,导致内皮功能障碍的重要因素。糖尿病时,持续高血糖状态使晚期糖基化终末产物(advanced glycation endproducts,AGEs)增加,AGEs 与内皮细胞和平滑肌细胞上的RAGE 受体结合,激活NF-κB,上调肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素1β(interleukin-1β,IL-1β)等多种细胞因子的表达,导致血管内皮细胞发生凋亡和炎症,引发血管疾病[12-13]。NF-κB 是多条炎症通路的交汇点,与多种炎症相关紊乱的发生关系密切。生理情况下,NF-κB以无活性形式存在于胞浆中。病理状态下,NF-κB迅速活化并移位至胞核,启动一系列炎症相关基因的转录。NF-κB p65 蛋白是NF-κB 的关键转录亚基之一,p65/p50异源二聚体是NF-κB最常见的活化形式。Kassan 等[14]的研究发现,NF-κB 活化损伤了糖尿病小鼠的血管功能,但NF-κB 对高糖作用内皮依赖性舒张影响的研究较少。本实验结果显示,高糖预孵育后,血管组织NF-κB p65的mRNA和蛋白表达水平均显著升高,而NF-κB 抑制剂PDTC 下调其mRNA 和蛋白表达同时,也明显恢复ACh 诱导的内皮依赖性舒张功能,改善高糖损伤的血管结构。这些结果提示,对于糖尿病初期内皮功能障碍的发生,NF-κB的活化可能也有重要作用。
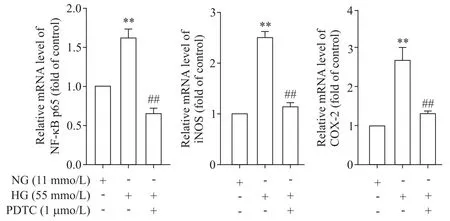
Figure 4.The effect of PDTC on the mRNA expression of NF-κB p65,iNOS and COX-2 in rat thoracic aorta under high glucose(HG)condition.Mean±SD.n=3.**P<0.01 vs NG group;##P<0.01 vs HG group.图4 PDTC对高糖作用下大鼠胸主动脉NF-κB p65、iNOS及COX-2 mRNA表达的影响
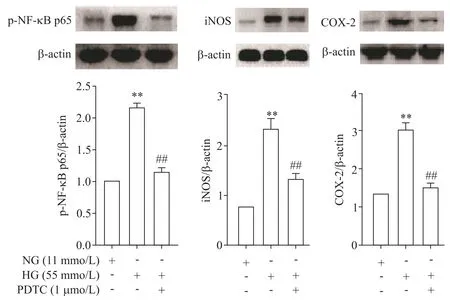
Figure 5.The effect of PDTC on the protein levels of p-NF-κB p65,iNOS and COX-2 in the rat thoracic aorta under high glucose(HG)condition.Mean±SD.n=3.**P<0.01 vs NG group;##P<0.01 vs HG group.图5 PDTC对高糖作用下大鼠胸主动脉p-NF-κB p65、iNOS及COX-2蛋白水平的影响
NF-κB 不仅调节重要炎症细胞因子的表达,也干预炎症反应相关因子的合成,如iNOS 和COX-2[15]。正常情况下,iNOS 在血管内皮细胞低水平表达。但在炎症等病理状态时,iNOS 表达水平明显增高,诱导内皮细胞持续生成大量NO。过量的NO 与超氧阴离子(·O2−)结合,生成过氧亚硝基阴离子,引起氧化应激反应,损伤血管内皮[16]。与iNOS 相似,生理状态下,COX-2在多数组织不表达,但受到细胞因子、感染等因素诱导时,表达上调。当血管内皮细胞COX-2 表达上调,PGI2合成酶活性下降;同时,TXA2释放增加[17]。PGI2/TXA2二者平衡失调是导致内皮依赖性舒张功能下降的重要因素。虽然已经证实,iNOS和COX-2是NF-κB重要的下游效应因子,但对于三者在高糖作用内皮依赖性舒张中的关系目前国内外未见报道。本研究中,高糖使内皮依赖性舒张功能显著降低同时,iNOS 及COX-2 的mRNA 和蛋白表达水平均显著上升;NF-κB抑制剂PDTC改善内皮结构和功能,并下调iNOS 及COX-2 的mRNA 和蛋白表达,提示iNOS 和COX-2 可能也介导了高糖激活NF-κB 损伤血管内皮的作用。值得注意的是,选择性iNOS 抑制剂SMT 和COX-2 抑制剂美洛昔康均只能部分恢复ACh 诱导的内皮依赖性舒张作用,提示iNOS 和COX-2 相关信号通路作用共同参与高糖损伤的内皮依赖性舒张功能。另外,PDTC 也不能完全恢复高糖损伤的内皮依赖性舒张,提示除了NFκB-iNOS/COX2 通路之外,可能还有其他机制参与高糖血症血管内皮依赖性舒张的调控。
综上所述,本研究结果提示NF-κB-iNOS/COX-2通路参与了高糖损伤血管内皮依赖性舒张的作用。该通路的激活在糖尿病内皮损伤早期可能有关键作用,对该通路各靶点的干预对于糖尿病血管病变的防治可能有重要意义。但由于糖尿病血管病变发生参与因素的复杂性,高糖损伤血管内皮依赖性舒张的调控机制仍然需要更进一步的研究。
