一氧化氮处理对马铃薯采后块茎愈伤的促进及机制
2020-11-27韩占红杨瑞瑞李志程DovPRUSKY
韩占红,王 斌,杨瑞瑞,杨 乾,李志程,Dov PRUSKY,2,毕 阳,*
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.以色列农业研究组织沃卡尼中心采后与食品研究所,以色列 贝达甘 50250)
马铃薯(Solanum tuberosumL.)是重要的粮菜兼用作物,在保障食物安全与营养方面作用突出。然而,马铃薯块茎在采收以及采后分级、包装、运输和装卸期间易受机械损伤[1],表面形成的伤口不仅加速块茎水分蒸腾,而且为多种采后病原菌的侵染提供了通道,导致块茎贮藏期间的腐烂[2]。此外,真菌侵染还会在块茎体内积累真菌毒素,造成潜在的食用安全隐患[3]。虽然马铃薯块茎表面的伤口具有自我愈合的能力,但自然愈伤所需时间较长[4]。因此,亟待开发促进马铃薯块茎采后愈伤的新措施。一些外源化学药物可促进马铃薯的块茎愈伤。脱落酸可通过促进马铃薯块茎伤口处的苯丙烷代谢,提高抗氧化酶活性来加速块茎的愈伤[5]。水杨酸及其结构类似物苯并噻重氮也可通过激活苯丙烷代谢而促进马铃薯块茎的愈伤[6-7]。一氧化氮(nitric oxide,NO)是植物体内重要的信号分子,在调节植物应对外界生物和非生物胁迫的防御反应中发挥着积极的作用[8]。有研究表明,采用NO供体硝普钠(sodium nitroprusside,SNP)处理番茄能提高番茄果实多种防御酶的活性,促进活性氧的积累,增强果实对Botrytis cinere和Rhizopus stolonifer的抗性[9-10]。NO可提高甘薯根苯丙烷代谢活性,增加伤口处木质化细胞层厚度,促进块根的愈伤[11]。此外,NO还可通过诱导细胞壁胼胝质的沉积,提高损伤相关防御基因的转录水平来促进马铃薯叶片的愈伤[12]。虽然已有NO促进甘薯块根和马铃薯叶片愈伤的报道,但NO是否影响马铃薯块茎的采后愈伤尚鲜见报道。本研究以‘陇薯7号’马铃薯块茎为试材,采用SNP溶液浸泡处理人工模拟损伤块茎,于常温黑暗条件下进行愈伤。评价处理对愈伤期间块茎质量损失率及病情指数的影响,观察块茎伤口部位软木脂和木质素的积累,分析伤口处组织苯丙烷代谢活性变化,以期为马铃薯块茎的快速愈伤提供方法及理论依据。
1 材料与方法
1.1 材料、菌株与试剂
‘陇薯7号’马铃薯于2018年11月采自甘肃省渭源县会川镇,选取大小均匀、无病虫害和机械伤的块茎装入网眼袋中(25 kg/袋),第二天运抵本实验室,在(4±2)℃冷库中贮藏待用。
硫色镰刀菌(Fusarium sulphureum)由本实验室保藏,在马铃薯葡萄糖琼脂培养基(potato dextrose agar medium,PDA)上保存待用。
SNP(纯度98.5%)、聚乙二醇 天津市光复精细化工研究所;过氧化氢试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
7 4-S 不锈钢双面刀片 上海吉列有限公司;CX21FSIC光学显微镜、BX51荧光显微镜 日本奥林巴斯有限公司;UV-2450紫外-可见光分光光度计 日本岛津公司;SW-CJ-2FD超净工作台 苏净集团苏州安泰空气技术有限公司;H-1850R高速冷冻离心机 长沙湘仪离心机仪器有限公司;LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;1510-04087酶标仪赛默飞世尔(上海)仪器有限公司;DHP-9082恒温培养箱 上海一恒科学仪器有限公司;DW-HL218超低温冰箱 中科美菱低温科技有限公司。
1.3 方法
1.3.1 块茎人工损伤及SNP处理
块茎人工损伤参照Jiang Hong等[7]的方法。将块茎从冷库中取出后回温24 h。先用自来水冲洗块茎除去表面泥土,然后用体积分数2% NaClO溶液浸泡3 min进行表面消毒,自然晾干后用刮皮刀在块茎表皮中部刮出直径为3 cm的伤口,每个块茎刮伤口3 处。
块茎的SNP浸泡处理参照Yin Jianyun等[11]的方法并略作修改。将上述损伤块茎浸入0.5 mmol/L的SNP溶液中10 min,以清水浸泡作为对照,取出自然晾干后,装入打孔的聚乙烯保鲜袋(30 cm×40 cm,厚度0.02 mm)中,置于常温(20~25 ℃、相对湿度70%~80%)黑暗条件下进行愈伤,在愈伤的第3、5、7、14、21天进行愈伤效果评价的指标测定。
1.3.2 孢子悬浮液的制备及损伤接种
孢子悬浮液的制备参照Yin Yan等[13]的方法并略作修改。取28 ℃恒温培养7 d的F. sulphureum一皿,加入5 mL无菌水,用灭菌涂布器轻轻刮下硫色镰刀菌的孢子,经4 层纱布过滤至50 mL三角瓶中,漩涡振荡15 s,使孢子分散均匀。使用血球计数板进行计数,将孢子浓度最终稀释至1×106spores/mL。
损伤接种参照姜红等[14]的方法,分别在块茎愈伤第0、3、5、7、14、21天时,将40 μL上述孢子悬浮液用涂布器均匀涂于伤口表面,稍作晾干后装入打孔的聚乙烯保鲜袋中(5 个块茎/袋),于室温(22±2)℃、相对湿度85%~90%的黑暗条件下贮藏7 d。
1.3.3 愈伤效果评价
1.3.3.1 质量损失率的测定
采用称质量法测定质量损失率。每个处理用块茎9 个,重复3 次。
1.3.3.2 病情指数的测定
发病级别分别定义为:0级,损伤表面不发病;1级,损伤表面0~25%发病;2级,损伤表面25%~50%发病;3级,损伤表面50%~75%发病;4级,损伤表面大于75%发病。每处理用块茎20 个,重复3 次。病情指数按下式进行计算。

1.3.3.3 块茎愈伤过程中软木脂及木质素的沉积观察
聚酚软木脂(suberin polyphenolic,SPP)的沉积观察参照Fugate等[15]的方法并稍作修改。用74-S不锈钢双面刀片垂直伤口表面切出厚度0.2~0.3 mm左右的薄片。按以下步骤完成切片染色:0.1%小檗碱染色45 min后,吸去染料,用蒸馏水和75%(体积分数,下同)乙醇溶液各冲洗3 遍,再用95%乙醇溶液冲洗2 遍,脱去染料,然后在0.25%甲苯胺蓝中放置1~2 min进行复染,最后用蒸馏水和75%乙醇溶液洗去染料,SPP即染为紫蓝色。将染色的切片置于载玻片上,盖上盖玻片并滴加蒸馏水在荧光显微镜下观察并拍照。
聚酯软木脂(suberin polyaliphatic,SPA)的沉积观察参照Lulai等[16]的方法并稍作修改。用不锈钢双面刀片垂直于块茎愈伤表面切出0.2~0.3 mm厚的薄片,蒸馏水冲洗3 遍后,进行染色观察。初染:质量分数0.05%甲苯胺蓝染液染色45 min,染色过程中轻轻上下摇晃使其染色均匀;脱染料:分别用75%乙醇溶液冲洗3 次,再用蒸馏水冲洗3 次;复染:吸取1%中性红染液,染色1.0~1.5 min;除去染料:先用蒸馏水冲洗,再用75%乙醇溶液冲洗,最后再用蒸馏水冲洗。将染好色的切片置于载玻片上,滴一滴蒸馏水后加盖盖玻片,在荧光显微镜下观察并拍照。
木质素的染色观察参照Alba等[17]的方法并略作修改。将损伤块茎用不锈钢双面刀片垂直于伤口表面切出厚度为0.2~0.3 mm的薄片,用蒸馏水浸泡冲洗数遍,以除去切片组织中的淀粉颗粒,随后置于干净的载玻片上,滴加1 g/100 mL的间苯三酚染色1.5 min后,再加1~2 滴浓盐酸,木质素即染为红色,置于荧光显微镜下进行观察并拍照。
块茎愈伤组织中的SPP、SPA和木质素细胞层厚度参照van Oirschot等[18]的方法通过IS Capture图像软件进行测量并计算。
1.3.4 生化指标测定
参照Jiang Hong等[7]的方法。用不锈钢刀片切取块茎损伤部位及以下2~3 mm左右的愈伤组织,立即用液氮冷冻后用研样机研磨成干粉装入50 mL离心管中,于-80 ℃的超低温冰箱中保存待测。
1.3.4.1 酶活力的测定
苯丙氨酸解氨酶(phenylalnine ammonia-lyase,PAL)活力的测定参照Koukol等[19]的方法并略作修改。取冷冻干粉1.0 g,加入3 mL提前预冷的提取缓冲液(含40 g/L聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、2 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)和5 mmol/L β-巯基乙醇),于4 ℃、8 000×g条件下离心30 min,上清液即为粗酶提取液。反应体系:3 mL pH 8.8硼酸缓冲液(50 mmol/L)、0.5 mL L-苯丙氨酸(20 mmol/L)、0.5 mL粗酶提取液,测定反应体系混合10 s后在290 nm波长处的吸光度(A0),将混合液于37 ℃恒温水浴锅中反应1 h后,再次测定290 nm波长处的吸光度(A1);空白对照以0.5 mL蒸馏水代替粗酶提取液,其余同反应体系。以每小时每克鲜质量果肉吸光度增加0.01为1 个PAL活力单位(U),PAL活力表示为U/g。
过氧化物酶(peroxidase,POD)活力的测定参照Jiang Aili等[20]的方法。取冷冻干粉2 g,加入5 mL乙酸-乙酸钠提取缓冲液(pH 5.5,含1 mmol/L聚乙二醇、4 g/100 mL PVP和体积分数1% Triton X-100),于4 ℃、8 000 r/min条件下离心30 min,收集上清液即为粗酶提取液。反应体系:3.0 mL 25 mmol愈创木酚溶液、0.3 mL粗酶提取液,0.1 mL 0.5 mol/L H2O2溶液。反应15 s时测定混合液在470 nm波长处的吸光度,测定持续2 min,以蒸馏水作为参比。以每克鲜质量果肉每分钟吸光度增加1为1 个POD活力单位(U),POD活力表示为U/g。
1.3.4.2 总酚、类黄酮和木质素的含量测定
总酚含量的测定参照Scalbert等[21]的方法。取冷冻干粉1.0 g,加入5 mL含体积分数0.5%乙酸和体积分数70%丙酮的混合溶液进行提取,之后将混合液置于4 ℃黑暗环境24 h,随后8 000×g离心30 min,收集上清液用于总酚和类黄酮含量的测定。测定体系:1 mL提取液、稀释10 倍的福林-酚试剂2 mL、2 mL 7.5 g/100 mL碳酸钠溶液,50 ℃放置5 min,以甲醇作对照,在760 nm波长处测定OD值,并以没食子酸为标准物质制定标准曲线来计算总酚含量,结果以每100 g鲜质量果肉中所含没食子酸质量表示,单位为mg/100 g。
类黄酮含量的测定参照C e v k 等[22]的方法并略作修改。测定体系:0.5 m L 提取液、0.1 5 m L 10 g/100 mL AlCl3·6H2O溶液、0.15 mL 0.5 g/100 mL NaNO2溶液,常温下静置反应5 min后,加入1 mL 1 mol/L NaOH溶液,在510 nm波长处测定OD值,并以儿茶素为标准物质建立标准曲线计算类黄酮含量。结果以每100 g鲜质量果肉中所含的没食子酸质量表示,单位为mg/100 g。
木质素含量的测定参照Hamerschmidt等[23]的方法。称取冷冻干粉1.0 g,加入3 mL预冷的体积分数95%乙醇溶液,于4 ℃、8 000×g离心30 min,弃去上清液,将沉淀物用95%乙醇溶液洗涤3 遍,用乙醇与正己烷体积比为1∶2的溶液冲洗3 遍,将清洗后的沉淀物在烘箱中干燥24 h,然后溶于1 mL体积分数25%溴化乙酰冰醋酸溶液,在70 ℃下水浴30 min,随后加入1 mL 2 mol/L NaOH溶液终止反应,再加入2 mL冰醋酸和0.1 mL 7.5 mol/L盐酸羟胺,于4 ℃、8 000 r/min条件下离心30 min,取上清液0.5 mL并用冰醋酸定容至5 mL,于280 nm波长处测定OD值,木质素含量以每克鲜质量果肉的OD280nm表示。
1.3.4.3 H2O2含量的测定
H2O2含量使用过氧化氢试剂盒进行测定。称取0.5 g的冷冻干粉,加入4.5 mL生理盐水置于冰上进行匀浆,转移至10 mL离心管中,于4 ℃、8 000×g离心10 min,取上清液。按试剂盒说明书加入相应试剂,混匀后,于405 nm波长处测定OD值。H2O2含量单位为mmol/g,结果以蛋白质量计。参照Brabford[24]的考马斯亮蓝染色法,以牛血清白蛋白为标准蛋白作标准曲线,计算蛋白含量。
1.4 数据统计与分析
上述各项测定至少重复3 次。全部数据采用Microsoft Excel 2010软件计算平均值及标准偏差,采用Origin 8.0软件作图;用SPSS 21.0软件进行Duncan’s差异显著性分析,P<0.05表示有统计学显著性差异。
2 结果与分析
2.1 NO处理对愈伤期间块茎质量损失率和病情指数的影响
由图1A可见,随着愈伤时间延长,SNP处理组块茎与对照组块茎的质量损失率均逐渐上升,且SNP处理组块茎的质量损失率显著低于对照组,愈伤7 d时,SNP处理组块茎质量损失率较对照组低43.5%(P<0.05)。由图1B可见,随着愈伤时间延长,SNP处理组与对照组损伤接种块茎的病情指数逐渐降低,且SNP处理组块茎的病情指数低于对照组,在愈伤7 d时,SNP处理组块茎病情指数低于对照组27%(P<0.05)。质量损失率和病情指数的结果表明,NO处理促进了马铃薯块茎的愈伤。
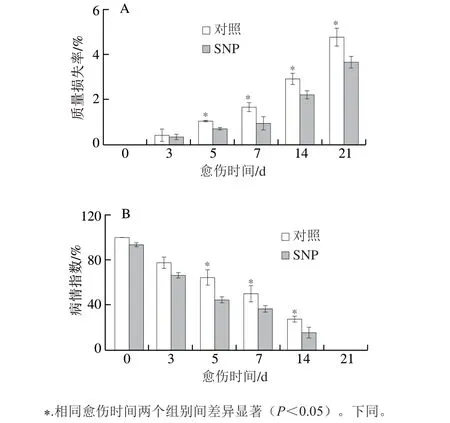
图1 NO处理对马铃薯块茎愈伤期间质量损失率(A)和病情指数(B)的影响Fig. 1 Effect of NO treatment on mass loss rate (A) and disease index (B)of potato tubers during wound healing
2.2 NO处理对马铃薯块茎伤口处软木脂和木质素积累的影响

图2 NO处理对愈伤期间马铃薯块茎伤口处SPP(A)、SPA(B)和木质素(C)积累的影响Fig. 2 Effect of NO treatment on the accumulation of SPP (A), SPA (B)and lignin (C) in wounds of potato tubers during healing

图3 NO处理对愈伤期间马铃薯块茎伤口处SPP(A)、SPA(B)和木质素(C)细胞层厚度的影响Fig. 3 Effect of NO treatment on cell layers thickness of SPP (A),SPA (B) and lignin (C) in wounds of potato tubers during healing
愈伤期间,SNP处理组块茎和对照组块茎伤口处的SPP和SPA均逐渐积累,积累差异始于愈伤的第3天,其积累速率和积累量均明显高于对照组(图2A、B)。同样,SPP和SPA细胞层厚度在愈伤期间逐渐增加,且SNP处理组显著高于对照组。愈伤7 d时,SPP和SPA细胞层厚度分别高于对照组25.2%和27.3%(P<0.05)(图3A、B)。愈伤期间,木质素的积累速率和积累量也逐渐增加,差异始于第5天,SNP处理组的积累速率和积累量均明显高于对照组(图2C)。处理组块茎伤口处木质素细胞层的厚度在愈伤期间也显著高于对照组,愈伤7 d时高出对照组23.6%(P<0.05)(图3C)。上述结果表明,NO处理促进了马铃薯块茎伤口处软木脂和木质素的积累。
2.3 NO处理对马铃薯块茎愈伤组织中PAL活力以及总酚、类黄酮和木质素含量的影响


图4 NO处理对愈伤期间马铃薯块茎伤口处PAL活力(A)以及总酚(B)、类黄酮(C)和木质素(D)含量的影响Fig. 4 Effect of NO treatment on PAL activity (A), and the contents of total phenols (B), flavonoids (C) and lignin (D) in wounds of potato tubers during healing
随愈伤时间延长,SNP处理组和对照组块茎伤口处的PAL活力先升高后下降,愈伤时间为7 d时达到峰值,SNP处理组块茎的PAL活力始终高于对照组,愈伤14 d时高出对照组75.3%(P<0.05)(图4A)。随愈伤时间延长,SNP处理组与对照组块茎伤口处的总酚和类黄酮的含量整体呈持续增加趋势,除愈伤第3天外,其他愈伤时间的SNP处理组均显著高于对照组。愈伤14 d时,SNP处理组块茎的总酚和类黄酮含量分别高出对照31%和39.6%(P<0.05)(图4B、C)。随愈伤时间延长,SNP处理组与对照组块茎伤口处的木质素含量不断增加,SNP处理组的木质素含量均显著高于对照组,愈伤14 d时高出对照组32.8%(P<0.05)(图4D)。上述结果表明,NO处理激活了马铃薯块茎伤口处组织的苯丙烷代谢。
2.4 NO处理对马铃薯块茎愈伤组织中的H2O2含量和POD活力的影响
SNP处理组和对照组块茎伤口处的H2O2含量随愈伤时间的延长而逐渐升高,愈伤时间较短(0~5 d)时,对照组的H2O2含量高于SNP处理组,愈伤时间较长(7~21 d)时,SNP处理组的H2O2含量高于对照组,愈伤14 d时高出对照组34.6%(P<0.05)(图5A)。SNP处理组和对照组块茎伤口处的POD活力随愈伤时间延长不断增加,且SNP处理组块茎的POD活力始终高于对照组,愈伤14 d时高出对照组81.7%(P<0.05)(图5B)。

图5 NO处理对愈伤期间马铃薯块茎伤口处H2O2含量(A)和POD活力(B)的影响Fig. 5 Effect of NO treatment on H2O2 content (A) and peroxidase activity (B)in wounds of potato tubers during healing
3 讨 论
作为植物体内重要的信号分子,NO在诱导植物抗病防御反应中发挥着重要作用[25],其可与水杨酸、茉莉酸(jasmonic acid,SA)、乙烯、活性氧以及Ca2+通道等信号分子相互作用,协同调控植物的抗病防御反应[26-27]。此外,NO还可激发苯丙烷代谢,从而诱导木质素以及一系列植保素的合成[28]。本研究发现,NO可激活马铃薯块茎伤口处的苯丙烷代谢,提高POD活力和愈伤后期H2O2含量,促进伤口处软木脂和木质素的积累,加速马铃薯块茎的采后愈伤。由此表明,NO在促进马铃薯块茎的愈伤中发挥了积极作用。
苯丙烷代谢在马铃薯块茎愈伤中具有重要的贡献,可为SPP和木质素提供聚合所需的酚类物质单体[29]。PAL是苯丙烷代谢的关键酶和限速酶,也是参与苯丙烷代谢第一步反应的酶[30],可催化L-苯丙氨酸脱去氨基生成反式肉桂酸,反式肉桂酸在肉桂酸-4-羟化酶的作用下生成香豆酸、阿魏酸和咖啡酸等酚酸,这些酚酸会被4-香豆酰-辅酶A(coenzyme A,CoA)-连接酶转化成为相对应的香豆酸-CoA、阿魏酸-CoA和咖啡酸-CoA,反应生成的这些酚酸-CoA会在肉桂酰CoA还原酶和肉桂醇脱氢酶的催化下合成SPP所需的酚类物质单体[31]。此外,肉桂醇脱氢酶还会将肉桂醛、咖啡醛和芥子醛转化为p-肉桂醇、咖啡醇和芥子醇,作为合成木质素的单体[32]。这些木质素单体在POD的作用下聚合形成木质素[33]。总酚、类黄酮和木质素是苯丙烷代谢的重要终产物。酚类化合物一方面作为合成木质素的前体,参与了愈伤结构的形成与伤口的修复;另一方面其本身具有抗病原菌的特性,可以抵抗真菌孢子的产生、萌发及其菌丝生长[34]。类黄酮具有较强的抗氧化和自由基清除能力,可有效抑制多种真菌孢子的萌发和菌丝生长[35]。木质素不仅作为植物体内的结构性屏障抵抗病原物侵染,还可使真菌菌丝尖端木质化[36]。已有研究表明,NO可有效诱导MdDHQS、MdSKDH、MdSK和MdEPSPS基因的表达,促进莽草酸途径中莽草酸、色氨酸、酪氨酸和苯丙氨酸的积累,从而为苯丙烷代谢途径提供底物[37]。NO还可显著诱导烟草和拟南芥叶片中SA的积累[38-39]。此外,NO处理还可显著上调马铃薯叶片损伤相关基因PAL的转录水平[12]。由此表明,NO通过促进SA积累激发了苯丙烷代谢。本研究发现,NO处理提高了马铃薯块茎伤口处的PAL活力,促进了总酚、类黄酮和木质素的积累。该结果与Yin Jianyun[11]等采用NO处理甘薯根和Ge Yonghong等[36]采用NO处理苹果果实观察到的结果类似。
H2O2在马铃薯块茎愈伤组织的形成中具有信号分子和氧化交联的双重作用。H2O2既可作为信号分子激发愈伤早期的防卫反应[40],如作为激活苯丙烷代谢的第二信使[41],也可上调软木脂形成过程中的相关基因表达和蛋白合成,参与酚单体与芳香结构域的氧化交联[42-43]。愈伤过程中所需的活性氧主要来源于质膜NADPH氧化酶[44]。首先,NADPH氧化酶通过转移NADPH电子到O2产生O2-·,由于O2-·存活寿命很短,其很快在超氧化物歧化酶的作用下歧化生成寿命较长的H2O2[45]。有研究表明,NO可提高超氧化物歧化酶活力来增加番茄[10]和蓝莓[45]果实的H2O2水平。由此表明,NO在诱导H2O2的积累方面具有积极贡献。POD作为软木脂和木质素合成的关键酶,在H2O2参与下通过氧化交联参与了软木脂和木质素的聚合[46]。SPP主要由苯丙烷代谢产生的羟基肉桂酸及其衍生物阿魏酸等通过酯键和醚键连接形成[47],主要阻止细菌对损伤块茎的侵染。SPA主要由α,ω-二元酸、ω-羟基酸、长链脂肪酸、中长链脂肪酸以及小部分的烷烃和烷酸通过酯键相连聚合而成,这些单体主要通过脂肪酸代谢产生[48],SPA主要对真菌性病害有抵抗作用。最终,SPP和SPA会进一步在甘油的交联作用下聚合形成三维网状结构,沉积于细胞壁表面形成封闭层[49]。本研究发现,NO处理后的块茎具有较高的POD活力和在愈伤后期具有较高的H2O2含量,表明POD和H2O2积极参与了软木脂和木质素底物的氧化交联。但至于POD如何氧化交联软木脂和木质素单体尚有待进一步的探讨研究。
4 结 论
与对照组相比,NO处理可激活马铃薯块茎伤口处的PAL活力,提高了总酚、类黄酮和木质素的含量,NO处理还可增加POD活力和愈伤后期的H2O2含量,加速软木脂和木质素在伤口处的积累,从而降低了损伤块茎的质量损失率和病情指数,促进了马铃薯块茎的采后愈伤。
