6 个遗传性凝血因子Ⅹ缺陷症家系的表型与基因型诊断
2020-04-28刘佳婕邵妍妍丁秋兰
刘佳婕,邵妍妍,梁 茜,丁秋兰
(上海交通大学医学院附属瑞金医院a.医学基因组国家重点实验室上海血液学研究所;b.检验科,上海 200025)
凝血因子Ⅹ(factor X,FⅩ)是一种维生素K 依赖的丝氨酸蛋白酶,在凝血共同途径中起到关键的作用。在生理条件下,其既可以被内源性凝血途径激活,又可以被外源性凝血途径激活,活化的凝血因子Ⅹ(FⅩa)在Ca2+及其辅因子活化凝血因子Ⅴ(FⅤa)的共同作用下,在磷脂膜表面形成凝血酶原酶复合物,激活凝血酶原成为凝血酶,凝血酶活化纤维蛋白原生成纤维蛋白凝块[1]。
FⅩ主要由肝脏合成并分泌至外周血中,以双链糖蛋白的形式存在,其相对分子质量为59 000,在血浆中的浓度为8~10 μg/mL。肝脏合成的未成熟FⅩ为一条含448 个氨基酸的单链,包括40 个氨基酸的前导肽。未成熟的FⅩ蛋白在内质网和高尔基体中进行蛋白质加工,去除前导肽后分泌至血浆,形成成熟的FⅩ蛋白。成熟的FⅩ蛋白由相对分子质量为17 000 大小的轻链和45 000 的重链组成,轻链与重链通过二硫键(Cys132/Cys302)相连。FⅩ轻链包含1 个γ-羧基谷氨酸区(Gla 区)、2 个类表皮生长因子区(EGF 区);FⅩ重链包含活化肽区和具有催化活性的丝氨酸蛋白酶区[2]。
遗传性FⅩ缺陷症是一种十分罕见的常染色体隐性遗传的出血性疾病,其由FⅩ基因(F10)突变所致。F10 位于常染色体13q34,与FⅦ基因(F7)相邻,并处于其下游。F10 纯合突变患者的FⅩ缺陷症发病率一般为1∶1 000 000[3-4],导致遗传性FⅩ缺陷症的F10 突变主要为错义突变、无义突变、剪接位点突变及移码突变,其中78%为错义突变[5]。另有报道提示,13 号染色体上的大片段缺失会导致FⅩ和FⅦ的联合缺陷[6]。根据FⅩ活性(FⅩ∶C)可将FⅩ缺陷症患者分为轻型(>6%)、中型(1%~5%)以及重型(<1%)[7]。但FⅩ缺陷症患者的出血表现与FⅩ∶C 水平间无明显相关性,轻型患者的出血表现为皮肤瘀斑、鼻出血、术后或者外伤后出血等症状;重型患者的出血则表现为关节出血、胃肠道出血,甚至颅内出血等症状,也有患者并无明显的出血症状[8]。遗传性FⅩ缺陷症分为4 种[9]。①Ⅰ型即交叉反应物质阴性,FⅩ抗原(FⅩ∶Ag)和FⅩ∶C 同时下降;②Ⅱ型即交叉反应物质阳性,FⅩ∶Ag 正常而FⅩ∶C下降;③Ⅲ型即交叉反应物质阳性,但内源性及外源性以及共同途径激活的FⅩ∶C 下降程度不同;④Ⅳ型、FⅩ和FⅦ联合缺陷症。
凝血酶生成试验(thrombin generation test,TGT)能够实时观察到凝血酶的生成,可从整体水平评价机体的出血倾向或高凝状态[10-11],是一个可以全面评估机体凝血状况的指标。TGT 中主要有4 个参数,延迟时间(lag time,LT)、峰值、达峰时间(time to peak,TTP)以及凝血酶生成潜力(endogenous thrombin potential,ETP)[12]。目前该检测已广泛应用于评估血友病患者的出血倾向及抑制物阳性血友病患者的疗效监测等领域[11],但对于评估其他少见凝血因子缺陷症患者的出血倾向的应用较少。本实验室Liang 等[13]曾报道,对于FⅩ缺陷症患者来说,在浓度为1pM(1 pmol/L)组织因子(tissue factor,TF)激活条件下,为避免接触激活的干扰,需预先在血浆中加入接触激活抑制剂,即玉米胰蛋白酶抑制剂(corn trypsin inhibitor,CTI),且与5pM TF 激活相比,1pM TF 激活下的TGT 具有更高的灵敏度,可以在该条件下评估FⅩ缺陷症患者的出血风险。因此,本研究在患者血浆内预先加入CTI,并在1pM TF 激活条件下进行TGT 的检测以评估FⅩ缺陷症患者的出血倾向。
本研究对6 个遗传性FⅩ缺陷症家系进行了临床表型和基因型的检测,并采用TGT 参数评估FⅩ缺陷症患者的出血风险。
资料与方法
一、资料
收集2014 年1 月到2019 年6 月就诊于上海交通大学附属瑞金医院血栓与止血门诊,经表型检测及基因检测确诊为遗传性FⅩ缺陷症,最终本研究纳入6 个遗传性FⅩ缺陷症家系。
二、方法
1.外周血采集:获得6 例先证者、4 名家系成员及6 名正常对照的知情同意后,采集其外周血,分别以2 种不同方式抗凝。①将外周血加入0.109 mol/L枸橼酸钠(9∶1)抗凝管中抗凝;②将外周血加入含0.109 mol/L 的枸橼酸钠0.3 mL 及0.05 mL CTI 的抗凝管中抗凝(CTI 终浓度为18.3 μg/mL),后者仅用于TGT 的检测。标本于室温下行3 000×g 离心15 min,取上层1/2 乏血小板血浆(platelet-poor plasma,PPP),剩余部分再次行3 000×g 离心15 min,收集上层PPP,立即置于-80 ℃保存备用。
2.凝血功能筛查:采用日本Sysmex CS5100 全自动凝血仪检测活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time,PT)、凝血酶时间(thrombin time,TT)、纤维蛋白原(fibrinoger,Fg)等凝血指标。采用HemosILTM 试剂(IL 公司,美国)和ACL-TOP 全自动血凝仪(IL 公司,美国)的凝固法检测凝血因子Ⅱ、Ⅴ、Ⅶ、Ⅷ、Ⅸ、Ⅺ、Ⅻ的促凝活性。将先证者血浆与正常混合血浆按1∶1 混合,分别检测即刻及37 ℃温育2 h 后的PT、APTT,检测血浆中FⅩ抑制物是否存在。
3.内源性凝血途径、外源性凝血途径及共同途径激活FⅩ后FⅩ∶C 的检测:FⅩ在内源性、外源凝血途径(PT 途径、APTT 途径)及共同途径蝰蛇毒(Russell's viper venom,RVV)激活的FⅩ∶C 检测均采用凝固法,在ST4 半自动血凝仪(法国Stogo 公司) 上进行检测。正常混合血浆用巴比妥缓冲液(pH=7.35)稀释,以1∶10 稀释后对应FⅩ∶C 为100%,以不同稀释度如1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640 对应的FⅩ∶C 与所测得的对应凝固时间作标准曲线。将先证者及家系成员血浆按1∶10 稀释后,检测凝固时间,并根据标准曲线计算内、外源途径及共同途径激活后FⅩ∶C。
4.FⅩ∶Ag 测定:利用酶联免疫吸附试验双抗体夹心法检测血浆中FⅩ∶Ag 含量。一抗为兔抗人FⅩ多克隆抗体(丹麦Dako 公司),二抗为辣根过氧化物酶标记的兔抗人FⅩ∶IgG(丹麦Dako 公司)。正常混合血浆以1∶200 稀释对应的FⅩ∶Ag 为100%,以不同稀释度如1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800 对应的FⅩ∶Ag 与所测得的对应吸光度值(A)作标准曲线。将先证者及家系成员血浆按1∶200 稀释,检测A,并根据标准曲线计算FⅩ∶Ag。
5.蛋白印迹法检测血浆中的FⅩ:6 例先证者血浆及正常人混合血浆分别用磷酸盐缓冲液稀释20 倍,加非还原型上样缓冲液,95 ℃变性5 min,上样10 μL 进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,然后将蛋白质转移至聚偏二氟乙烯膜,以鼠抗人FⅩ多克隆抗体(丹麦Dako 公司)为一抗,用辣根过氧化物酶标记的山羊抗鼠IgG(Santa cruz 公司,美国)作二抗,用电化学发光检测试剂放色自显影检测血浆中FⅩ相对分子质量及含量变化。
6.TGT:采用自动校正凝血酶曲线法(calibratedautomated thrombogram,CAT)法检测,试剂盒及软件均购自荷兰Thrombinoscope BV 公司。用Fluoroskan Ascent FL 荧光读数仪检测在1pM TF激活下血浆的凝血酶生成量。TGT 主要有4 个参数,LT 即从反应开始到凝血酶开始生成所经历的时间;峰值即生成的凝血酶的最大量;TTP 即从反应开始到凝血酶到达最大量所经历的时间;ETP 即凝血酶生成曲线下的微积分面积,整体反映凝血酶生成的量。
7.F10 突变检测及外显子拷贝数变异分析:外周血DNA 采用Qiagen 公司的DNA 抽提试剂盒进行抽提(Qiagen 公司,荷兰)。扩增先证者F10 的8 个外显子及其侧翼序列和5′、3′端非翻译区,直接进行测序,将测序结果同基因文库中F10 序列进行比对,寻找致病突变,并对其家系成员相应突变位点进行检测。针对先证者新的突变位点,在千人数据库中进行筛查,并同时筛查100 名健康献血者的DNA,PCR 扩增并测序,排除突变位点的多态性。利用AccuCopy(上海天昊生物科技有限公司)多重荧光竞争PCR 法对先证者F10 的8 个外显子进行拷贝数变异分析。
8.统计学处理:用Graphpad Prism V5.0 软件进行统计学分析,各组间比较采用Kruskal Wallis检验,P<0.05 为差异有统计学意义。
结 果
一、先证者及家系成员的临床信息及相关检测结果
6 例先证者包括3 例男性及3 例女性,具体的临床表现、出血评分及相关检测结果详见表1。所有先证者的PT 及APTT 均延长,FⅩ∶C 及FⅩ∶Ag均有不同程度的下降,依据FⅩ∶C 及FⅩ∶Ag 下降程度的不同,先证者1、5、6 属于Ⅰ型FⅩ缺陷症患者,先证者2、3、4 属于Ⅱ型FⅩ缺陷症患者。蛋白印迹检测结果显示,6 例先证者血浆中FⅩ含量较正常人混合血浆中FⅩ含量明显减少,相对分子质量与正常FⅩ相同(见图1)。
二、F10 突变检测结果
6 例先证者F10 突变检测结果详见表1。家系分析均符合孟德尔遗传规律,家系图见图2。先证者1、3、4、5、6 均为双杂合突变患者,突变分别来自于父母,先证者2 为单杂合突变患者。
三、TGT 各项参数检测结果及凝血酶生成曲线
6 例FⅩ缺陷症患者及部分家系成员TGT 各项参数检测结果及凝血酶生成曲线如表2 和图3。
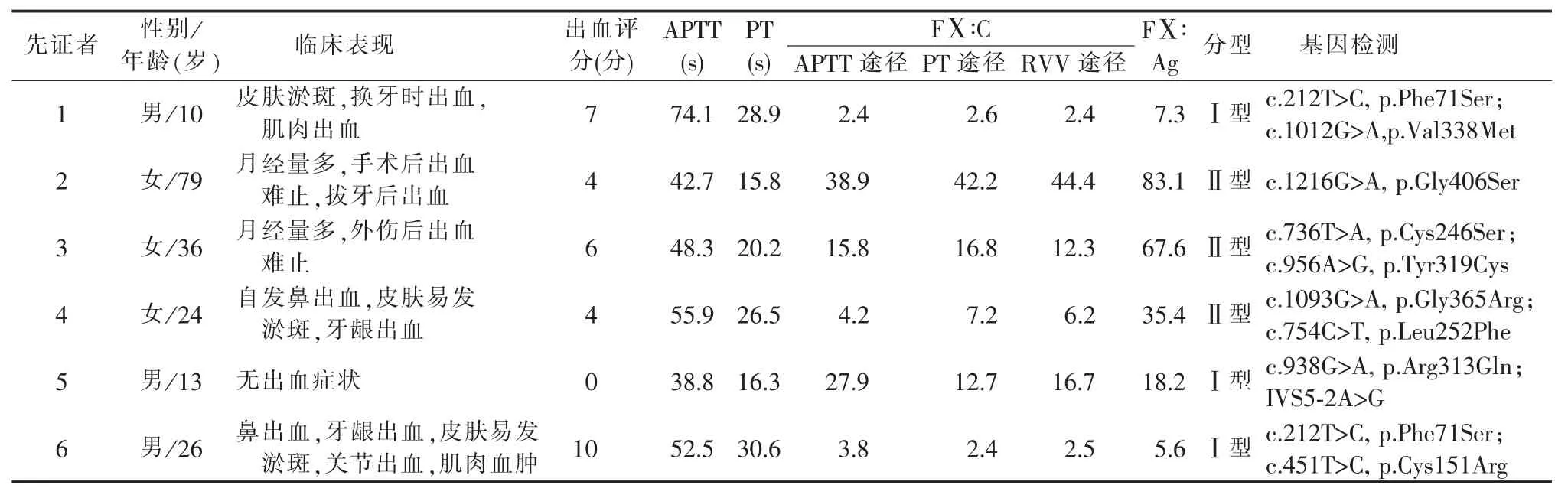
表1 6 例先证者临床信息、表型及基因检测结果

图2 6 个遗传性FⅩ缺陷症患者家系图及相关突变
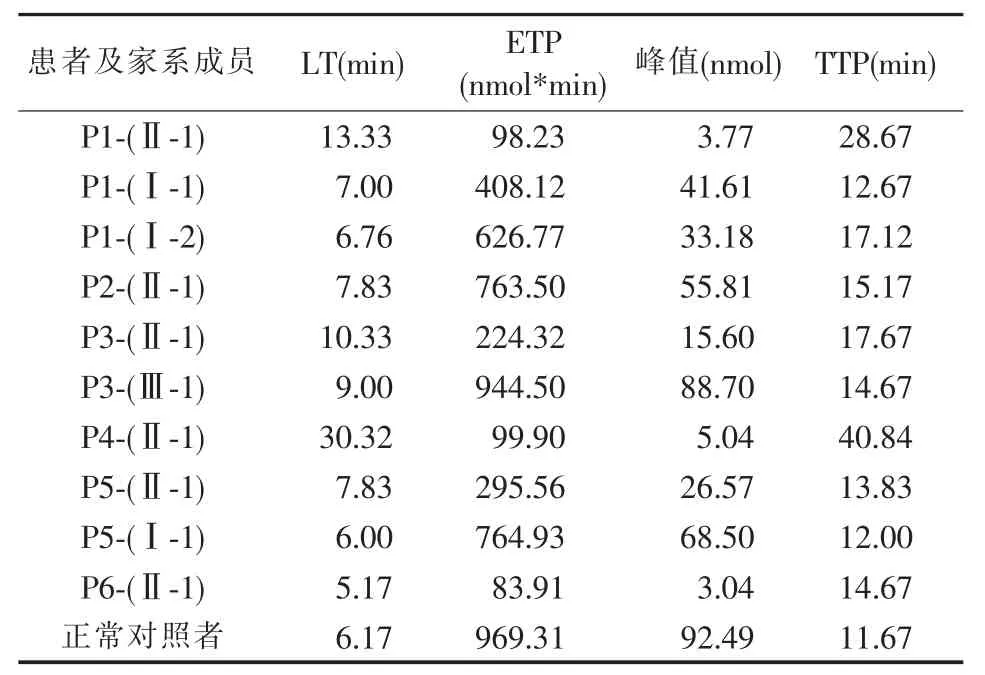
表2 6 例FⅩ缺陷症患者及部分家系成员TGT 各项参数检测结果
四、TGT 各参数在3 组临床出血严重程度不同的FⅩ缺陷症患者间的比较
根据临床表型的不同,将先证者和其家系成员分为3 类,将关节出血、肌肉出血、消化道出血等危及生命的出血症状列为重型,而轻型则为伤后或者术后出血以及鼻出血、口腔出血,其余为无出血症状。
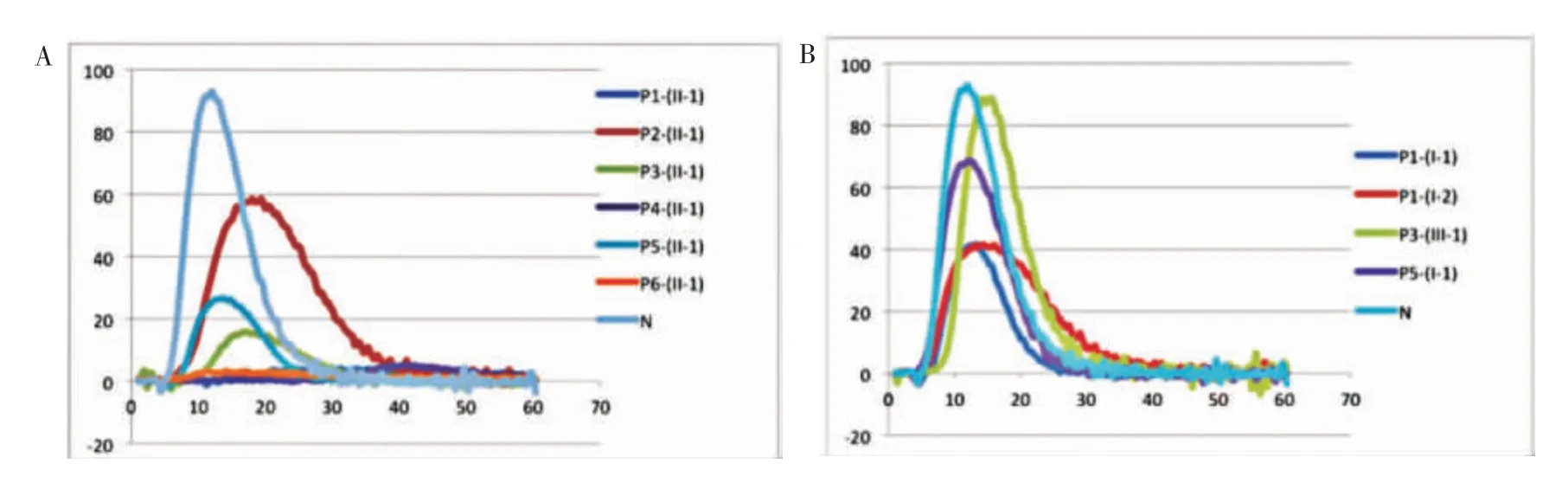
图3 凝血酶生成曲线
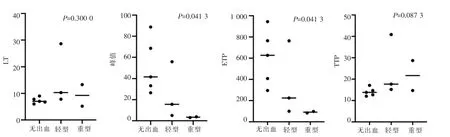
图4 3 组临床出血严重程度不同的FⅩ缺陷症患者间的TGT 各参数比较
在本研究中,先证者1 的父母、先证者3 的儿子,先证者5、先证者5 的父亲为无出血症状组,先证者2、3、4 为轻型症状组,先证者1、先证者6 为重型症状组。本研究将TGT 的各项参数在3 组中进行比较发现(见图4),峰值、ETP 在3 组间差异有统计学意义(P<0.05),而LT 和TTP 在各组间差异无统计学意义(P>0.05)。对于存在重型出血症状的先证者6 和先证者1 来说,其TGT 中仅检测到非常少量的凝血酶生成,峰值分别仅有正常人的3.27%和4.08%,ETP 为正常人的8.66%和10.13%。而在轻型症状组中,先证者3 以及先证者4 的峰值分别为正常人的16.87%以及5.45%,ETP 分别为正常人的23.14%和10.31%,而同样存在轻型出血症状的先证者2 的峰值和ETP 分别为正常人的60.34%和78.77%,与其表型不相符合,其原因有待于进一步探讨。无出血症状组中,ETP 和峰值均为正常对照的30%以上。
讨 论
遗传性FⅩ缺陷症是一种由于F10 突变所导致的罕见遗传病,至今已有146 种F10 基因突变被报道[14](见图5)。本研究在6 个遗传性FⅩ缺陷症家系中共发现了5 名携带F10 双杂合突变的先证者以及1 名携带F10 单杂合突变的先证者,并发现了10 种可导致FⅩ缺陷症的突变,其中5 种为新突变。
一、各先证者分析
1.先证者1:先证者1 携带Phe71Ser 和Val338Met 2 种已报道的F10 突变。Phe71 位于FⅩ轻链Gla 结构域的N 端,该位点在16 个物种中保守,Phe71Ser 会导致Ⅰ型FⅩ缺陷症。苯丙氨酸是一种芳香族的疏水基团,丝氨酸为亲水性的氨基酸,两者理化性质不同,苯丙氨酸被丝氨酸取代后会破坏FⅩ蛋白的疏水内核,改变了蛋白质二级结构,导致部分Gla 结构域错误折叠,从而改变了Gla结构域的构象。携带纯合Phe71Ser 突变的患者表现为重型出血,包括关节出血等[13]。Val338 位于丝氨酸蛋白酶区,并且结构保守,蛋氨酸取代缬氨酸后对局部亲水性不会有很大的影响,但是蛋氨酸具有较大侧链,取代缬氨酸后影响了蛋白质空间结构,引发蛋白质错误折叠,可能导致蛋白质合成分泌障碍。该突变会导致Ⅰ型FⅩ缺陷症,携带该纯合突变的患者,表现为重型出血[15]。本研究中携带Phe71Ser 以及Val338Met 双杂合突变的先证者1 为Ⅰ型FⅩ缺陷症,表现为重型出血,如肌肉出血等。
2.先证者2:先证者2 存在单杂合F10 突变Gly406Ser。Gly406 位于底物结合位点中,与Asp413和Gly440 结合形成底物结合口袋,该突变会破坏酶促活性区的原始构象,导致底物结合的缺陷,使FⅩ失去酶活性。携带纯合Gly406Ser 突变的患者,表现为轻型出血,包括牙龈出血,月经量过多等症状。有研究报道,携带单杂合突变的患者存在轻度鼻出血的症状[16-19]。先证者2 为Ⅱ型FⅩ缺陷症患者,存在术后出血以及拔牙后出血等轻型出血症状,但该名携带单杂合突变先证者的发病机制有待于进一步研究。
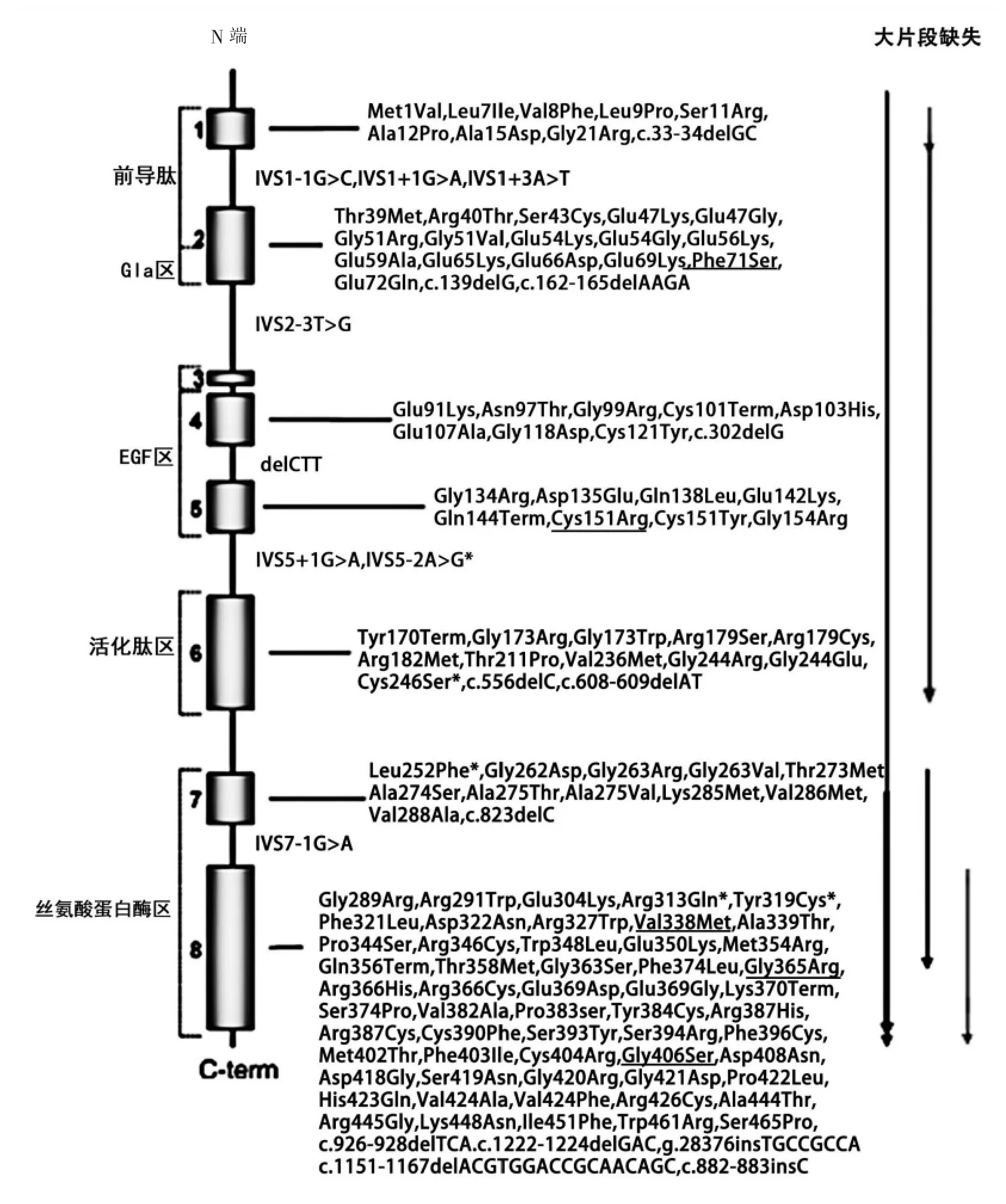
图5 F10 结构以及发现的突变
3.先证者3:先证者3 携带Cys246Ser 以及Tyr319Cys 2 种新的F10 突变。Cys246 位于活化肽区,Cys240 和Cys246 之间形成二硫键,维持该区域的结构稳定性,丝氨酸取代半胱氨酸,可能破坏了Cys240-Cys246 二硫键的形成,影响蛋白质折叠及蛋白质转运。Tyr319 位于FⅩ蛋白的丝氨酸蛋白酶区,该位点在空间位置上靠近由His276、Asp322 以及Ser379 形成的活性中心,因此Tyr319Cys 突变可能会影响蛋白质功能。先证者3 为Ⅱ型FⅩ缺陷症患者,存在月经量多、外伤后出血等轻型出血表现。
4.先证者4:先证者4 存在Gly365Arg 和Leu252Phe 2 种F10 突变。Gly365Arg 突变已被报道,该突变导致Ⅱ型FⅩ缺陷症[20],Gly365 位于FⅩ因子2 个β 折叠之间,对于FⅩ蛋白结构稳定起了很大作用,Gly365Arg 突变使得甘氨酸被精氨酸取代,破坏氨基酸残基间的相互作用,从而导致蛋白质部分错误折叠。Leu252 位于FⅩ蛋白的活化肽区,并组成了一条疏水性的β 链,亮氨酸被苯丙氨酸取代后,可能会破坏β 链的结构,导致蛋白质的错误折叠并进一步影响FⅩ蛋白的功能。先证者4为Ⅱ型FⅩ缺陷症患者,3 条不同途径的FⅩ∶C 均在5%左右,而FⅩ∶Ag 则为35.4%,且存在自发鼻出血、牙龈出血,皮肤易发淤斑等轻型出血症状。文献报道了Gly365Arg 突变导致的1 例Ⅱ型FⅩ缺陷症患者,而其FⅩ∶Ag 为35.4%,仅为正常值的一半,因此新突变Leu252Phe 很可能会导致Ⅰ型FⅩ缺陷症。
5.先证者5:先证者5 携带Arg313Gln、IVS5-2A>G 2 种新的F10 突变,其中Arg313 位于FⅩ蛋白的丝氨酸蛋白酶区,该位置与Arg327 邻近,Arg327 位于与FⅤa 结合位点的区域内,因此313位精氨酸被谷氨酰胺取代后,很可能会影响到蛋白质构象从而影响FⅩa 与FⅤa 的结合。IVS5-2A>G 可能会影响到FⅩ蛋白质剪切,产生不稳定的mRNA,从而导致其在体内降解过快。先证者5 为Ⅰ型FⅩ缺陷症患者,无明显的出血症状。
6.先证者6:先证者6 存在Phe71Ser、Cys151Arg 2 种F10 突变。Phe71Ser 也在先证者1身上发现,而Cys151Arg 此前也由Liang 等[13]进行了报道。Cys151 位于表皮生长因子2 结构域,并与Cys164 间存在二硫键,与FⅩ蛋白的二级结构相关。当半胱氨酸被精氨酸取代后,可破坏此二硫键,并严重影响FⅩ蛋白的正确折叠、稳定性及分泌。在此前的报道中,Cys151Arg 被发现于1 例双杂合FⅩ缺陷症患者中,该患者为Ⅰ型FⅩ缺陷症患者,存在颅内出血等重型出血表现。先证者6 为Ⅰ型FⅩ缺陷症患者,表现为重型出血,包括关节出血及肌肉血肿等症状。
二、TGT 的价值
FⅩ缺陷症是一种罕见的出血性疾病,由于患者携带突变的不同,临床表现存在异质性,重则危害生命,轻则无出血症状,FⅩ∶C 不能较好地预测患者的出血状况,而TGT 是一种可以较全面地评估机体凝血功能的检测方法,因此本研究对这6 例先证者及其部分家系成员进行TGT 的检测,来研究TGT 可否作为预测FⅩ缺陷症患者出血情况的有效检测手段。分析患者的临床表现及TGT 结果可以发现,在FⅩ缺陷症患者中LT、TTP 均存在不同程度的延长,其中先证者4 延长程度最甚,但LT 及TTP 在无出血症状患者、重型出血表现患者和轻型出血表现患者间差异无统计学意义(P>0.05)。6 例FⅩ缺陷症患者的ETP 和峰值均明显降低,表明在FⅩ缺陷症患者中凝血酶生成量存在不同程度的减少,并且在无出血症状患者、重型出血表现患者和轻型出血表现患者间差异有统计学意义(P<0.05),因此,在FⅩ缺陷症患者中,TGT 的ETP 及峰值可以预测、评估患者的出血状况。但存在轻型出血症状的先证者2 的ETP 和峰值分别占到了正常对照的78.77%和60.34%,与其临床出血表现不符,这可能是由于该患者机体内的凝血状况受到了除FⅩ因子以外其他因素的影响,具体的原因有待于进一步研究。
总之,FⅩ缺陷症是一种非常少见的遗传性出血性疾病,本研究在6 个FⅩ缺陷症家系中发现了10 种F10 突变,其中包括5 种新突变,并且探讨了6 例FⅩ缺陷症患者可能的分子发病机制,另外,在本研究中发现1pM TF 激活下的TGT 中测得的ETP 及峰值与FⅩ缺陷症患者的临床表现间具有相关性,因此TGT 中的ETP、峰值结合常规凝血指标及FⅩ∶C 可以作为评估FⅩ缺陷症患者出血倾向的有效手段,对临床预防和治疗起一定的作用。
