不同菌株对发酵大豆后熟期间品质特性的影响
2018-12-26,,,,,-
,,, ,, -
(1.齐鲁工业大学(山东省科学院),山东省科学院生物研究所,山东济南 250103; 2.好当家集团食品检测中心,山东荣成 264305; 3.建国大学(韩国),分子生命工学学科,韩国首尔 143701)
发酵豆制品在全世界有着悠久的历史,大豆中含有的抗营养因子经过浸泡、蒸制被破坏;在发酵过程中,大分子物质被微生物酶解,变得更容易吸收,并且发酵后大豆的风味也得到了改善。发酵的过程中,蛋白质和多糖类物质在发酵菌株的作用下,生成各种氨基酸和可溶性寡糖类物质,从而产生特有的风味。韩国代表性的大豆发酵制品有大酱、清麴酱、干酱等,于此相类似的发酵豆制品在中国、日本等亚洲地区有着悠久的历史[1]。
传统的大豆发酵类产品在制作过程中应用了多种微生物,主要以Aspergillus属、Penicillium属为常见菌株,根据地域不同,其他类型的豆豉中也发现了Mucor属,、Rhizopus属、Absidia属等[2]。中国的细菌型豆豉多以Bacillussp.为主要发酵菌株,其中B.megaterium和B.subtilis较多。迄今为止,世界各地的发酵大豆产品中分离了多种菌株,经鉴定,丝状菌多为Aspergillus属、Rhizopus属、Absidia属、Mucor属菌株,细菌类多为B.subtilis、B.pumilus菌株,酵母类以Saccharomyces较为常见[3]。A.oryzae是大豆发酵工艺中常见的曲霉菌株之一,能产生优良的蛋白酶和淀粉酶,使豆类或谷物类在发酵期间产生独特的酱香味[4]。张建华[5]在曲霉型豆豉发酵机理研究中,通过优化发酵工艺改良了豆豉的风味。黄占旺[6]在纳豆混菌发酵技术研究中,利用A.oryzae和B.natto菌协同发酵技术,提高了大豆制品中nattokinase酶活性和氨基酸含量,并且改善了其风味口感。刘锦绣等[7]的研究结果显示,利用不同株枯草芽孢杆菌发酵的大豆,比单一菌株发酵大豆的中游离态异黄酮含量更高,且抗氧化能力更强。同时,毛霉属也是在发酵食品中广泛应用的菌株之一,在永川豆豉发酵中以M.racemosus为主。夏岩石等[8]在利用毛霉菌优化豆豉前发酵的研究中发现,发酵过程中蛋白酶活性的提高,使大豆蛋白得到更充分的水解,氨基态氮含量升高的同时,发酵大豆的硬度下降,改善了毛霉豆豉的品质。
目前,大豆发酵方向的研究工艺很多,但利用细菌和霉菌进行混合发酵的工艺并不常见。本研究不仅利用三种单一菌株发酵大豆,并且利用混菌发酵工艺对大豆发酵食品的品质特性进行了改善,对总计7种样品进行品质特性分析,以期为发酵大豆制品的工艺改进提供理论依据。
1 材料与方法
1.1 材料与仪器
Aspergillusoryzae(KACC 40247)、Mucorracemosus(KACC 40270) 购自韩国农业微生物保存中心(Korean Agricultural Culture Collection);B.subtilis菌株 分离于韩国市售清麴酱(cheonggukjang);营养琼脂培养基、脱脂乳粉、马铃薯葡萄糖琼脂培养基、营养肉汤培养基 美国Becton Dickinson and Company公司;食盐 山东肥城精制盐厂;大豆 韩国首尔地区;其他试剂 均为化学纯,韩国Samchun Pure Chemical公司。
pH计 美国Woonsocket;CR-400色度计 日本Konica Minolta Inc.。
1.2 实验方法
1.2.1 菌株的分离B.subtilis菌株的培养:取清麴酱1 g于9 mL灭菌蒸馏水中,振荡30 min后,经稀释10-5~10-7后,在含有2%脱脂乳粉的营养琼脂平板培养基上涂布分离,并在37 ℃培养24 h。接种前取1个菌落,于营养液体培养基中,在37 ℃摇床中120 r/min转速下,培养48 h。
A.oryzae及M.racemosus霉菌的培养:干燥菌体用2 mL灭菌水制成悬浊液后,经稀释至10-7后,在马铃薯葡萄糖琼脂平板培养基上涂布分离,并在28 ℃下培养96 h。接种前取少量孢子,置于马铃薯葡萄糖液体培养基中,培养3~4 d,待孢子长出为止。
1.2.2 大豆发酵工艺流程
1.2.2.1 细菌型发酵 精选大豆1 kg洗净,置于纯净水中浸泡20 h,在120 ℃下蒸煮2 h至大豆完全熟软。待冷却后,将准备的B.subtilis种子液10 mL(2%)均匀接种于大豆表面,37 ℃下发酵 48 h。随后接种3%食盐,并搅拌均匀,于20 ℃下进入后熟(后酵)阶段。该样品命名为B。
1.2.2.2 霉菌型发酵 霉菌型发酵工艺在孙成行[9]的基础上进行修改。大豆浸泡蒸煮后,接种霉菌悬液5 mL(1%),置于28 ℃下发酵96 h至孢子长出。添加3%食盐均匀搅拌后,放入35~38 ℃进入后熟阶段。接种A.oryzae菌株的样品命名为A,接种M.racemosus的样品命名为M。
1.2.2.3 混菌型发酵 在蒸煮好的大豆表面先接种2%的B.subtilis菌株,于37 ℃下发酵48 h,再接种1%的A.oryzae菌株,在28 ℃下二次发酵96 h。加入3%的食盐搅拌后35 ℃下进行后熟,并命名该样品为BA。
在蒸煮好的大豆表面先接种1%的A.oryzae菌株,置于28 ℃下发酵96 h,再接种2%的B.subtilis,于37 ℃下发酵48 h。加入3%的食盐搅拌后在25 ℃下后熟。并命名该样品为AB。
样品BM依照BA的制作工艺,样品MB遵从AB的制作工艺。各个样品在后熟阶段中的0、1、3、5、7、9 d进行取样保存,待用。
1.2.3 指标的测定
1.2.3.1 粗酶液的制备 各取10 g发酵大豆,加入100 mL蒸馏水,室温下振荡30 min后,10000 r/min离心20 min,取上清液为待测粗酶液。
1.2.3.2 粗蛋白酶活性测定 蛋白酶活性测定方法依照Anson[10]方法实施。样品每1 g作用生成酪氨酸1 μg作为1 U。
1.2.3.3 粗淀粉酶活性测定 粗淀粉酶活性的测定按照DNS方法[11],测定一定时间内粗酶液水解淀粉后得到葡萄糖的量进行换算。酶活性定义为1 min 1 μg葡萄糖的生成量为1 U活性。
1.2.3.4 还原糖含量测定 还原糖含量测定同样依照DNS方法[11],取1 mL样品粗酶液,加入3 mL DNS试剂,后续操作同粗淀粉酶活性测定。还原糖计算公式为:
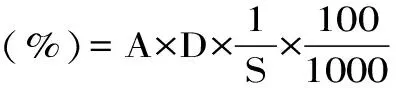
式(1)
式中:A-样品的还原糖含量(mg);D-稀释倍数;S-样品的质量(g)。
1.2.3.5 氨基态氮含量测定 福尔马林溶液加2~3滴酚酞指示剂,用0.1 mol/L NaOH中和至红色。取10 g发酵大豆样品,加入100 mL蒸馏水中,微沸后定容至250 mL,过滤取上清液25 mL至20 mL中性福尔马林溶液,并加入20 mL蒸馏水。对照组在样品滤液中加入40 mL蒸馏水。用4 g/L NaOH分别滴定至微红色,通过消耗的NaOH量计算氨基态氮含量[12]。
式(2)
式中:V1-实验组消耗量(mL);V0-对照组消耗量(mL);F-4 g/L NaOH溶液的当量;D-稀释倍数;S-样品取量(g);0.0014-4 g/L NaOH溶液1 mL相对应氮含量(g)。
1.2.3.6 铵态氮含量测定 取氨基态氮测定实验相同滤液0.1 mL,加入A溶液和B溶液各2 mL,37 ℃反应20 min后,630 nm处测定其吸光度。用(NH4)2SO4做标准曲线。A溶液:苯酚 10 g和硝普钠 0.05 g溶于1 L蒸馏水中。B溶液:Na2HPO4·12H2O 9 g,NaOH 6 g,NaOCl 10 mL溶于1 L[13]。
1.2.3.7 pH与滴定酸度测定 取粗酶液10 mL,用pH计直接测定样品的pH;滴定酸度需要取粗酶液20 mL,用4 g/L NaOH滴定至pH8.2所消耗的量进行计算。
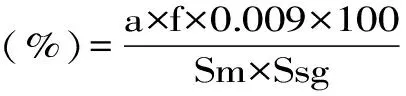
式(3)
式中:a-4 g/L NaOH溶液消耗量;f-4 g/L NaOH 酸碱价;0.009-4 g/L NaOH溶液 1 mL相当于中和酸的克数;Sm-样品量;Ssg-样品比重。
1.2.3.8 色度测定 用色度计对冻干后样品的明度L*值、红色度a*值、黄色度b*值进行测定,反复5次取平均值。标准白色版标准为L*(87.1),a*(0.3159),b*(0.3231)。
1.3 数据处理
每个实验平行测定四次,数据分析采用SPSS 19.0进行处理,通过ANOVA利用Duncan’s multiple range test进行显著性差异分析(p<0.05)。
2 结果与分析
2.1 不同菌株发酵大豆后熟期间粗蛋白酶活性的变化
通过图1可知,后熟初期所有样品的粗蛋白酶活性呈上升趋势,后随着时间推移有下降的趋势。样品B和AB在后熟5 d现出最大活性(B:(257.32±3.04) U/g,AB:(161.91±0.81) U/g)。但样品BA((95.07±0.44) U/g),M((201.21±2.76) U/g),MB((248.71±6.72) U/g)和BM((175.83±2.60) U/g)在第3 d达到最大活性。样品A在第7 d活性最高((248.47±5.01) U/g)。
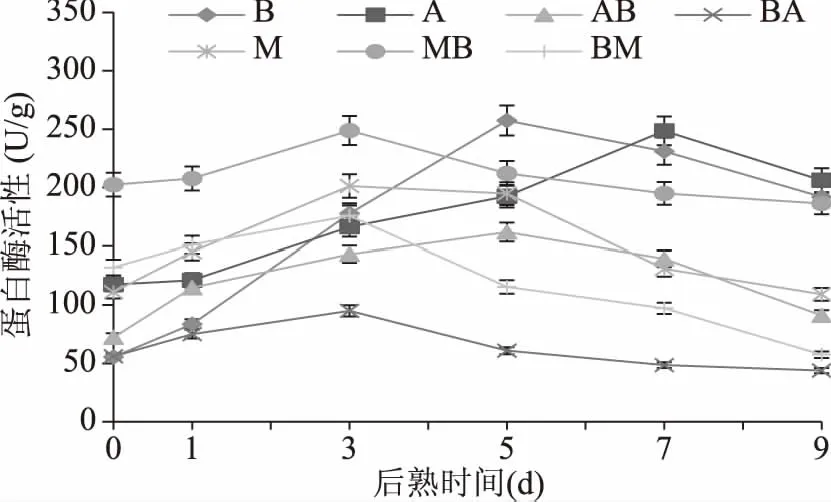
图1 不同菌株发酵大豆在后熟期间的蛋白酶活性变化Fig.1 Changes of protease activity in soybeans fermented by different microorganisms with aging time
样品AB和BA比较中,A.oryzae先接种的样品酶活性更高,同样M.racemosus先接种的MB比BM酶活性更高。所有样品中,在后熟后期,营养源和氧含量不足导致微生物生长减少,造成酶活性下降。
袁小娟[14]在利用Mucor属和Bacillus属菌株1∶1接种发酵的大豆制品中蛋白酶活性较高。刘锦绣[15]在两种混菌豆豉发酵72 h期间,测得其蛋白酶活性成上升趋势,与本研究结论相同。方雅洁等[16]研究的结论中,混合M.mucedo和B.natto菌株接种4%后发酵56 h时,风味最佳且蛋白酶活性最高,与本研究中的样品MB比M有更高的蛋白酶活性的结论一致。
2.2 不同菌株发酵大豆后熟期间粗淀粉酶活性的变化
各样品粗淀粉酶活性的测定结果如图2所示,后熟期间M.racemosus发酵组淀粉酶活性最高,其余各组结果差异不大。M组合BM组后熟第1 d酶活性最大,之后缓慢降低,样品B、A和MB在后熟第5 d达到最高活性。
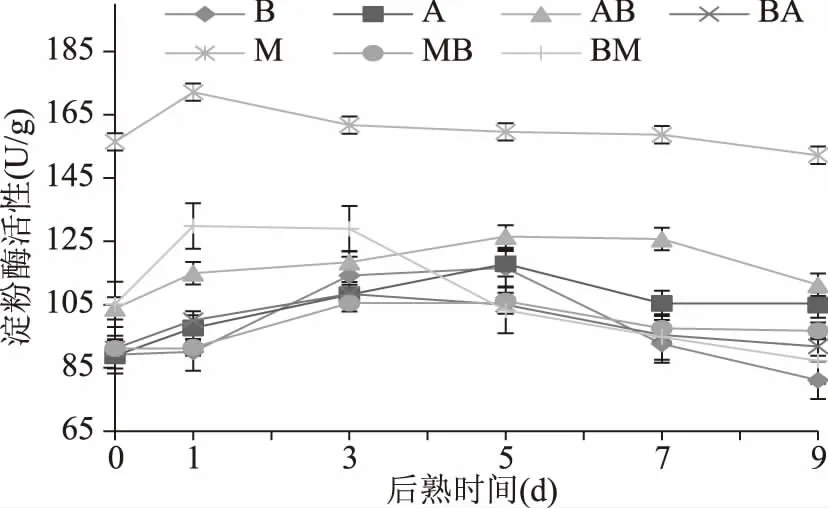
图2 不同菌株发酵大豆在后熟期间的淀粉酶活性变化Fig.2 Changes of amylase activity in soybeans fermented by different microorganisms with aging time
本实验中Aspergillus属菌株参与发酵组中,测得最大活性为AB>A>BA顺序,可得知A.oryzae先接种的实验组比B.subtilis先接种实验组的淀粉酶活性高,这与蛋白酶活性测定实验中的结论一致。
孙成行[9]在混合菌发酵豆豉制作工艺的研究中表明,菌株接种方式不同将产生酶活性差异。混菌接种后的发酵和后熟期间,不同菌株之间存在营养成分竞争关系,也会存在多种代谢产物相互作用,导致多种酶活性的环境发生变化。刘锦绣[15]在研究中利用两种B.subtilis同时混合接种发酵,结果显示,β-glucosidase酶活性有所增加,与本实验结果相似。本实验中结果中可知,样品AB、A和B的淀粉酶最大活性为AB>A>B,这表明,在混合接种发酵时样品AB比单一菌株发酵的A和B样品淀粉酶活性高。
2.3 不同菌株发酵大豆后熟期间还原糖含量的变化
各样品还原糖含量变化如图3所示。M.racemosus菌种接种的样品中还原糖相对于其他样品组更高。样品M和MB在后熟其间还原糖含量与其他组的变化趋势相似,样品M中还原糖含量在0 d时为0.94%,1 d时上升到1.17%,并在第9 d时,下降到0.99%。样品MB中第1 d时,含量最高为,0.43%,第9 d时减少为0.29%。样品B、AB和BM中后熟3 d时分别为0.73%、0.81、0.32%,随后呈下降趋势。样品BA和A中还原糖含量随后熟时间一直保持下降趋势且无明显差异。
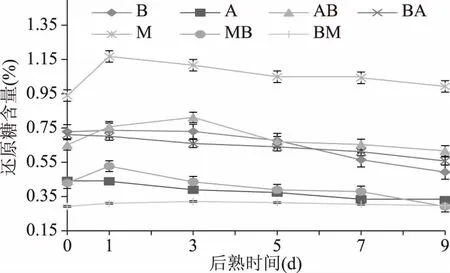
图3 不同菌株发酵大豆在后熟期间的还原糖含量变化Fig.3 Changes of reducing sugar contents in soybeans fermented by different microorganisms with aging time
本实验结果与淀粉酶活性结果中,样品M活性最高,因此在较高淀粉分解能力下,还原糖浓度也比其他组高。比较样品AB和BA还原糖的最高含量,样品AB在后熟第3 d达到0.81%,BA在后熟0 d时为0.71%,A.oryzae先接种的样品比B.subtilis先接种的样品中还原糖最高量更高。后熟期间样品B和A的还原糖含量为0.74%、0.44%。混菌发酵的样品AB和BA与单菌发酵样品B还原糖含量差异不大,但比单菌发酵样品A有所增加。
孙成行[9]在利用Aspergillus属和Bacillus属菌株混合发酵大豆的研究中指出,0~24 h中,还原糖含量上升到18.638 mg/g之后呈下降趋势,这与本实验中还原糖含量变化趋势一致。龙菊等[17]在利用M.mucedo菌株发酵腐乳的研究中测得,还原糖最高含量为1.1 g/100 g,与本实验中单一菌株发酵样品M中测得的还原糖含量(1.17%)相近。张建华[18]在利用Aspergillus发酵豆豉的研究中测得,还原糖含量在后熟24 h时上升至25 mg/g,随后在72 h内急速下降,这与本实验中样品M、AB、MB中还原糖的变化趋势相似。
2.4 不同菌株发酵大豆后熟期间氨基态氮含量的变化
从图4可以得出,大部分样品的氨基态氮含量在后熟0~9 d期间保持上升的趋势,其中样品A中氨基态氮最终含量测得为1.77%,高于其余组。样品MB、B、AB、BA分别为1.65%、1.17%、0.63%、0.45%。粗蛋白酶活性测定结果(图1)中酶活性为A>AB>BA,样品MB和A的蛋白酶最高活性相近,这与本实验中氨基态氮含量的变化一致。并且,大豆发酵期间,菌株蛋白酶生成的同时分解蛋白质,得到的氨基肽氮含量也在增加。
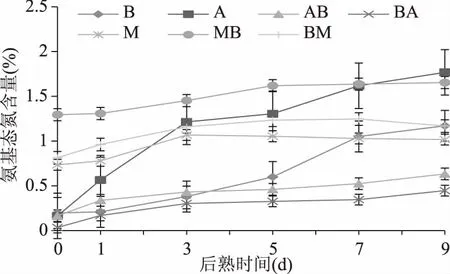
图4 不同菌株发酵大豆在后熟期间的氨基态氮含量变化Fig.4 Changes of amino type nitrogen in soybeans fermented by different microorganisms with aging time
胡鹏[19]测得利用Mucor菌株发酵豆豉中氨基态氮含量在后熟初期随着蛋白质分解积累,在后期没有明显变化,这与本实验中的结果一致。张建华[18]在Aspergillus-type豆豉的研究中得出,在蛋白酶的作用下,后熟期产氨基酸比发酵期间更多,单一菌株发酵后后熟15d时氨基态氮含量高达1.76%。黄占旺等[6]利用A.oryzae和B.natto混菌发酵豆豉在后熟60 h期间测得氨基态氮含量呈持续上升趋势。
2.5 不同菌株发酵大豆后熟期间铵态氮含量的变化
铵态氮含量变化如图5中显示,样品B和其他组样品中铵态氮含量存在较大差异。样品B利用了单一细菌发酵大豆,形成了细菌型豆豉(韩国清麴酱)特有的风味。在蛋白酶的作用下,大分子蛋白质不仅分解成氨基酸,氮元素也存在于铵态氮中。所以,蛋白酶活性的结果中,样品B虽然酶活性较高,但在氨基态氮含量测定中数值偏低(图5),蛋白质中的氮元素转化成了铵态氮。

图5 不同菌株发酵大豆在后熟期间的铵态氮含量变化Fig.5 Changes of ammoniacal nitrogen in soybeans fermented by different microorganisms with aging time
样品AB和B中铵态氮含量都在后熟期间成上升趋势,但样品B在第9 d达(64.64±0.31) mg/mL,比样品AB((20.68±0.02) mg/mL)含量更高。样品BA中铵态氮含量也呈上升趋势,但与样品B相比含量很低。并且,样品A、BA、M、MB、BM中的铵态氮含量较低,测得出其范围为1.64~8.84 mg/mL。
2.6 不同菌株发酵大豆后熟期间pH的变化
由图6得知,所有样品稀释液的pH呈下降趋势。样品BM的pH在后熟期间从7.94±0.01下降到7.56±0.02;样品MB的pH从7.75±0.01下降到7.433±0.01,两者相近。样品B在后熟0~9d期间从6.799±0.12下降到6.122±0.11;样品M从6.68±0.02下降到6.21±0.01;样品A的变化范围为6.14±0.01~5.83±0.01。样品BA从6.03±0.01下降到5.46±0.01,与AB没有明显差异。
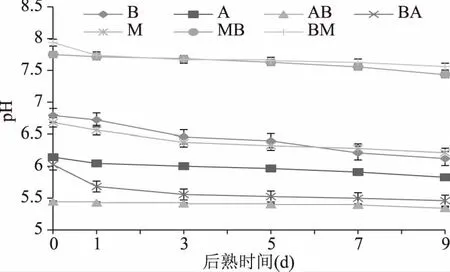
图6 不同菌株发酵大豆在后熟期间的pH变化Fig.6 Changes of pH in soybeans fermented by different microorganisms with aging time
大豆接种菌株后的发酵和后熟期间,在各种生物酶的作用下,分解大分子营养成分生成氨基酸或代谢生成有机酸,导致pH下降。张建华[18]在多种豆豉的研究中发现,发酵期间和后熟0~15d期间的豆豉pH变化范围为5~6,豆豉pH变化也与大豆的品种和浸泡时间以及发酵菌株差异有着相关性。汪立君[20]在利用Aspergillus菌株发酵豆豉的研究中发现,接种量不同会影响后熟期间pH的变化,且其范围为7.5~5,与本实验结果范围相似。胡鹏[19]毛霉型豆豉的研究中发现,后熟期间中pH呈下降趋势,并推断蛋白质和碳水化物的分解、有机酸的生成有相关关系。这些文献中的结果与本研究中的结论一致。
2.7 不同菌株发酵大豆后熟期间滴定酸度的变化
由图7中可以看出,所有样品的滴定酸度均呈上升趋势。样品BA在后熟期间的酸度从0.10%上升到0.19%,样品A从0.06%上升至0.17%。样品M的酸度则呈缓慢上升至0.11%。其余样品B、MB和BM的滴定酸度变化不大。Joo[21]在清麴酱的后熟11 d期间测得,总酸含量保持上升趋势,与本实验结果一致。胡鹏[19]在毛霉型豆豉的相关研究中测得,后熟期间总酸含量呈上升趋势。汪立君[20]在利用Aspergillus属菌株发酵豆豉中发现,菌株接种量不同的豆豉中,接种量为104cfu/g时,样品在后熟期间酸度变化范围为2.455%~4.277%,当接种量为106cfu/g时,酸度为1.385%~2.034%,该研究中的酸度变化范围和上升趋势与本实验结果接近。

图7 不同菌株发酵大豆在后熟期间的酸度变化Fig.7 Changes of titratable acidity in soybeans fermented by different microorganisms with aging time
2.8 不同菌株对发酵大豆后熟期间色度的变化
用不同发酵菌株制得的样品在后熟期间色度的变化结果(L*、a*、b*)如表1所示。所有样品的L*值变化范围为43.5~88.98,其中样品MB和BM的L*值较低,比其他组样品颜色深,并且后熟0~9 d期间,L*值有降低的趋势。这是因为,大豆在发酵后的后熟期间发生了褐变反应,导致明度下降。本实验中,样品AB和BA的L*值最高,样品A为霉菌豆豉,制作工艺与韩国大酱相仿,在后期后熟阶段最终L*值为51.51。

表1 不同菌株发酵大豆在后熟期间的色度变化(n=4)Table 1 Changes of color value in dry powder of soybeans fermented by different microorganisms with aging time(n=4)
后熟期间红色度(a*值)有明显差异,范围在2.8~12.99之间。样品A在0~9 d期间,从2.8上升至9.76,有明显的变化。同时,样品BA在6.09~8.5,M在6.86~12.99,BM在9.46~12.97之间,红色度呈上升趋势。样品B在后熟期间从7.03下降至6.89。样品AB也有相同的变化趋势。样品MB变化区间为10.24~11.42之间,其余样品a*值变化不大。
黄色度(b*值)在各样品间的差异并不大,后熟期间整体变化范围为30.18~37.66。这是由于使用了单一品种的大豆进行实验所致。Minhwa[22]利用不同品种的大豆制作清麴酱,其黄色度变化范围在7.49~15.42之间。汪立君等[23]在米曲霉豆豉的研究中发现,后熟期间L*值持续下降,有较大差异,但a*和b*值没有明显变化。但本实验中的褐变现象较为明显,可能是因不同的接种方式和制作工艺产生了不同程度的颜色加深。大豆在发酵食品中的褐变原因主要是由于在后熟期间,原料自体含有的蛋白、多肽、糖类等多种碳源成分生成melanine类的黑色素成分。Go[24]在研究中将此类豆发酵食品中发生的褐变反应称之为着色现象。
发酵微生物生成的一部分酶在氧气接触下也作用于食品的褐变反应。其中B.subtilis、B.niger等Bacillus属菌株生成酪氨酸酶结合氧以及金属离子发生发酵中的褐变效应[25]。
3 结论
本研究利用B.subtilis、A.oryzae和M.racemosus3种不同的微生物,结合韩国清麴酱、大酱,中国豆豉的发酵技术制作了7种不同的发酵大豆样品。在其后熟(后酵)期间测定了各样品的酶活性、还原糖含量、氮含量、pH、酸度、色度的变化。通过对各项指标的分析评价得知,后熟0~9 d期间,样品B的蛋白酶活性最高((257.32±3.04) U/g);样品M的还原糖在后熟第1 d达到1.17%,高于其他样品。样品A和MB氨基态氮含量较高,样品B中态氮含量最高。所有样品的pH呈下降趋势,而滴定酸度变化范围则相反,从0.02%上升到0.19%。在后熟9 d期间各样品色度中的L*值呈持续下降趋势,样品MB褐变现象明显。单一菌株接种时,样品A的品质较好,混合菌株接种时,样品MB的综合评价高于其他样品。因此,利用M.racemosus和B.subtilis混菌发酵工艺可以改进发酵大豆的品质特性。
