利用光谱技术分析加热温度对肌红蛋白结构的影响
2018-12-26,,,,
, ,,,
(南京农业大学,肉品加工与质量控制教育部重点实验室,农业部肉品加工重点实验室,江苏省肉类生产加工与质量控制协同创新中心,江苏南京 210095)
肌红蛋白是动物细胞内的色素蛋白,由一条多肽链与一个血红素辅基构成,其含量与状态是影响肉色的重要因素,对于肉品外观评定具有重要意义[1-3]。处于还原态的肌红蛋白为紫红色;当它与氧结合后,生成鲜红色的氧合肌红蛋白,是新鲜肉的标志;肌红蛋白和氧合肌红蛋白均可被进一步氧化成为褐色的高铁肌红蛋白,使肉色变暗,此时血红素中心的铁离子被氧化为正三价态[4]。
大部分的肉制品都需要经过加热之后才会被食用,加热处理会改变肉蛋白质的理化与结构特性,进而对肉制品的品质产生影响。肌红蛋白作为主要的肌浆蛋白之一,热处理会使其发生变性,严重影响肉色等品质特征,并且导致其对消化酶的敏感性发生变化,进一步影响到肉及肉制品的营养价值。Joseph等[5]研究表明,肉中肌红蛋白随加热时间延长变性程度不断增加;Berisha等[6]发现,肌红蛋白在100 ℃加热时,蛋白的二、三级结构发生剧烈变化;王琳可[7]发现不同温度下加热鸡肉,肉中三种形式的肌红蛋白所占比例不同,且会出现一个使肌红蛋白状态发生转变的关键温度。黄明等[8]研究表明,猪肉色泽随加热温度增加而增加;黄甜和李升升等[9-10]研究表明,加热后鸡肉和牛肉亮度值L*和红度值a*会发生变化,同时热处理会使肉品质下降。
目前,对于肌红蛋白的研究主要集中在对肉品呈色机理的探讨和肉品色泽的评定。而应用模拟体系,对加工过程中的物理因素导致肌红蛋白结构变化进而影响肉品质的研究尚不深入。本研究利用多种光谱技术,重点研究加热处理对纯肌红蛋白结构的影响,以期为实际热加工引起的蛋白质结构和营养价值的变化提供理论基础,为肉类加工与合理消费提供一定的科学依据。
1 材料与方法
1.1 材料与仪器
马骨骼肌肌红蛋白 美国Sigma Aldrich公司;盐酸、磷酸氢二钠、磷酸二氢钾、8-苯胺-1-萘磺酸(ANS)等 均为分析纯。
TW 20水浴锅 德国Julabo公司;Fiveeasy台式pH计 瑞士Mettler Toledo公司;J-1500圆二色谱仪 日本JASCO公司;UV-2450紫外分光光度计 日本岛津公司;RF-5301荧光分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 肌红蛋白溶液的制备及处理 配制10 mmol/L磷酸盐缓冲液(含10 mmol/L Na2HPO4与10 mmol/L NaH2PO4,pH7.0)。将肌红蛋白溶解于上述磷酸盐缓冲液,配制为0.5、2 mg/mL的蛋白溶液。将配制好的肌红蛋白溶液分别置于60、70和80 ℃水浴中加热20 min,然后将样品从水浴锅中取出并迅速浸入冰中,待溶液中心温度恢复至室温后,进行下述测定。
1.2.2 紫外-可见吸收光谱 取3 mL肌红蛋白溶液(0.5 mg/mL),置于石英比色皿中,以10 mmol/L 磷酸盐缓冲液为参比,测定并记录250~650 nm的紫外-可见吸收光谱。
1.2.3 内源荧光光谱 取3 mL肌红蛋白溶液(0.5 mg/mL),置于1 cm石英比色皿中,以280 nm为激发波长,在荧光分光光度计上记录300~400 nm波长范围内的荧光发射光谱。
1.2.4 同步荧光光谱 取3 mL肌红蛋白溶液(0.5 mg/mL),置于1 cm石英比色皿中,改变发射波长λem与激发波长λex之间的波长差Δλ,λem=λex+Δλ[11]。固定Δλ分别为30和60 nm,同时对激发和发射波长进行扫描,并记录相应波长范围内的同步荧光光谱。
1.2.5 圆二色光谱 移取200 μL处理后肌红蛋白溶液(0.5 mg/mL)于0.1 cm的石英样品池,测定190~250 nm波长范围的光谱[12]。设置测量参数为:扫描速率200 nm/min,带宽1 nm,分辨率0.5 nm,响应时间1 s,扫描次数3次,取平均值。
1.2.6 表面疏水性的测定 肌红蛋白的表面疏水性测定参考Schma等[13]的ANS探针方法,并略做改动。取20 μL的ANS溶液(10 mmol/L,pH7.0的0.01 mol/L磷酸盐缓冲液配制)与2 mL肌红蛋白溶液混匀(2 mg/mL),室温避光0.5 h后,以375 nm为激发波长,记录465 nm处荧光的强度变化。
1.3 数据分析
每个处理组设置五个重复,进行上述各项指标的测定并进行相关参数分析,用SAS 8.0对测定的数据进行标准差的分析计算。
2 结果与分析
2.1 紫外-可见吸收光谱
蛋白质中的芳香氨基酸残基侧链和肽键对光的吸收会产生紫外光谱[14]。蛋白质的构象变化会导致紫外吸收的光谱变化,因此蛋白质构象信息可由紫外吸收光谱的变化反映。如图1,对肌红蛋白溶液进行250~650 nm的全波长扫描发现其紫外-可见吸收光谱特征符合高铁肌红蛋白光谱特征,可见实验所购肌红蛋白几乎全部为高铁肌红蛋白形式。

图1 加热温度对肌红蛋白紫外-可见吸收光谱的影响Fig.1 Effect of heating temperature on UV-VIS spectroscopy of myoglobin注:a为Soret带;b为Q带;c为LMCT带。
当扫描波段处于紫外光区时,所有处理组肌红蛋白特征吸收峰均在280 nm附近,这是由肽链上色氨酸和酪氨酸的苯杂环发生了π-π*跃迁[15]。由表1可见,样品的紫外吸收强度随温度升高而呈降低趋势。表明随着温度升高,肌红蛋白变性程度增加,蛋白逐渐发生沉降损失,造成280 nm处吸光值显著降低(p<0.05)。
高铁肌红蛋白血红素辅基中的铁原子是六配体,它与四个吡咯环的氮原子相连,同时其第五配位与多肽链的His-93残基结合、第六配位与一个水分子结合后,分别在409 nm(Soret带)、504 nm(Q带)以及630 nm(LMCT带)出现特征谱峰[16]。如图1可见,当扫描波段位于可见光区时,吸收图谱出现了3处特征峰。卟啉环共轭体系的π-π*跃迁导致Soret带和Q带产生吸收峰,可据此分别判断铁卟啉结构的变化以及铁原子与多肽链的结合情况。表1为加热温度对紫外-可见吸收光谱特征峰的影响。由表1可知,60 ℃和70 ℃加热时,409 nm处吸收强度变化不显著(p>0.05),而80 ℃加热后该处吸光值显著低于对照组(p<0.05),表明加热温度达80 ℃会导致铁卟啉结构的破坏。504 nm处的特征峰强度均随着加热温度升高呈降低趋势。且60 ℃加热时504 nm处吸收强度即显著低于对照组(p<0.05),可能是加热导致了中心铁原子和远端组氨酸之间的结合减弱,表明该结构对加热较为敏感。
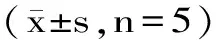
表1 加热温度对紫外-可见吸收光谱特征峰的影响Table 1 Effects of heating temperature on spectral characteristic peaksof UV-VIS
2.2 内源荧光光谱
肌红蛋白的内源荧光主要来源于色氨酸(Trp)和酪氨酸(Tyr),可灵敏反映环境对蛋白的影响,被广泛应用于蛋白质结构的研究[17]。如图2,肌红蛋白的内源荧光最大发射峰在360 nm附近。表2为加热温度对同步荧光光谱特征峰的影响。由表2可见,仅80 ℃加热使荧光强度显著高于对照组(p<0.05),而60、70 ℃加热后荧光强度变化不显著(p>0.05)。可能是因为,加热温度低于80 ℃加热时,肌红蛋白的变性程度较小或仍未可逆变性,蛋白结构变化较小,因而荧光强度变化不显著(p>0.05)。温度达80 ℃时,蛋白变性使多肽链展开,疏水基团暴露程度增高,使得荧光强度显著增高(p<0.05)。
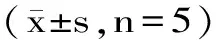
表2 加热温度对同步荧光光谱特征峰的影响Table 2 Effects of heating temperature on the characteristic peaks of synchronous fluorescence
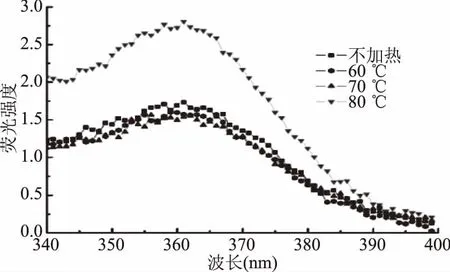
图2 加热温度对肌红蛋白内源荧光光谱的影响Fig.2 Effect of heating temperature on intrinsic fluorescence spectra of myoglobin
2.3 同步荧光光谱
芳香族氨基酸引起肌红蛋白280~400 nm处的荧光,当Δλ=30 nm时,同步荧光光谱仅表现酪氨酸残基的荧光特性;当Δλ=60 nm时,仅表现色氨酸残基的荧光特性。酪氨酸与色氨酸荧光最大发射波长处的荧光变化见表2。
图3a显示,Δλ=30 nm时,最大荧光发射峰出现在329 nm附近。60 ℃加热时,酪氨酸荧光光谱未见明显改变;70 ℃时,酪氨酸最大发射峰强度显著降低(p<0.05);而80 ℃时显著增加(p<0.05)。推测该现象与肌红蛋白变性过程中发生的血红素解离与多肽链展开有关。温度较低时,血红素解离造成部分酪氨酸残基的损失,而多肽链尚未展开,导致酪氨酸荧光强度下降;温度较高时,多肽链迅速展开,血红素口袋打开,使酪氨酸荧光强度增大。
图3b显示,Δλ=60 nm时,最大荧光发射峰在353 nm附近。80 ℃加热时,荧光强度显著高于其他处理组(p<0.05),可能是因为其多肽链变性程度增加,血红素口袋逐渐打开,色氨酸残基暴露程度随之增加。
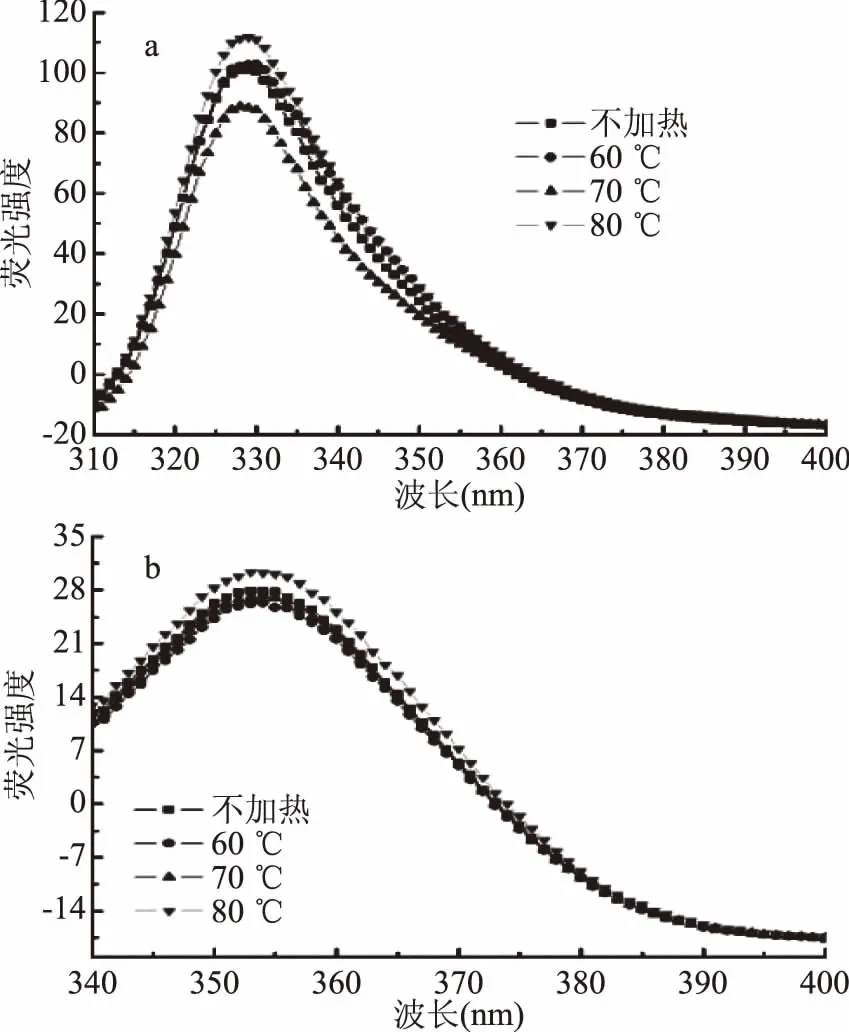
图3 加热温度对肌红蛋白同步荧光光谱的影响Fig.3 Effect of heating temperature on Synchronous fluorescence spectra of myoglobin 注:a为酪氨酸残基,Δλ=30 nm; b为色氨酸残基,Δλ=60 nm。
同步荧光结果表明,色氨酸残基比酪氨酸残基对加热处理更为敏感,在60 ℃加热时色氨酸残基荧光强度即发生显著变化(p<0.05)。这可能与两种氨基酸残基的位置分布有关,酪氨酸为极性基团,而色氨酸为疏水性较强的非极性基团[18]。因此酪氨酸残基分布在肌红蛋白表面,色氨酸残基则处于血红素口袋中。由于酪氨酸残基本来就在蛋白表面,因此在较低温度加热时,其暴露程度与对照组无显著差异(p<0.05),而血红素的暴露及脱落变化则较为显著,即外界加热对色氨酸残基的影响更大。
2.4 圆二色谱
圆二色谱是一种测定溶液中蛋白质二级结构的灵敏技术[19]。蛋白质二级结构的规律取决于肽键的有序排列,其排列方向决定了能级跃迁的分裂情况,因此蛋白质的二级结构发生改变,其CD谱峰随之变化[20]。
如图4,肌红蛋白的圆二色光谱在192 nm附近出现一个正吸收峰,209和223 nm附近出现两个负吸收峰,这是典型的α螺旋结构特征CD峰,表明α-螺旋为该蛋白二级结构主要成分[21]。加热后,CD特征峰强度发生略微改变,但肩峰的位置和形状都没有发生明显改变,表明加热虽然改变了蛋白二级结构组成,但α-螺旋结构仍占主导地位。肌红蛋白二级结构各成分含量见图5。随着加热温度的升高,α-螺旋呈先增后减趋势,在60 ℃加热时增加,而加热温度高于70 ℃时,α-螺旋含量逐渐降低,肌红蛋白结构的无序化程度增高。Moriyama等[22]指出,当加热温度低于75 ℃并且加热后恢复至室温时,肌红蛋白的α-螺旋含量可基本恢复至初始值,即低于75 ℃的加热为可逆加热;但当加热温度高于75 ℃时,二级结构的变化则不可逆转,α-螺旋含量显著降低。这与本研究结果相似,但在本研究中温度高于70 ℃加热时,二级结构含量出现显著变化(p<0.05),表明70 ℃时已发生不可逆加热,可能是与之前研究的蛋白生物来源不同导致的差异。
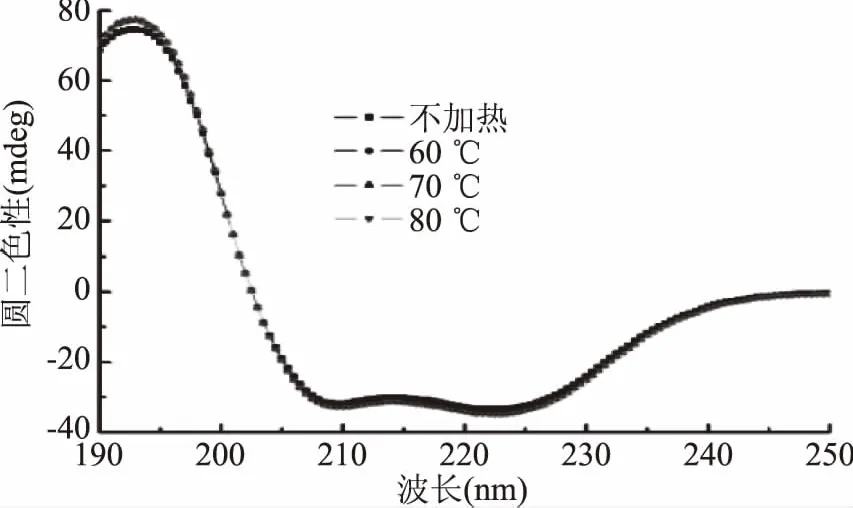
图4 加热温度对肌红蛋白圆二色光谱的影响Fig.4 Effect of heating temperature on CD spectra of myoglobin
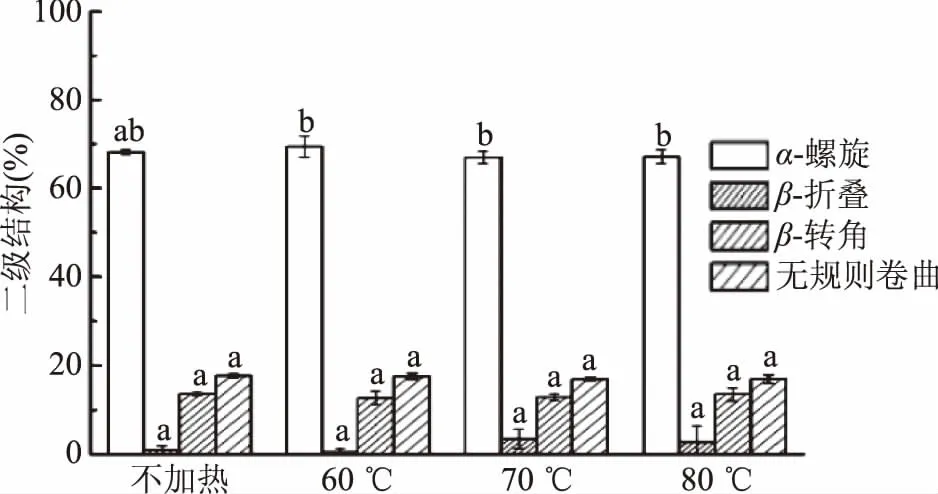
图5 加热温度对肌红蛋白二级结构影响Fig.5 Effect of heating temperature on the secondary structure of myoglobin 注:不同字母表示加热温度不同时差异显著(p<0.05);图6同。
2.5 表面疏水性
疏水相互作用力是维持蛋白三级结构中最重要的稳定力。以ANS作为荧光探针,可反映蛋白的三级结构变化情况[23]。通常来说,加热会导致疏水氨基酸残基的暴露,使蛋白质的疏水性增加。以最大吸收波长475 nm处荧光强度表征不同加热程度处理的肌红蛋白的疏水性,结果见图6。加热后肌红蛋白表面疏水性均显著高于对照组(p<0.05),但不同温度处理组的结果无显著性差异(p>0.05)。表明加热后肌红蛋白的三级结构展开,从而利于ANS与蛋白疏水部位结合。70 ℃时表面疏水性略有下降,与酪氨酸荧光的结果一致,表明70 ℃加热时肌红蛋白血红素沉积的阻碍作用较为明显。

图6 加热温度对肌红蛋白表面疏水性的影响Fig.6 Effect of heating temperature on surface hydrophobicity of myoglobin
3 结论
本研究中,随着加热温度的增高,肌红蛋白紫外可见光谱特征峰吸收强度降低,血红素铁原子与多肽链结合力减弱,血红素逐渐解离沉积,蛋白变性损失;荧光光谱特征峰强度和表面疏水性增高,多肽链逐渐展开,极性基团暴露,三级结构发生明显改变;α-螺旋含量降低,蛋白二级结构的无序化程度增高。肌红蛋白虽然具有一定的耐热性,但高温加热仍会导致非血红素铁的释放和蛋白结构的无序化,加热温度不超过70 ℃时,肌红蛋白主要发生三级结构的局部变化,但高于70 ℃的加热会严重扰乱肌红蛋白二、三结构,且变性过程不可逆。加热导致的蛋白二级结构变化还将进一步影响蛋白质的体外消化情况[24]。实际加工中的热处理操作应把握好肌红蛋白结构发生转变的关键温度和加热时间,避免过度加热。
