山奈抗氧化活性部位研究
2018-12-26,,,
,, ,
(1.重庆工商大学环境与资源学院,重庆 400067; 2.天然药物研究重庆高校市级重点实验室,重庆 400067; 3.重庆工商大学评估与督导办公室,重庆 400067)
越来越多的证据显示,在细胞损伤、癌症、衰老和动脉粥样硬化等众多人类疾病的发病机制中,自由基和活性氧产生了相当大的危害[1],自由基也会导致食物的脂质过氧化从而引起食物变质[2]。虽然通过添加合成抗氧化剂(如二丁基羟基甲苯(BHT)、丁基羟基茴香醚(BHA)和特丁基对苯二酚(TBHQ)),可以预防食品氧化,但是由于这些人工合成抗氧化剂存在一定的安全问题,最近对天然抗氧化剂的关注越来越多[3]。近年来,人们对水果、蔬菜、种子、茶叶、葡萄酒和许多植物中的天然抗氧化剂进行了广泛的研究,因为这些天然抗氧化剂,如多酚、黄酮类化合物和维生素,做为抗氧化损伤的化学预防剂,能有效清除自由基,减少对细胞造成的损伤,并参与调节体内氧化-抗氧化平衡,能有效防止某些氧化相关慢性疾病[4-5]。
山奈(KaempferiagalangaL.),又名沙姜、三赖、山辣和三奈等,多年生宿根草本植物,原产于热带地区,我国主产广西和广东两省区。山奈气芳香且浓烈、味辛辣,既是著名的食物调料,又是著名的香料。同时山奈有行气、温中和止痛的功效,2014年,被中华人民共和国卫计委增列为食药两用中药材物质。现代药理研究表明,山奈具有抑制胃溃疡[6]、镇痛[7]、镇静[8]、抗癌[9]、防晒10]和抗氧化[11-13]等功效。山奈药食两用、食用安全,粗提物已发现有较好的抗氧化活性,但是报道很少。
山奈提取物活性测试较为简单,且主要集中在其乙醇提取物对食用油脂的抗氧化活性研究,为进一步明确山奈的抗氧化活性,确定山奈抗氧化活性部位,便于进一步寻找其抗氧化活性成分,从中筛选出高效、安全的天然抗氧化剂,更好地开发利用山奈资源,本实验制备了山奈乙醇提取物和石油醚相、氯仿相、乙酸乙酯相、正丁醇相和水余相等5个萃取部位,并分别采用DPPH和ABTS法测试了提取物和各萃取部位的抗氧化活性,以期确定山奈抗氧化活性部位,为进一步的抗氧化活性成分研究提供实验基础。
1 材料与方法
1.1 材料与仪器
山奈 重庆市某生活超市,产地为广西桂平;1,1-二苯基-2-苦基肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS) 99.9%,Sigma公司;抗坏血酸(VC) 分析纯,广东光华科技股份有限公司;过硫酸钾、95%乙醇、石油醚(60~90 ℃)、氯仿、乙酸乙酯、正丁醇 均为分析纯。
U-2910型紫外可见分光光度计 日立高新技术公司;SQP分析电子天平 赛多利斯科学仪器(北京)有限公司;KQ3200DE型数控超声波清洗器 昆山市超声仪器有限公司;RE-52AA型旋转蒸发器 上海贤德实验仪器有限公司;DZF-1B(6050)型真空干燥箱 上海龙跃仪器设备有限公司;DHG-9036A电热恒温鼓风干燥箱 北京京科瑞达科技有限公司。
1.2 实验方法
1.2.1 乙醇总提物和萃取部位的制备 山奈置60 ℃烘箱干燥1 h后,粉碎,过60目筛,称取山奈粉75 g,按1∶20 (g/mL)的固液比,用体积分数为80%的乙醇溶液浸泡1 h后,在超声功率250 W下超声波提取45 min,真空抽滤,重复提取3次,合并提取液,放入旋转蒸发仪中,60 ℃下减压回收至无醇味,得总提取液V(总)mL;取一定量体积V(1)mL总提取液置蒸发皿中,60 ℃、15 kPa下真空干燥,得到乙醇总提物M g;余下的总提取液V(2)mL,按1∶1 (V/V)的体积比依次用石油醚、氯仿、乙酸乙酯和正丁醇各萃取4次,每次静置24 h,相同萃取相合并,减压浓缩,然后在60 ℃、15 kPa下真空干燥,依次得到石油醚相、氯仿相、乙酸乙酯相、正丁醇相和水余相5个部位。
得率计算公式:
醇提物得率(%)=(M(醇提物)×(V(总)/V(1)))/M(总)×100
部位得率(%)=(M(相)×(V(总)/V(2)))/M(总)×100
式中,M(醇提物)为V(1)mL总提取液浓缩、干燥后质量,g;V(总)为总提取液体积mL;V(1)为总提取液中取出制备M(醇提物)的体积,mL;M(总)为称取的山奈粉质量,g;M(相)为每个萃取相浓缩、干燥后质量,g。
1.2.2 测试液的配制 乙醇提取物配制:准确称取乙醇提取物0.1000 g,用95%的乙醇配成质量浓度4.0 mg/mL的溶液,再按比例依次稀释,配成质量浓度为2.0、1.0、0.5、0.25、0.125 mg/mL的样液备用。
石油醚相配制:准确称取石油醚萃取部位0.4000 g,用95%的乙醇配成质量浓度为16.0 mg/mL的溶液,再按比例依次稀释,配成质量浓度为8.0、4.0、2.0、1.0、0.5 mg/mL的样液备用。
氯仿相配制:准确称取氯仿萃取部位0.0500 g,用95%的乙醇配成质量浓度为2.0 mg/mL的溶液,再按比例依次稀释,配成质量浓度为1.0、0.5、0.25、0.125、0.0625 mg/mL的样液备用。
乙酸乙酯相配制:准确称取乙酸乙酯萃取部位0.0500 g,用95%的乙醇配成质量浓度为2.0 mg/mL的溶液,再按比例依次稀释,配成质量浓度为1.0、0.5、0.25、0.125 mg/mL的样液备用。
正丁醇相配制:准确称取正丁醇萃取部位0.2000 g,用95%的乙醇配成质量浓度为8.0 mg/mL的溶液,再按比例依次稀释,配成质量浓度为4.0、2.0、1.0、0.5 mg/mL的样液备用。
水余相配制:准确称取水余液部位1.0000 g,用蒸馏水配成质量浓度为40 mg/mL的溶液,再按比例依次稀释,配成质量浓度为20.0、10.0、5.0、2.5 mg/mL的样液备用。
VC阳性对照的配制:准确称取VC0.0150 mg,用蒸馏水定容至25.00 mL,得0.6 mg/mL的抗坏血酸溶液,再依次稀释配制质量浓度为0.4、0.2、0.1、0.05、0.025、0.0125 mg/L的样品溶液。
1.2.3 DPPH法测试抗氧化活性 参考Pan等[14]和项昭保[15]的方法,准确称取25.0 mg DPPH试剂,用无水乙醇完全溶解后转移至25.00 mL容量瓶中定容,制备得浓度为1.0 mg/mL DPPH溶液,再按比例稀释,配成质量浓度为0.04 mg/mL的DPPH溶液备用。取0.50 mL不同浓度的待测液,再加入4.50 mL的DPPH溶液,在室温避光环境下静置30 min,再在517 nm处测定其吸光值。按下列公式计算VC及各部位对DPPH自由基的清除率:
DPPH自由基清除率(%)=(A0-Ai)/A0×100
其中:S为DPPH自由基清除率,%;A0为0.50 mL无水乙醇与4.50 mL DPPH溶液的吸光值;Ai为0.30 mL样品溶液与2.70 mL DPPH溶液的吸光值。
通过测定山奈不同部位对DPPH自由基的清除率,得到山奈各部位不同浓度-DPPH自由基回归方程,根据方程计算DPPH自由基清除率为50%时的SC50。
计算公式:
SC50=50%×加入DPPH质量/加入试样溶液中溶质质量
1.2.4 ABTS法测试抗氧化活性 参照Xiang等[16]的方法,用95%乙醇配制7.4 mmol/L ABTS溶液,以及蒸馏水配制2.6 mmol/L的K2S2O8溶液,吸取两种溶液各10.00 mL混合,置于室温黑暗环境下12 h,使其充分反应后制得ABTS母液,之后用95%的乙醇稀释30倍,得到ABTS工作液。用移液管准确移取ABTS溶液4.00 mL,再分别加入不同浓度的样品溶液1.00 mL,振荡10 s使其充分混合后,再于室温避光下静置6 min,在734 nm处测定其吸光度。按下列公式计算VC及山奈各部位对ABTS自由基的清除率:
ABTS自由基清除率(%)=(A0-Aj)/A0×100
其中:A0为1.00 mL 95%乙醇与4.00 mL ABTS·工作液的吸光值;Aj为1.00 mL样品溶液与4.00 mL ABTS·工作液的吸光值。
通过测定山奈不同部位对ABTS自由基的清除率,得到山奈各部位不同浓度-ABTS自由基回归方程,根据方程计算ABTS自由基清除率为50%时的SC50。
计算公式:
SC50=50%×加入ABTS质量/加入试样溶液中溶质质量
1.3 数据处理
抗氧化活性测试实验平行三次,结果以平均值±标准差表示。测得的实验数据采用SPSS 20统计软件进行回归方程分析。
2 结果与分析
2.1 山奈乙醇总提物和各部位的得率
根据得率计算公式,乙醇提取物得率达13.43%,说明超声提取4次,山奈有效成分基本转移到乙醇溶液中,有效成分提取完全。从图1可以看出,山奈不同部位得率从高到低依次是:水余相>正丁醇相>石油醚相>氯仿相>乙酸乙酯相,说明山奈中化学成分主要是极性大的正丁醇相和水余相,以及极性小的石油醚相,这与其常作为食用调料炖煮(大极性)和香料香精(小极性)的用法相匹配[17]。中等极性的乙酸乙酯相和氯仿相得率较低,分别为0.33%和0.48%。进一步的活性成分研究,应根据活性部位极性大小,选择相应极性的溶剂提取和进一步的分离纯化。
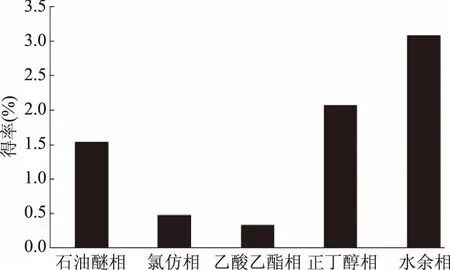
图1 山奈不同部位的得率Fig.1 Yield ratio of different extracts of Kaempferia galanga L.
2.2 DPPH法筛选抗氧化活性部位
从图2~图5可知,山奈乙醇提取物及各萃取部位均有清除DPPH自由基的能力,其中氯仿相对DPPH自由基清除能力最好,但较阳性对照VC对DPPH自由基清除能力,还有一定差距;其次是乙酸乙酯相;乙醇提取物和正丁醇相也有较好的DPPH自由基清除能力,石油醚相和水余相的DPPH自由基清除能力比较差。且在试验浓度线性范围内,各部位清除DPPH自由基的能力随着浓度的增加而增加,其抗氧化能力也相应增高。但随着浓度增加到一定量后,每个部位对DPPH自由基清除能力的增长趋势由快逐渐变慢。其原因可能是DPPH自由基存在单电子,其单电子在自由基清除剂存在时与之配对,从而随自由基清除剂吸收逐渐消失,溶液颜色也逐渐褪色[18]。在测试样液浓度较低时,DPPH溶液中的单电子数多于自由基清除剂,因此DPPH自由基清除能力增长趋势较快;而当测试样液浓度较大时,单电子数和自由基清除剂基本达到饱和,因此自由基清除能力增长趋势变缓。
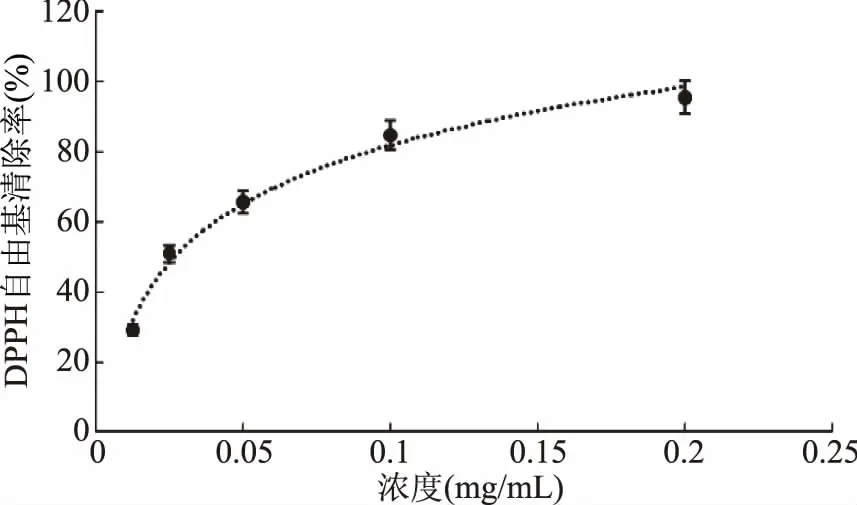
图2 VC对DPPH自由基的清除作用Fig.2 Scavenging capacity against DPPH· of VC
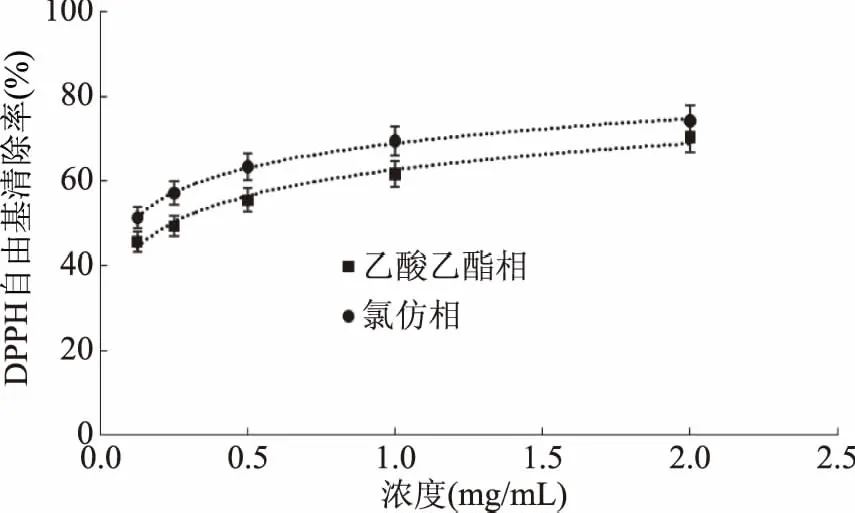
图3 乙酸乙酯相和氯仿相对DPPH自由基的清除作用Fig.3 Scavenging capacity against DPPH· of chloroform fraction and ethyl acetate fraction from Kaempferia galanga L.
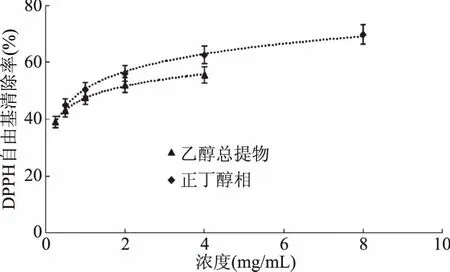
图4 乙醇总提物和正丁醇相对DPPH自由基的清除作用Fig.4 Scavenging capacity against DPPH· of ethanol extract and n-butanol fraction from Kaempferia galanga L.
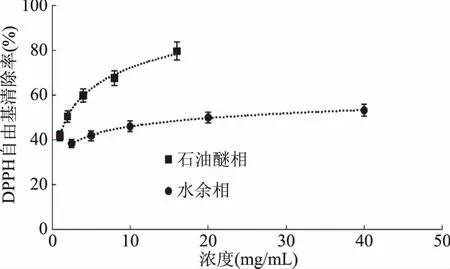
图5 石油醚相和水余相对DPPH自由基的清除作用Fig.5 Scavenging capacity against DPPH· of petroleum ether fraction and water fraction from Kaempferia galanga L.
从图2~图5可以看出,山奈提取物和各部位的浓度与DPPH自由基清除活性并不呈线性关系,所以根据浓度-DPPH自由基清除率关系,做回归方程后,计算出其半清除浓度(SC50),SC50越小,其抗氧化活性越大。由表1中SC50可知,DPPH自由基清除作用的强弱顺序依次为:VC>氯仿相>乙酸乙酯相>正丁醇部相>乙醇总提物>石油醚相>水余相。乙醇提取物SC50为1.5422 mg/mL,体现出良好的体外抗氧化活性,石油醚相SC50为1.7573 mg/mL,活性稍弱于乙醇提取物;水余相浓度达40 mg/mL时,对DPPH自由基的清除率仍达不到60%,SC50达到21.9276 mg/mL,因此对DPPH自由基的清除活性差。活性强于乙醇提取物的氯仿相的SC50,大约是VC的4倍,乙酸乙酯相的SC50大约是VC的9倍,正丁醇相的SC50大约是VC的35倍。由此可见,山奈氯仿相的抗氧化活性好,是山奈的主要抗氧化活性部位,有望从中分离得到抗氧化活性很好的天然抗氧化剂。乙酸乙酯相的SC50大约是氯仿相的2.3倍,也具有良好的抗氧化活性。
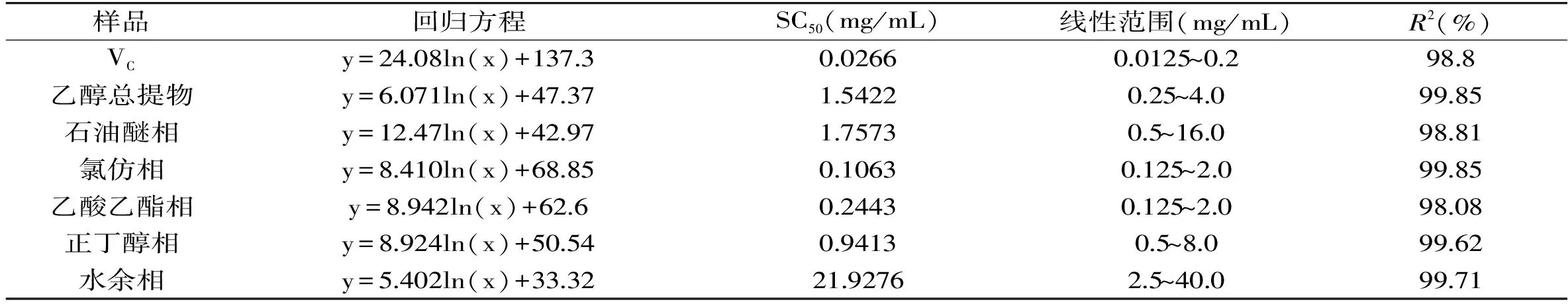
表1 山奈乙醇提取物、各部位及VC对DPPH自由基清除率的回归方程和SC50Table 1 Regression equation and SC50 against DPPH· of ethanol extract and fractions from Kaempferia galanga L.
2.3 ABTS法筛选抗氧化活性部位
图6~图9可以看出,山奈提取物和各部位都具有清除ABTS自由基的能力,且在试验浓度线性范围内,各部位清除ABTS自由基的能力随着浓度的增加而增加。氯仿相和乙酸乙酯相清除ABTS自由基能力很好,在较低浓度下,就能达到较好清除效果,但低于阳性对照VC。石油醚相和水余相ABTS自由基能力较差,正丁醇相和乙醇总提物居中。
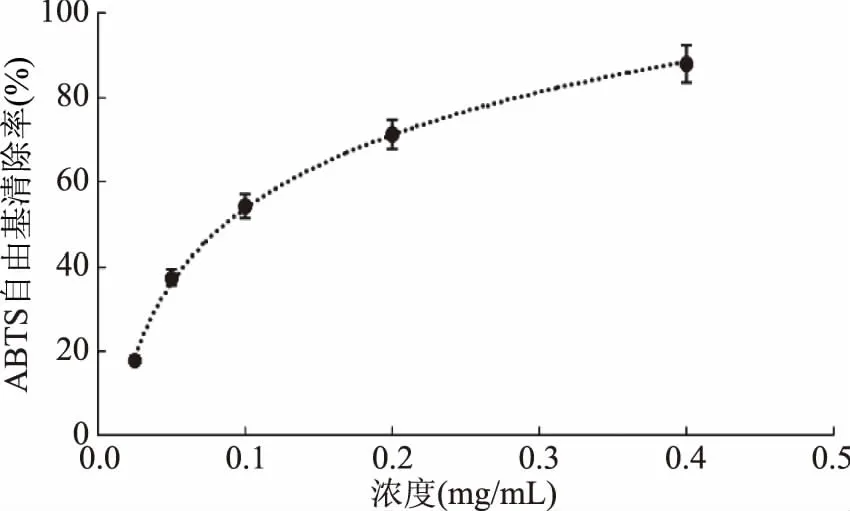
图6 VC对ABTS自由基的清除作用Fig.6 Scavenging capacity against ABTS· of VC
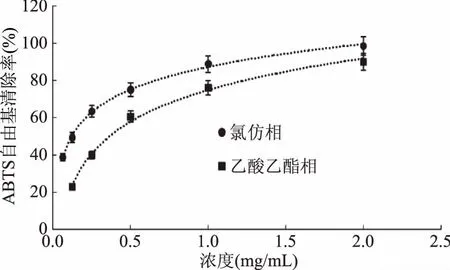
图7 乙酸乙酯相和氯仿相对ABTS自由基的清除作用Fig.7 Scavenging capacity against ABTS· of chloroform fraction and ethyl acetate fraction from Kaempferia galanga L.
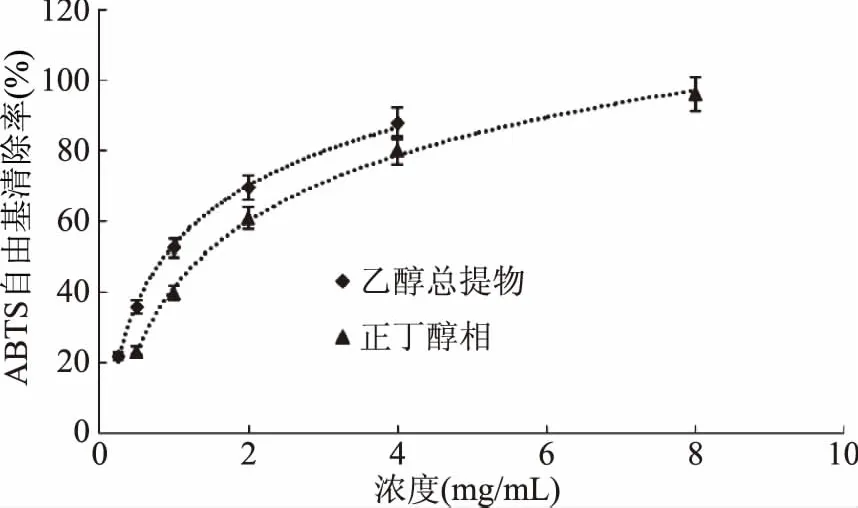
图8 乙醇总提物和正丁醇相对ABTS自由基的清除作用Fig.8 Scavenging capacity against ABTS· of Ethanol extract and n-butanol fraction from Kaempferia galanga L.
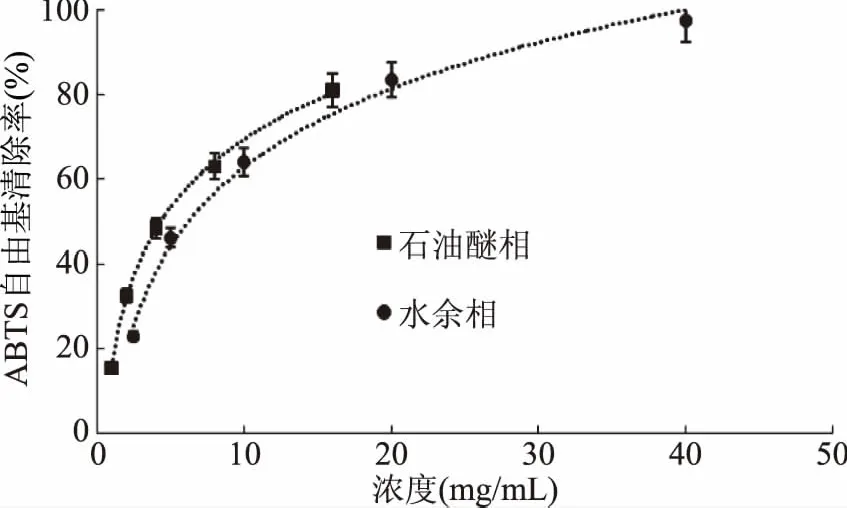
图9 石油醚部位和水余相部位对ABTS自由基的清除作用Fig.9 Scavenging capacity against ABTS·of petroleum ether fraction and water fraction from Kaempferia galanga L.
从图6~图9可以看出,山奈提取物和各部位的浓度与ABTS自由基清除活性并不呈线性关系,所以根据浓度-ABTS自由基清除率关系,做回归方程后计算SC50。由表2可知,ABTS自由基清除作用的强弱顺序依次为:VC>氯仿相>乙酸乙酯相>乙醇总提物>正丁醇相>石油醚相>水余相,乙醇提取物的SC50大约是VC的10倍,显示出山奈乙醇提取物具有良好的抗氧化活性。氯仿相的SC50不到VC的2倍,乙酸乙酯相的SC50不到氯仿部位的3倍,进一步说明氯仿相具有良好的抗氧化活性,乙酸乙酯相活性稍弱。正丁醇相的SC50约为氯仿相的10倍,但其得率是氯仿相的4倍,在抗氧化方面也有一定的应用价值。石油醚相的SC50约为氯仿相的32倍,抗氧化活性较差,在山奈中含量为氯仿相的3倍,近年来发现石油醚相抑菌活性良好[19],应加强其在抑菌方面的应用。水余相浓度在40 mg/mL时,对ABTS自由基的清除率接近100%,强于其对DPPH自由基的清除率,但SC50也达到6.2119 mg/mL,接近VC的76倍,氯仿部位的47倍,因此对ABTS清除活性差。水余相在这5个部位中,得率最高,抗氧化活性最差,今后的研究应着重水余相其它活性的筛选和进一步的产品开发。
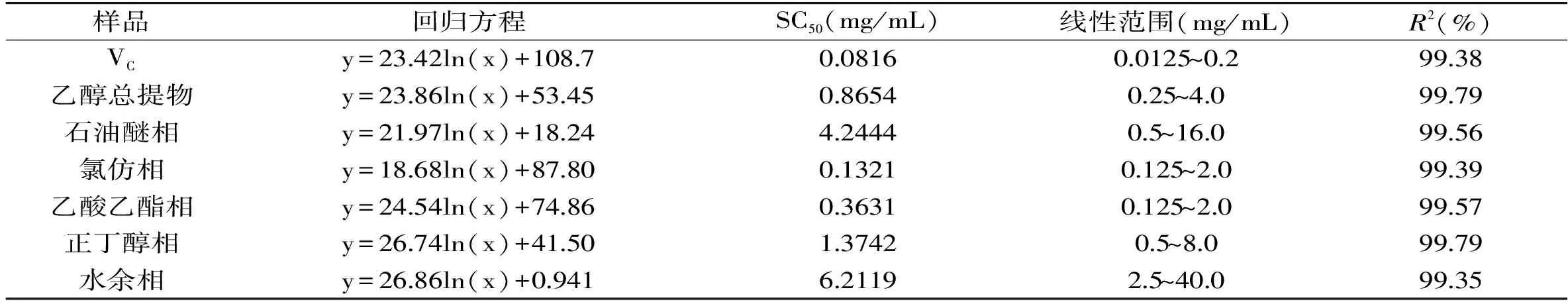
表2 山奈乙醇提取物、各部位及VC对ABTS自由基清除率的回归方程和SC50Table 2 Regression equation and SC50 against ABTS· of ethanol extract and fractions from Kaempferia galanga L.
3 结论
山奈乙醇提取物中各萃取部位得率从高到低依次为水余相、正丁醇相、石油醚相、氯仿相、乙酸乙酯相。山奈的醇提物对DPPH和ABTS自由基都具有良好的清除能力,所以山奈具有良好的抗氧化活性;山奈的氯仿相在两种方法中都表现出明显的清除自由基的能力,其对ABTS的SC50约为阳性对照VC的2倍,对DPPH的SC50约为阳性对照VC的4倍,是山奈主要的抗氧化活性部位,从山奈中寻找天然抗氧化剂应重点在其氯仿相中筛选。
