环境胁迫下食窦魏斯氏菌的耐受性评价
2018-12-26,,,,
,,, ,
(重庆第二师范学院重庆市功能性食品协同创新中心,重庆市功能性食品工程技术研究中心,功能性食品研发重庆市工程实验室,生物与化学工程学院,重庆 400067)
食窦魏斯氏菌(Weissellacibaria)是魏斯氏菌属(Weissella)的一个种,呈革兰氏阳性、过氧化氢酶阴性,属于乳酸菌属的一个分支。目前,GeneBank数据库中魏斯氏菌属已命名的种有19个,其分布极为广泛,从新鲜蔬菜、泡菜、小麦酸面团、胡萝卜汁肉制品、胃肠道和口腔中均可获得[1-4]。此外,研究发现魏斯氏菌及其代谢产物在食品、医药等诸多行业中具有潜在应用价值。Li等[5]从泰国发酵鱼产品中分离出的Weissellacibaria110产生的weissellicin 110细菌素,可作为肉制品及乳制品的防腐剂;Lee等[6]以前期从人体粪便中分离出的3株融合魏斯氏菌(Weissellaconfusa)和5株食窦魏斯氏菌为研究对象,评价实验菌株的潜在益生特性,结果表明融合魏斯氏菌和食窦魏斯氏菌对pH3.0和0.3%胆盐具有一定的耐受性,且对Coca-2细胞的粘附能力较好,均高于LactobacillusrhamnosusGG对Coca-2细胞的粘附能力。在致病性Escherichiacoli诱导的腹泻小鼠中,Jurnalis等[7]研究表明,灌胃Weisellaparamesenteroides能够有效减少腹泻小鼠的腹泻频率、降低腹泻小鼠粪便中TNF-α的水平、增加腹泻小鼠肠道中的乳酸菌数量和减少其厌氧细菌与大肠杆菌的数量。Lim等[8]研究WeissellacibariaWIKIM28改善2,4-二硝基氯诱导的过敏性皮炎,结果表明,灌胃WeissellacibariaWIKIM28不仅可以减少过敏性皮炎皮肤损伤、表皮增厚和血清免疫球蛋白E水平,还能减少外周淋巴结细胞Th2细胞因子IL-4、IL-5和 IL-13的水平;此外,灌胃WeissellacibariaWIKIM28还能促进肠系膜淋巴结中CD4+CD25+Foxp3+调节T细胞的分化和增强IL-10的分泌,对小鼠过敏性皮炎具有较好的预防作用,对预防人类过敏性皮炎具有潜在的应用价值。
益生菌是指摄入一定量后对机体具有益生作用的一类活性微生物,然而,由于益生菌在贮藏、运输、制剂化或工业化生产中常受到多种环境因素的影响,使其活性减弱或生理特性受到影响;加之菌体进入机体内会受到胃肠道中的胃酸与胆盐的影响,因此并不是所有的微生物都可作为益生菌[9]。在益生菌的筛选中通常需要通过一定的评价标准进行筛选。首先,微生物进入机体内会受到胃肠道低酸和胆盐的作用,导致其活性受到抑制或杀死,影响其益生作用的发挥[10-11]。因此,微生物对低酸环境和胆盐的耐受能力常作为筛选益生菌的重要指标。其次,在益生菌的功能及其性质研究中,菌株在肠道内的定植能力、对致病菌的抑制作用、对抗生素的耐受性,以及对温度和渗透压的耐受力也常作为筛选的指标。Ojekunle等[12]通过体外实验结果表明,WeissellacibariaWD2在模拟人工胃液中具有较高的存活率,并对低酸和胆盐具有很好的耐受性;Elavarasi等[13]在评价乳酸菌的潜在益生特性中发现,分离自山羊奶的Weissellacibaria(KTSMBNL 28)的抗菌活性较好,能够有效的抑制肠道致病菌的活性,且对人工胃液、胆盐、青霉素、万古霉素和萘啶酸具有一定的耐受性,溶血实验结果也表明,该菌株具有非溶血性,从而确保其运用的安全性。此外,Lee等[16]在研究人体粪便中8株魏斯氏菌的益生特性中发现,7株魏斯氏菌在15和45 ℃下均能很好的生长,所有菌株在含有6.5% NaCl的MRS中也能够很好生长。
本研究以新鲜竹笋表面分离到的16株食窦魏斯氏菌为对象,研究低酸环境、人工胃液、胆盐、温度和NaCl胁迫下食窦魏斯氏菌的生长情况,初步评价出具有良好耐受性的食窦魏斯氏菌,为进一步研究食窦魏斯氏菌的益生功能及应用提供理论依据。
1 材料与方法
1.1 材料与仪器
16株食窦魏斯氏菌(HSG 01~HSG 16) 分离自重庆市万盛区黑山谷新鲜竹笋的表面,保藏于重庆市功能性食品协同创新中心;MRS肉汤 生化试剂,美国BD公司;琼脂、胆盐、胃蛋白酶 生化试剂,北京索莱宝生物科技有限公司;硫代乙醇酸钠 生化试剂,山东西亚化学工业有限公司;氯化钠、盐酸 生化试剂,成都市科龙化工试剂厂;D2000 DNA Marker、2×Taq PCR MasterMix、细菌基因组DNA提取试剂盒(DP302) 天根生化科技(北京)有限公司。引物27F(5′-AGAG TTTGATCCTGGCTCA-3′)、1495R(5′-CTACGGC TACCTTGTTACGA-3′) 由生工生物工程(上海)股份有限公司合成。
SW-CJ-2F洁净工作台 苏州安泰空气技术有限公司;BY-G20医用离心机 北京北洋医疗器械有限公司;SY-2230恒温水浴摇床 美国精骥有限公司;MSC-100恒温振荡器 杭州奥盛仪器有限公司;OLYMPUS-BX43生物显微镜 日本奥林巴斯公司;LDZM-80KCS-Ⅱ立式压力蒸汽灭菌锅 上海申安;A200梯度PCR仪 杭州朗基科学仪器有限公司;Tanon-2500全自动数码凝胶图像分析系统 上海天能公司;BIOMA TE 35紫外可见分光光度计 赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 菌株的活化与镜检 将保藏于20%甘油中的16株实验菌株从-20 ℃冰箱中取出,室温放置解冻后,分别取100 μL接种于5 mL MRS液体培养基中,水浴恒温振荡器37 ℃、100 r/min培养24 h,如此连续活化2代后。取菌液1 mL于4000 r/min 离心10 min,用接种环挑取少量沉淀均匀的涂于载玻片上,经革兰氏染色[14]、镜检后,确定菌株是否为纯种,备用。
1.2.2 菌株的种属分析 细菌基因组DNA(模板)的提取按照试剂盒说明书方法进行。
PCR反应体系为25 μL:模板1 μL,引物27F、1495R各1 μL,2×Taq PCR MasterMix 12.5 μL,加无菌超纯水补足至25 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 40 s,55 ℃ 40 s,72 ℃ 1 min,共30个循环;72 ℃ 10 min[15]。反应结束后,取5 μL PCR产物用1.5% 琼脂糖凝胶电泳进行检测,检测合格样品送成都擎科梓熙生物技术有限公司测序,测序所得序列通过NCBI中的BLAST程序进行同源性比对分析。
从GeneBank中调取魏斯氏菌属的6个种的序列作为参考序列,用MEGA 5.0软件中的Alignment程序进行多序列匹配比对,并采用Kimura 2-parameter模式计算遗传距离,Neighbor-Joining构建实验菌株的16S rDNA序列的系统发育树,Bootstrap为1000[16-18]。
1.2.3 菌悬液的制备 实验菌株37 ℃、100 r/min培养18 h后,取10 mL培养液于4 ℃、4000 r/min离心10 min,收集菌体沉淀,用无菌生理盐水洗涤2次,并调节其OD600 nm为1.0,备用[19]。
1.2.4 酸胁迫下生长效率的测定 取菌悬液按2%接种量加入pH4.0的MRS肉汤中(1 mol/L HCl调节pH)[20],实验中以2%接种但未调节pH的MRS肉汤作对照,未接种且未调节pH的MRS肉汤作空白。37 ℃、100 r/min培养24 h后,测定培养液的OD600 nm值,按公式(1)计算实验菌株酸胁迫下的生长效率。
生长效率(%)=(不同pH培养液的OD600 nm-空白OD600 nm)/(对照OD600 nm-空白OD600 nm)×100
式(1)
1.2.5 温度胁迫下生长效率的测定 取菌悬液按2%接种量(v/v)加入MRS肉汤中(不调节pH,约为6.2),分别于4、15、37、45 ℃下,100 r/min培养24 h,并测定相应MRS肉汤的OD600 nm值。实验中以37 ℃下MRS肉汤作对照,以未接种的MRS肉汤作空白[21]。按公式(2)计算实验菌株对温度胁迫下的生长效率。
生长效率(%)=(不同温度下培养液的OD600 nm-空白OD600 nm)/(37 ℃下培养液的OD600 nm-空白OD600 nm)×100
式(2)
1.2.6 NaCl胁迫下生长效率的测定 取菌悬液按2%接种量(v/v)加入含4%、6%和8% NaCl的MRS培养基中,以接种但不含NaCl的MRS培养基作对照,以未接种且不含NaCl的MRS培养基作空白[21]。37 ℃、100 r/min培养24 h后,测定培养液的OD600nm值,按公式(3)计算实验菌株盐胁迫下的生长效率。
生长效率(%)=(不同NaCl浓度下培养液的OD600 nm-空白OD600 nm)/(不含NaCl培养液的OD600 nm-空白OD600 nm)×100
式(3)
1.2.7 人工胃液胁迫下存活率的测定 基于酸胁迫实验,同时参考温度和渗透压胁迫实验的结果,选出具有良好耐受力的菌株进行实验。取菌悬液1 mL与9 mL pH3.0人工胃液混匀,于37 ℃、100 r/min培养3 h,并采用平板计数分别记录处理人工胃液处理0、3 h的活菌数[22],按公式(4)计算实验菌株在pH3.0人工胃液中的存活率。

式(4)
1.2.8 胆盐胁迫下生长效率的测定 基于酸胁迫实验,同时参考温度和渗透压胁迫实验的结果,选出具有良好耐受力的菌株进行实验。取菌悬液按2%接种量分别加入含0.1%、0.2%和0.3%胆盐的MRS-THIO培养基(指含有0.2%巯基乙酸钠的MRS肉汤)中,实验中以2%接种但不含胆盐的MRS-THIO培养基作对照,以不接种且不含胆盐的MRS-THIO培养基作空白[23]。37 ℃、100 r/min培养24 h后,测定培养液的OD600nm值,按公式(5)计算实验菌株在不同胆盐浓度胁迫下的生长效率。
生长效率(%)=(不同胆盐浓度下培养液的OD600 nm-空白OD600 nm)/(对照OD600 nm-空白OD600 nm)×100
式(5)
1.3 数据处理
2 结果与分析
2.1 活化菌株镜检结果
实验菌株活化后在MRS平板上的菌落形态均一,菌落边缘整齐,中间凸起,表面光滑,呈黄色不透明状(图1a)。经革兰氏染色后,菌株细胞呈蓝紫色,为革兰氏阳性。此结果表明菌株仍为纯种,可用于后续实验(图1b)。
图1 菌株HSG 02菌落形态(a)及革兰氏染色结果(b)(1000×)Fig.1 Colonial morphology(a)and gram staining results(b)of HSG 02(1000×)
2.2 菌株16S rDNA序列分析
图2为实验部分菌株16S rDNA序列经PCR扩增后的琼脂糖凝胶电泳检测结果,由图可知,扩增条带的位置介于1000~2000 bp,与预计目的条带位置(1500 bp)相符;此外,PCR 扩增后的条带清晰明亮,无拖尾,且阴性对照无条带,说明 PCR扩增成功,扩增产物可用于后期测序。
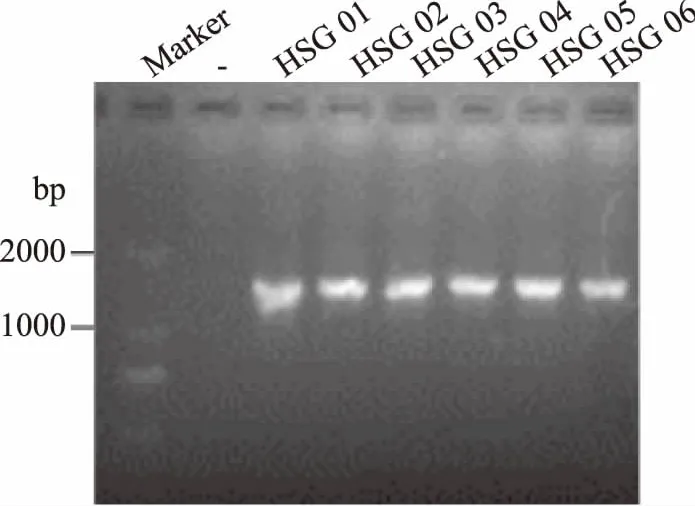
图2 部分菌株16S rDNA序列的PCR扩增结果Fig.2 PCR amplification results of parts strains 16S rDNA sequences
扩增产物经测序检测后,将所得序列基于NCBI中的BLAST程序进行同源性比对分析,结果表明16株菌株均为食窦魏斯氏菌(Weissellacibaria)。
2.3 系统发育树分析
系统发育树中,各分支下的菌株亲缘关系近,差异小;各分支长度的差异代表进化程度的高低。如图3可知,实验菌株均与食窦魏斯氏菌以99%的自举支持率聚在一起,此结果与16S rDNA序列分析结果相一致。此外,与选取的参考菌株相比,食窦魏斯氏菌与融合魏斯氏菌的亲缘关系较近;而其它4种魏斯氏菌则单独聚在另一分支,与食窦魏斯氏菌的亲缘关系较远。

图3 实验菌株16S rDNA序列的系统发育树Fig.3 Phylogenetic tree based on the selected strains 16S rDNA sequences
2.4 酸胁迫下的生长效率
益生菌具有一定耐酸能力是其进入肠道发挥益生作用的前提。实验中基于pH4.0 MRS肉汤初步筛选具有耐受低酸环境的食窦魏斯氏菌。由图4可知,各实验菌株对低酸环境的耐受性明显不同,其中HSG 04和HSG 07在酸胁迫下的生长效率较低,分别为15.37%和17.21%,说明其对低酸环境的耐受性较差;而HSG 08和HSG 09均具有较高的生长效率,分别为82.77% 和71.68%,说明二者对低酸环境的耐受性较好。目前,对实验菌株耐受酸性环境的机制尚不明确,主要的可能机制包括质子泵机制、大分子保护和修复、碱生成、细胞密度及生物膜等[24]。如Lorca等[25]研究表明,L.acidophilusCRL639酸胁迫耐受的主要机制是膜F0F1-ATPase的作用,并不依赖于合成新的蛋白质(F0F1-ATPase,又称H+-ATP酶或质子移位膜ATP酶,是一种多亚基酶);而De等[26]在研究L.sanfranciscensisCB1的酸胁迫反应中发现,相对于未进行酸胁迫处理的菌株,酸耐受菌株中有15种蛋白质合成增加。此外,相关研究结果也表明,精氨酸脱亚氨基酶途径在很多乳酸菌的酸耐受性中发挥重要作用,其原因在于精氨酸通过一系列反应后被分解为NH3,从而降低环境中的pH,从而起到保护菌体的作用,如菌株LactococcuslactisMG1363[27]。
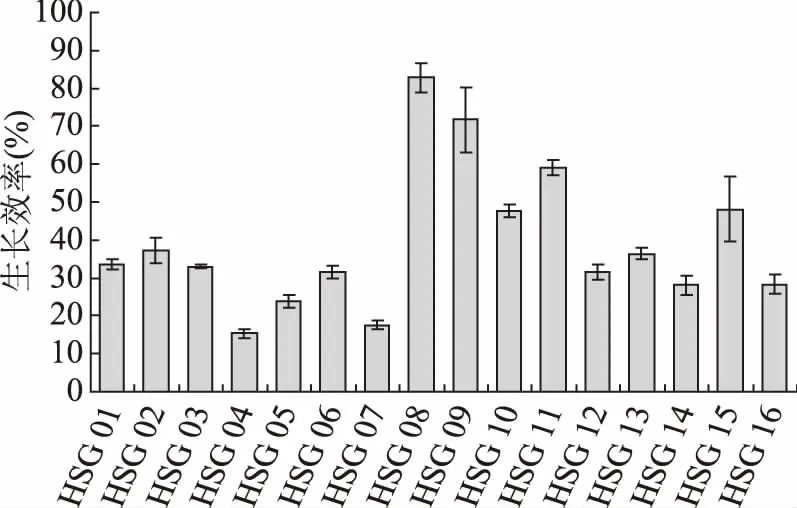
图4 酸胁迫下菌株的生长效率Fig.4 Growth efficiency of the selected strains under acid stress
2.5 温度胁迫下的生长效率
微生物的生长与其环境温度密切相关,通常乳酸菌在37 ℃时,生长状况较好,但是高于或低于此温度均对其生长不利。尤其在运输、储藏或制剂化的过程中受到的温度胁迫严重影响了菌体的结构、活性及其产量,使益生菌的应用受到限制[28-29]。因此,本实验通过设定不同温度来研究食窦魏斯氏菌在不同温度胁迫下的生长状况。由图5可知,与培养温度为37 ℃时的生长效率相比,4 ℃时各菌株的生长效率均较低,说明各菌株在4 ℃时,其生长效率均能得到很好的抑制;当培养温度升至15 ℃时,各菌株生长效率较4 ℃时的生长效率出现不同程度的升高,但HSG 01、HSG 02、HSG 08、HSG 09、HSG 10、HSG 11、HSG 13和HSG 16的生长效率明显低于自身菌株37 ℃时的生长效率;当培养温度升至45 ℃时,部分菌株的生长效率较37 ℃时的生长效率低,而HSG 02、HSG 06、HSG 08、HSG 09、HSG 10、HSG 11、HSG 13和HSG 16的生长效率均高于37 ℃时的生长效率,说明这些菌株对高温具有一定程度的耐受力。综上所述,菌体对不同温度胁迫时的应激反应存在明显差异,受到温度胁迫时,菌体适应环境温度变化的能力也各不相同。研究发现,菌株对高温胁迫或冷胁迫耐受力的不同与菌体自身分子伴侣的活性、细胞膜的流动性及核糖体和RNA的稳定性密切相关。高温胁迫下产生的相关伴侣蛋白或蛋白酶可作用于损伤的蛋白质,从而提高菌体自身耐受高温的能力,而在冷胁迫中产生的相关蛋白(冷诱导蛋白)则可改变菌体自身细胞膜的流动性,DNA的超螺旋、转录和翻译,从而影响菌体的耐受力,改变程度的差异则导致最终耐受力的不同。因此,通过对菌株不同温度胁迫下生长效率的评价,可为后期生产中筛选具有耐受冷热环境变化的菌株提供理论依据[30-31]。

图5 温度胁迫下菌株的生长效率Fig.5 Growth efficiency of the selected strains under temperature stress
2.6 NaCl胁迫下的生长效率
益生菌在工业应用中的渗透压胁迫主要以盐胁迫为主,然而食品中添加适量的盐虽然可以降低食品的水分活度,起到预防食品腐败变质,延长其保质期的目的,同时也会造成渗透压的改变,而渗透压的改变能够导致菌体细胞体积变化和胞内代谢发生紊乱,严重则导致细胞死亡[32]。因此,筛选具有耐受高渗环境的菌株对其后期功能性质的发挥具有重要意义。由图6可知,在不同浓度NaCl下,实验菌株间的生长效率明显不同;随着盐浓度的增加,菌株的生长效率均呈下降趋势。其中,HSG10对盐的耐受性最佳,在8%盐浓度下仍能保持较高的生长效率(87.18%);而HSG03、HSG06和HSG07在4% NaCl胁迫时,其生长效率相对较低,分别为61.20%、57.00%和59.46%,表明其对盐胁迫的耐受性差。研究表明,各菌株对NaCl胁迫表现出不同的耐受力,与诱导抗渗透蛋白的表达和积累可混溶溶质(K+、谷氨酸、脯氨酸、甘氨酸和甜菜碱)等物质有关。这些物质可以防止由于外部高渗透压而引起的细胞内水分的损失,确保细胞内外的溶胀平衡,且不会干扰细胞的生理过程[33]。因此,筛选具有耐受一定浓度NaCl胁迫的菌株,为后期具有良好益生特性菌株的研究与应用具有重要意义。

图6 盐胁迫下菌株的生长效率Fig.6 Growth efficiency of the selected strains under salt stress
2.7 人工胃液中的存活率
人体胃液的pH约为3,当机体空腹或摄入酸性食物时,其pH会有所下降;而当摄入碱性食物时,pH会有所上升;此外,食物在胃中的消化时间通常为1~3 h[34]。因此,在益生菌筛选实验中,通常用pH3.0人工胃液处理菌株3 h来模拟体内胃液消化情况,从而筛选出具有良好耐受胃酸消化能力的菌株。本实验基于酸胁迫、渗透压胁迫和温度胁迫实验结果,选取生长效率相对较高的5株食窦魏斯氏菌(HSG 08、HSG 09、HSG 10、HSG 11、HSG 15)进行人工胃液实验,实验结果如图7。 由图可知,5株食窦魏斯氏菌经人工胃液处理后,其存活率均不同,存活率由高到低依次为HSG 08>HSG 09>HSG 11>HSG 15>HSG 10,HSG 08的存活率最高为70.55%,而HSG 10的存活率最低为18.80%。人工胃液处理即模拟人体胃肠道低酸环境筛选菌株,人工胃液中存活率的不同与菌体自身耐受低酸环境能力的差异密切相关,其主要的可能机制也包括质子泵机制、大分子保护和修复、碱生成、细胞密度及生物膜等[24]。

图7 人工胃液中菌株的存活率Fig.7 Survival rates of the selected stains in simulated gastric fluid
2.8 胆盐胁迫下的生长效率
人体肠道中的胆盐浓度介于0.03%~0.3%之间动态波动,研究表明,肠道中的胆盐对益生菌的生长具有抑制或杀死作用[24]。因此,评价菌株对胆盐的耐受能力也是筛选益生菌的重要指标。本实验基于酸胁迫、渗透压胁迫和温度胁迫实验选取的5株食窦魏斯氏菌(HSG 08、HSG 09、HSG 10、HSG 11、HSG 15)进行胆盐胁迫实验,实验结果如图8所示。5株食窦魏斯氏菌经不同浓度胆盐处理后,其生长效率各不相同。在0.1%胆盐胁迫下,5株食窦魏斯氏菌的生长效率均较高,其生长效率由高到低依次为HSG 08>HSG 09>HSG 11>HSG 15>HSG 10,其中HSG 08的生长效率最高为72.06%,随着胆盐浓度的增加,5株食窦魏斯氏菌的生长效率均明显下降。研究表明,高浓度胆盐胁迫会导致菌株细胞膜通透性发生改变、膜内蛋白发生解离,从而使细胞内物质流出,最终导致细胞死亡[35]。

图8 胆盐中菌株的生长效率Fig.8 Growth efficiency of the selected strains in bile salt
3 结论
食窦魏斯氏菌由于其对机体健康的多种益生作用及其在发酵食品的风味形成及发酵进程中的重要作用而受到广泛关注。本实验通过酸、温度和NaCl胁迫实验研究16株食窦魏斯氏菌在不同胁迫下的生长效率,结果表明HSG 08、HSG 09、HSG 10、HSG 11和HSG 15在酸胁迫下的生长效率均高于45%,其中HSG 10的生长效率最低为47.61%,HSG 08的生长效率最高为82.77%。在45 ℃温度胁迫下,HSG 02、HSG 06、HSG 08、HSG 09、HSG 10、HSG 11、HSG 13和HSG 16的生长效率均高于37 ℃下的生长效率,说明这8菌株均具有一定耐受高温的能力,而在15 ℃下,HSG 01、HSG 02、HSG 08、HSG 09、HSG 10、HSG 11、HSG 13和HSG 16的生长效率明显降低,说明这8株菌在15 ℃下其活性在一定程度上得到有效的抑制。NaCl胁迫实验结果表明,随着其浓度的增加,各菌株的耐受性均逐渐减弱;在4% NaCl胁迫下,HSG 06的生长效率最低为57.00%,而HSG 01、HSG 02、HSG 08、HSG 10、HSG 12、HSG 13、HSG 14、HSG 15和HSG 16的生长效率均高于80%,其中HSG 15的生长效率最高达93.91%。人工胃液和胆盐耐受力实验结果表明,HSG 08经人工胃液处理后,其存活率最高为70.55%,而HSG 10的存活率最低为18.80%;而胆盐实验结果表明,随着胆盐浓度的增加,实验菌株的生长效率明显降低,在0.1%胆盐下,HSG 08的生长效率最高为72.06%,HSG 10的生长效率最小为56.57%。综上所述,HSG 08对不同环境胁迫均表现出很好的耐受力,因此可用于下一步益生特性菌株的研究。
