凝结芽孢杆菌中与乳酸生产相关的乳酸脱氢酶基因的研究
2018-12-26,
,
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
乳酸的首次发现可以追溯到1780年,它被Scheele在酸乳中发现[1]。乳酸在发酵和人类食品方面的应用有着悠久的历史[2]。乳酸是一种多用途天然有机酸,现今还应用于医药、化妆品和化工等领域[3]。乳酸的分子结构简单,但含有不对称碳源,有两种光学异构体:L(+)-乳酸和D(-)-乳酸[3]。乳酸已被美国食品药品监督管理局(FDA)列为安全的(GRAS)食品添加剂,但D(-)-乳酸对人体代谢是有害的,可能导致酸中毒和脱钙作用[4]。
凝结芽孢杆菌(Bacilluscoagulans)具有较高的乳酸生产能力[5],属于革兰氏阳性菌,细胞壁硬(或厚),细胞呈杆状,细胞两端产芽孢,无鞭毛[6]。凝结芽孢杆菌的生长温度为45~60 ℃,是一种嗜热菌,耐酸能力极强,可在pH小于2.4的培养液中存活一年,最适pH在4.5~6.5之间[7]。凝结芽孢杆菌最早是在变质的牛奶中发现并分离出来[8],后经研究发现其可以利用各种糖类转化成乳酸,并且具有耐高温、耐酸,糖酸转化率高和产乳酸光学纯度好等特点。凝结芽孢杆菌有很好的发酵特性,其在50~55 ℃的发酵条件下进行分批发酵和补料发酵生产乳酸的过程可以不用灭菌操作。Qin等[9]在50 ℃培养条件下,不经过灭菌利用凝结芽孢杆菌进行乳酸发酵,获得了光学纯度99%以上的L-乳酸。凝结芽孢杆菌虽然具有很高的商业应用价值,但当前工业上对凝结芽孢杆菌的应用还不是很多,其良好的生物学特性尚未得到充分利用,其原因之一就是对凝结芽孢杆菌乳酸发酵相关基因的了解还很少[10]。
凝结芽孢杆菌乳酸代谢过程是葡萄糖经过糖酵解途径(EMP),再经过乳酸脱氢酶催化后生成乳酸[11-12],在凝结芽孢杆菌ATCC7050菌种中存在三种乳酸脱氢基因:ldhL1、ldhL2和ldhD,即L型乳酸生成相关的L-乳酸脱氢酶基因两个,D型乳酸生成相关的D-乳酸脱氢酶基因一个。本文对5株凝结芽孢杆菌的乳酸发酵特性进行了研究,并以ATCC7050为例,研究了3个乳酸脱氢酶基因转录与乳酸合成的关系,对凝结芽孢杆菌代谢研究和基因改造奠定了基础。
1 材料与方法
1.1 材料与仪器
凝结芽孢杆菌(Bacilluscoagulans)ATCC7050、凝结芽孢杆菌36D1、凝结芽孢杆菌P4-102B、凝结芽孢杆菌HL5、凝结芽孢杆菌HL5-C 均由本实验室保藏;葡萄糖、蛋白胨、酵母膏、牛肉膏 凌峰化学试剂有限公司(上海);L/D-LACTATE试剂盒 Megazyme公司;葡萄糖试剂盒 科欣生物技术(上海)研究所;RNA提取试剂盒、cDNA合成试剂盒、SYBR Premix Dimer Eraser、细菌基因组DNA小量纯化试剂盒 宝日医生物技术(北京)有限公司。
SBA-40E型生物传感分析仪 山东省科学院生物研究所;ZWY-211C型恒温摇床振荡培养柜 智城分析仪器制造有限公司(上海);UV-2102PC型紫外可见分光光度计 菁华科技仪器有限公司(上海);FE20型pH计 梅特勒-托利仪器;96孔实时定量PCR仪CFX connect 美国Bio-Rad公司。
1.2 实验方法
1.2.1 培养基的配制 LB培养基(g/L)[13],固体培养基再加入2%的琼脂,pH调节为5.0,用于凝结芽孢杆菌培养。
茄子瓶斜面培养基:葡萄糖40 g/L,蛋白胨10 g/L,牛肉浸膏6 g/L,酵母提取物10 g/L,柠檬酸二胺2 g/L,磷酸氢二钾2 g/L,乙酸钠4 g/L,硫酸镁0.2 g/L,硫酸锰0.2 g/L,琼脂18 g/L,吐温-80 1 mL,碳酸钙10 g/L,NaOH调pH至6.0。
种子培养基:葡萄糖40 g/L,蛋白胨10 g/L,牛肉膏10 g/L,酵母膏10 g/L,柠檬酸二胺2 g/L,磷酸氢二钾2 g/L,硫酸镁0.2 g/L,硫酸锰0.2 g/L,氯化钠0.03 g/L,硫酸亚铁0.01 g/L,乙酸钠4 g/L,吐温-80 1 mL,碳酸钙25 g/L,NaOH调pH至6.0。
发酵培养基:葡萄糖90 g/L,蛋白胨13.33 g/L,酵母膏13.33 g/L,硫酸镁0.0133 g/L,硫酸锰0.0133 g/L,氯化钠0.0133 g/L,硫酸亚铁0.0133 g/L,乙酸钠0.67 g/L,碳酸钙40 g/L,NaOH调pH至6.0。
1.2.2 凝结芽孢杆菌乳酸发酵培养 取100 μL甘油管中的凝结芽孢杆菌(ATCC7050、36D1、HL5、HL5-C和P4-102B)菌液,均匀涂布于茄子瓶斜面培养基中,50 ℃,12 h,连续培养两代进行活化,用50 mL灭菌水将活化菌株从茄子瓶斜面培养基中洗脱下来,之后接入(按15% v/v接种量)种子摇瓶培养基中,摇床(50 ℃,100 r/min)振荡培养12 h后再接入(按15% v/v接种量)发酵摇瓶培养基中,摇床(50 ℃,200 r/min)振荡培养48 h 。
1.2.3 五种凝结芽孢杆菌乳酸发酵48 h指标的测定
1.2.3.1 L-乳酸和D-乳酸的测定 根据1.2.2方法对五种凝结芽孢杆发酵48 h后,对发酵液进行离心(6000 r/min,4 ℃离心10 min)处理后取上清。按照L/D-LACTATE试剂盒说明,分别对五种凝结芽孢杆菌发酵液中的L-乳酸和D-乳酸含量进行测定。
1.2.3.2 L-乳酸光学纯度的计算 根据1.2.3.1方法分别测定五种凝结芽孢杆菌发酵48 h后L-乳酸ML(g/L)和D-乳酸MD(g/L)的生产量,L-乳酸的光学纯度计算公式为:
1.2.3.3 残糖含量的测定 利用葡萄糖试剂盒对五种凝结芽孢杆菌48 h发酵后的残糖含量进行测定,具体的测定方法参考葡萄糖试剂盒中说明书进行操作。
1.2.4 凝结芽孢杆菌ATCC7050乳酸发酵过程中指标的变化测定 根据1.2.2方法对五种凝结芽孢杆菌进行48 h发酵,但在发酵过程中每隔5 h取一次样,每次取样后离心(6000 r/min,4 ℃离心10 min)处理取上清,对每个样品利用紫外可见分光光度计、pH计、生物传感分析仪和葡萄糖试剂盒分别进行OD600、pH、L-乳酸和残糖含量的测定。最后以培养时间作为横坐标,分别绘制凝结芽孢杆菌OD600、pH、L-乳酸和残糖的发酵过程曲线。
1.2.5 凝结芽孢杆菌基因组的提取 对凝结芽孢杆菌ATCC7050进行基因组提取。将凝结芽孢杆菌在LB液体培养基进行培养,50 ℃,200 r/min,当OD600达到1~2时,取2 mL菌液到灭菌离心管中,12000 r/min,4 ℃离心2 min收集菌体。利用细菌基因组DNA小量纯化试剂盒对菌体进行基因组的提取,具体提取的方法参考试剂盒内说明书进行操作。
1.2.6 凝结芽孢杆菌总RNA的提取 对凝结芽孢杆菌ATCC7050中ldhL1、ldhL2和ldhD三个基因进行转录情况分析,分别在菌体培养的对数期(5 h)、稳定期(20 h)和衰亡期(45 h)时收集菌体提取RNA。将凝结芽孢杆菌在LB液体培养基中培养至OD600达到1~2时,取2 mL菌液于灭菌离心管中,12000 r/min,室温离心2 min收集菌体,之后参考AxyPrep总RNA小量制备试剂盒说明书中的从细菌中提取总RNA的操作步骤进行。
1.2.7 RNA反转录cDNA 将提取好的RNA进行逆转录形成cDNA,以cDNA为模板进行PCR和RT-PCR检测,对ldhL1、ldhL2和ldhD三个基因设计三对引物(RTldhL1-F/RTldhL1-R、RTldhL2-F/RTldhL2-R、RTldhD-F/RTldhD-R),引物序列见表1。以cDNA为模板进行PCR扩增,RNA反转录cDNA过程按照PrimeScript cDNA Synthesis Kit说明书进行操作。

表1 实验中使用的引物Table 1 Primers used in this study
1.2.8 RT-PCR反应 在八联管中加入SYBR Premix Dimer Eraser(2×)10 μL,引物(10 μmol/L)各1 μL,模板cDNA 2 μL,灭菌蒸馏水 6 μL。RT-PCR反应条件为95 ℃,30 s;95 ℃,5 s,60 ℃,30 s,40个循环;4 ℃,维持。反应结束后,可以得到其扩增曲线并可根据循环数进行分析。
1.3 数据处理
每组实验重复三次,数据采用SPSS软件处理并用Origin 8.0软件作图。
2 结果与分析
2.1 五种凝结芽孢杆菌乳酸发酵48 h指标(生长情况)的测定
测定结果见表2,五种凝结芽孢杆菌L型乳酸的产量明显比D型乳酸的产量高,并由此可以计算出五种凝结芽孢杆菌L-乳酸的光学纯度,即五种凝结芽孢杆菌的L-乳酸光学纯度都达到了97%以上,ATCC7050、36D1和HL5的L-乳酸光学纯度甚至达到99%以上,说明凝结芽孢杆菌主要生产L型乳酸。凝结芽孢杆菌P4-102B发酵液中残糖的含量为15.37 g/L,但只生成了18.42 g/L的乳酸,其所消耗的葡萄糖并没有全部转化成乳酸,葡萄糖的消耗可能进入到其他的代谢途径中。

表2 五种凝结芽孢杆菌发酵48 h实验结果Table 2 Experimental results of five Bacillus coagulans strains after 48 h fermentation
2.2 凝结芽孢杆菌ATCC7050乳酸发酵过程中指标变化情况
2.2.1 凝结芽孢杆菌ATCC7050生长曲线中OD值变化 生长过程曲线如图1所示,凝结芽孢杆菌ATCC7050由于经过了活化,其延迟期很短,凝结芽孢杆菌在复合培养基中短时间内进行快速生长,即在0~10 h处于对数生长期,在10~30 h凝结芽孢杆菌细胞因生长中不利因素的增多,其生长速度变慢达到稳定期,在30 h以后凝结芽孢杆菌细胞基本停止增长,即达到细胞的衰亡期。

图1 凝结芽孢杆菌ATCC7050发酵中细胞生长过程Fig.1 Profiles of cell growth in Bacillus coagulans ATCC7050 fermentation
2.2.2 凝结芽孢杆菌ATCC7050发酵过程中发酵液pH的变化 从图2可以看出,凝结芽孢杆菌ATCC7050在发酵0~5 h时发酵液的pH迅速降低,5~10 h的pH下降速度变慢,10 h之后发酵液的pH基本维持了稳定。发酵液中pH的调节主要是依靠发酵摇瓶中的碳酸钙来调节,在发酵开始时,乳酸的合成使发酵液中悬浮起来的碳酸钙被消耗,从而使发酵液的pH降低,随着发酵过程的进行,摇瓶底部碳酸钙不断被悬浮到发酵液中,使发酵液的pH维持稳定。

图2 凝结芽孢杆菌ATCC7050发酵中发酵液pH变化Fig.2 Change of pH in fermentation broth of Bacillus coagulans ATCC7050
2.2.3 凝结芽孢杆菌ATCC7050发酵过程中L-乳酸含量和葡萄糖含量的变化 凝结芽孢杆菌ATCC7050利用葡萄糖生产L-乳酸的发酵过程如图3所示,在发酵开始时,乳酸的生成速率基本维持不变,随着发酵过程到达后期(35 h以后),凝结芽孢杆菌细胞也达到衰亡期,乳酸的生成速率明显变缓。凝结芽孢杆菌乳酸的合成过程为葡萄糖的转化过程,其发酵液中葡萄糖的变化过程如图4所示,葡萄糖在发酵开始时的消耗速率较快,到发酵后期(35 h以后)葡萄的消耗速率明显变缓,与乳酸的生成过程含量变化相反。

图3 凝结芽孢杆菌ATCC7050 L-乳酸的生产过程Fig.3 Profiles of L-lactic acid fermentation by Bacillus coagulans ATCC7050

图4 凝结芽孢杆菌ATCC7050 发酵液中葡萄糖的变化Fig.4 Change of glucose in fermentation broth of Bacillus coagulans ATCC7050
2.3 凝结芽孢杆菌ATCC7050乳酸脱氢酶基因的确定
根据NCBI中凝结芽孢杆菌ATCC7050全基因组信息对ldhL1、ldhL2和ldhD三个乳酸脱氢酶基因分别设计引物(LdhL1-F/LdhL1-R、LdhL2-F/LdhL2-R、LdhD-F/LdhD-R),引物序列见表1,进行PCR。PCR电泳结果如图5所示,泳道1位ldhL1基因PCR,ldhL1基因的扩增片段大小应为1075bp;泳道2为ldhL2基因PCR,ldhL2基因的扩增片段大小应为1053bp;泳道3为ldhD基因PCR,ldhD基因的扩增片段大小应为1068bp,三个基因的PCR扩增片段大小验证正确,说明凝结芽孢杆菌ATCC7050中存在有ldhL1、ldhL2和ldhD三个基因。
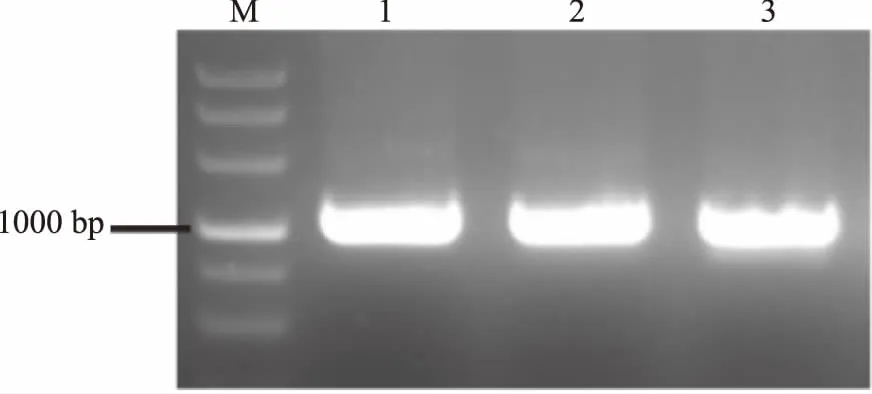
图5 ldhL1、ldhL2、ldhD基因PCR结果Fig.5 PCR results of ldhL1,ldhL2 and ldhD genes注:M:DL5000;泳道1为ldhL1基因PCR;泳道2为ldhL2基因PCR;泳道3为ldhD基因PCR。
2.4 对ldhL1、ldhL2和ldhD三个基因转录情况分析
对凝结芽孢杆菌ATCC7050中ldhL1、ldhL2和ldhD三个基因进行转录情况分析,其电泳结果如图6所示,ldhL1和ldhD基因分别以对数期、稳定期和衰亡期的cDNA为模板PCR扩增出正确条带,表明ldhL1和ldhD基因在对数期、稳定期和衰亡期都有转录;ldhL2基因分别以对数期、稳定期和衰亡期的cDNA为模板PCR没有扩增出条带,表明ldhL2基因在对数期、稳定期和衰亡期未进行转录。

图6 cDNA PCR结果Fig.6 Results of cDNA PCR注:M:DL500;泳道1~3、4~6、7~9分别为ldhL1基因、ldhL2基因和ldhD基因在对数期、稳定期和衰亡期的PCR结果。
对ldhL1和ldhD基因在对数期、稳定期和衰亡期细胞转录水平进行测定,其结果如图7所示,ldhL1和ldhD基因的转录水平随细胞生长过程逐渐降低,ldhL1基因的转录水平在任何细胞生长期都要高于ldhD的转录水平,对数期ldhL1基因的转录水平约为ldhD基因转录水平的68倍,稳定期ldhL1基因的转录水平约为ldhD基因转录水平的96倍,衰亡期ldhL1基因的转录水平约为ldhD基因转录水平的63倍。综上结果,ldhL1基因是凝结芽孢杆菌ATCC7050 L-乳酸生产的最主要基因,可以作为对凝结芽孢杆菌研究的表型基因。

图7 凝结芽孢杆菌ATCC7050的ldhL1(A)和ldhD(B)基因转录水平Fig.7 Transcriptional level of ldhL1(A)and ldhD(B) gene of Bacillus coagulans ATCC7050
3 结论
五种凝结芽孢杆菌(B.coagulans)ATCC7050、36D1、HL5、HL5-C和P4-102B主要生产L-乳酸,其光学纯度在97%以上。乳酸脱氢酶是凝结芽孢杆菌乳酸生产的关键酶,ATCC7050菌株中与乳酸合成直接相关的基因—三种乳酸脱氢酶基因:ldhL1、ldhL2和ldhD在对数生长期、稳定期和衰亡期转录情况研究结果表明,ldhL1基因是凝结芽孢杆菌ATCC7050 L-乳酸合成相关的关键基因;ldhL2基因在菌体内并未转录;ldhD基因在ATCC7050中的转录水平较ldhL1基因转录水平明显要低,在不同生长阶段ldhL1基因转录水平是ldhD基因转录水平的63~96倍,这是凝结芽孢杆菌主要生产L-乳酸的重要原因。
