PTD4- Cu/ZnSOD融合蛋白对缺氧复氧损伤模型大鼠心肌细胞H9C2心肌线粒体功能的影响
2018-07-27,,,
,,,
随着中国人口老龄化问题加剧,近20年来缺血性心脏病引起的死亡率上升到各种致死疾病的第二位[1]。有研究显示,缺血性心脏病死亡年龄段主要集中在70岁~79岁的老年后期,该阶段缺血性心脏疾病的病死率为653.2/10万[2]。随着冠状动脉搭桥术(CABG)、经皮冠状动脉内成形术(PTCA)、溶栓疗法等灌流再通技术的广泛应用[3],导致心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)病人日益增多。线粒体是细胞内氧化磷酸化和合成三磷酸腺苷(ATP)的主要场所,为细胞的活动提供能量,称为“细胞动力工厂”,线粒体也是氧自由基(reactive oxygen species,ROS)产生的主要来源和损伤的主要靶点[4- 5]。正常线粒体的膜电位(mitochondrialtransmembrane potential,MMP)是维持线粒体进行氧化磷酸化、产生ATP的先决条件,线粒体膜电位的改变直接反映线粒体功能的变化。线粒体膜电位的降低启动细胞凋亡的级联反应,是细胞凋亡的早期敏感特征[6]。MIRI发生时产生大量ROS并快速覆盖细胞内源性自由基清除系统,使细胞及线粒体膜脂质过氧化,破坏线粒体膜的完整性,通透性增加,线粒体膜电位降低,导致线粒体功能障碍,继而ATP生成减少,钙泵失活引起细胞内钙超载[7],线粒体呼吸链功能障碍使ROS过量产生得不到及时清除,最终导致心肌细胞发生不可逆损伤或凋亡。本研究采用厌氧培养箱法制备大鼠心肌缺氧复氧损伤模型,以大鼠心肌细胞为研究对象并用蛋白质转导结构域4- 铜锌超氧化物歧化酶(PTD4- Cu/ZnSOD)融合蛋白干预,通过电子显微镜结合生化检测方法,观察大鼠心肌细胞线粒体形态结构的变化,与能量代谢相关的线粒体ATP酶及与自由基清除、脂质过氧化相关的线粒体超氧化物歧化酶(SOD)和丙二醛(MDA)含量。采用Western blot测定大鼠心肌细胞B淋巴细胞瘤- 2基因(Bcl- 2)和BAX表达的表化并对其机制进行研究,从线粒体水平探讨PTD4- Cu/ZnSOD融合蛋白对缺氧复氧损伤心肌的保护作用。
1 材料与方法
1.1 实验材料及仪器 大鼠心肌细胞H9C2,购于美国模式培养物集存库(American type culture collection,ATCC)。主要试剂:PTD4- Cu/ZnSOD融合蛋白,上海生物工程有限公司;Cu/ZnSOD融合蛋白,上海生物工程有限公司;线粒体膜电位JC- 1检测试剂盒,碧云天生物技术研究所;TUNEL细胞凋亡检测试剂盒,碧云天生物技术研究所;ATP酶测定试剂盒(高速),南京建成生物工程研究所;MDA测定试剂盒,南京建成生物工程研究所;SOD测定试剂盒、BAX抗体、Bcl- 2抗体、BCA蛋白浓度测定试剂盒、β- actin抗体,南京建成生物工程研究所;其余试剂均为国产分析纯。
主要仪器:HW- 1000超级恒温水浴箱,成都泰盟科技有限公司;DT系列电子天平,中国江苏常熟长青仪器仪表厂;D- 37520低温高速离心机,德国Heraeus公司;低温离心机,Eppendorf(德国);荧光显微镜,Olympus(日本);超净工作台,Thermo(美国);微量移液器,EPpendorf(德国);超纯水系统,Millipore(美国);凝胶数字图像分析仪,美国;电泳仪(MINI- PROTEAN 3 BIO- RAD),德国;伯乐半干转膜仪,BIO- RAD;脱色摇床,海门市麒麟医用仪器厂有限公司;全自动酶标仪(Multiskan MK3),上海跃进医疗器械厂。
1.2 方法
1.2.1 缺氧复氧模型建立及分组 6孔板中的细胞在37 ℃ CO2培养箱中培养24 h后换液,细胞长满至80%后,使用磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗,再加入不含血清的低糖氨基酸和葡萄糖的培养基(dulbecco's modified eagle medium,DMEM),置入85%N2,10%H2,5%CO2的37 ℃饱和湿度厌氧培养箱。培养4 h后取出,完成缺氧。缺氧后,加入新鲜含15%胎牛血清的DMEM培养基,置入CO2培养箱中继续培养2 h,完成复氧。将培养的细胞随机分为4组,正常培养的心肌细胞作为正常组。在缺氧复氧损伤的细胞培养液中不加任何处理因素作为HRI组,加入10 μmol/L的PTD4- Cu/ZnSOD融合蛋白作为PTD4- Cu/ZnSOD组,加入10 μmol/L的Cu/ZnSOD融合蛋白作为Cu/ZnSOD组,之后共同孵育30 min。
1.2.2 线粒体膜电位检测 吸出每孔的培养液,PBS洗涤细胞1次,加入1 mL培养液。加入1 mL JC- 1染色工液,充分混匀,37 ℃孵育20 min。孵育期间按1 mL JC- 1染色缓冲液(5×)加入4 mL蒸馏水比例,配制JC- 1染色缓冲液(1×),放置冰浴。37 ℃孵育结束后,吸去上清液,用JC- 1染色缓冲液洗涤2次(冰浴)。荧光显微镜下观察。
1.2.3 TUNEL细胞凋亡检测 4%的多聚甲醛固定细胞30 min~60 min,之后用PBS洗涤3次,每次5 min。加入含0.2%的TritonX- 100的PBS,冰浴5 min。PBS洗涤2次,每次5 min。滴加100 μL的平衡缓冲液(equilibration buffer)于样本区域上,室温平衡5 min~10 min。滴加100 μL的末端转移酶(terminal transferase,TdT)酶反应液于样本区域上,于37 ℃湿盒中孵育60 min。样本放入20×SSC溶液的染色缸中终止反应,加入100 μL的本辣根过氧化物酶标记Streptavidin(HRP- labeled Streptavidin,HRP- Streptavidin)室温孵育30 min。室温显色30 s至5 min,最后用蒸馏水冲洗终止显色。苏木素复染30 s至1 min,脱水后封片。显微镜下观察凋亡的细胞显色为棕褐色。
1.2.4 线粒体ATP酶检测 将不同处理的心肌细胞弃去培养液后,分别用细胞收集液作用2 min~3 min,收集细胞,以6 000 r/min离心15 min。弃上清液,之后加细胞匀浆液,用匀浆器匀浆,将匀浆后的液体置于离心管配平后放入普通离心机,以2 500 r/min离心15 min,缓慢吸取上清液,移入高速离心管中,以17000 r/min离心20 min,弃上清液,留取沉淀物。加入0.25 mol/L蔗糖与0.003 mol/L氯化钙液1 mL,用吸管吹打成悬液,以17 000 r/min离心20 min,将上清液吸入另一试管中,留取沉淀物,加入0.1 mL 0.25 mol/L蔗糖与0.003 mol/L氯化钙溶液混匀成悬液,即得线粒体悬液。BCA法测定蛋白浓度。
1.2.5 线粒体SOD含量检测 将不同处理的心肌细胞弃去培养液后,分别用细胞收集液作用2 min~3 min,将细胞收集起来,6 000 r/min离心15 min。弃上清液,之后加细胞匀浆液,用匀浆器匀浆,将匀浆后的液体置于离心管配平后放入普通离心机,以2500 r/min离心15 min,缓慢吸取上清液,移入高速离心管中,以17 000 r/min离心20 min,弃上清液,留取沉淀物。加入0.25 mol/L蔗糖与0.003 mol/L氯化钙液1 mL,用吸管吹打成悬液,以17 000 r/min离心20 min,将上清液吸入另一试管中,留取沉淀物,加入0.1 mL 0.25 mol/L蔗糖与0.003 mol/L氯化钙溶液混匀成悬液,即得线粒体悬液。取部分线粒体悬液用1×PBS(pH7.4)稀释20倍用于之后的检测。
1.2.6 线粒体MDA含量检测 将不同处理的心肌细胞弃去培养液后,分别用细胞收集液作用2 min~3 min,将细胞收集起来,6 000 r/min离心15 min。弃上清液,之后加细胞匀浆液,用匀浆器匀浆,将匀浆后的液体置于离心管配平后放入普通离心机,以2500 r/min离心15 min,缓慢吸取上清液,移入高速离心管中,以17 000 r/min离心20 min,弃上清液,留取沉淀物。加入0.25 mol/L蔗糖与0.003 mol/L氯化钙液1 mL,用吸管吹打成悬液,以17 000 r/min离心15 min,将上清液吸入另一试管中,留取沉淀物,加入0.1mL 0.25 mol/L蔗糖与0.003 mol/L氯化钙溶液混匀成悬液,即得线粒体悬液。再用涡旋混匀器混匀,试管口用保鲜膜扎紧,用针头刺一小孔,95 ℃水浴40 min,取出后,流水冷却,之后3 500 r/min离心10 min。取上清液,535 nm处测定各管吸光度值。
1.2.7 Western检测BCL- 2、BAX蛋白的表达 收集细胞后用含酶抑制剂的蛋白质抽提试剂进行细胞裂解,裂解液于预冷的离心机14 000 r/min离心15 min,收集上清液。用BCA蛋白定量法进行蛋白质浓度测定。计算含50 μg蛋白的溶液体积即为上样量,加入上样总体积20 mL,100 ℃变性5 min,根据蛋白分子量配制12%的聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)。根据预染maker判断目的蛋白充分分离后,停止电泳。取出凝胶切下目的条带,用蒸馏水冲洗,剪与PAGE凝胶相同大小的聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)和滤纸,PVDF膜甲醇浸泡数秒后与滤纸一起浸泡于电转缓冲液中。按照黑色版—纤维垫—滤纸—凝胶—PVDF膜—滤纸—纤维垫—白色版依次放好,夹紧板后放入转膜仪内。转膜条件:BAX,BCL- 2,200 mA,40 min。用含5%脱脂奶粉的封闭液浸泡PVDF膜,室温摇床封闭2 h。用封闭液稀释一抗,使PVDF膜浸泡于孵育液中,4℃孵育过夜。BAX,1︰600稀释;BCL- 2,1︰600稀释。用封闭液稀释HRP标记的二抗,使PVDF膜浸泡于孵育液中,室温摇床孵育2 h。ECL显色。X光片显影,扫描,照片。应用凝胶图像扫描系统对显影胶片进行吸光度扫描,结果以目标蛋白条带吸光度与对内参条带吸光度比值表示。

2 结 果
2.1 心肌细胞线粒体膜电位检测 正常的心肌细胞呈现红色荧光,无绿色荧光呈现(无线粒体膜电位下降)。PTD4- Cu/ZnSOD组红色荧光明显强于HRI组、Cu/ZnSOD组,而Cu/ZnSOD组相较HRI组红色荧光增强不明显,说明缺氧复氧损伤后,大部分心肌细胞呈现绿色荧光,线粒体膜电位下降较明显,Cu/ZnSOD不能减轻线粒体膜电位的下降趋势,PTD4- Cu/ZnSOD可明显减轻线粒体膜电位的降低。详见图1。

正常组 HRI组 Cu/ZnSOD组 PTD4- Cu/ZnSOD组
2.2 各组心肌细胞凋亡指数、总ATP酶、MDA含量、SOD活性比较 HRI组心肌细胞棕褐色的凋亡细胞明显多于正常组;PTD4- Cu/ZnSOD组棕褐色凋亡细胞明显少于HRI组,详见图2。HRI组、Cu/ZnSOD组、PTD4- Cu/ZnSOD组的凋亡指数、MDA含量、均明显高于正常组,总ATP酶、SOD含量均明显低于正常组,差异有统计学意义(P<0.01);Cu/ZnSOD组与HRI组凋亡指数、总ATP酶、MDA含量及SOD活性比较,差异无统计学意义(P>0.05);PTD4- Cu/ZnSOD组凋亡指数、MDA含量明显低于HRI组、Cu/ZnSOD组;总ATP酶、SOD活性明显高于HRI组、Cu/ZnSOD组,差异有统计学意义(P<0.01)。详见表1。

正常组 HRI组 Cu/ZnSOD组 PTD4- Cu/ZnSOD组

表1 各组心肌细胞凋亡指数、总ATP酶、MDA含量、SOD活性比较(±s)
2.3 Western检测Bcl- 2、Bax蛋白的表达 各组心肌细胞中均有Bcl- 2、Bax蛋白的表达。HRI组、Cu/ZnSOD组、PTD4- Cu/ZnSOD组Bcl- 2表达水平均明显低于正常组,Bax蛋白表达明显高于正常组(P<0.05)。PTD4- Cu/ZnSOD组Bcl- 2表达水平明显高于HRI组、Cu/ZnSOD组,BAX表达水平则明显较低(P<0.05)。HRI组与Cu/ZnSOD组Bcl- 2、Bax表达水平比较,差异无统计学意义(P>0.05)。详见表2、图3。

表2 各组心肌细胞Bcl- 2、Bax蛋白水平表达比较(±s) pg/mL
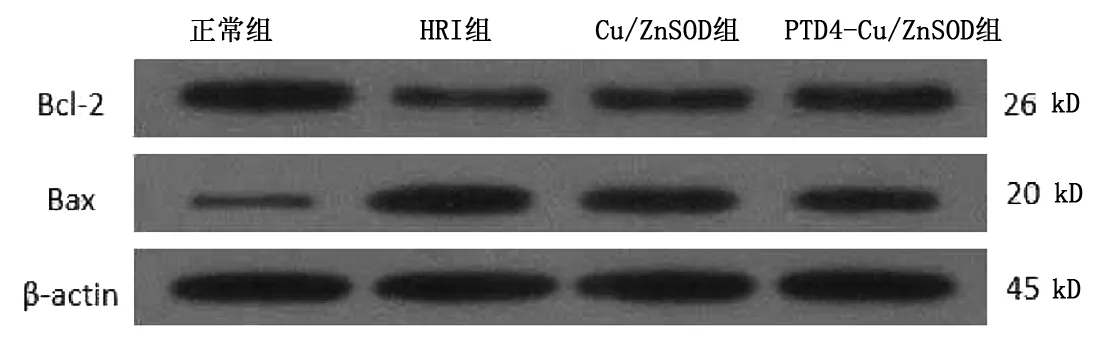
图3 各组心肌细胞BCL- 2与BAX蛋白的表达
3 讨 论
ATP酶作为一种逆化学梯度转运的蛋白酶在细胞膜、线粒体膜及微粒体膜上广泛存在,其能将ATP催化水解成为ADP且释放一定的能量,其中Na+- K+- ATP酶及Ca2+- ATP酶对维持心肌细胞线粒体的形态、离子浓度梯度的平衡具有重要的作用[7- 9]。存在于心肌细胞线粒体内膜的ATP酶对维持线粒体膜内外离子浓度平衡起重要作用。心肌缺氧复氧损伤的过程,细胞能量代谢出现障碍,线粒体氧化磷酸化受阻,ATP酶活性显著下降,ATP合成减少,离子浓度失衡,形成恶性循环,最后导致心肌细胞凋亡[10]。本研究结果显示,心肌缺氧复氧损伤后线粒体ATP酶活性呈现明显降低趋势,而PTD4- Cu/ZnSOD融合蛋白干预后有明显提升,说明PTD4- Cu/ZnSOD融合蛋白可提高心肌细胞线粒体ATP酶活性,维持线粒体内离子浓度平衡,稳定线粒体膜通透性,减轻线粒体水肿,维持线粒体膜电位发挥心肌保护作用,此与线粒体超微结构及线粒体膜电位检测结果保持一致。
线粒体是细胞内氧化磷酸化及ATP形成的主要场所,是人体内ROS生成的主要部位,同时也是对ROS损伤敏感的细胞器之一[11]。当线粒体受损时,主要表现为线粒体膜通透性明显增加,膜电位呈现明显下降趋势,即线粒体膜电位下降标志着线粒体的受损及细胞凋亡的开始[11]。本研究结果表明,心肌细胞缺氧复氧损伤引起线粒体膜电位明显降低,而PTD4- Cu/ZnSOD融合蛋白干预可明显减轻下降趋势;在对细胞凋亡的检测中,PTD4- Cu/ZnSOD融合蛋白干预明显减轻心肌细胞凋亡情况,说明PTD4- Cu/ZnSOD融合蛋白能有效抑制线粒体膜电位降低,减轻心肌细胞凋亡情况。
心肌缺氧复氧损伤时,ROS能主动攻击细胞膜中的不饱和脂肪酸(polyunsaturatedfattyacid,PUFA),从而引起脂质过氧化反应[12],反应产生的主要物质是MDA,因此MDA间接体现心肌细胞的脂质过氧化程度。机体线粒体内的ROS主要是通过SOD清除,以此减少MDA生成,从而保护线粒体不受过氧化损伤。当出现缺血再灌注情况时,SOD活性明显下降,进而引起线粒体形态功能障碍。因此检测SOD活性可直观反映线粒体ROS的清除能力。本研究结果表明,PTD4- Cu/ZnSOD融合蛋白干预可明显提高线粒体SOD活性,降低MDA含量,使心肌线粒体ROS的清除能力提升,发挥心肌保护作用。
Bcl- 2家族蛋白能极大程度地影响细胞凋亡,而Bcl- 2蛋白、Bax蛋白是Bcl- 2家族的重要组成部分。Bcl- 2蛋白是一种重要的细胞存活促进因子,主要通过抑制自由基产生促进细胞生存[13]。当凋亡信号受到刺激后,Bax单体能从细胞质中转位至线粒体膜,且与Bcl- 2蛋白结合,最终诱发细胞的凋亡[14- 15]。本研究结果显示,HRI组、Cu/ZnSOD组、PTD4- Cu/ZnSOD组Bcl- 2蛋白表达下降明显,Bax蛋白明显升高;经PTD4- Cu/ZnSOD处理后的细胞Bcl- 2/Bax比值明显较高,说明PTD4- Cu/ZnSOD融合蛋白能提升Bcl- 2蛋白表达水平,降低Bax表达,以此保护线粒体膜的渗透性,从而起到抗细胞凋亡的作用。
本研究将PTD4- Cu/ZnSOD融合蛋白作用于受到缺氧复氧损伤的心肌细胞,验证融合蛋白能减轻线粒体形态及结构的损伤,抑制线粒体膜电位降低,最终达到减少心肌细胞凋亡目的。在本研究结果基础上,检测线粒体ATP酶、SOD和MDA含量、Bcl- 2/Bax蛋白的表达,使上述研究结果得到了进一步验证。本实验结果表明,PTD4- Cu/ZnSOD融合蛋白通过提高线粒体的ATP酶活性,保持线粒体离子浓度保持平衡;通过提高线粒体SOD活性清除氧自由基,减轻脂质过氧化,以此减轻自由基对线粒体造成的损伤;通过提升线粒体膜Bcl- 2蛋白的表达水平,降低Bax蛋白的表达水平,抑制心肌细胞凋亡,进而发挥对心肌的保护作用。
综上所述,PTD4- Cu/ZnSOD融合蛋白通过提高线粒体ATP酶活性,维持线粒体离子浓度平衡状态,稳定线粒体膜电位,从而减轻线粒体损伤;通过提高线粒体的SOD活性,减轻自由基对线粒体造成的损伤;PTD4- Cu/ZnSOD融合蛋白能提升线粒体膜Bcl- 2蛋白的表达水平,降低Bax蛋白的表达,抑制心肌细胞凋亡,发挥心肌保护作用。
