微小RNA-204-5p靶向蛋白质酪氨酸磷酸酶1B基因对缺氧复氧诱导的大鼠心肌细胞氧化应激的影响
2022-04-29李琼王磊高波
李琼,王磊,高波
急性心肌梗死(acute myocardial infarction,AMI)是由冠状动脉急性持续缺血缺氧引起心肌坏死的心血管疾病,具有极高的致死率。目前,临床主要采用溶栓、经皮冠状动脉介入治疗和冠状动脉搭桥手术等手段恢复心肌血液供应。然而,一旦心肌供血恢复,会引起心肌细胞氧化应激,导致细胞损伤和凋亡[1]。近年来,越来越多的数据表明,微小RNA(microRNA,miRNA)的表达失调与人类多种心血管疾病有关[2],包括缺氧复氧损伤[3]。miR-204-5p位于人类染色体9q21.12,Xiao 等[4]研究发现,缺氧复氧诱导下心肌细胞中miR-204-5p 表达下调,miR-204-5p 通过靶向自噬相关蛋白LC3-Ⅱ调控缺氧复氧诱导的心肌细胞自噬;此外,Qiu 等[5]研究表明,miR-204-5p 通过调节沉默调节蛋白1(Silencing regulatory protein 1,sirt1)介导的自噬,保护H9C2 细胞免受缺氧复氧诱导的损伤。然而,miR-204-5p 对缺氧复氧诱导下的心肌细胞氧化应激的影响和机制仍有待阐明。本研究以心肌细胞缺氧复氧模型模拟AMI 过程,旨在阐明miR-204-5p 对缺氧复氧诱导下的心肌细胞氧化应激和凋亡的影响,探索其分子机制,以期为临床治疗AMI提供新思路。
1 材料与方法
1.1 实验材料大鼠胚胎心肌细胞株H9C2购于上海中科院典型培养物保藏细胞库;MTT 试剂盒购于美国Sigma 公司;荧光素酶报告基因检测试剂盒均购自美国Promega 公司;乳酸脱氢酶(LDH)、心肌肌钙蛋白(cTnT)、超氧化物歧化酶(SOD)、活性氧簇(ROS)和丙二醛(MDA)检测试剂盒南京建成生物工程研究所;PCR 引物、miR-con、miR-204-5p mimics、pcDNA、pcDNA-蛋白质酪氨酸磷酸酶1B(The protein tyrosine phosphatase 1B,PTP1B)及WT-PTP1B 和MUT-PTP1B 的构建和测序均由上海生工公司提供。膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)试剂盒购于北京索莱宝生物科技有限公司;Trizol 试剂和western 相关试剂购于上海碧云天公司;细胞周期蛋白D1(cyclin D1)、B 细胞淋巴瘤-2(Bcl-2)和Bcl相关X(Bax)等鼠源Ⅰ抗购于美国Santa Cruz公司;兔源PTP1B抗体购于Abcam公司;HRP标记的羊抗兔和羊抗鼠Ⅱ抗购于武汉博士德公司;LipofectamineTM2000购于Invitrogen公司。
1.2 实验方法
1.2.1 H9C2 心肌细胞缺氧复氧模型的建立用高糖DMEM 培养基(含10%胎牛血清和1%青链霉素混合液)在37 ℃含5%二氧化碳的细胞培养箱中培养H9C2。将H9C2 细胞培养基更换为无糖DMEM培养基,置于缺氧培养箱中培养6 h,复氧时更换为新鲜高糖DMEM 培养基常规培养6 h,标记为缺氧复氧组;未经任何处理的H9c2细胞标记为空白组。
1.2.2 细胞转染和实验分组收集对数期的H9c2细胞,分别将miR-con、miR-204-5p mimics 转染至H9c2细胞,转染成功后按照“1.2.1”方法进行缺氧复氧处理,分别标记为缺氧复氧+miR-con 组、缺氧复氧+miR-204-5p 组。后续实验中为进一步验证miR-204-5p 是通过调控PTP1B 表达进而影响缺氧复氧诱导的心肌细胞氧化应激,将miR-204-5p mimics 和pcDNA 共转染至H9c2 细胞,进行缺氧复氧处理后标记为缺氧复氧+miR-204-5p+pcDNA 组;将miR-204-5p mimics 和pcDNA-PTP1B 共转染至H9c2 细胞,进行缺氧复氧处理后标记为缺氧复氧+miR-204-5p+pcDNA-PTP1B 组。转染方法参照LipofectamineTM2000使用说明书。
1.2.3 实时荧光定量逆转录聚合酶链式反应(qRTPCR)检测用Trizol 法提取H9C2 细胞总RNA,反转录合成cDNA,以cDNA为模板制备qRT-PCR反应体系,上实时荧光定量PCR 仪检测miR-204-5p 和PTP1B mRNA的相对表达量。
1.2.4 荧光素酶报告基因实验 TargetScan 预测发现miR-204-5p 与PTP1B 序列的3’-UTR 存在结合位点。将含有结合位点的PTP1B3’-UTR 片段或cDNA插入荧光素酶报告基因载体构建WT-PTP1B、MUTPTP1B。分别将WT-PTP1B、MUT-PTP1B 与miR-204-5p mimics 共转染至H9c2 细胞,收集转染48 h细胞并测定各组细胞中荧光素酶活性。
1.2.5 四甲基偶氮唑盐微量酶反应比色(MTT)法检测细胞增殖收集各组对数生长期H9c2细胞,细胞接种至96 孔板,每孔加入10µL 的MTT 试剂(5 g/L)孵育4 h,弃上清,向各孔内加入150µL的DMSO,振荡10 min,利用酶标仪检测各孔490 nm 处吸光度值(OD),细胞存活率(%)=(处理组OD/对照组OD)×100%。
1.2.6 检测LDH、cTnT、SOD、MDA、ROS 水平细胞分组处理后,收集细胞培养液,按试剂盒操作说明检测LDH、cTnT含量。同时收集各组H9C2细胞,加入RIPA 裂解液,冰上裂解30 min,低温下12 000 r/min 转速离心15 min,收集上清液,按照试剂盒说明书检测SOD、MDA、ROS水平。
1.2.7 流式细胞术检测细胞凋亡用1×binding buffer 重悬各组细胞调整其浓度为1×105个/毫升。取5µL的Annexin V/FITC 和10µL的PI溶液依次加入到100 µL 细胞悬液中,避光孵育15 min,补加1×binding buffer至500µL后,于1 h内上机检测。
1.2.8 蛋白质印迹法(Western blotting)检测 RIPA裂解液提取细胞总蛋白,每组取30 µg 蛋白样品进行SDS-PAGE 电泳,经湿法转膜、脱脂奶粉封闭后,加入各蛋白Ⅰ抗(1∶500 稀释)及内参β-actin 一抗(1∶1 000 稀释),洗膜后,加入Ⅱ抗(1∶2 000),化学发光显影,放入自动凝胶成像系统拍照,Image J 软件测定各蛋白条带相对灰度值。
1.3 统计学方法用SPSS 19.0 进行统计学分析,所有数据均用±s表示。两组数据的比较采用t检验;多组数据采用单因素方差分析,组间多重比较采用SNK-q检验。P<0.05表示差异有统计学意义。
2 结果
2.1 缺氧复氧处理后心肌细胞中miR-204-5p 和PTP1B 表达情况与空白组比较,缺氧复氧组心肌细胞miR-204-5p 表达降低,PTP1BmRNA 和PTP1B蛋白的表达升高(P<0.05),见表1和图1。
表1 缺氧复氧处理心肌细胞影响miR-204-5p和PTP1B表达/±s

表1 缺氧复氧处理心肌细胞影响miR-204-5p和PTP1B表达/±s
注:①与空白组向比较,P<0.05。
组别空白组缺氧复氧组t值P值重复次数99 miR-204-5p 1.00±0.09 0.21±0.04①24.06<0.001 PTP1B mRNA 1.00±0.13 6.74±0.58①28.97<0.001 PTP1B蛋白0.31±0.05 0.76±0.08①14.31<0.001

图1 检测心肌细胞中PTP1B蛋白表达
2.2 miR-204-5p 靶向调控PTP1B 的表达 Targetscan 预测到miR-204-5p 与PTP1B 序列的3’UTR存在部分连续结合位点,见图2A。当上调miR-204-5p 表达后,转染WT-PTP1B 的3’UTR 报告基因心肌细胞的荧光素酶活性显著下降(P<0.05),而转染MUT-PTP1B 的3’UTR 报告基因心肌细胞的荧光素酶活性无显著变化(P>0.05),见表2。当上调miR-204-5p 表达后,心肌细胞中PTP1B 蛋白的表达显著降低;当下调miR-204-5p 表达后,心肌细胞中PTP1B 蛋白的表达显著增加(P<0.05),见表3 和图2B。提示PTP1B 是miR-204-5p 的靶基因,miR-204-5p可负性调控PTP1B的表达。
表2 双荧光素酶报告实验/±s

表2 双荧光素酶报告实验/±s
组别miR-con组miR-204-5p组t值P值重复次数99 WT-PTP1B 1.00±0.09 0.35±0.05 18.94<0.001 MUT-PTP1B 1.46±0.12 1.52±0.15 0.94 0.363
表3 miR-204-5p靶向PTP1B调控其表达/±s

表3 miR-204-5p靶向PTP1B调控其表达/±s
注:①与miR-con组比较,P<0.05。②与anti-miR-con组比较,P<0.05。
组别miR-con组miR-204-5p组anti-miR-con组anti-miR-204-5p组F值P值重复次数9999 PTP1B蛋白0.31±0.04 0.06±0.03①0.29±0.05 0.45±0.06②109.22<0.001
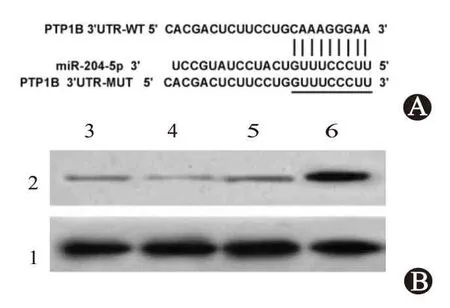
图2 miR-204-5p靶向调控PTP1B的表达:A为PTP1B的3’UTR中含有与miR-204-5p互补的核苷酸序列;B为心肌细胞中PTP1B蛋白的表达
2.3 过表达PTP1B逆转miR-204-5p对缺氧复氧处理诱导的心肌细胞增殖的影响与空白组相比,缺氧复氧处理显著抑制心肌细胞的存活,促进PTP1B表达,抑制Cyclin D1 表达,促进LDH 和cTnT 的释
放;与缺氧复氧+miR-con 组相比,缺氧复氧+miR-204-5p 组心肌细胞存活率显著升高,PTP1B 表达含量显著降低,Cyclin D1 表达显著升高;与缺氧复氧+miR-204-5p+pcDNA 组比较,缺氧复氧+miR-204-5p+pcDNA-PTP1B 组心肌细胞存活率显著降低,PTP1B表达和LDH 含量显著升高,Cyclin D1 表达显著降低,LDH 和cTnT 含量显著升高(P<0.05),见表4 和图3。以上结果表明,缺氧复氧处理可显著抑制心肌细胞存活,而miR-204-5p 通过下调PTP1B 表达促进心肌细胞存活。

图3 检测心肌细胞中Cyclin D1蛋白表达
表4 转染miR-204-5p促进缺氧复氧处理心肌细胞存活率/±s

表4 转染miR-204-5p促进缺氧复氧处理心肌细胞存活率/±s
注:①与空白组向比较,P<0.05。②与缺氧复氧+miR-con组向比较,P<0.05。③与缺氧复氧+miR-204-5p+pcDNA组向比较,P<0.05。
组别空白组缺氧复氧组缺氧复氧+miR-con组缺氧复氧+miR-204-5p组缺氧复氧+miR-204-5p+pcDNA组缺氧复氧+miR-204-5p+pcDNA-PTP1B组F值P值重复次数999999 PTP1B 0.27±0.07 0.81±0.05①0.78±0.04 0.42±0.18②0.46±0.18 0.61±0.18③23.09<0.001 Cyclin D1 0.75±0.06 0.34±0.03①0.31±0.04 0.56±0.06②0.61±0.05 0.38±0.04③120.43<0.001 LDH/(U/L)480.76±36.96 895.91±51.84①850.83±62.11 629.63±54.59②657.84±56.76 721.85±55.49③72.98<0.001 cTnT/(µg/L)0.26±0.04 0.73±0.08①0.75±0.09 0.42±0.05②0.44±0.06 0.63±0.08③72.16<0.001细胞存活/%100.00±6.80 55.99±4.69①52.72±4.59 78.37±6.48②78.89±5.74 61.23±6.28③85.49<0.001
2.4 过表达PTP1B逆转miR-204-5p对缺氧复氧处理诱导的心肌细胞氧化应激的影响与空白组比较,缺氧复氧处理后心肌细胞ROS 水平显著提高,SOD 活力显著降低,MDA 含量显著升高;与缺氧复氧+miR-con 组比较,缺氧复氧+miR-204-5p 组心肌细胞SOD 活力显著升高,ROS 水平显著降低,MDA含量显著降低;与缺氧复氧+miR-204-5p+pcDNA 组比较,缺氧复氧+miR-204-5p+pcDNA-PTP1B 组心肌细胞SOD 活力降低,ROS 水平显著提高,MDA 含量升高(P<0.05),见表5。结果表明,缺氧复氧可诱导心肌细胞氧化损伤,miR-204-5p 通过下调PTP1B 表达则提高抗氧化物酶SOD的活力,降低MDA含量和细胞内ROS水平,对心肌细胞具有保护作用。
表5 过表达PTP1B逆转miR-204-5p对缺氧复氧处理诱导的心肌细胞氧化应激的影响/±s

表5 过表达PTP1B逆转miR-204-5p对缺氧复氧处理诱导的心肌细胞氧化应激的影响/±s
注:①与空白组向比较,P<0.05。②与缺氧复氧+miR-con组向比较,P<0.05。③与缺氧复氧+miR-204-5p+pcDNA组向比较,P<0.05。
组别空白组缺氧复氧组缺氧复氧+miR-con组缺氧复氧+miR-204-5p组缺氧复氧+miR-204-5p+pcDNA组缺氧复氧+miR-204-5p+pcDNA-PTP1B组F值P值重复次数9 99999 SOD/(U/L)24.60±1.34 9.85±0.87①10.61±0.95 16.39±0.78②17.46±1.27 12.53±0.86③255.35<0.001 ROS荧光强度486.53±75.69 1486.24±162.087①1557.26±156.86 789.57±93.62②726.75±86.45 1236.27±126.58③118.14<0.001 MDA/(nmol/mL)4.83±0.35 15.73±1.18①15.35±1.78 7.84±0.85②8.13±1.09 12.21±1.32③127.54<0.001
2.5 过表达PTP1B逆转miR-204-5p对缺氧复氧处理诱导的心肌细胞凋亡的影响与空白组比较,缺氧复氧处理显著抑制心肌细胞Bcl-2蛋白表达,促进Bax 蛋白表达,促进心肌细胞凋亡;与缺氧复氧+miR-con 组比较,缺氧复氧+miR-204-5p 组心肌细胞Bcl-2蛋白表达显著升高,Bax蛋白表达显著降低,细胞凋亡率降低;与缺氧复氧+miR-204-5p+pcDNA 组比较,缺氧复氧+miR-204-5p+pcDNA-PTP1B 组心肌细胞Bcl-2 蛋白表达显著降低,Bax 蛋白表达显著升高,细胞凋亡率升高(P<0.05),见表6 和图4。以上结果表明,缺氧复氧处理可诱导心肌细胞凋亡,而miR-204-5p 通过下调PTP1B 表达可抑制缺氧复氧处理诱导的心肌细胞凋亡。
表6 转染miR-204-5p抑制缺氧复氧处理心肌细胞凋亡/±s

表6 转染miR-204-5p抑制缺氧复氧处理心肌细胞凋亡/±s
注:①与空白组向比较,P<0.05。②与缺氧复氧+miR-con组向比较,P<0.05。③与缺氧复氧+miR-204-5p+pcDNA组向比较,P<0.05。
组别空白组缺氧复氧组缺氧复氧+miR-con组缺氧复氧+miR-204-5p组缺氧复氧+miR-204-5p+pcDNA组缺氧复氧+miR-204-5p+pcDNA-PTP1B组F值P值重复次数9 99999 Bcl-2蛋白0.67±0.05 0.14±0.03①0.18±0.03 0.45±0.05②0.40±0.04 0.22±0.03③237.52<0.001 Bax蛋白0.21±0.04 0.85±0.06①0.89±0.07 0.34±0.03②0.41±0.04 0.57±0.06③256.77<0.001细胞凋亡率/%5.57±0.72 23.26±1.82①22.81±1.44 13.66±1.35②12.59±0.96 18.38±1.16③249.22<0.001

图4 检测心肌细胞中Bax和Bcl-2蛋白表达
3 讨论
AMI是临床最常见的心血管疾病之一。心肌细胞损伤发生在缺血再灌注损伤后的心肌组织中,氧化应激是心肌缺血再灌注损伤时心肌损伤扩大的重要因素,在急性心肌梗死中起重要作用[6]。
近年来,miRNA 在心血管疾病中的作用引起研究者的兴趣,包括miR-223-3p[7]和miR-210[8]在内的许多miRNA 参与心肌细胞氧化应激损伤和凋亡。此外,Li 等[9]研究发现miR-340-5p 通过调节Act1/NF-κB通路对缺氧复氧诱导的心肌细胞凋亡和氧化应激具有保护作用。目前,对miR-204-5p 的研究主要集中在肿瘤领域,其在心血管疾病中的作用并完全阐明。Koyama 等[10]研究发现,miR-204-5p 是醛固酮刺激心肌细胞中t 型钙通道表达的必需基因;Yu等[11]研究表明,敲减lncRNA AK139328 通过调控miR-204-3p 表达,抑制心肌细胞自噬,可减轻糖尿病小鼠心肌缺血/再灌注损伤;此外,miR-204通过靶向LC3-Ⅱ对缺血再灌注诱导的心肌细胞自噬具有抑制作用[4]。PTP1B 是蛋白酪氨酸磷酸酶家族成员之一,广泛存在于心脏组织中,与心血管疾病密切相关[12]。PTP1B的缺失通过调节细胞自噬可消除内质网应激引起的心肌功能障碍[13]。PTP1B还是循环ADP 核糖体诱导心室肌细胞钙离子信号转导的调节因子[14]。此外,miR-135a 通过靶向PTP1B 对大鼠心肌缺血再灌注损伤具有保护作用[15]。生物信息学分析显示,PTP1B 是miR-204-5p 潜在靶基因,但miR-204-5p 能否介导PTP1B 表达调控缺氧复氧诱导的心肌细胞氧化应激尚未可知。
本研究首先检测了缺氧复氧处理的心肌细胞中miR-204-5p 和PTP1B 的表达,结果显示,缺氧复氧处理可抑制miR-204-5p 表达,促进PTP1B 表达。进一步研究证实miR-204-5p 可靶向负性调控PTP1B 的表达,于是推测miR-204-5p 通过下调PTP1B参与对缺氧复氧诱导的心肌细胞氧化应激的调控。当心肌损伤发生时,LDH和cTnT释放将明显增加,通过检测细胞培养液LDH 和cTnT 的渗漏率能够有效反映细胞损伤程度[16]。ROS 是引起氧化应激的主要因子,氧化应激引起细胞损伤,导致终产物MDA 的累积[17]。MDA 含量可以反映氧自由基攻击引起的细胞膜损伤的严重程度[18]。研究人员发现,在缺氧复氧诱导的心肌损伤中ROS和MDA的水平升高,超氧化物歧化酶SOD 活性降低[19]。本研究中,缺氧复氧诱导后,心肌细胞存活率降低,细胞上清液中LDH 和cTnT 含量显著升高,细胞内MDA和ROS 水平显著升高,而超氧化物歧化酶SOD 水平显著降低,细胞凋亡率增加;而上调miR-204-5p 可以促进心肌细胞存活,抑制LDH 和cTnT 的释放,抑制细胞内MDA 和ROS 水平,增加SOD 水平,抑制缺氧复氧诱导的细胞凋亡。此外,我们发现过表达PTP1B 可部分逆转miR-204-5p 对心肌细胞氧化应激和凋亡的影响。这些结果表明,miR-204-5p 通过靶向PTP1B 表达能够保护心肌细胞免受缺氧复氧诱导的细胞凋亡和氧化应激。
