氧化变构制备大豆分离蛋白质基表面活性剂
2017-11-13李军生阎柳娟黄国霞
钟 新 , 李军生 *, 阎柳娟 , 黄国霞
(1.广西科技大学生物与化学工程学院,广西柳州 545006;2.广西糖资源绿色加工重点实验室,广西柳州 545006;3.广西高校糖资源加工重点实验室,广西柳州 545006)
氧化变构制备大豆分离蛋白质基表面活性剂
钟 新1,2,3, 李军生1,2,3*, 阎柳娟1,2,3, 黄国霞1,2,3
(1.广西科技大学生物与化学工程学院,广西柳州 545006;2.广西糖资源绿色加工重点实验室,广西柳州 545006;3.广西高校糖资源加工重点实验室,广西柳州 545006)
本文通过控制性打开二硫键的方式,制备以大豆分离蛋白质基表面活性剂。试验结果表明:随着过氧乙酸量的增加,二硫键的打开率逐渐增加,当二硫键断开率为46%时,此条件下的γCMC,CMC值分别为53.12 mN/m,0.15 g/L,具有表面活性;HLB值为9,表明样品的亲油性较强;起泡性和起泡稳定性、乳化性和乳化稳定性都有一定的提高;圆二色谱以及荧光图谱表明,不同程度的打开二硫键,蛋白质的结构由β型转变为α+β型,内部的疏水基团暴露,导致疏水性能提高。
大豆分离蛋白;二硫键;表面活性;结构
许多水溶性的高分子聚合物都具有两性结构(亲水基团和疏水基团),具有与传统表面活性剂类似的性质(Lin等,2016)。蛋白质具有独特的结构,因此展示了其特有的功能,例如水溶性、乳化性和乳化稳定性、起泡性和起泡稳定性、凝胶性以及流变能力等。为了提高工业化的应用,许多研究学者改善其功能特性以及其表面活性(Lin等,2010)。其中化学改性是改进蛋白质表面活性的有效方法之一,可以提高其乳化能力、起泡能力、降低表面张力等。
卢滇楠(2006)通过Langevin分子动力学模拟蛋白与表面活性剂在溶液中自组装结构,结果发现,蛋白质的转换微观结构对蛋白质表面活性剂的分子设计以及应用有着重要的指导作用。吴丹(2006)通过总结光谱仪器在蛋白质表面活性剂混合体系中的应用发现,光谱技术可以研究蛋白质结构与功能的关系,并且对蛋白质以及表面活性剂的作用机理作了介绍。谢新华(2008)等研究表明,十二烷基磺酸钠可降低稻米淀粉蛋白质的含量。
大豆蛋白理论上应该具有良好的表面活性性能,但其内部存在大量的链间和链内作用力,其中包括二硫键和氢键等,限制了蛋白质结构的伸展,另外,由于其自身的结构,内部的疏水基团无法转移至分子的表面,这也是制约蛋白质表面活性的重要因素(Hudson等,2015)。因此,本文通过过氧乙酸氧化大豆分离蛋白断开内部的二硫键,改变分子内的极性和非极性基团的分布,进一步提高大豆分离蛋白质的表面活性,制备以蛋白质为基础的表面活性剂。
1 材料和方法
1.1 试验试剂 脱脂大豆粕,购自安阳得天力食品有限公司;金龙鱼大豆调和油市售;过氧乙酸,西陇化工有限公司;还原性谷胱甘肽,上海源叶生物科技有限公司。
1.2 试验仪器 pH计(PHS-250W),上海般特仪器制造有限公司;高速冷冻离心机,J-26XPI Bechman Coulter;中型冷冻干燥机YFD2000,北京博医康实验仪器有限公司;荧光分光光度计(RF-5301pc),日本岛津;100XL型高剪切混合乳化头,上海威宇机电制造有限公司;紫外可见分光光度计(Cary-60,Agilent Technologies)。
1.3 试验方法
1.3.1 大豆分离蛋白质的制备 粉粹机研磨,过80目筛。将所得的大豆粉按照重量体积比1∶10溶于去离子水,2 mol/L的NaOH调节pH至8.0,在室温下搅拌2 h,然后4000 r/min离心30 min,去掉沉淀,保留上清液并调节pH至4.8,再4000 r/min离心30 min,倒掉上清液,冷冻干燥,待用。
1.3.2 大豆分离蛋白质的氧化 取1.25 g大豆分离蛋白粉溶于50 mL pH 2.2的磷酸缓冲溶液中,分别加入 0、0.1、0.2、0.5、0.7、0.9 mL 过氧乙酸,震荡摇匀后置于-4℃黑暗反应,过夜,得到所需的样品并编号0~5待测。
1.3.3 大豆分离蛋白质含量的测定 采用双缩脲法(Kella,1986)测定蛋白质的溶解度。待测蛋白质的溶解度与双缩脲以2∶3的比例混合,室温下静置30 min,紫外分光光度计在540 nm处测定吸光度值,以横坐标为吸光度,纵坐标为酪蛋白质浓度,作标准曲线。利用标准曲线计算待测样品的蛋白质浓度。测得标准曲线为y=2.6987x+0.0603(R2=0.9935)。
1.3.4 氧化大豆分离蛋白质二硫键含量的测定采用 Elaimme(1959)法稍作修改。
溶液的配置:0.1%DTNB试剂:称取100 mg DTNB,溶于100 mL pH 8.0的磷酸缓冲液中;0.1%NTSB试剂:称取100 mg DTNB,溶于10 mL 1 mol/L的Na2SO3,再用pH 8.0磷酸缓冲液定容至100 mL。
利用谷胱甘肽做标准曲线,以谷胱甘肽浓度为横坐标,吸光度为纵坐标绘制标准曲线。所得到的标准曲线为 y=0.3697x-0.0162(R2=0.9976)。
将所得的还原型谷胱甘肽的浓度转换成巯基的浓度(mol/L),由于还原型谷胱甘肽的摩尔质量为307.32 g/moL,所以最终所得:
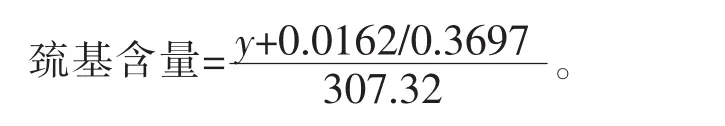
测定游离巯基:取0.4 mL待测样品加入0.4 mL DTNB试剂,用0.2 mol/L pH 8.0磷酸缓冲液再定容至10 mL,以空白组作对照。测定412 nm处的吸光度值,对照标准曲线和计算公式计算可得游离巯基浓度,若测总巯基含量,只需将上述方法中的DTNB换为NTSB即可。

1.3.5 HLB值测定 取10 mL待测样品,稀释到100 mL,取5 mL进行乳化。使用松节油(HLB值为16)和大豆油(HLB值为6),制备一系列的乳化体系(见表1)。5 mL样品加100 g乳化剂,再加85 mL水,摇匀,24 h后记录刻度管的乳化层高度,乳化层最高的,则为样品的HLB值。
1.3.6 CMC测定 采用表面张力法测定表面活性剂的CMC值。表面活性剂随着浓度的升高,表面张力越来越小,当达到CMC值后,表面张力数值几乎不变或者变化很小。试验采用以表面张力为纵坐标,以浓度的对数为横坐标作图。取样品0.1、0.3、0.5、0.7、0.9、1.1、1.3、1.5、2.0 mL 定 容 到50 mL,采用DT-102型自动界面张力仪测定。
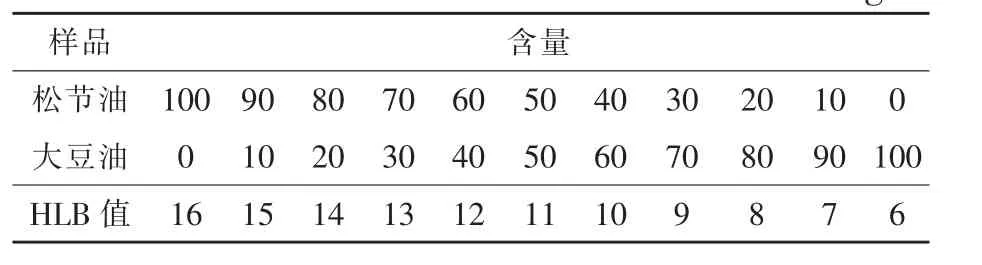
表1 制备乳化体系 g
1.3.7 乳化性及乳化稳定性的测定 采用Molina等(2001)的方法,取5 mL待测大豆分离蛋白质氧化样品,加5 mL大豆油于烧杯中,以10000 r/min的速度在高剪切混合头下搅打1 min,分别在0、30 min后于烧杯底部取 20 μL样品,与 5 mL 0.1%的SDS混合,利用紫外分光光度计在500 nm处,测定其吸光度值:

式中:T=2.303;N为蛋白质稀释倍数;c为待测样品蛋白质浓度,g/mL;φ为乳化液中油相所占体积分数(0.5);A0为 0min 的吸光度值;A30为 30min的吸光度值。
1.3.8 起泡性及起泡稳定性的测定 取10 mL待测溶液定容至50 mL,用以10000 r/min的速度在高剪切混合头下搅打1 min,将均质后的溶液倒入100mL量筒中,记下0min时刻的泡沫体积V0,30min后记下泡沫体积V30,采用以下公式计算:
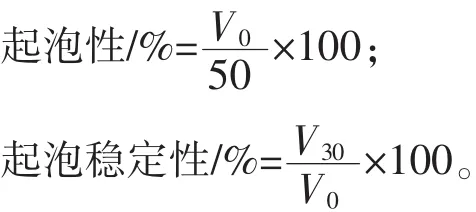
1.3.9 疏水性的测定 参照Kato等(2003)的方法。用ANS法测定氧化前后大豆分离蛋白表面疏水性的变化。取不同量的样品加入20 μL 8 mmol/L的ANS试剂。用荧光光度计扫描待测样品的荧光光谱。以样品浓度对荧光强度作图,曲线初始阶段的斜率(H0)即为样品的表面疏水指数。
1.3.10 荧光光谱的测定 以290 nm为激发波长,将样品以4000 r/min离心10 min,取0.1 mL定容至10 mL,测定大豆分离蛋白质各个样品的内源荧光,双缩脲法测定样品的蛋白质含量。设定激发狭缝宽度:5 nm;发射狭缝宽度:3 nm;扫描范围:300~420 nm;强度范围:0~1000;扫速:中速。
1.3.11 圆二色谱分析 取样品0.1 mL稀释10倍,配置成浓度为10 μg/mL的蛋白质溶液。室温条件下,测定不同样品的远紫外CD光谱图。扫描速率:100 nm/min,扫描波段:190 ~ 250 nm,间隔时间:0.25 s,狭缝宽度:1.0 nm,最小间隔度:0.2 nm。以蒸馏水作为空白,扫描3次取平均值最终得到扫描CD光谱。
2 结果与讨论
2.1 二硫键打开程度 过氧乙酸等氧化剂可以将蛋白质中二硫键氧化成磺酸基团,从而不可逆转的断开蛋白质分子中的二硫键,从表2可以看出,随着过氧乙酸浓度的增加二硫键的含量越来越少,即二硫键的打开程度越来越高。表明二硫键的断开程度与氧化剂的浓度有很大的关系。二硫键的打开程度从46%增加到98.7%,随着过氧乙酸浓度的增加大豆分离蛋白质中的二硫键断开程度迅速增加。过氧乙酸氧化处理可以使得大豆分离蛋白质分子中游离巯基以及二硫键发生不可逆氧化。同时过量的氧化会造成蛋白质分子中其他分子间作用力改变,导致蛋白质分子结构无规律破坏。
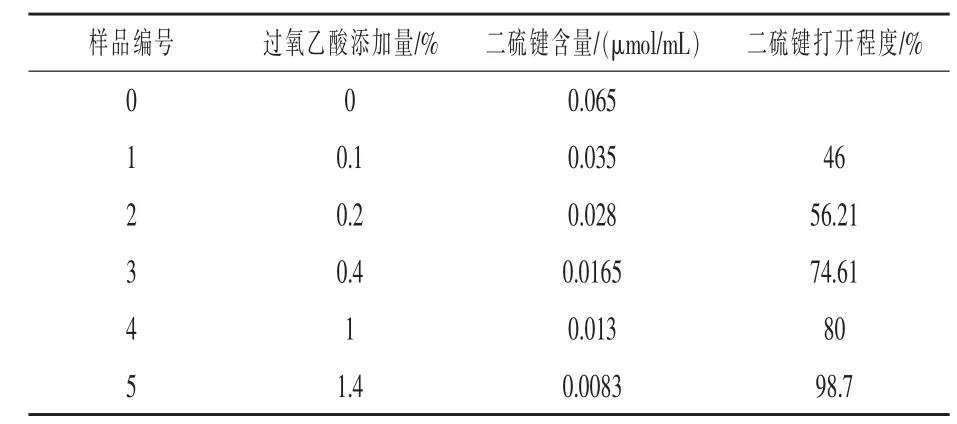
表2 过氧乙酸对二硫键打开程度的影响
2.2 氧化大豆分离蛋白质基表面活性剂的HLB值 HLB值是表面活性剂亲水基与亲油基大小和力量平衡效率的重要指标,同时也是不同性质及不同用途的重要参数。当HLB值为3~6时可用作水-油乳化剂;为7~9时可作为润湿剂;为8~15时可作为油-水乳化剂;为13~15时可作为洗涤剂;为15~18时可作为增溶剂 (巩建平,2003)。当HLB值越大时,亲水性越高,亲油性越低,反之相反。由图1可知,未经过改性的0号样品的HLB值为14,通过不同程度的断开二硫键,HLB 值依次为 9、11、11、14、13, 提高了大豆分离蛋白质的亲油性。
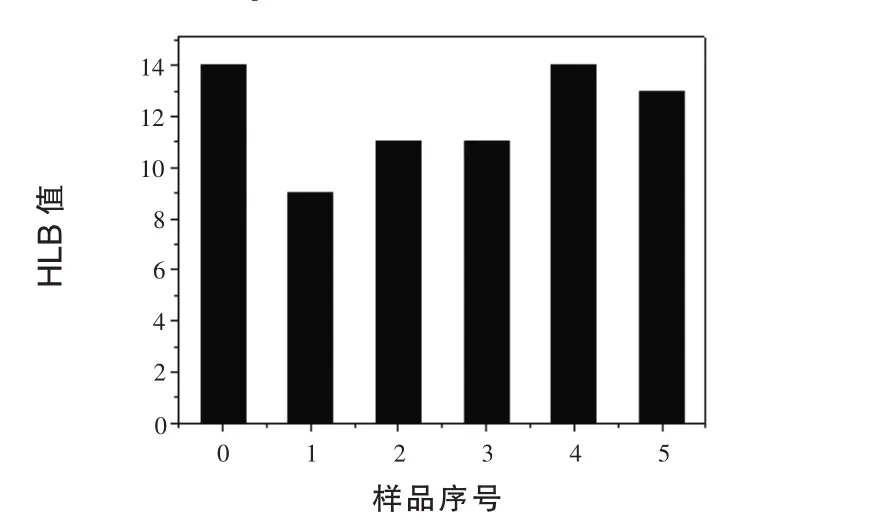
图1 0~5号样品的HLB值
2.3 氧化大豆分离蛋白质基表面活性剂的表面张力及临界胶束浓度 分子在溶液中达到某一临界浓度时,就会形成胶体。溶液形成临界胶束的浓度为临界胶束浓度(CMC),当表面活性剂在溶液中达到CMC时,溶液的表面吸附值达到饱和,溶液内部形成胶束,此时溶液的表面张力最低,因此CMC值可以作为表面活性剂的一种度量和表面活性剂溶液性质发生显著变化的一个转折点,因此CMC值对表面活性剂有着重要的研究价值(张佳程,2007)。由表3可知,氧化之后的大豆分离蛋白质形成临界胶束的浓度明显降低,说明氧化可以降低大豆分离蛋白质的表面张力,提升分离蛋白质溶液在空气界面形成胶束的能力,从而提高大豆分离蛋白质的表面活性。出现这一结果的原因可能是,蛋白质属于柔性分子,氧化断开二硫键之后,蛋白质的三级结构被打开,变得松散,分子的亲水基团和疏水基团重新排列,从而使氧化大豆分离蛋白质具有明显的表面活性特征。合适的氧化有利于提高大豆分离蛋白质的表面活性,过度的氧化会使得蛋白质发生聚集,亚基在水溶液中相互作用再次折叠,从而使得表面活性下降。

表3 0~5号样品的CMC值
2.4 氧化大豆分离蛋白质基表面活性剂的起泡性及起泡稳定性 未加入过氧乙酸时大豆分离蛋白质起泡性为51.2%,气泡稳定性为60%。由图2可知,随着二硫键打开程度的增加,起泡性随之增加,主要是因为随着氧化程度的增强蛋白质中二硫键与游离巯基发生转移,蛋白质发生去折叠、重组装等导致分子中疏水基团之间的相互作用增强(Hu等,2009),二硫键被大部分断开后蛋白质分子内部的疏水基团暴露,蛋白质在溶液状态时亲水基团与疏水基团比例接近平衡,蛋白质分子在溶液表面的定向排列更加有序,所以大豆分离蛋白质的起泡性能提高。氧化强度过强时蛋白质分子分解为各种亚基组分,从而增大了蛋白质在溶液中分子数目,较小的亚基也较易在水中定向排列,从而泡沫稳定性增加,但由于亚基在水溶液状态会受到疏水相互作用,从而使得部分疏水基团包埋,所以过度氧化,稳定性呈现下降的趋势。
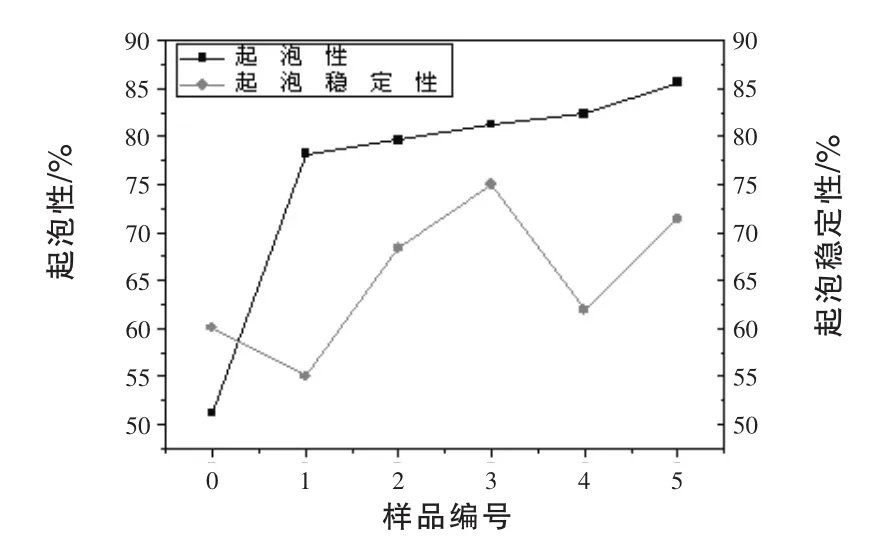
图2 氧化大豆分离蛋白质基表面活性剂的起泡性及起泡稳定性
2.5 氧化大豆分离蛋白质基表面活性剂的乳化性及乳化稳定性 由图3可知,打开二硫键之后,大豆分离蛋白质的乳化性以及乳化稳定性都有很大程度上的提高。并且暴露出更多的非极性基团,表现出了亲油性,使得大豆分离蛋白表面活性剂易溶于油相体系中,使油乳化,随着氧化强度的增强二硫键被不可逆转的断开,游离的巯基被氧化成磺酸基团,蛋白质分子中各亚基之间的作用力减弱,蛋白质高级结构被破坏,乳化性以及乳化稳定性提高。
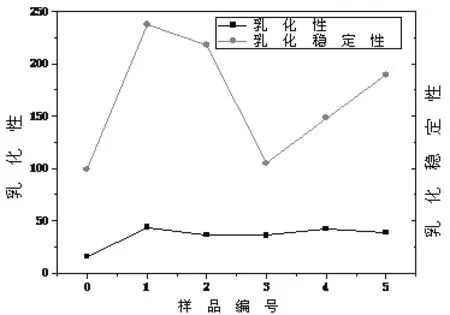
图3 氧化大豆分离蛋白质基表面活性剂的乳化性及乳化稳定性
2.6 氧化大豆分离蛋白质基表面活性剂的疏水性 蛋白质表面的疏水性能直接反映分子表面非极性基团的含量,是评价蛋白质分子构象变化的重要指标。同时疏水性的大小与蛋白质表面活性有着重要的关系。由图4可知,天然的大豆分离蛋白质的表面疏水性为1.49,1号样品的表面疏水性能为2.46,之后随着过氧乙酸浓度的增加,疏水性出现先增高后降低的趋势,这是由于二硫键被氧化后使得内部的疏水性基团暴露在分子表面,这也是大豆分离蛋白质性能提高的重要原因之一。随着二硫键打开的进一步提高,大豆分离蛋白质发生聚集,因此表面疏水性下降。
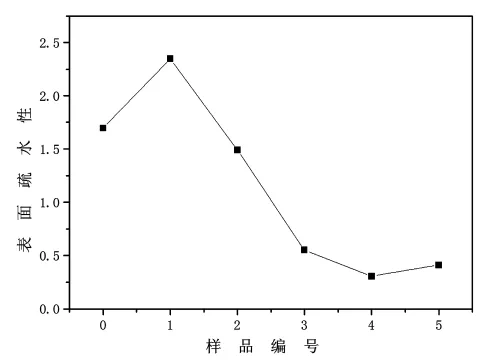
图4 氧化大豆分离蛋白质基表面活性剂的疏水性
2.7 荧光光谱图 通过分析290 nm处色氨酸的发色情况,通过分析色氨酸被激发后产生的图谱信息,可以了解过氧乙酸对大豆分离蛋白质的氧化情况。由图5可知,天然的大豆分离蛋白质在336 nm处荧光强度最强,而经过氧化后的大豆分离蛋白质最大吸收峰发生了红移,位于341 nm附近,说明蛋白质分子所处的极性环境发生了改变。当蛋白质分子发生去折叠时,极性分子所处的环境发生变化(Wei等,2009),导致最高吸收峰发生了变化。1号样品的峰高最强,发生位移的程度也最大,说明所具有的的疏水性程度最高,随着过氧乙酸量的增加,最大吸收峰逐渐变小,可能是由于蛋白质分子发生聚集,使得发色基团从蛋白质分子的外部迁移到蛋白质分子的内部,氧化程度的加深,破坏了蛋白质分子的结构。
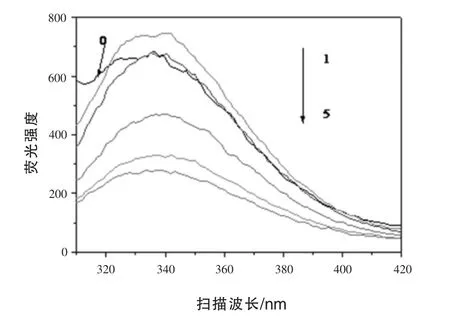
图5 荧光光谱图
2.8 圆二色谱图 蛋白质分子中二级结构基团(α-螺旋、β转角、β-折叠及无规卷曲)相对含量的改变可以反映出蛋白质分子三级结构的变化。采用远紫外圆二色谱测定各组样品三级构象的变化趋势。由图6可知,0号样品在185~195 nm出现正峰,在197~200 nm出现负峰,对比Manavalan等(1983)所作的特征CD光谱图发现,未经处理的大豆分离蛋白质属于β型蛋白质,结构中以β-折叠为主,疏水基团被包埋在蛋白质分子内部。经过氧化的大豆分离蛋白质,正峰出现蓝移,正峰出现在190 nm附近,负峰出现蓝移出现在195 nm附近,且正峰、负峰均出现增强的趋势,对比Manavalan等(1983)所作的特征 CD光谱图可知,经过处理之后蛋白质分子由β型蛋白质向α+β型蛋白质转化,α螺旋增加,另外在α+β型蛋白质中折叠链60%以上均成反平行排列,这也说明经过氧化处理大豆分离蛋白的三级结构逐渐伸展,整体分子结构松散,柔性增加。通过以上分析可以得出,氧化大豆分离蛋白质的整体结构更加疏松,内部疏水性基团暴露在分子表面,从而有效提高大豆分离蛋白质的表面活性性能。
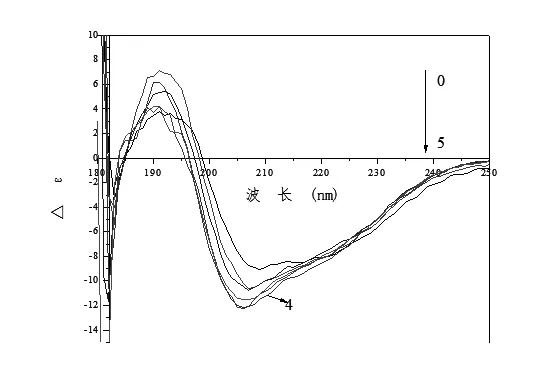
图6 圆二色谱图
3 结论
本试验结果表明,天然的大豆分离蛋白质并没有很好的表面活性剂性能,但是通过控制性的打开二硫键,内部的疏水基团被暴露在分子表面,提升了乳化性能以及起泡性能,有效降低了其表面张力,形成了一个良好的蛋白质基表面活性剂。
[1]巩建平.表面活性剂的 HLB 值[J].内蒙古石油化工,2003,29(2):43 ~ 43.
[2]卢滇楠,闫明,张敏莲,等.蛋白质-表面活性剂组装结构的分子模拟[J].化工学报,2006,8:1949 ~ 1956.
[3]吴丹,徐桂英.光谱法研究蛋白质与表面活性剂的相互作用[J].物理化学学报,2006,2:254 ~ 260.
[4]谢新华,李晓方,肖昕.表面活性剂处理降低稻米淀粉蛋白质含量[J].粮食与饲料工业,2008,8:28 ~ 29.
[5]张佳程.食品物理化学[M].北京:中国轻工业出版社,2007.
[6]Ellman G L.Tissue sulfhydryl groups[J].Archives of Biochemistry&Biophysics,1959,82(1):70 ~ 77.
[7]Hudson D A,Gannon S A,Thorpe C.Oxidative protein folding:From thiol–disulfide exchange reactions to the redox poise of the endoplasmic reticulum[J].Free Radical Biology&Medicine,2015,80:171 ~ 182.
[8]Hu H,Wu J,Li-Chan E C Y,et al.Effects of ultrasound on structural and physical properties of soy protein isolate (SPI)dispersions[J].Food Hydrocolloids,2013,30(2):647 ~ 655.
[9]Lin L H,Lai Y C,Chen K M,et al.Preparation and Surface Activities of Modified Soy Protein-Dextrin Surfactants[J].Journal of Surfactants and Detergents,2016,19(1):19 ~ 28.
[10]Lin Li‐Huei,Chen Keng-Ming.Preparation and surface activity of modified soy protein[J].Journal of Applied Polymer Science,2010,102(4):3498 ~ 3503.
[11]Kella N K D,Barbeau W E,Kinsella J E.Effect of disulfide bond cleavage on the structure and conformation of glycinin[J].International Journal of Peptide&Protein Research,1986,27(4):421 ~ 432.
[12]Kato A,Nakai S.Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins.[J].BiochimicaEt-BiophysicaActa,1980,624(1):13 ~ 20.
[13]Molina E,Papadopoulou A,Ledward D A.Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J].Food Hydrocolloids,2001,15(3):263 ~ 269.
[14]Manavalan P,Johnson W C.Sensitivity of circular dichroism to protein tertiary structure class[J].Nature,1983,305(5937):831 ~ 832.
[15]Wei W,Zhang C,Kong X,et al.Oxidative modification of soy protein by peroxyl radicals[J].Food Chemistry,2009,116(1):295 ~ 301.■
In this paper,a soybean-isolated protein-based surfactant was prepared by controlling the opening of disulfide bonds.The results showed that with the increase of the amount of peracetic acid,the opening rate of disulfide bond gradually increased.When the disulfide bond breaking rate was 46%,the γCMCwas 53.12 mN/m and the CMC value was 0.15 g/L,there were surface activity.The HLB value was 9,indicating that the sample of strong lipophilic;foaming and foaming stability,emulsifying and emulsifying stability have improved.Circular dichroism and fluorescence patterns showed that varying degrees of open disulfide bond,the structure of the protein changes from type β to α + β,the internal hydrophobic groups were exposed,resulting in hydrophobicity improved.
soybean protein isolate;disulfide bond;surface activity;structure
S816.9
A
1004-3314(2017)20-0023-05
10.15906/j.cnki.cn11-2975/s.20172006
国家自然科学基金项目(21466006);广西高等学校高水平创新团队及卓越学者计划[桂教人(2014)7号]
*通讯作者
