SLE患者血清EB病毒诱导基因2和胆固醇25α7羟化酶CYP7B1水平变化及临床意义
2017-03-13闫永龙邓新娜霍丽静曹京旌
闫永龙,邓新娜,霍丽静,曹京旌
(河北省人民医院,石家庄050051)
SLE患者血清EB病毒诱导基因2和胆固醇25α7羟化酶CYP7B1水平变化及临床意义
闫永龙,邓新娜,霍丽静,曹京旌
(河北省人民医院,石家庄050051)
目的 探讨EB病毒诱导基因2(EBI2)和胆固醇25α7羟化酶CYP7B1在系统性红斑狼疮(SLE)发生、发展中的作用。方法 选取SLE患者20例(观察组),体检健康者20例(对照组),采用ELISA法检测两组血清EBI2和胆固醇25α7羟化酶CYP7B1水平。根据SLE疾病活动指数(SLEDAI)评分,比较观察组SLEDAI<10分者和≥10分者血清EBI2和胆固醇25α7羟化酶CYP7B1水平。结果 观察组血清EBI2及胆固醇25α7羟化酶CYP7B1水平分别为(2.82±0.60)×10-1、(158.8±22.62)×10-1ng/mL,均高于对照组的(1.89±0.68)×10-1、(89.92±23.78)×10-1ng/mL(P均<0.01)。观察组SLEDAI≥10分13例,SLEDAI<10分7例;SLEDAI≥10分者血清EBI2及胆固醇25α7羟化酶CYP7B1水平分别为(3.26±0.35)×10-1、(183.78±17.41)×10-1ng/mL,均高于SLEDAI<10分者的(2.20±0.25)×10-1、(130.57±16.19)×10-1ng/mL(P均<0.01)。结论 SLE患者血清EBI2及胆固醇25α7羟化酶CYP7B1水平均升高,二者可能共同参与了SLE的发生、发展。
系统性红斑狼疮;EB病毒诱导基因2;7α,25-羟胆甾醇:胆固醇25α7羟化酶CYP7B1
系统性红斑狼疮(SLE)是一种以全身免疫异常而导致多系统、多器官受累为特征的自身免疫性疾病[1],其发病机制目前尚不清楚。EB病毒诱导基因2(EBI2)受体为7次跨膜偶联受体(7TM),主要在次级淋巴器官中表达。7α,25-羟胆甾醇(7α,25-OHC)是胆固醇代谢产物之一,被认为是胆汁酸补救合成途径中的中间物质。研究发现,EBI2受体及其配体7α,25-OHC与自身免疫性疾病相关[2],且二者是体液免疫反应的关键调控因子[3]。胆固醇25α7羟化酶CYP7B1是7α,25-OHC合成过程中的限速酶,其血液水平可客观反映血液7α,25-OHC水平。本研究探讨SLE患者血清EBI2和胆固醇25α7羟化酶CYP7B1水平变化及临床意义。现分析结果并报告如下。
1 资料与方法
1.1 临床资料 选取2015年1~3月河北省人民医院初治的SLE患者20例(观察组),男3例、女17例,年龄20~45(30.0±5.6)岁,均符合2009年美国风湿病学会SLE修订的分类诊断标准,均无其他结缔组织病、恶性肿瘤、病毒性肝炎、糖尿病等。同期选取体检健康者20例作为对照组,男5例、女15例,年龄18~42(28.0±5.0)岁。两组性别、年龄具有可比性。
1.2 相关指标观察 ①血清EBI2及胆固醇25α7羟化酶CYP7B1水平:抽取两组空腹静脉血,采用ELISA法检测血清EBI2和胆固醇25α7羟化酶CYP7B1水平。②SLE活动度:采用美国风湿病学会制定的SLE疾病活动指数(SLEDAI)评价SLE活动度。评价标准:0~4分为基本不活动,>4~≤9分为低度活动,>9~≤14分为中度活动,>14分为高度活动。③ SLE活动度与血清EBI2、胆固醇25α7羟化酶CYP7B1水平的关系:比较观察组SLEDAI<10分者与≥10分者血清EBI2和胆固醇25α7羟化酶CYP7B1水平。

2 结果
观察组血清EBI2及胆固醇25α7羟化酶CYP7B1水平均高于对照组(P均<0.01)。观察组SLEDAI≥10分者13例,<10分者7例;SLEDAI≥10分者血清EBI2及胆固醇25α7羟化酶CYP7B1水平均高于SLEDAI<10分者(P均<0.01)。见表1、2。
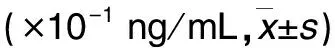
表1 两组血清EBI2和胆固醇25α7羟化酶CYP7B1水平比较
注:与对照组比较,*P<0.01。
3 讨论
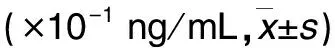
表2 观察组不同SLEDAI评分者血清EBI2和胆固醇25α7羟化酶CYP7B1水平比较
注:与SLEDAI<10分者比较,*P<0.01。
SLE是一种累及皮肤黏膜、骨骼、肌肉、肾脏、中枢神经系统、肺、心脏、血液等多个器官和系统的自身免疫性疾病。SLE患者体内可检测到多种自身抗体,并同时存在细胞免疫及体液免疫紊乱。交叉免疫反应参与多种自身免疫性疾病的发生,而核抗原与病毒之间存在序列相似性,病毒感染后可通过分子模拟机制诱导抗体产生,促使SLE发病。临床研究发现,SLE患者EB病毒感染率高于健康者,推测EB病毒感染可能与SLE发病有关[4~7],但其确切作用机制尚不清楚。
7TM是一个非常庞大的蛋白家族,在人体众多病理生理过程中发挥重要作用。EBI2属于7TM家族中的视紫红质样受体,主要表达于次级淋巴器官、外周血单核细胞和肺组织等。EBI2是EB病毒感染淋巴细胞后表达上调最高的基因之一。7α,25-OHC是胆固醇代谢产物之一,为EBI2的天然配体[8],其在CH25H和胆固醇25α7羟化酶CYP7B1的作用下逐步合成,在HSD3B7作用下发生氧化反应;其中,胆固醇25α7羟化酶CYP7B1是7α,25-OHC合成过程的限速酶。研究发现,胆固醇类物质不仅对胆固醇、脂肪酸等代谢产生影响,还具有免疫调节作用,与某些神经退行性疾病的发生、发展相关[9~12]。EBI2受体与其配体7α,25-OHC结合共同介导B细胞在淋巴滤泡内、外的运动,调节体液免疫。在外周淋巴结内,EBI2表达于成熟B细胞,B细胞被激活早期其表达上调,转移至生发中心后其表达下调。有研究证实,EBI2受体与其配体7α,25-OHC在调控CD4+DC稳定性及刺激T、B淋巴细胞活化等方面可发挥关键性作用[13]。此外,EBI2可直接促进活化的B细胞进入次级淋巴器官的滤泡外区域,促进T细胞依赖型抗体免疫反应的发生,其表达水平与免疫反应程度密切相关,提示其具有调节机体免疫平衡的作用[14]。Gatto等[15]报道,EBI2基因缺失的B细胞在抗体免疫反应中可出现迁移紊乱和严重免疫缺陷。目前认为,EBI2/7α,25-OHC轴的生物学功能主要为介导免疫及炎症反应、调控B细胞的迁移及归巢、负向调控固有免疫、参与恶性肿瘤的发生等。但目前对EBI2、7α,25-OHC与SLE关系的研究报道较少。
本研究结果显示,SLE组血清EBI2和胆固醇25α7羟化酶CYP7B1水平明显高于对照组。由于EBI2表达于成熟B细胞,而成熟B细胞多位于外周淋巴器官内,提示EBI2与胆固醇25α7羟化酶CYP7B1参与了SLE的发病过程。本研究观察组SLEDAI≥10分者血清EBI2及胆固醇25α7羟化酶CYP7B1水平均高于<10分者,提示血清EBI2与胆固醇25α7羟化酶CYP7B1水平与SLE的活动度有关。
综上所述,SLE患者血清EBI2及胆固醇25α7羟化酶CYP7B1水平均升高;EBI2受体与其配体7α,25-OHC可能参与了SLE的发生、发展。
[1] 蒋明, David Yu,林孝义,等.中华风湿病学[M].北京:华夏出版社,2004:865-942.
[2] Heinig M, Petretto E, Wallace C, et al. A trans-acting locus regulates an anti-viral expression network and type 1 diabetes risk[J]. Nature, 2010,467(7314):460-467.
[3] Cahir-McFarland ED, Carter K, Rosenwald A, et al. Role of NF-kappa B in cell survival and transcription of latent membrane protein 1-expressing or Epstein-Barr virus latency Ⅲ-infected cells[J]. J Virol, 2004,78(8):4108-4119.
[4] Gross AJ, Hochberg D, Rand WM, et al. EBV and systemic lupus erythematosus:a new perspective[J]. J Immunol, 2005,174(11):6599-6607.
[5] Wang H, Nicholas MW, Conway KL, et al. EBV latent membrane protein 2A Induces Autoreactive B cell activation and TLR hypersensitivity[J]. J Immunol, 2006,177(5):2793-2802.
[6] James JA, Neas BR, Moser KL, et al. Systemic lupus erythematosus in adults is associated with previous Epstein-Barr virus exposure[J]. Arthritis Rheum, 2001,44(5):1122-1126.
[7] Kang I, Quan T, Nolasco H, et al. Defective control of latent Epstein-Barr virus infection in systemic lupus erythematosus[J]. J Immunol, 2004,172(2):1287-1294.
[8] Hannedouche S, Zhang J, Yi T, et al. Oxysterols direct immune cell migration via EBI2[J]. Nature, 2011,475(7357) :524-527.
[9] Liu C, Yang XV, Wu J, et al. Oxysterols direct B-cell migration through EBI2[J]. Nature, 2011,475(7357):519-523.
[10] Schroepfer GJ Jr. Oxysterols: modulators of cholesterol metabolism and other processes[J]. Physiol Rev, 2000,80(1):361-554.
[11] Björkhem I, Diczfalusy U. Oxysterols: friends, foes, or just fellow passengers[J]. Arterioscler Thromb Vasc Biol, 2002,22(5):734-742.
[12] Zhao C, Dahlman-Wright K. Liver X receptor in cholesterol metabolism[J]. J Endocrinol, 2010,204(3):233-240.
[13] Gatto D, Wood K, Caminschi I, et al. The chemotactic receptor EBI2 regulates the homeostasis, localization and immunological function of splenic dendritic cells[J]. Nat Immunol, 2013,13(5):446-453.
[14] Reif K, Ekland EH, Ohl L, et al, Balanced responsiveness to chemoattractants from adjacent zones determines B-cell position[J]. Nature, 2002,416(6876):94-99.
[15] Gatto D, Wood K, Brink R, et al. EBI2 operates Independently of but in cooperation with CXCR5 and CCR7 to direct B cell migration and organization in follicles and the germinal center[J]. J Immunol, 2011,187(9):4621-4628.
10.3969/j.issn.1002-266X.2017.08.031
R593.24
B
1002-266X(2017)08-0094-02
2016-04-18)
