同时测定鲜切荸荠黄化组织中柚皮素和圣草酚的高效液相色谱条件探究
2016-09-13何凤平潘永贵李艺筱
何凤平,潘永贵,李艺筱
(海南大学食品学院,海南海口 570228)
同时测定鲜切荸荠黄化组织中柚皮素和圣草酚的高效液相色谱条件探究
何凤平,潘永贵*,李艺筱
(海南大学食品学院,海南海口 570228)
采用Agilent Eclipse XDB-C18色谱柱,通过考察流动相、柱温、流速等色谱条件建立了能同时测定鲜切荸荠黄化组织中柚皮素和圣草酚的高效液相色谱法。色谱条件为柱温:40 ℃;流动相:0.5%冰醋酸溶液(A)-乙腈(B),梯度洗脱(0~10 min,10%→20% B;10~15 min,20%→30% B;15~25 min,30%→40% B;25~35 min,40%→50% B);流速:1 mL·min-1;进样量:10 μL;检测波长:280 nm。此色谱条件下,柚皮素和圣草酚均能得到有效分离,分别在5.60~28.00 μg·mL-1(r=1.0000)、3.20~16.00 μg·mL-1(r=0.9999)范围内峰面积与浓度的线性关系良好,加标回收率分别在99.49%~100.71%、98.68%~101.65%(n=6)。本研究所得的高效液相色谱条件简便快捷、准确可靠,重现性好,能排除其中所含其他物质色谱和其他物质产生的干扰,因此可用于同时测定鲜切荸荠黄化组织中的柚皮素及圣草酚。
鲜切荸荠,柚皮素,圣草酚,色谱条件,高效液相色谱法
荸荠(Eleocharistuberose),别称马蹄、凫茈、地栗、乌芋等,为多年生草本植物莎草科荸荠属形成的地下球茎。荸荠不仅质脆多汁、营养丰富,而且还可入药,对多种疾病具有辅助治疗的作用。荸荠经去皮、切分处理之后即可食用,具有方便、快捷等优点,但是经过鲜切处理之后,切割表面短期内会变黄,严重影响了产品外观品质及其他价值。研究发现,引起鲜切荸荠黄化的主要原因是组织中某些物质经过苯丙烷代谢途径生成黄酮类物质所致,随着黄色的加深,鲜切荸荠中总黄酮的含量相应增加[1]。进一步通过对黄化物质进行分离纯化和结构鉴定,表明鲜切荸荠切割表面的黄化可能主要与圣草酚和柚皮素两种黄酮类物质有关[2]。因此,建立一种能够同时测定鲜切荸荠黄化组织中圣草酚和柚皮素含量的方法,是进一步研究鲜切荸荠黄化机制的基础。
近年来,国内外有关于柚皮素、圣草酚检测及其含量测定的文献报道,主要是高效液相色谱法(HPLC),或是与其他方法联用[3-6],但是HPLC法主要集中于中草药中单一柚皮素或圣草酚的检测及其含量测定,这些条件并不一定适用于鲜切荸荠黄化组织中的柚皮素和圣草酚检测及其含量测定[7-12]。另外,目前也尚未见到HPLC法测定鲜切荸荠黄化组织中柚皮素或圣草酚的报道,更未曾有同时测定鲜切荸荠黄化组织中柚皮素及圣草酚的报道。
因此,本研究将通过考察色谱条件(包括流动相、柱温、流速等),使鲜切荸荠黄化组织中柚皮素及圣草酚达到较好的分离,探寻能够同时测定鲜切荸荠黄化组织中柚皮素和圣草酚及其含量的高效液相色谱条件。
1 材料与方法
1.1材料与仪器
柚皮素标准品(Naringenin,西力生物公司),CAS号:480-41-1,纯度98.0%;圣草酚标准品(Eriodictyol,西力生物公司),CAS号:552-58-9,纯度98.0%。
甲醇、乙腈购自美国TEDIA公司,色谱纯;水为超纯水;冰醋酸、甲酸、磷酸、无水乙醇购自广州化学试剂厂,分析纯。
Agilent 1260高效液相色谱仪包括G1367E自动进样器、G1312B二元泵、G1316E柱温箱、G1314C可变波长紫外检测器、Agilent 1260LC化学工作站美国Agilent公司;TU-1810紫外可见分光光度计北京普析通用仪器有限责任公司;旋转蒸发器上海申生科技有限公司;SB-5200D超声波清洗机宁波新芝生物科技股份有限公司;AR124CN电子天平奥豪斯仪器有限公司。
1.2实验方法
1.2.1标准品溶液的制备分别精确称取标准品柚皮素0.70 mg、圣草酚0.40 mg置于5 mL棕色容量瓶中,甲醇溶解并稀释至刻度,摇匀,制成标准品储备液。精确量取标准品储备液各1 mL置于5 mL棕色容量瓶中,甲醇溶解并稀释至刻度,摇匀,即得浓度为柚皮素28 μg·mL-1、圣草酚16 μg·mL-1的混合标准品溶液,4 ℃避光保存,备用。
1.2.2样品制备样品制备参照Pan等[2]的方法。取新鲜荸荠去皮、切分,置于16 ℃温度条件下贮藏,待其表面黄化,用不锈钢刀具削下表面黄化部分,并精确称取其30.00 g,置于三角瓶中,按料液比为1∶5加入无水乙醇150 mL,40 ℃下超声波提取30 min,4000 r/min离心分离15 min,取上清液;残渣同法提取一次。合并上清液,旋转蒸发浓缩至干。将浓缩部分用4 mL甲醇溶解,0.22 μm微孔滤膜过滤,滤液即为待测样品溶液。
1.2.3色谱条件的选择色谱柱为Aglient Eclipse XDB-C18(150 mm×4.6 mm,5 μm),进样量为10 μL。最佳检测波长采用紫外可见分光光度计对“1.2.1”项中制备的柚皮素和圣草酚标准品溶液分别在190~400 nm范围内扫描进行确定;流动相中,比较梯度洗脱1(0~30 min,5%→100%有机相,30~45 min,100%有机相)和梯度洗脱2(0~10 min,10%→20%有机相;10~15 min,20%→30%有机相;15~25 min,30%→40%有机相;25~35 min,40%→50%有机相)以及乙腈-0.5%冰醋酸、甲醇-0.5%冰醋酸、甲醇-1%冰醋酸、甲醇-1%甲酸、甲醇-1%磷酸、甲醇-水六种流动相体系对柚皮素和圣草酚混标分离效果的影响,确定最终流动相;通过对流速(0.5~1.5 mL·min-1)和柱温(20~40 ℃)对柚皮素和圣草酚混标分离效果及峰形的影响,确定适宜的流速和柱温。
1.2.4数据统计分析各个指标测定均重复至少3次。运用Excel2007计算平均值、标准误(SD)和相关系数(r)。运用SPSS软件进行数据分析,采用单因素方差分析(one-way ANOVA)方法进行差异显著性分析(p<0.05有显著差异,p<0.01有极显著差异)。
2 结果与讨论
2.1色谱条件的选择
2.1.1检测波长的选择按照“1.2.3”项中方法进行全波段扫描,结果见图1。由图1所示,柚皮素和圣草酚均在239 nm、280 nm附近有较大吸收,但是由于280 nm波长附近吸收曲线较平稳,故选择检测波长280 nm。
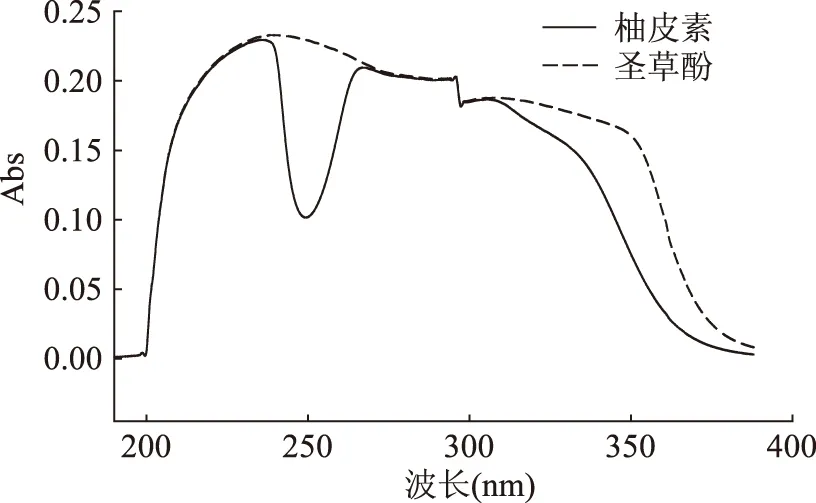
图1 柚皮素和圣草酚标准品紫外光谱图Fig.1 UV spectra of naringenin and eriodictyol
2.1.2流动相的选择为了提高黄化鲜切荸荠中柚皮素和圣草酚的分离效果及结果的准确度,分别研究了流动相比例和流动相组成对分离的影响。首先,比较了“1.2.3”项中梯度洗脱1和梯度洗脱2对柚皮素和圣草酚混标的分离效果的影响,研究结果表明柚皮素和圣草酚在梯度洗脱2条件下均能达到有效的分离,故最终选择梯度洗脱2。此外,乙腈-0.5%冰醋酸、甲醇-0.5%冰醋酸、甲醇-1%冰醋酸、甲醇-1%甲酸、甲醇-1%磷酸、甲醇-水六种流动相体系在梯度洗脱2下对柚皮素和圣草酚标准品分离效果及色谱峰形的影响见图2。由图2可以看出,当有机相组成为甲醇时,柚皮素和圣草酚出峰时间较晚,且峰形不佳,然而有机相乙腈代替之后,柚皮素和圣草酚不仅出峰时间大大提前,而且峰形变得更尖锐,基线变得平稳。从出峰时间、峰形及基线情况考虑,最终选择乙腈-0.5%冰醋酸体系为流动相。
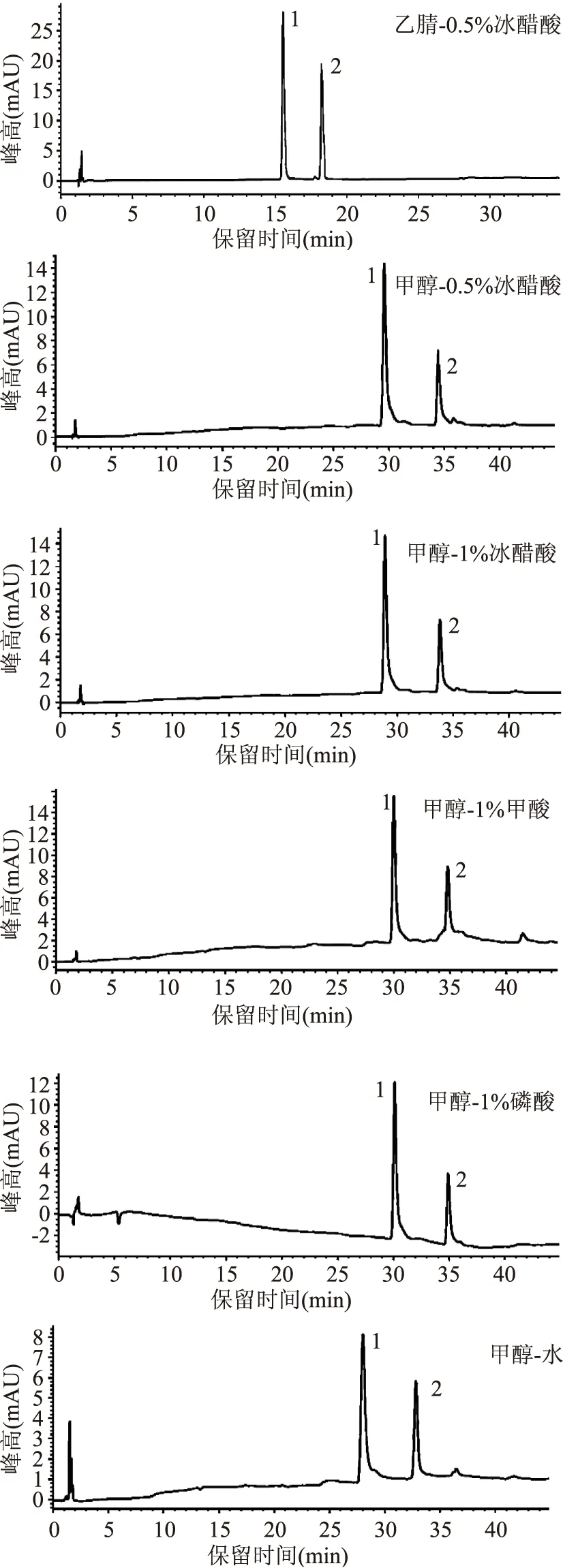
图2 不同流动相的圣草酚(1)和柚皮素(2)标准品HPLC色谱图Fig.2 HPLC chromatograms of naringenin and eriodictyolstandard substance analyzed by varied mobile phases
2.1.3流速的选择流速改变不仅可能影响柚皮素和圣草酚的出峰时间及色谱峰形,也可能影响色谱图中基线的稳定程度[13],因此研究了不同流速对柚皮素和圣草酚分离效果的影响。由图3知,随着流速的增加,柚皮素和圣草酚的出峰时间极显著缩短(p<0.01),而且拖尾现象减轻;另外峰宽极显著变小(p<0.01),从而使得峰形变得更加尖锐。但是当流速达到1.2 mL·min-1时,也许是流速太大致使泵压力不稳,使得基线不稳。因此最终选择最佳流速为1.0 mL·min-1。
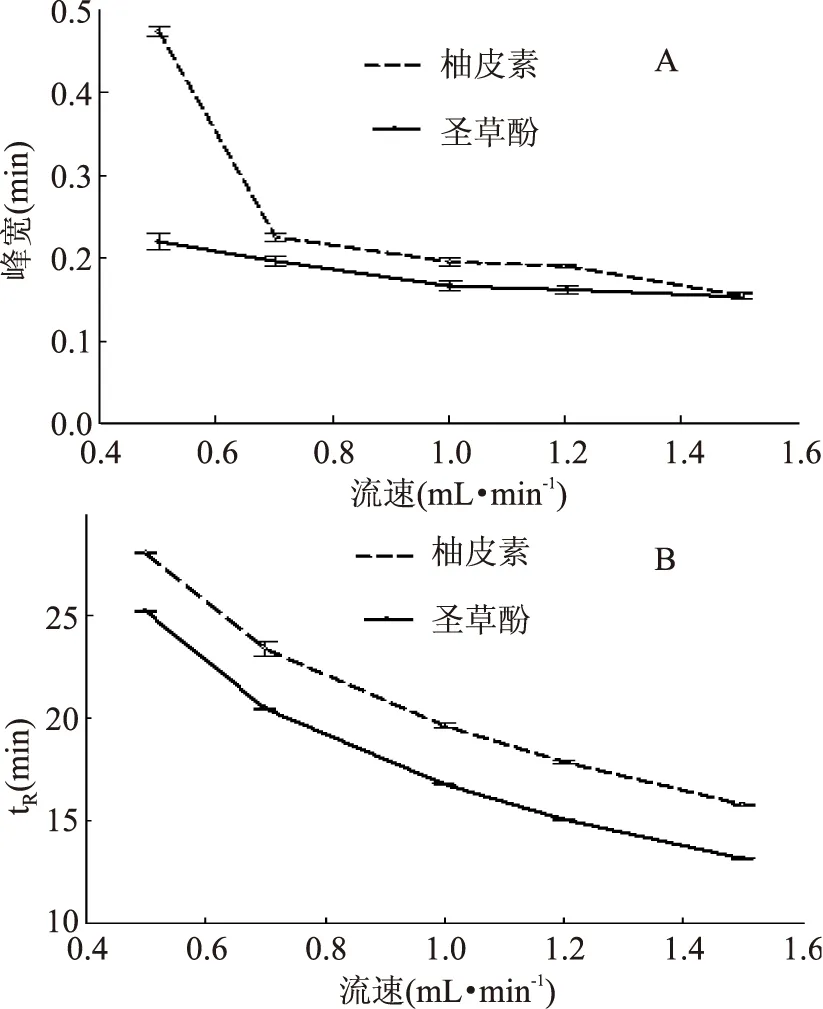
图3 不同流速对柚皮素及圣草酚峰形(A)和保留时间(B)的影响Fig.3 Effect of varied flow rate on peak sharp(A) and retention time(B)of naringenin and eriodictyol standard substance
2.1.4柱温的选择色谱柱温的改变会引起溶剂的密度、粘度等物理性质改变,谱图中峰的分离效果、峰形及出峰时间均会因此而受到影响[13],由此进一步研究了不同柱温对柚皮素和圣草酚分离效果的影响。由图4可以看出,随着柱温升高,柚皮素和圣草酚的出峰时间均前移,与柱温20 ℃相比,柱温40 ℃时柚皮素和圣草酚的出峰时间均极显著缩短(p<0.01),且缩短时间大约为6 min,从而节省了分析时间;峰宽同样也极显著减小(p<0.01),峰形变得更佳。而且适当升高柱温也利于降低柱压、保护色谱柱,可延长其使用寿命,这与马建刚等[14]报道结果一致。故最终选择40 ℃为理想柱温。
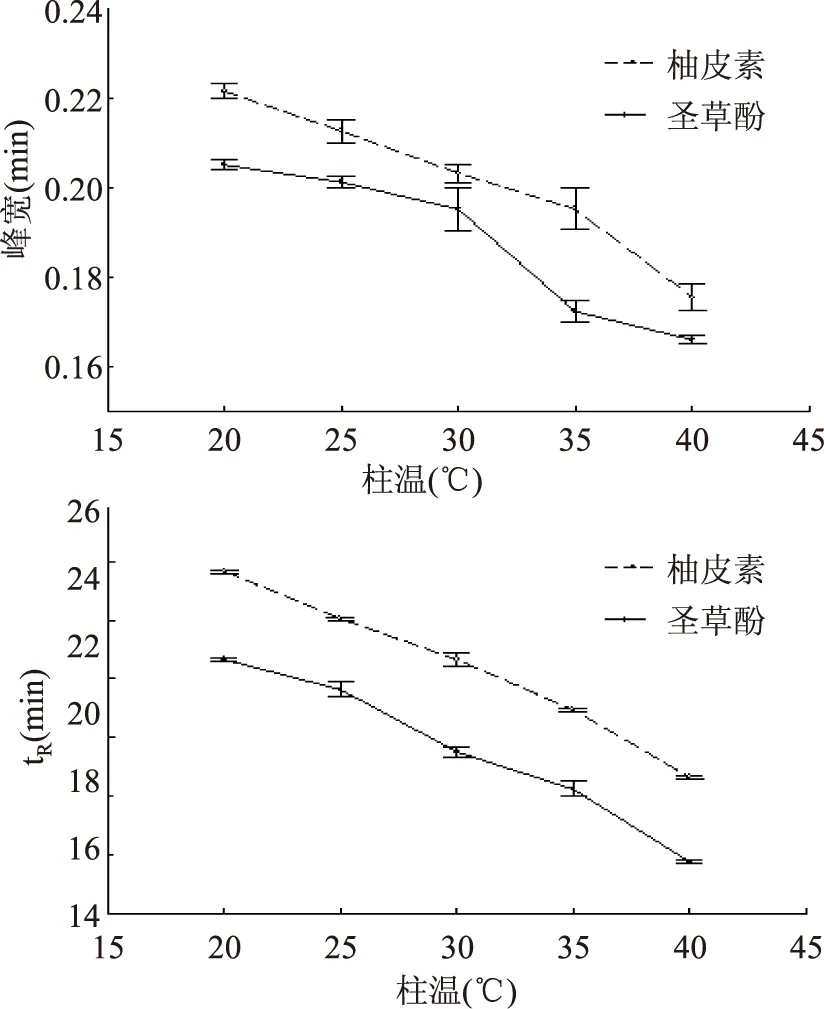
图4 不同柱温对柚皮素及圣草酚峰形(A)和保留时间(B)的影响Fig.4 Effect of varied column temperature on peak sharp(A) and retention time(B)of naringenin and eriodictyol standard substance
2.1.5色谱条件的确定根据以上实验结果,确定同时测定鲜切荸荠黄化表面中柚皮素和圣草酚的HPLC色谱条件如下:
色谱柱:Agilent Eclipse XDB-C18(150 mm×4.6 mm,5 μm);柱温:40 ℃;流动相:0.5%冰醋酸溶液(A)-乙腈(B),流动相使用前需经0.22 μm微孔滤膜抽滤并超声脱气;流速:1 mL·min-1;进样量:10 μL;检测波长:280 nm;梯度洗脱条件见表1。
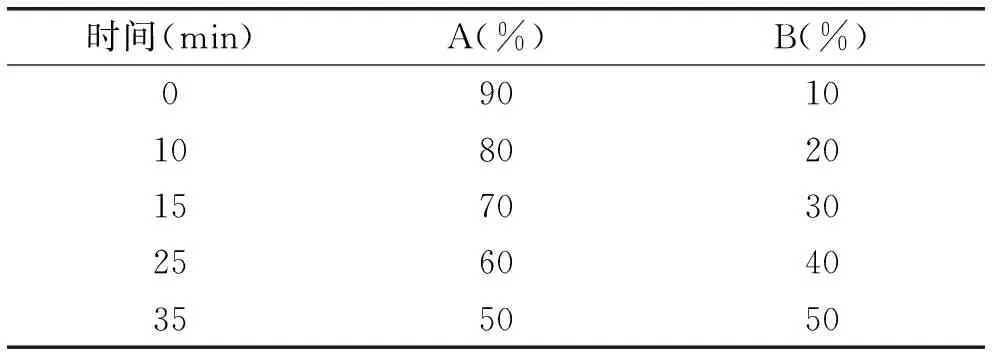
表1 梯度洗脱条件
2.2液相检测方法验证
液相检测方法的验证参照药典方法[15]并作一些修改。
2.2.1标准曲线及线性关系实验取柚皮素和圣草酚标准品混合溶液,配制成柚皮素5.60~28.00 μg·mL-1、圣草酚3.20~16.00 μg·mL-1一系列浓度的标准品混合溶液,按照“2.1.5”项中确定的色谱条件测定色谱峰峰面积,分别以柚皮素和圣草酚浓度X(μg ·mL-1)为横坐标,色谱峰面积Y为纵坐标进行线性回归得到回归方程,以3倍信噪比(3 S/N)计算检出限,10倍信噪比(10 S/N)计算测定下限[16],结果见表2。柚皮素和圣草酚具有良好的线性关系,相关系数r≥0.9999,可满足检测要求。

表2 柚皮素和圣草酚的回归方程、相关系数、线性范围、检出限和测定下限(n=5)
2.2.2精密度实验取柚皮素和圣草酚标准品混合溶液,按照“2.1.5”项中确定的色谱条件测定,连续进样6次,分别记录柚皮素和圣草酚保留时间及色谱峰面积。求得柚皮素和圣草酚保留时间RSD分别为0.03%和0.02%,色谱峰面积RSD分别为0.90%和0.86%(n=6)。柚皮素和圣草酚保留时间和峰面积的相对偏差RSD均小于1%,表明该仪器精密度良好。
2.2.3稳定性实验取待测样品溶液,分别在制备后0~8 h内进样,然后每隔2 h在“2.1.5”项中确定的色谱条件下进样分析,记录柚皮素和圣草酚的色谱峰面积,求得柚皮素和圣草酚色谱峰面积的平均值分别为121.49和228.71,相对偏差RSD分别为0.65%和0.78%(n=5)。柚皮素和圣草酚峰面积相对偏差RSD均小于1%,说明待测样品在8 h内稳定性较好。
2.2.4重现性实验取同一批鲜切荸荠黄化样品,平行6份,按照“1.2.2”项方法制备待测样品溶液,然后在“2.1.5”项中确定的色谱条件下测得柚皮素平均含量为8.33 μg·g-1,RSD为0.65%(n=6);圣草酚平均含量为3.47 μg·g-1,RSD为0.62%(n=6)。结果表明该方法的重现性较好。
2.2.5加标回收率实验精确称取已知柚皮素和圣草酚含量的同一批鲜切荸荠黄化样品6份,每份精确称取30.00 g,适量加入柚皮素和圣草酚标准品储备液,按照上述“1.2.2”项方法制备待测样品溶液,在“2.1.5”项中确定的色谱条件下进样分析,计算出柚皮素含量加标回收率和圣草酚含量回收率结果见表3。本方法测得柚皮素含量加标回收率在99.46%~100.71%,RSD=0.44%(n=6);圣草酚含量回收率为98.68%~101.54%,RSD=1.09%,表明本方法简便快捷、准确可靠。
2.3样品分析
取同一批的鲜切荸荠黄化表面样品各3份,按1.2.2方法制备,然后在确定的色谱条件进样分析,用外标法计算样品中柚皮素和圣草酚含量,结果见表4,色谱图见图5。由表4和图5可以看出,尽管鲜切荸荠黄化表面中含有很多不同的其他组分,但是其中确实存在柚皮素和圣草酚,而且含量较高。
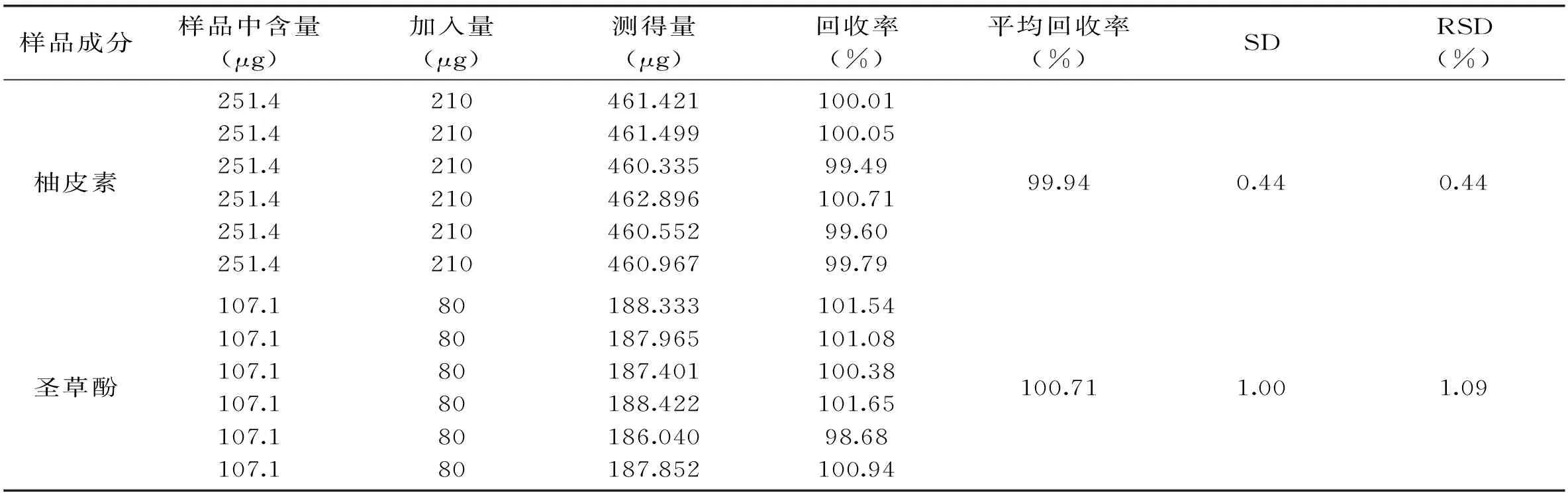
表3 鲜切荸荠黄化组织中柚皮素和圣草酚回收率(n=6)
研究中,曾对提取样品的试剂进行了研究,荸荠中多糖含量丰富,若提取剂醇浓度太低,提取液会比较粘稠,不易进样分析,故选择高浓度的无水乙醇;还比较了无水乙醇和甲醇试剂的提取效果,发现无水乙醇提取的效果优于甲醇。另外,稀释10倍、100倍和未稀释的待测样品进样分析之后,发现稀释10倍的待测样品杂峰较少,且峰形良好。
表4 鲜切荸荠黄化组织中柚皮素和圣草酚含量±SD)
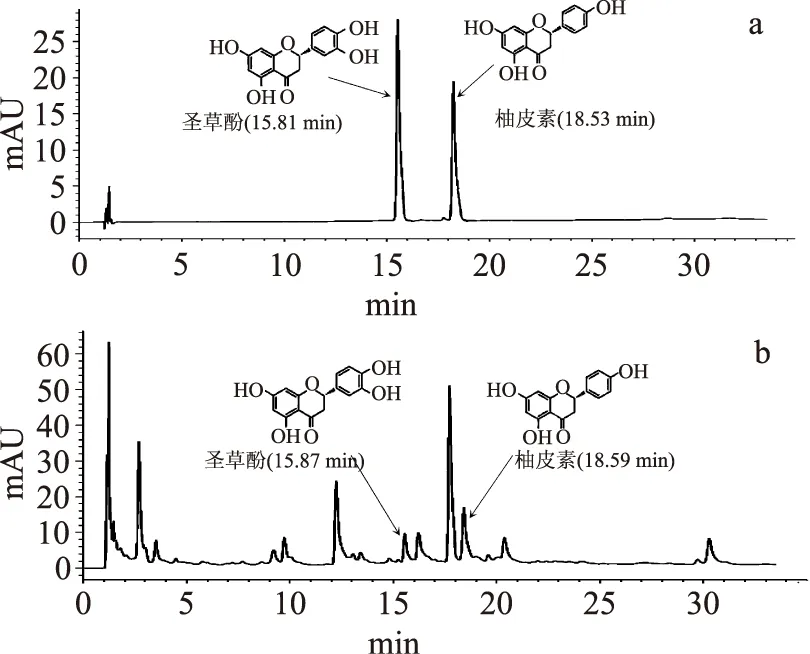
图5 标准品(a)和鲜切荸荠黄化样品(b)的HPLC色谱图Fig.5 HPLC chromatograms of standard substance(a) and fresh-cut Chinese water-chestnut etiolation sample(b)
3 结论
本研究采用高效液相色谱法对鲜切荸荠黄化组织中的柚皮素和圣草酚进行分离测定,研究表明在色谱条件为:柱温40 ℃,流动相0.5%冰醋酸溶液(A)-乙腈(B)梯度洗脱,流速1 mL·min-1,进样量10 μL,检测波长280 nm时柚皮素和圣草酚的分离效果良好。所得的色谱条件简便快捷,结果准确可靠,能排除鲜切荸荠黄化组织中所含其他物质色谱和其他物质产生的干扰,为鲜切荸荠黄化组织中柚皮素和圣草酚测定提供了一定的理论依据。
[1]潘永贵,陈维信. 鲜切荸荠中黄化物质研究[J]. 食品研究与开发,2008(2):33-36.
[2]Pan Y G,L Y X,Yuan M Q. Isolation,purification and identification of etiolation substrate from fresh-cut Chinese water-chestnut(Eleocharis tuberose)[J]. Food Chemistry,2015,186:119-122.
[3]Kawakami C M,Gaspar L R. Mangiferin and naringenin affect the photostability and phototoxicity of sunscreens containing avobenzone[J]. Journal of Photochemistry and Photobiology B:Biology,2015,151:239-247.
[4]Cordenonsia L M,Brombergerb N G,Raffin R P,et al. Simultaneous separation and sensitive detection of naringin and naringenin in nanoparticles by chromatographic method indicating stability and photodegradation kinetics[J]. Biomedical Chromatography,2015,DOI 10.1002/bmc.3531
[5]Ni H,Zhang S F,Gao Q F,et al. Development and evaluation of simultaneous quantification of naringin,prunin,naringenin,and limonin in citrus juice[J]. Food Science and Biotechnology,2015,24(4):1239-1247.
[6]Fischer U A,Carle R,Kammerer D R. Identification and quantification of phenolic compounds from pomegranate(Punica granatum L.)peel,mesocarp,aril and differently produced juices by HPLC-DAD-ESI/MSn[J]. Food Chemistry,2011,127(2):807-821.
[7]李江. 反相高效液相色谱法测定化橘红中柚皮苷和柚皮素含量[J]. 实用临床医药杂志,2009,13(10):74-77.
[8]路玫,潘洪平,荆树汉. 复方战骨搽剂中柚皮素的含量测定[J]. 中国药师,2004,7(3):181-182.
[9]姚利,林玉萍,龚云麒,等. 花生壳中5,7-二羟基色原酮及圣草酚的HPLC测定[J]. 食品科技,2006(3):116-118.
[10]周桂芬,陈素红,吕圭源,等. 高效液相色谱法测定铁皮石斛中柚皮素的含量[J]. 中国中药杂志,2013,38(4):520-523.
[11]Rodríguez-Solana R,Salgado J M,Domíngueza J M,et al.
Comparison of soxhlet,accelerated solvent and supercritical fluid extraction techniques for volatile(GC-MS and GC/FID)and phenolic compounds(HPLC-ESI/MS/MS)from Lamiaceae species[J]. Phytochemical Analysis,2015,26:61-71.
[12]Boros B,Jakabová S,Dörnyei,et al. Determination of polyphenolic compounds by liquid chromatography-mass spectrometry in Thymus species[J]. Journal of Chromatography A,2010,1217(51):7972-7980.
[13]孙方卉. 不同产地枳壳药材的HPLC鉴别[J]. 药品医学,2015,3(1):22-26.
[14]马建刚,刘娇,曾祥峰,等. 大肠杆菌9种有机酸代谢产物的高效液相检测条件优化[J]. 现代食品科技,2011(5):591-594.
[15]国家药典委员会. 中华人民共和国药典[M]. 二部. 北京:中国医药科技出版社. 2010:附录V D 29-30.
[16]Vial J,Jardy A. Experimental comparison of the different approaches to estimate LOD and LOQ of an HPLC method[J]. Analytical Chemistry,1999,71(14):2672-2677.
Exploration of simultaneous determination for naringenin and eriodictyol in etiolation tissues of fresh-cut Chinese water-chestnut
HE Feng-ping,PAN Yong-gui*,LI Yi-xiao
(College of Food Science and Technology,Hainan University,Haikou 570228,China)
To explore the simultaneous determination of naringenin and eriodictyol in etiolation extract of fresh-cut Chinese water-chestnut,HPLC was established by optimizing the chromatographic conditions including mobile phase,column temperature,flow rate,etc. in using Agilent Eclipse XDB-C18column. The optimal simultaneous determination conditions were the mobile phase composed of 0.5%(v/v)acetic acid in water(eluent A)and acetonitrile(eluent B)in a linear gradient program of 0~10 min,10%~20% B,10~15 min of 20%~30% B,15~25 min of 30%~40% B and 25~35 min of 40%~50%B at a continual flow rate of 1.0 mL·min-1at a column temperature of 40 ℃,the injection volume was 10 μL,and the UV detection was performed at 280 nm,which could make naringenin and eriodictyol separate successfully. Naringenin and eriodictyol revealed high correlation between 5.60~28.00 μg·mL-1(r=1.0000)and between 3.20~16.00 μg·mL-1(r=0.9999)and exhibited recovery range of 99.49%~100.71% and 98.68%~101.65%(n=6),respectively. The chromatographic conditions were simple,accurate and reliable,with good reproducibility,which can eliminate the chromatography of other substances contained and interference of other substances produced,so it can be used as a method that simultaneously determine naringein and eriodictyol in etiolation tissues of fresh-cut Chinese water-chestnut.
fresh-cut Chinese water-chestnut;naringenin;eriodictyol;chromatographic condition;high performance liquid chromatography(HPLC)
2015-12-08
何凤平(1991-),女,硕士,研究方向:果蔬采后生理及保鲜,E-mail:hfping123@126.com。
潘永贵(1970-),男,博士,教授,研究方向:果蔬采后生理和贮运保鲜技术,E-mail:yongui123@126.com。
国家自然科学基金项目(31360414)。
TS207.3
A
1002-0306(2016)13-0271-06
10.13386/j.issn1002-0306.2016.13.047
