棕榈发酵细菌(Zymobacter palmae)利用海带不同组分发酵产乙醇研究
2013-04-23温顺华黄庶冰黄庶识
李 锋,温顺华,黄庶冰,刘 晖 *,黄庶识
(1.广西科学院 生物物理实验室,广西 南宁 530007;2.黔南民族师范学院化学与化工系,贵州 都匀 558000;3.广西大学 商学院,广西 南宁 530004)
化石能源的过度消耗导致一系列的环境问题(如温室效应、酸雨、大气污染等)出现。为解决环境问题,世界各个主要经济体争相发展生物质能、太阳能、核能、风能、水电能等各种可再生能源。在生物能源中,作为替代性可再生能源之一的乙醇,因为具有燃烧完全、效率高、无污染等特点,近30年来获得了大力发展;目前已成为除生物柴油外,唯一可作为汽油添加剂进入市场,可替代石油燃料的大宗生物质能源。然而,不管以玉米等农作物亦或木薯、甘蔗等非粮作物为碳源发酵制取乙醇,都会占用大量耕地和消耗有限的淡水资源;而且陆生作物种植过程中,大量化学肥料和农药的使用,会导致土壤冲蚀和环境污染,引发更为激烈的粮食、耕地和水资源竞争。未来,随着人口的增加与可利用的土地不断减少,粮食和土地供给将是燃料乙醇发展的瓶颈。
海洋面积占地球表面积70%,蕴藏着丰富的海藻资源,其种类繁多,每年通过光合作用产生的生物质总量达550亿t。其中褐藻(如海带、马尾藻等)生长快速,光合作用效率高,碳水化合物含量高,不含木质素,不与粮食争土地、肥料、淡水资源[1-2]。我国在海带人工养殖与培育方面的技术比较成熟,年产量占世界产量的70%以上[3]。海带中碳水化合物占藻体干重的50%以上,主要含有褐藻胶、褐藻糖胶、褐藻淀粉、甘露醇等组分。褐藻胶是由α-L-古罗糖醛酸以及其C5差向异构体β-D-甘露糖醛酸通过随机组合成的多聚体[4]。褐藻糖胶是类硫酸化杂多糖,主要由岩藻糖和硫酸基组成,并且会含有少量的半乳糖、木糖、鼠李糖、甘露糖、葡萄糖、阿拉伯糖、葡萄糖醛酸[5]。褐藻淀粉为线体聚合体,由β-(1→3)交联葡萄糖残基组成,含少量β-(1→6)交联物作为中间或分支点残基,含少量D-甘露醇作为末端基团[6]。海藻中多糖类物质经过物理、化学、生物等方法处理后可以得到单糖或低聚糖,并以水解液为碳源可以发酵生产燃料乙醇、生物丁醇等[7-11]。
海带中的糖类物质复杂多样,其中主要多糖和甘露醇不能被大多数乙醇发酵菌利用产乙醇。HORN S等[12]研究发现,Z.palmae能够利用甘露醇转化为乙醇的最大产量达0.38g/g 底物;以海带提取液为碳源发酵生产乙醇,最大产量为0.61g乙醇/g甘露醇,远远超过理论产量0.51g 乙醇/g甘露醇;研究表明,Z.palmae除了能够利用甘露醇外,还能够利用海带中的其他糖类,但Z.palmae具体能直接利用海带中何种多糖组分以及多糖水解后具体利用何种单糖产生酒精,相应的乙醇转化率为多少,尚未见报道。本实验研究Z.palmae利用海带中多糖及相应单糖为碳源发酵产酒精的能力,为后续海带发酵乙醇提供依据。
1 材料与方法
1.1 材料与试剂
菌种:棕榈发酵细菌Z.palmae(ATCC51623)复苏活化后,用斜面培养基保存于4℃冰箱备用,部分置于-80℃冰箱用20%甘油中保藏菌种。
试剂:甘露醇、褐藻酸、半乳糖、甘露糖、阿拉伯糖、木糖、葡萄糖、L-鼠李糖、肌醇、麦芽浸粉、酵母浸粉、蛋白胨、琼脂、乙腈、高碘酸钠、浓盐酸、醋酸铵、冰醋酸、乙酰丙酮、3,5-二硝基水杨酸、苯酚、亚硫酸钠、氢氧化钠、酒石酸钾钠、MgSO4·7H2O、KH2PO4、(NH4)2SO4、NaCl、K2HPO4,以上所有试剂均为国产分析纯。L-聚古罗糖醛酸(分子质量分别为1ku、6ku、8ku)、D-聚甘露糖醛酸(分子质量分别为1ku、6ku、8ku)购于中国海洋大学医药学院;褐藻糖胶、岩藻糖、昆布淀粉购于陕西慈缘生物技术有限公司。
活化培养基:酵母提取物10.0g/L,麦芽糖20.0g/L,NaCl 5.0g/L,KH2PO42.0g/L。
斜面培养基:酵母提取物10.0g/L,麦芽糖20.0g/L,NaCl 5.0g/L,KH2PO42.0g/L,琼脂20g/L。
增殖培养基:共配制17种培养基,除碳源不同以外,其他组分都相同;都含有3g/L酵母提取物,3g/L麦芽浸粉,5g/L蛋白胨,pH6.0;其中每种增值培养基的碳源部分为每种培养基添加甘露醇10g/L,另外分别添加褐藻酸、L-聚古罗糖醛酸(分子质量分别为1ku、6ku、8ku)、D-聚甘露糖醛酸(分子质量分别为1ku、6ku、8ku)、阿拉伯糖、褐藻糖胶、岩藻糖、半乳糖、甘露糖、木糖、昆布淀粉、葡萄糖、L-鼠李糖、肌醇各10g/L。
发酵培养基:共配制18种发酵培养基,除了碳源部分不同外,其他组分相同,都含有3.0g/L酵母提取物,MgSO4·7H2O 0.2g/L,2.0g/L KH2PO4,2.5g/L(NH4)2SO4,pH6.0。每种发酵培养基中碳源部分分别为以下糖类:甘露醇、褐藻酸、L-聚古罗糖醛酸(分子质量分别为1ku、6ku、8ku)、D-聚甘露糖醛酸(分子质量分别为1ku、6ku、8ku)、褐藻糖胶、岩藻糖、半乳糖、甘露糖、木糖、昆布淀粉、葡萄糖、L-鼠李糖、阿拉伯糖、肌醇各20.0g/L,pH6.0,以上培养基均115℃灭菌20min。
1.2 仪器与设备
6890N气相色谱仪、52#ZB-WAXPLUSTM色谱柱:美国安捷伦公司;SW-CJ-1FD医用洁净工作台:苏州安泰空气技术有限公司;UV-9100紫外可见分光光度计:北京瑞利分析仪器有限公司;SYQ-DSX-280B不锈钢压力蒸汽灭菌器:上海申安医疗器械厂;CF-10小型高速离心机:德国SIGMA公司;TS-200B恒温摇床天呈:上海天呈实验仪器制造有限公司。
1.3 实验方法
1.3.1 发酵培养条件及方法
将Z.palmae接入装有20mL活化培养基的50mL三角瓶中,活化24h后,将菌液以接种量为2%,置于100mL增殖培养基中,对棕榈发酵细菌进行增殖培养48h后,再以接种量为2%增殖培养液接入装有150mL 发酵培养基中(250mL三角瓶中),恒温摇床参数设置为温度30℃,转速150r/min,培养72h。无菌条件下每隔12h取样一次,将样品12000r/min离心10min,取上清液保存于-20℃冰箱中以备后期分析发酵液中的乙醇浓度及糖的消耗情况。
1.3.2 分析方法
乙醇含量测定:乙醇含量测定按李自达等[13]的方法。将待测样品溶液与10%(v/v)乙腈溶液等量充分混合后进行气相色谱检测。检测条件:氢火焰离子化检测器(flame ionization detector,FID),温度325℃,进样器温度250℃;柱温100℃,高纯氮28.7mL/min,氢气40mL/min,空气450mL/min,尾吹气30.0mL/min,进样量0.2μL。每个样品重复检测3次。
乙醇含量计算公式:

注:0.9724 为校正系数,10%为乙腈溶液体积分数。
发酵细菌生长曲线测定:发酵细菌生长曲线采用比浊法测定,每隔12h取样稀释一定倍数测其在波长600nm处的吸光度值,绘制出棕榈发酵细菌生长曲线。
甘露醇含量的测定:甘露醇含量按杨晓东等[14]方法测定。
配制0.015mol/L高碘酸钠:将3.2g高碘酸钠和10mL浓盐酸加适量蒸馏水溶解后倒入1000mL容量瓶中,用蒸馏水定容至1000mL。
配制Nash试剂:将75g醋酸铵、1mL冰醋酸和1mL乙酰丙酮混合后加适量蒸馏水溶解,再移入500mL容量瓶中,用蒸馏水定容至500mL。
用蒸馏水将1mg/mL 甘露醇标准品分别稀释成0μg/mL、10μg/mL、20μg/mL、30μg/mL、40μg/mL、50μg/mL质量浓度梯度,每个浓度分别加入0.015mol/L高碘酸钠1mL,混匀,室温放置10min,每个试管再加入0.1%(w/v)L-鼠李糖2mL,充分混合后,加入4mL Nash试剂,在53℃水浴15min后即刻冷却,紫外分光光度计测其波长412nm处的吸光度值,以甘露醇质量浓度为横坐标,OD412nm值为纵坐标绘制标准曲线。
样品测定:取1mL不同浓度甘露醇溶液稀释适当倍数后加入试管中,空白对照管中加蒸馏水1mL,然后按照制标准曲线实验操作方法,将测得OD412nm值代入标准曲线方程,即可求出样品甘露醇含量。每个样品重复测3次。
发酵液中残糖含量测定:发酵液中残糖含量测定采用DNS法测定[15]。
DNS试剂配制:称取3,5-二硝基水杨酸2.5g溶于少量水中,加入0.5g 苯酚,再溶解0.075g 亚硫酸钠、2.5g 氢氧化钠和50g 酒石酸钾钠,移入500mL 容量瓶中,摇匀后定容至500mL,储存于棕色瓶中,放置在冰箱中保存一周后方可使用。
葡萄糖标准液配制:称取2g葡萄糖置于干燥箱中98℃干燥至质量恒定,准确称取1.000g 葡萄糖,用蒸馏水溶解并定容至1000mL。准备若干试管,将样品在试管中充分混匀后,置于沸水浴锅中水浴5min,用冷水冲洗至冷却后,再分别向各试管中加入蒸馏水4mL混匀;以1号试管为空白对照,在波长550nm处测各管的吸光度值。
样品测定:将样品稀释一定倍数后,按照绘制标准曲线方法进行实验操作,波长550nm处测定吸光度值。将所测OD值代入葡萄糖标准曲线方程中,得到相应的还原糖含量。每个样品重复测3次。
Z.palmae利用甘露醇、葡萄糖、半乳糖、岩藻糖、昆布淀粉为碳源发酵产乙醇。
分别以Z.palmae利用甘露醇、葡萄糖、半乳糖、岩藻糖、昆布淀粉为碳源发酵,探讨Z.palmae细胞浓度及乙醇含量的变化情况。
2 结果与分析
2.1 甘露醇含量测定结果
甘露醇标准曲线见图1。标准曲线方程为Y=0.01035X-0.01033,相关系数R2为0.99879。
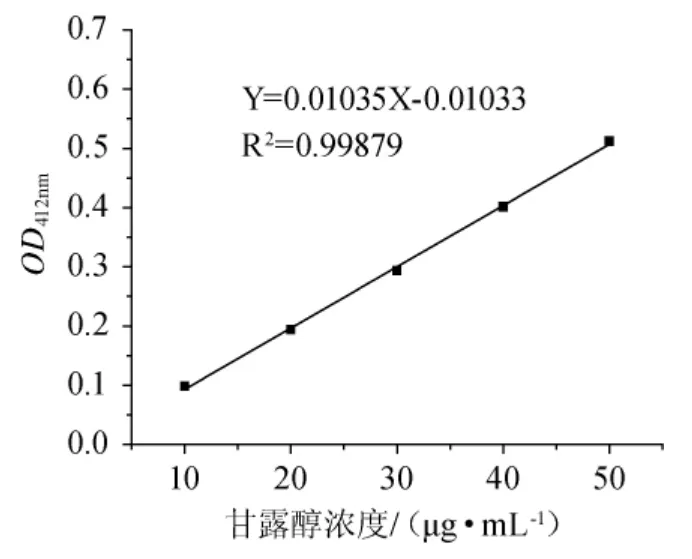
图1 甘露醇标准曲线Fig.1 Standard curve of mannitol
2.2 还原糖含量测定结果
葡萄糖标准曲线见图2。标准曲线方程为Y=0.7267X-0.06067,相关系数R2为0.99952。
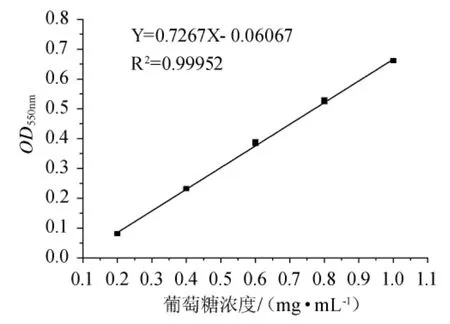
图2 DNS法测葡萄糖标准曲线Fig.2 Standard curve of glucose determination by DNS
2.3 Z.palmae发酵海带多糖以及相应单糖成分产生乙醇的总体情况
表1是Z.palmae以海带主要组分为碳源发酵生产乙醇的情况。由表1可知,Z.palmae可以直接利用甘露醇、葡萄糖、半乳糖、岩藻糖、昆布淀粉产乙醇,利用能力有所差异;在以褐藻酸、L-聚古罗糖醛酸(分子质量分别为1ku、6ku、8ku)、D-聚甘露糖醛酸(分子质量分别为1ku、6ku、8ku)、褐藻糖胶、甘露糖、木糖、鼠李糖、阿拉伯糖、肌醇为唯一碳源的培养基上没有生长。
2.4 Z.palmae发酵甘露醇产乙醇分析
由图3可知,在发酵初期的24h中,Z.palmae处于对数生长期,甘露醇被迅速消耗,其质量浓度从20g/L下降至13.4g/L,消耗率为0.275g/(L·h)。在这个阶段,棕榈发酵细菌消耗了大量甘露醇,以满足菌体生长、繁殖的需求。随着细胞浓度的增大,发酵培养基中溶氧体积分数逐渐下降,在氧限制条件下Z.palmae进入无氧代谢阶段。此时Z.palmae分解甘露醇产生其生长繁殖所需的初级代谢产物,期间伴随着三磷酸腺苷(triphosadenine,ATP)和乙醇的产生,从而提供了低氧条件下Z.palmae所需的物质和能量。
24h~48h时Z.palmae细胞生长速率处于稳定期,随发酵时间的延长乙醇产量也稳步增加。36h~48h时乙醇产率明显增大,到48h时乙醇含量达到其最大值6.92g/L,相应乙醇转化率为0.346g/g甘露醇,达到乙醇理论转化率的67.84%。48h~72h时随着发酵时间的延长,发酵液中副产物积累较多,使得其pH值下降,较低的pH值影响Z.palmae细胞中有关代谢酶的活性,故发酵菌利用甘露醇的速度较发酵初期有所下降;72h时,发酵液中残留甘露醇质量浓度为2.36g/L。到发酵后期(60h~72h),菌体活力下降,产酒精能力降低,发酵液甘露醇耗尽,菌体就会以酒精作碳源,导致乙醇产量呈下降趋势。
2.5 Z.palmae 发酵葡萄糖产乙醇分析
图4是Z.palmae以葡萄糖为碳源产乙醇的情况,0~12h时Z.palmae以0.473g/(L·h)的速率消耗葡萄糖,相应的细胞浓度大量增加,OD600nm达到0.672,至12h时,乙醇含量为1.14g/L。可见,棕榈发酵细菌有较强代谢葡萄糖的能力,虽处于发酵初期,可在短时间内已经进入乙醇代谢阶段。12h~24h时葡萄糖消耗速率迅速提高,达到0.791g/(L·h);24h时残留葡萄糖质量浓度为5.38g/L,相应的乙醇含量和产率则分别为4.98g/L和0.32g/(L·h)。24h~36h时葡萄糖完全耗尽;与此同时,细胞生长放缓,至36h时,乙醇含量达到最大值为5.86g/L,其对应的乙醇转化率为0.293g/g底物,达到理论值的57.45%。36h~72h时葡萄糖已被完全消耗,细胞生长趋势保持较稳定状态,而乙醇含量呈持续下降的趋势,从最高的5.86g/L下降至5.46g/L。

表1 棕榈发酵细菌以甘露醇、褐藻多糖及其相应单糖为碳源发酵乙醇产量Table 1 Ethanol yields of fermentation byZ.palmae using mannitol,brown algae polysaccharides and the corresponding monosaccharides as carbon source
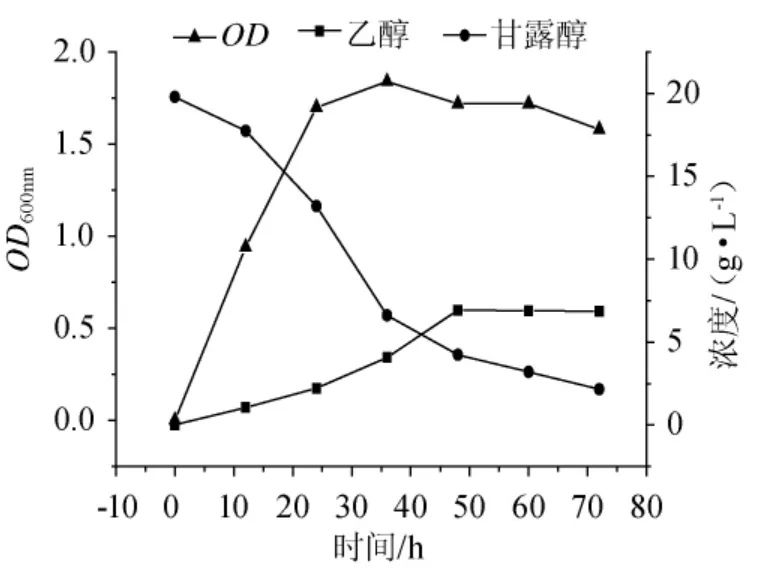
图3 甘露醇的乙醇发酵Fig.3 Ethanol fermentation of mannitol
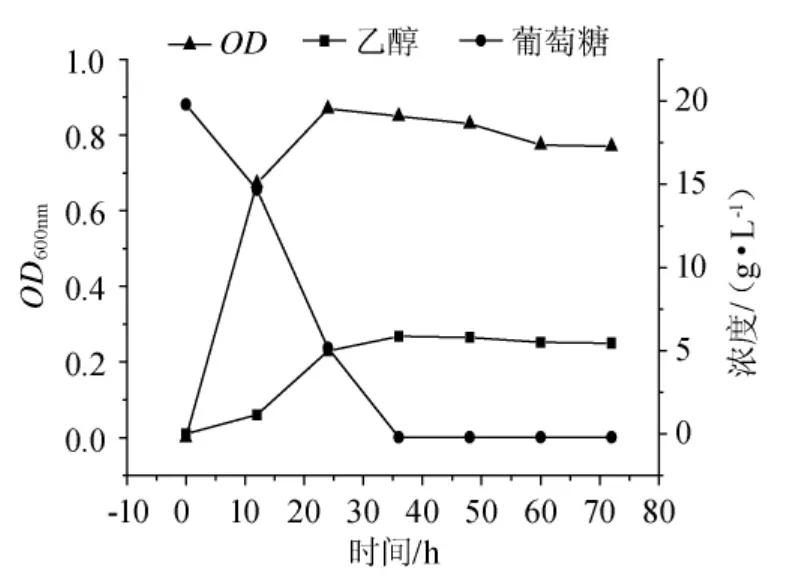
图4 葡萄糖的乙醇发酵Fig.4 Ethanol fermentation of glucose
2.6 Z.palmae发酵半乳糖产乙醇分析
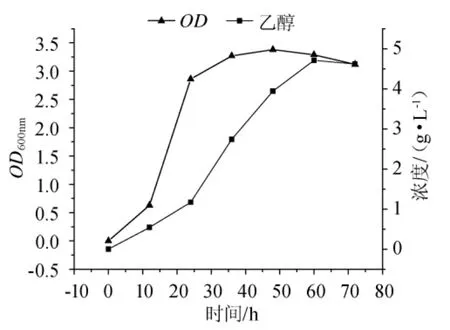
图5 半乳糖的乙醇发酵Fig.5 Ethanol fermentation of galactose
由图5可知,0~12h时棕榈发酵细菌处于生长延迟期,在这个阶段,细胞生长增殖缓慢,细胞生长OD600nm仅为0.63;乙醇产量仅为0.54g/L。12h~36h时Z.palmae生长进入了对数期,36h时OD600nm达到3.27,比延迟期提高将近5倍多,此时乙醇产量为2.74g/L;36h~60h时细胞生长速率趋于稳定,Z.palmae正式转入无氧条件下的乙醇代谢,以0.108g/(L·h)的恒定速率产生乙醇。至60h时,发酵液中乙醇含量达到4.72g/L,相应乙醇转化率约为0.236g/g 底物,为理论值的46.27%。
2.7 Z.palmae 发酵昆布淀粉产乙醇分析
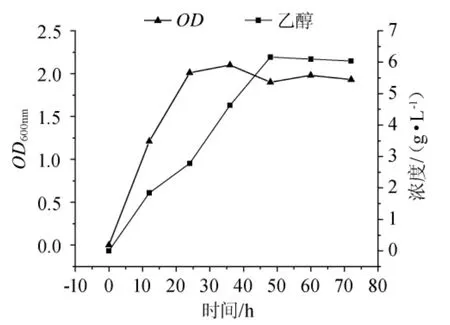
图6 昆布淀粉的乙醇发酵Fig.6 Ethanol fermentation of laminarin
由图6可知,0~24h时Z.palmae处于对数生长期,并有少量乙醇产生;24h~48h时细菌进入生长稳定期,至36h时,细胞浓度升至最高;48h时,乙醇含量也达到最大值为6.16g/L,此时乙醇转化率最高可达0.308g/g 底物,达到理论产量的60.39%。48h~72h,细胞浓度略微下保持稳定,然而乙醇含量开始呈现下降的趋势,从6.16g/L下降至6.04g/L。稳定期乙醇含量下降的趋势,原因可归结于发酵液中昆布多糖耗尽后,Z.palmae转而利用乙醇为碳源进入产能代谢。
2.8 Z.palmae 发酵岩藻糖产乙醇结果分析
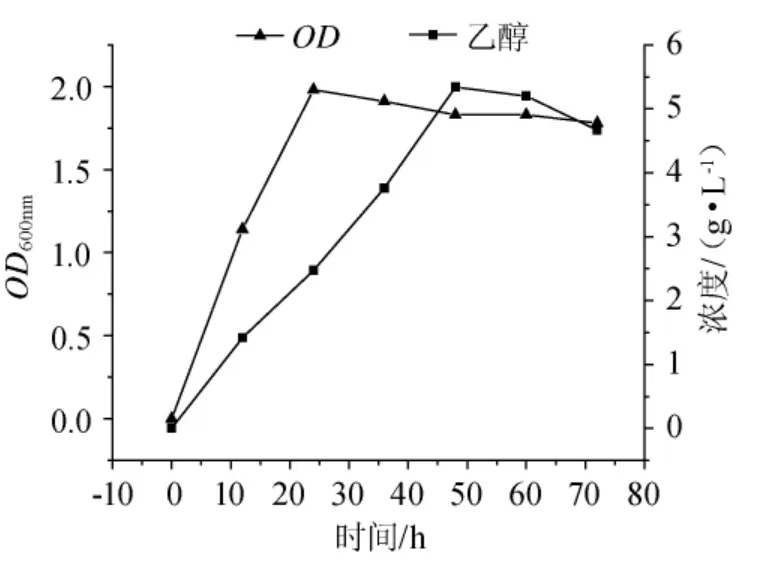
图7 岩藻糖的乙醇发酵Fig.7 Ethanol fermentation of fucose
由图7可知,0~24h时棕榈发酵细菌进入生长对数期,在这一阶段,乙醇含量随细胞浓度的增加而逐渐升高。24h~60h时,Z.palmae细胞生长进入相对稳定期,乙醇含量从2.47g/L上升至5.34g/L,这一阶段乙醇含量达到最大,说明Z.palmae代谢类型已经从有氧代谢转向无氧代谢,以较高的速率稳定地产生乙醇。60h~72h时细胞浓度和乙醇含量明显下降,说明菌体开始衰老,菌体内的酶活力降低,产酒精的能力也跟随降低。在此次以岩藻糖为底物的乙醇发酵实验中得到数据显示,最大乙醇含量为6.16g/L,相应的乙醇转化率为0.267g/g底物,相当于理论转化率的52.35%。
3 结论
综上所述,Z.palmae能够以甘露醇、葡萄糖、半乳糖、岩藻糖、昆布淀粉为碳源发酵生产乙醇,相应的乙醇转化率分别为0.346g、0.293g、0.236g、0.267g、0.308g乙醇/g底物。该细菌能够以褐藻糖胶的单糖组分岩藻糖为底物发酵产乙醇,而不能直接利用褐藻糖胶发酵乙醇,可能是由于此种多糖分子量太大无法进入细胞体内;并且Z.palmae细胞内缺乏能够把褐藻糖胶降解为小分子量的相关酶体系。Z.palmae不能以褐藻胶及其褐藻胶的降解产物为底物发酵产生乙醇。昆布淀粉是一种多糖,Z.palmae可以利用昆布淀粉为底物产生乙醇,而且乙醇转化率和葡萄糖相近,说明该细菌具有将昆布淀粉完全分解为单糖的能力。
[1]BERNDES G,HOOGWIJK M.The contribution of biomass in the future global energy supply:a review of 17 studies[J].Biomass Bioenerg,2003,25(1):1-28.
[2]JANG J S,CHO Y K,JEONG G T,et al.Optimization of saccharification and ethanol production by simultaneous saccharification and fermentation (SSF) from seaweedSaccharina japonica[J].Bioproc Biosyst Eng,2012,35(1-2):11-18.
[3]周志刚,毕燕会.大型海藻能源化利用的研究与思考[J].海洋经济,2011,1(4):23-27.
[4]刘万顺,王 海,戴继勋.海藻酸解壁酶研究[J].海洋学报,1997(3):47-48.
[5]李 林,罗 琼,张声华.海带中褐藻糖胶的组分分析[J].中国食品学报,2001,1(1):46-49.
[6]HORN S,AASEN I,ØSTGAARD K.Production of ethanol from mannitol byZymobacter palmae[J].J Ind Microbiol Biot,2000,24(1):51-57.
[7]LEE SM,LEE JH.The isolation and characterization of simultaneous saccharification and fermentation microorganisms forLaminaria japonicautilization[J].Bioresource Technol,2011,102(7):5962-5967.
[8]LEE SM,LEE JH.Ethanol fermentation for main sugar components of brown-algae using various yeasts[J].J Ind Eng Chem,2012,18(1):16-18.
[9]ADAMS JM,GALLAGHER JA,DONNISON IS.Fermentation study onSaccharina latissimafor bioethanol production considering variable pretreatments[J].J Appl Phycol,2009,21(5):569-574.
[10]PARK JH,HONG JY,JANG HC,et al.Use ofGelidium amansiias a promising resource for bioethanol:A practical approach for continuous dilute-acid hydrolysis and fermentation[J].Bioresource Technol,2012,108:83-88.
[11]HUESEMANN MH,KUO LJ,URQUHART L,et al.Acetone-butanol fermentation of marine macroalgae[J].Bioresource Technol,2012,108:305-309.
[12]HORN S,AASEN I,ØSTGAARD K.Ethanol production from seaweed extract[J].J Ind Microbiol Biot,2000,25(5):249-254.
[13]李自达,申乃坤,赖钧灼,等.基于96 孔板与拉曼光谱的发酵乙醇高通量快速检测[J].分析化学,2010,38(9):1267-1271.
[14]杨晓东,崔勤敏,朱妙琴,等.发酵虫草菌粉中甘露醇含量的比色法测定[J].中国现代应用药学杂志,2006,23(6):504-506.
[15]赵 凯,许鹏举,谷光烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8)534-536.
