川西高原冰酒发酵中Pichia anomala的鉴定与耐受性研究
2013-04-23许青莲邢亚阁车振明张丽珠罗建峰
许青莲,邢亚阁*,车振明,李 可,张丽珠,罗建峰,卢 靖
(1.西华大学 生物工程学院 食品生物技术重点实验室,四川 成都 610039;2.理县塔斯酒庄有限公司,四川 阿坝藏族羌族自治州 623104)
冰葡萄酒是在-7℃的气温条件下,将葡萄挂在枝头上并通过低温自然冷冻和风干,使果实中的糖度及其他内容物得到高浓度浓缩,然后在低温结冰的状态下采摘,立即进行压榨、低温保糖发酵酿造而成的葡萄酒。酿造冰酒的葡萄酒品种有威达尔(Vidal)、雷司令(Riesling)、长相思(Sauvigon Blance)、贵人香(I-talian Riesling)等[1]。近年来,川西高原藏区阿坝州理县以其特殊的气候条件,开发研制了威代尔等系列冰葡萄酒,不仅酒体口感好,味道独特,而且很受当地人的喜欢。在冰葡萄酒生产中,由于影响葡萄酒品质的关键因素是其中的发酵微生物,而酵母菌作为主要的发酵微生物不仅对葡萄酒产量、质量和发酵生产管理影响很大,而且对葡萄酒特色和风格的形成也至关重要[2]。真正优良的葡萄酒酵母,应该具备起酵快,能耐乙醇、高SO2、低温等优点[2-4]。
利用基因测序通过对威代尔冰葡萄汁发酵过程中的主要酵母菌之一的异常毕赤酵母(Pichia anomala)菌株进行了分离鉴定,并进一步研究了Pichia anomala菌株的耐温性能、耐酸碱性能、耐乙醇、SO2和糖等性能,为川西藏区冰葡萄酒扩大生产提供了一定的技术支持,对川西高原冰葡萄酒行业的发展具有十分重要的意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
冰葡萄发酵汁,由四川阿坝州理县塔斯酒庄提供;乙醇、亚硫酸、甘油、氯化镁等化学试剂均由成都科龙化工厂提供;酵母菌18S rDNA PCR和电泳检测试剂,胶回收和连接试剂,酶切试剂等由成都东盛公司提供。
1.1.2 培养液、培养基的制备[4-7]
酵母浸出粉胨葡萄糖琼脂(yeast extractpeptone dextrose,YPD)培养基:酵母粉1%,蛋白胨2%,葡萄糖2%,琼脂2%。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养液:马铃薯20%,葡萄糖2%,琼脂1.5%~2.0%。
虎红琼脂培养基:蛋白胨0.5%,磷酸二氢钾0.1%,硫酸镁0.05%,葡萄糖1.0%,琼脂2.0%,0.1%孟加拉红溶液:0.33%,氯霉素:0.01%。
1.2 仪器与设备
DHP-9052型电热恒温培养箱:上海益恒实验仪器公司;SHA-B型恒温振荡箱:金坛市富华仪器有限公司;pHS-25精密pH计:上海精科雷磁仪器厂;721分光光度计:上海精密科学仪器有限公司;DYY-8C型双定时电泳仪:郑州朋来仪器有限公司。
1.3 方法
1.3.1 菌株分离
从酒庄运至实验室的威代尔冰葡萄进行榨汁处理,用虎红培养基从葡萄汁中筛选出生长旺盛且特征明显的1株菌,通过平板划线分离出该株菌的单菌落,挑取单菌落在液体PDA培养液中培养后用甘油保存菌株,放置在-20℃备用[4,8-10]。
1.3.2 菌株分子鉴定
采用18S rDNA序列分析法对分离出的菌种进行分子鉴定。采用玻璃珠法[1]提取基因组总DNA:聚合酶链反应(polymerase chain reaction,PCR)体系:30μL重蒸水(ddH2O),5μL 10×PCR 扩增缓冲液(Reaction Buffer)(Mg2+Free),6μL MgCl2(25mmol/L),4μL 三磷酸脱氧核苷酸(dNTP)(2.5mmol/L),引物NSl(5’-GTAGTCATATGCTTGTCTC-3’)和NS8(5’-TCCGCAGGTTCACCTACGGA-3’)各1μL,1μL Taq聚合酶(2.5U/μL),2μL总DNA模板,PCR程序[4,11-13]简述如下:95℃预变性5min;95℃变性1min,50℃退火1min,72℃延伸2min,经30个循环后最终72℃保持10min,然后电泳和溴化乙锭(ethidium bromide,EB)染色检测目标产物有无及效果。并按照pGEM-T Easy Vector System I(Promega USA)说明将PCR产物连接至pGEM-T载体,并转化至感受态细胞E.coliDH5α中,涂布于含氨苄青霉素(Amp,100μg/mL)、异丙基-β-D-硫代吡喃半乳糖苷(IPTG,24μg/mL)和5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal,40μg/mL)的LB平板上,筛选阳性克隆子。挑取阳性克隆子,按照Plasmid Mini Kit I(OMEGA USA)说明提取重组质粒,应用酶切法鉴定插入片段是否正确。酶切反应条件[9,14]:重组质粒2μL,EcoRI(Fermentas)1μL,10×EcoRI Buffer 1μL,重蒸水(ddH2O)6μL。经E.coli RI酶切检测后含有完整16S rRNA的重组质粒采用Applied Piosystems DNASequencer(model 377)自动测序。测序结果与数据库NCBI Blast比对后,再通过Clustal X1.8将代表序列与数据库中所得序列进行完全比对,测得序列提交至GenBank数据库,获得序列号。
1.3.3 耐受性实验
耐温性分析:将实验菌株Pichia anomala活化后接种于带有杜氏管的YPD培养基中,接种量为1.0×107CFU/mL,然后分别放于8℃、20℃、28℃、32℃和36℃条件下培养24h,在波长600nm条件下测其吸光度值。耐pH值、耐二氧化硫和耐糖性能分析[15]:分别采用不同的pH值(1.5、2.0、4.0、6.0、8.0、10.0、12.0)、乙醇浓度(4%vol、8%vol、12%vol、16%vol)、二氧化硫(采用亚硫酸钠进行二氧化硫浓度调节,二氧化硫浓度采用碘吸收滴定法进行测定[16])含量(100mg/L、200mg/L、300mg/L、400mg/L、500mg/L、600mg/L)、及蔗糖含量(15%、25%、40%、55%、70%)的带有杜氏管的YPD培养基中,接种量为1.0×107CFU/mL,25℃培养24h,在波长600nm处测其吸光度值。
2 结果与讨论
2.1 Pichia anomala 酵母菌的分离鉴定
标准品基因和目的基因扩增电泳结果分别如图1和图2。由图1和图2电泳亮斑可知,对样本的18S rDNA基因进行PCR扩增,所扩增片段的大小约为1.8kb,和真核生物的18S rRNA/DNA基因片段大小一致,因此达到了对酵母的18S rDNA基因的PCR扩增目的。
图1 标准品基因Fig.1 Standard gene
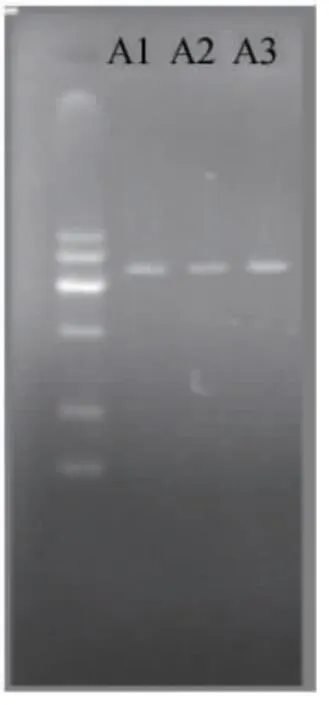
图2 目的基因扩增电泳图琼脂糖(1%)Fig.2 PCR electrophoretogram of objective gene (agarose 1%)
经TaqDNA聚合酶扩增后的PCR产物末端都带有单个A。正是基于这一原理,pGEM质粒经EcoRⅠ切成平端后,在开口端加上一个T制成T载体,一方面避免了自身环化,另一方面由于T-A互补,从而提高了T载体与PCR产物之间的连接效率。由于T-A克隆只需要纯化PCR产物,因而操作较为简便。pGEM-T载体含丝状噬菌体f1的复制起始区,用于产生环状ssDNA;含有T7和SP6 RNA聚合酶启动子;在多克隆区域具有编码β-半乳糖苷酶的基因(LacZ),插入失活α-肽可在指示平板上通过蓝、白菌落直接筛选重组菌落。
在实验中采用了内切酶EcoRⅠ对重组后的质粒进行了切割,因此嵌合有18S rRNA/DNA目的基因的重组质粒pGEM-T的酶切片段电泳亮斑应和DNA MarkerⅦ中长度为2.0kb和1.5kb的核酸片段亮斑位置相近。如图3,连接反应成功的将PCR扩增后的18S rDNA基因连接到了T-载体上,并在感受态的大肠杆菌中得到了表达,形成白色菌落,通过电泳检测到完整的18S rDNA基因,通过基因测序,鉴定出为异常毕赤酵母菌(Pichia anomala)。
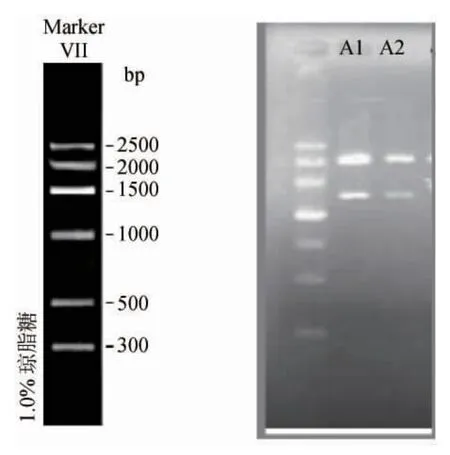
图3 质粒酶切琼脂糖(1%)Fig.3 Plasmid enzyme digestion(agarose 1%)
2.2 耐温性分析
在四川高原藏区,冰葡萄酒的发酵温度一般控制在10℃左右,这样使得冰葡萄酒原料能够在一定的低温条件进行缓慢长时间发酵,以期获得较好的冰葡萄酒品质。将分离纯化得到的异常毕赤酵母菌(Pichia anomala)接种于培养基后在不同温度下观察其生长情况,结果表明(图4),随着温度的增加,该酵母菌株的生长情况明显好转,然而当温度超过28℃后,其生长力有所下降。由图4可知,该酵母菌株在低温条件下如8℃时,具有一定的生长力。结果表明,该酵母菌株可以满足冰葡萄酒的生产所需。
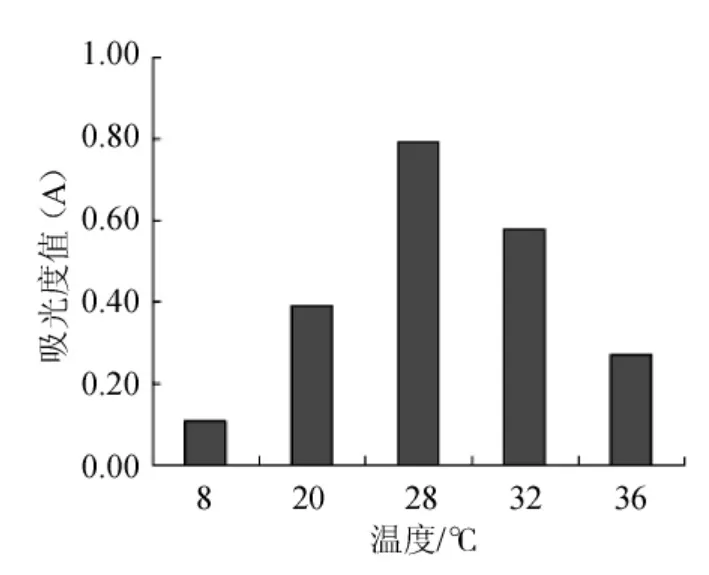
图4 不同温度对Pichia anomala酵母菌活性的影响Fig.4 Effect of different temperature on the activity ofPichia anomala
2.3 耐酸碱性能分析
酵母菌的耐酸碱性能对于葡萄酒的发酵过程影响比较大,因此,本实验将异常毕赤酵母菌(Pichia anomala)接种于pH值分别为1.5、2.0、4.0、6.0、8.0、10.0和12.0的培养基中进行培养,结果表明(图5),该酵母菌株随着pH值的增加,其活菌数出现先增加后减少的趋势,在pH=6.0处,生长得最好,在pH=4.0处,生长情况也比较好。在pH值为4.0和6.0时,其生长情况明显好于在其他pH值的环境中。
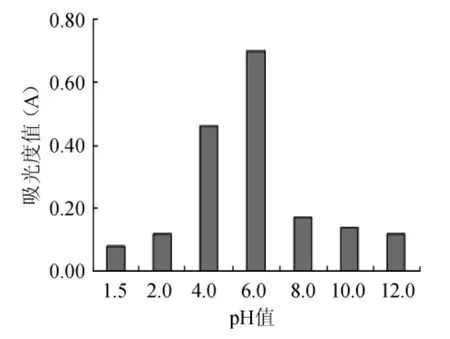
图5 不同pH值对Pichia anomala酵母菌活性的影响Fig.5 Effect of different pH values on the activity ofPichia anomala
2.4 耐乙醇性能分析
在冰葡萄酒酿造中,随着发酵的进行,葡萄醪中的酒精度会有一定的变化,发酵前期会有上升的趋势。因此,在冰葡萄酒酿造过程中,对酵母菌株耐乙醇性能的研究具有一定的意义。由图6可知,当乙醇浓度为4%vol时,该菌株的生长情况较好,而当浓度增加8%vol时,该酵母菌的生长变得缓慢,当乙醇浓度进一步增加,该酵母菌的存活量明显低于其在低乙醇浓度环境下。结果表明,该酵母菌对乙醇具有一定的耐受性。
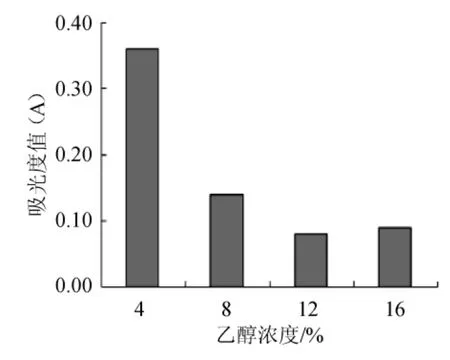
图6 不同乙醇浓度对Pichia anomala酵母菌活性的影响Fig.6 Effect of different ethanol concentrations on the activity ofPichia anomala
2.5 耐SO2性能分析
在冰葡萄酒或其他类型的葡萄酒酿造中,通常在葡萄醪中添加一定亚硫酸,转化为二氧化硫,从而起杀菌、澄清、增酸等作用。因此,在冰葡萄酒酿造过程中,对酵母菌株的耐二氧化硫能力的研究就显得必要。由图7可以看出,采用亚硫酸钠调节培养基中SO2浓度,当SO2含量为100mg/L时,该菌株的生长情况较好,而当浓度增加200mg/L时,该酵母菌的生长明显得到抑制。随着SO2(亚硫酸钠)浓度的增加,该酵母菌的存活量逐渐下降,结果表明,该酵母菌对SO2具有一定的耐受性。
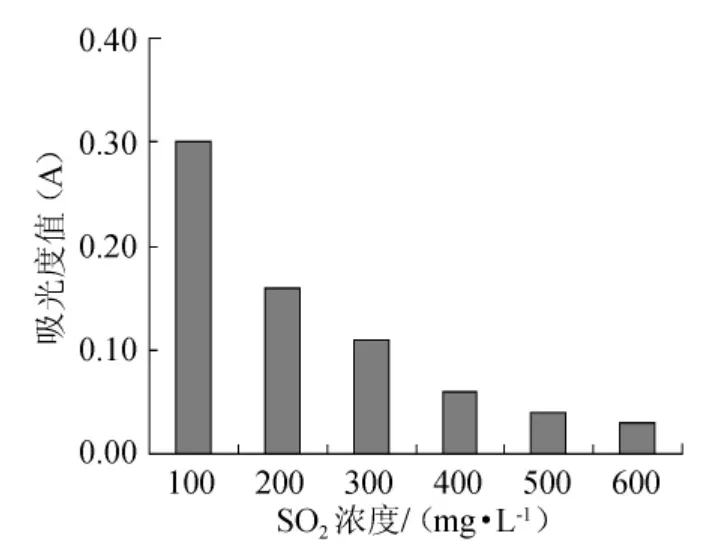
图7 不同SO2浓度对Pichia anomala酵母菌活性的影响Fig.7 Effect of different SO2 concentrations on the activity ofPichia anomala
2.6 耐糖性能分析
对于冰葡萄酒而言,在发酵初期,发酵液中的含糖量是比较高的,随着发酵的进行,残糖的下降速度也比较快,酵母菌应具有一定的耐糖性能,才能使冰葡萄酒的发酵顺利进行。由图8可知,当蔗糖质量浓度为15%时,该菌株的生长情况较好,而当质量浓度增加为25%时,该酵母菌的生长有所减缓。随着糖质量浓度的增加,该酵母菌的存活量逐渐下降,而当糖的质量浓度增加至40%时,该酵母菌的生长明显得到抑制。结果表明,该酵母菌具有较好的耐糖性能。
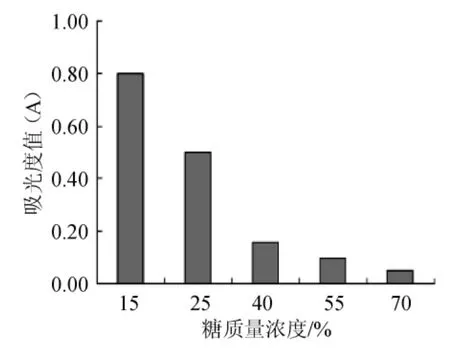
图8 不同蔗糖质量浓度对Pichia anomala酵母菌活性的影响Fig.8 Effect of different sucrose contents on the activity ofPichia anomala
3 结论
本研究从四川藏区高原威代尔冰葡萄果实中分离纯化出了异常毕赤酵母菌(Pichia anomala)菌株,采用18S rDNA D1/D2序列进行了基因鉴定,并通过耐性实验分析,结果显示鉴定出的异常毕赤酵母分别在28℃、pH=4.0或6.0条件下,生长情况较好,在低温8℃条件下具有一定的生存力。并对乙醇、二氧化硫和糖均有一定的耐受性。此研究对筛选川西冰葡萄酒产区特色酵母菌,构建冰葡萄酒发酵微生物资源库和丰富其种质资源具有重要意义。但是,由于形成冰葡萄酒特有风味品质的发酵微生物菌群十分复杂,我们的研究也仍将继续,以期为川西藏区冰葡萄酒标准化生产提供技术支持。
[1]张 彦.冰葡萄酒[J].酿酒,2007,34(5):89-90.
[2]崔 艳.菌种选育技术在葡萄酒酿造中的应用与发展[J].食品研究与开发,2011,32(9):171-175.
[3]程 雷.葡萄自然发酵过程中酵母的分离鉴定及优良葡萄酒酵母筛选[D].哈尔滨:东北林业大学硕士论文,2010.
[4]王国平.宁夏御马葡萄酒厂野生酵母菌株的分离筛选及分子鉴定[J].中国酿造,2009,28(8):38-41.
[5]王凤梅.土默川平原葡萄酒相关酵母的分离与鉴定[J].四川食品与发酵,2008,44(5):62-64.
[6]MERIN M G,MENDOZA L M,FARIAS M E,et al.Isolation and selection of yeasts from wine grape ecosystem secreting cold-active pectinolytic activity[J].Int J Food Microbiol,2011,147(2):144-148.
[7]杨雪峰.利用WL 营养培养基鉴定葡萄酒中的相关酵母菌[J].中外葡萄和葡萄酒,2006(4):4-7.
[8]王 慧.产地葡萄酒优良酵母菌株的筛选及鉴定[J].酿酒科技,2007(9):29-34.
[9]杨美景.赤霞珠葡萄自然发酵过程中酵母菌的分离与鉴定[J].食品与发酵工业,2011,37(7):22-27.
[10]薛军侠.WL 培养基在酿酒酵母筛选中的应用[J].中国酿造,2007,26(9):36-39.
[11]NAUMOVA ES,NAUMOV GI,MICHAILOVA YV,et al.Genetic diversity study of the yeastSaccharomyces bayanusvar.uvarum reveals introgressed subtelomericSaccharomyces cerevisiaegenes[J].Res Microbiol,2011,162(2):204-213.
[12]AUNG W,WATANABE Y,HASHINAGA F.Isolation and phylogenetic analysis of two thermotolerant,fermentative yeast strains from liquid tape ketan(indonesian rice wine)[J].Food Sci Technol Res,2012,18(2):143-148.
[13]张志华.核酸序列直接分析在真菌鉴定方面的应用[J].华南热带农业大学学报,2006,12(2):39-43.
[14]RODRIGUEZ M E,INFANTE J J,MOLINA M,et al.Using RFLPmtDNA for the rapid monitoring of the dominant inoculated yeast strain in industrial wine fermentations[J].Int J Food Microbiol,2011,145(1):331-335.
[15]赵祥杰,涂国全.一株桑椹果酒酵母的分离筛选及耐性测定[J].酿酒科技,2007(1):28-32.
[16]何红梅,薛则尧,曹小彦.碘吸收滴定法测定食品中二氧化硫残留量[J].食品与机械,2006,22(3):142-143.
