糖及乙醇对木葡糖酸醋杆菌种子液活力的影响
2013-04-23康丽茹钟春燕王锡彬王志国
康丽茹,钟春燕,王锡彬,向 东,王志国*
(1.海南大学 食品学院,海南 海口 570228;2.海南椰国食品有限公司,海南 海口 570311)
细菌纤维素与高等植物细胞中的纤维素相比,具有高结晶度、高纯度、高持水力,高杨氏模量等特性,因此广泛应用于食品、医药材料、造纸、服装等领域,因此得以广泛研究[1-2]。就目前的研究来看,主要集中于如何高产纤维素,如通过诱变筛选高产菌株[3-4]、优化培养基配方[5-7]、发酵工艺的优化等[8-11]。高产纤维素的前提是种子液活力要高,而种子液的制备方式通常为静置培养,但在实验过程中,发现静置培养制备种子液时,传代次数多了,种子液的活力就会下降。尽管糖源及乙醇对纤维素的产量影响已有不少报道[12-15],但就这些物质对种子液活力的研究鲜有报道。本实验以木葡糖酸醋杆菌为研究对象,对种子传代次数、糖源及乙醇对纤维素的产量进行了研究,对提高纤维素产量具有重要的实际意义。
1 材料和方法
1.1 材料
1.1.1 菌种
木葡糖酸醋杆菌(Gluconacetobacter xylinus),海南大学食品学院综合实验室分离保存。
1.1.2 培养基
斜面培养基:2.0%葡萄糖、0.5%酵母膏、0.5%蛋白胨、0.27%Na2HPO4、0.115%柠檬酸、2.0%琼脂,自然pH值,121℃、15min条件下灭菌。
种子培养基:糖源(1.0%葡萄糖、2.0%葡萄糖、2.0%蔗糖、4.0%蔗糖),0.3%Na2HPO4、0.3%(NH4)2SO4、0.1%柠檬酸、0.025%MgSO4,调节pH值至4.0,105℃消毒15min。研究乙醇的影响时,添加1%vol乙醇。
生产培养基:自然发酵椰子水、白砂糖4.0%、0.3%(NH4)2SO4、0.1%KH2PO4、0.05%MgSO4,用10%NaOH调节pH值至4.5,105℃、15min条件下消毒[16]。
1.2 仪器与设备
SW-CJ-1F单人双面净化工作台:苏州净化设备有限公司;YX280A手提式不锈钢蒸汽消毒器:上海三申医疗器械有限公司;SHP-1500生化培养箱:上海精宏实验设备有限公司;SHZ-82气浴恒温振荡器:常州市华普达教学仪器有限公司。
1.3 方法
1.3.1 实验方法
菌种活化:挑取斜面培养基上的木葡糖酸醋杆菌(Gluconacetobacter xylinus)于50mL种子培养液中,30℃静置培养4d。
静置方式制备种子液:菌种活化液按5%(v/v)的接种量转接于100mL种子培养液,30℃静置培养4d后,按5%(v/v)转接至新鲜的种子培养液中,30℃静置培养4d,连续转接5次,对每次转接所制备的种子液进行活力评估。
振摇方式制备种子液:菌种活化液按5%(v/v)的接种量转接于100mL种子培养液,30℃、120r/min培养4d,按5%(v/v)转接至新鲜的种子培养液中,30℃静置培养4d,连续转接5次,对每次转接所制备的种子液进行活力评估。
1.3.2 糖源对Ga.xylinus种子液活力的影响
在种子培养液中分别加入1.0%葡萄糖、2.0%葡萄糖、2.0%蔗糖、4.0%蔗糖,分别考察静置方式、振摇方式对种子培养液活力的影响。
1.3.3 乙醇对Ga.xylinus种子液活力的影响
在种子培养液中以2.0%葡萄糖为碳源,加入1%vol的乙醇,分别考察静置方式、振摇方式对种子培养液活力的影响。
1.3.4 分析方法
种子液活力的评估:种子液按5%(v/v)的接种量接种于300mL生产培养液中,30℃静置培养6d,得到细菌纤维素,置于80℃,0.1mol/L NaOH溶液中,保持2h,冷却后用0.1mol/L HCl中和至pH值为7.0,用自来水充分洗涤,在80℃条件下干燥至质量恒定,称质量。
菌落计数:将种子液取1mL,加入9mL无菌0.85%生理盐水,如此重复后,将稀释10、100、1000倍的稀释液涂布于固体平板上,涂布后,置于30℃静置培养6d,平板菌落计数[17]。
2 结果与分析
2.1 静置方式制备Ga.xylinus 种子液
2.1.1 糖种类及浓度对Ga.xylinus种子液活力的影响
从图1可以看出,静置方式制备Ga.xylinus种子液,其活力随转接次数增加而下降。
第1次转接时,种子液活力差别不大(1%葡萄糖、2%葡萄糖、2%蔗糖、4%蔗糖的活力分别为4.1g/L、4.2g/L、4.2g/L、4.3g/L),但随着转接次数的增加,差别逐渐显现,转接至第5次时,2%蔗糖的种子液活力为2.1g/L,分别比1%葡萄糖、2%葡萄糖、4%蔗糖少38%、57%、52%。
当种子液中的糖源为2%的葡萄糖时,下降的趋势较为平缓,至第5代时,活力为3.3g/L,比第1代种子液的活力(4.2g/L)下降了约24%;而糖源为2%蔗糖时,种子液活力下降十分明显,至第5代时,活力为2.1g/L,比第1代种子液的活力(4.2g/L)下降了50%。
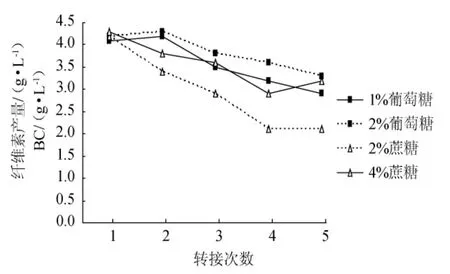
图1 糖对静置方式制备种子液的活力影响Fig.1 Effects of sugars in stationary culture on its viability
2.1.2 乙醇对Ga.xylinus种子液活力及生物量的影响
静置培养时,2%葡萄糖的种子液在连续5次传代过程中活力相对稳定,但仍下降了24%(见图1),因此添加1%vol的乙醇进行研究。
从图2可以看出,添加1%vol的乙醇,传代次数增加,种子液活力仍下降。但在同代中,比单纯葡萄糖种子培养基的活力高,即使转接至第5次时,种子液活力(4.3g/L)也与仅含2%葡萄糖的种子液转接第1次的活力(4.2g/L)相当。
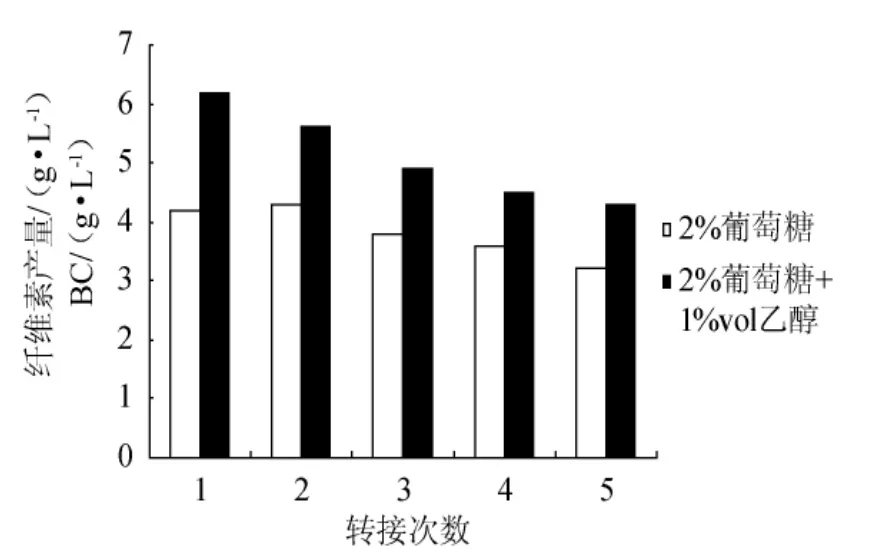
图2 乙醇对静置方式制备种子液的活力影响Fig.2 Effects of ethanol in stationary culture on its viability
对含有乙醇的种子液进行菌落计数,结果见图3。从图3可看出,静置连续培养的8d时间内,含乙醇的种子液比不含乙醇对照组(CK)中的菌落数始终更多。可见乙醇能增加生物量,从而减缓种子液在传代过程中的活力下降。
总的说来,以静置方式制备Ga.xylinus种子液时,其合适的培养基为2%葡萄糖、1%vol乙醇、0.3% Na2HPO4、0.3%(NH4)2SO4、0.1%柠檬酸、0.025%MgSO4,调节pH至4.0。培养条件为30℃,4d。
2.2 振摇方式制备种子液
2.2.1 糖种类及浓度对Ga.xylinus种子液活力的影响
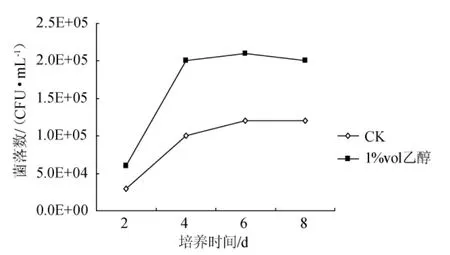
图3 乙醇对静置方式制备种子液的生物量影响Fig.3 Effects of ethanol in stock culture cultivated statically on its biomass
振摇方式制备种子液,种子液活力随代数增加变化降低趋势更为明显(图4)。从图4可以看出,采用1%的葡萄糖培养基,至第3代时,种子液几乎没有活力,采用2%蔗糖,至第4代时,种子液活力也几乎丧失。
这种活力丧失的原因是种子液中木葡糖酸醋杆菌的数量锐减,因为将种子液用显微镜观察,几乎看不见木葡糖酸醋杆菌细胞的存在。
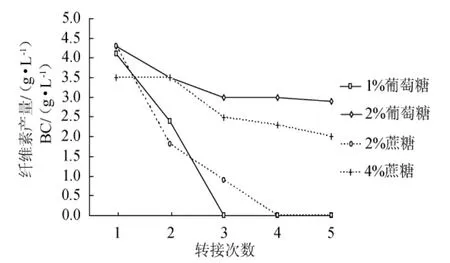
图4 糖源对振摇方式制备种子液的活力影响Fig.4 Effects of sugars in stock culture cultivated shaking on its viability
总体说来,种子培养基的糖源以2%的葡萄糖更为合适,其次为4%的蔗糖。
2.2.2 乙醇对Ga.xylinus种子液活力及生物量的影响
在2%的葡萄糖种子培养基中添加1%vol乙醇,采用振摇方式制备种子液,其活力随传代次数增加逐渐减小(图5),但在同一代中,添加乙醇,明显增加了种子液活力,这是由于前面4d内,含乙醇的振摇种子液中含有更多的木葡糖酸醋杆菌细胞(如第4d时,无乙醇中为1.6×105CFU/mL,而乙醇培养液中为2.0×105CFU/mL)。从图6可以看出,如果增加每代培养的时间,可以预料,添加1%vol乙醇的种子液的活力在传代过程中,可能下降更快。
从图7可以看出,每代种子液培养时间延长至8d,无论是否添加乙醇,种子液活力在传代过程中都持续下降,而且同代种子液的活力比较看,乙醇似乎具有负作用,即种子液活力相对更低。
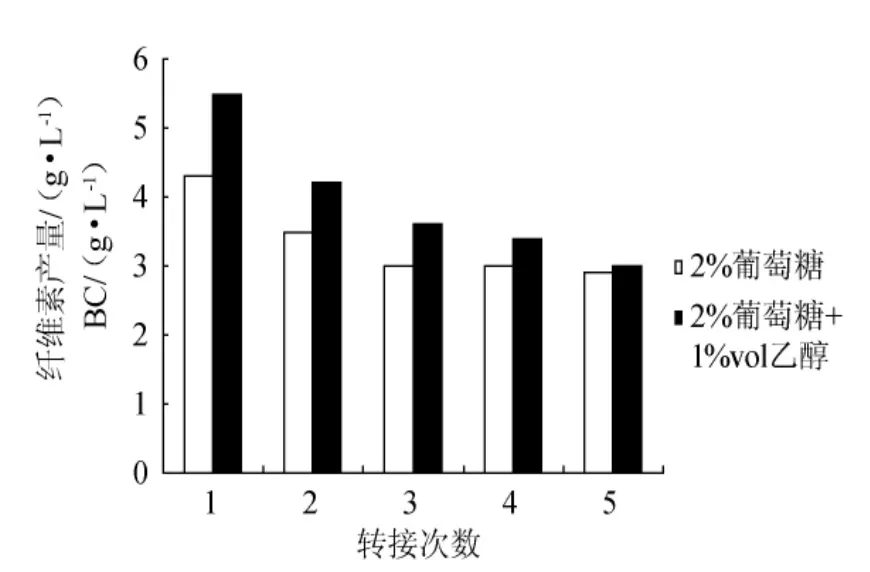
图5 乙醇对振摇方式制备种子液的活力影响Fig.5 Effects of ethanol in stock culture cultivated shaking on its viability
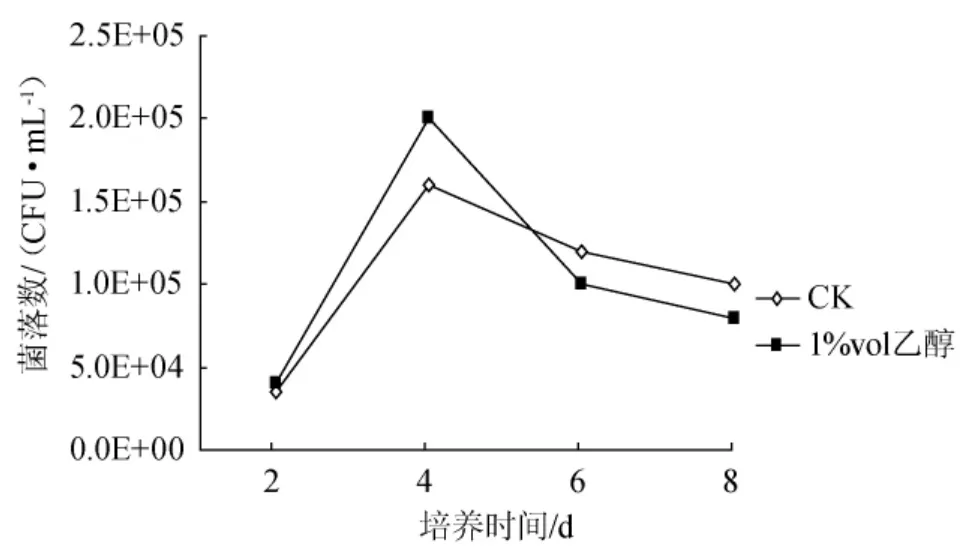
图6 乙醇对振摇方式制备种子液的生物量影响Fig.6 Effects of ethanol in stock culture cultivated shaking on its biomass
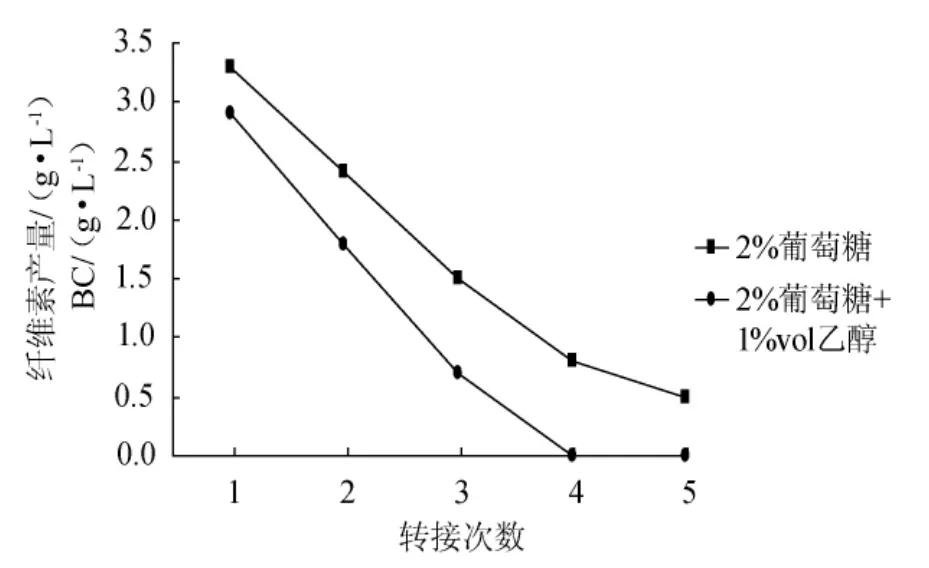
图7 乙醇对振摇方式制备种子液的活力影响Fig.7 Effects of ethanol in stock culture cultivated by shaking for 8d on its viability
造成这一现象的原因可能是乙醇具有增菌作用,正因如此,培养液中的营养物质消耗更快,培养时间延长,微生物总数量反倒减少,从而导致种子液活力下降。从图7可以看出,添加乙醇的种子液中,当传代至第4代时,此时的种子液几乎不能产生纤维素。
3 结论
Ga.xylinus种子液代数增加,无论是静置方式还是振摇方式制备时,种子液活力随转接次数增加而下降,但这种下降的趋势因糖的种类不同而异,以2%葡萄糖为糖源时,下降趋势更缓,如果添加1%vol的乙醇,因为乙醇有增菌作用,下降趋势得到缓解。但在振摇制备时,尽管添加乙醇也能缓解种子液活力的下降,但培养的时间不宜超过4d。
静置培养制备Ga.xylinus种子液时,以2%葡萄糖结合1%vol乙醇为较佳,但传代次数宜控制,结合先前的实验结论[18],还要注意装液量不能太大,否则易出现衰退菌株。
[1]POKALWAR S U,MISHRAL M K,MANWAR A V.Production of cellulose byGluconacetobactersp.[J].Recent Res Sci Tech,2010,2(7):14-19.
[2]CHAWLA P R,BAJAJ I B,SURVASE S A,et al.Microbial cellulose:fermentative production and applications[J].Food Technol Biotech,2009,47(2):107-124.
[3]毋锐琴.高产细菌纤维素菌株的筛选及发酵工艺优化[D].西北农林科技大学硕士论文,2008.
[4]葛含静.细菌纤维素高产菌株高压诱变选育及其机理研究[D].西北农林科技大学硕士论文,2012.
[5]李兆乾,裴重华,彭碧辉.细菌纤维素的研究现状及进展[J].纤维素科学与技术,2007,15(2):64-67.
[6]谢健健,洪 枫.细菌纤维素发酵原料的研究进展[J].纤维素科学与技术,2011,19(3):68-77.
[7]张继东.木醋杆菌发酵产细菌纤维素的研究[D].南京理工大学博士论文,2004.
[8]赵 琼,杨 谦.木醋杆菌突变株产细菌纤维素发酵条件优化[J].食品研究与开发,2007,28(6):44-48.
[9]秦微微,迟玉杰.木醋杆菌发酵培养基优化及发酵方式的探讨[J].中国酿造,2006,25(6):33-36.
[10]SANI A,DAHMAN Y.Improvements in the production of bacterial synthesized biocellulose nanofibres using different culture methods[J].J Chem Technol Biot,2010,85(2):151-164.
[11]JUNG J Y,KHAN T,PARK J K,et al.Production of bacterial cellulose byGluconacetobacter hanseniiusing a novel bioreactor equipped with a spin filter[J].Korean J Chem Eng,2007,24(2):265-271.
[12]王志国,王锡彬,向 东,等.乙醇在合成培养基中对木醋杆菌HN001合成纤维素的影响[J].食品科技,2007(12):47-49.
[13]马 霞,王瑞明,关凤梅,等.非碳水化合物对木醋杆菌合成细菌纤维素影响规律的初探[J].中国酿造,2003,22(4):15-17.
[14]张凤清,张海悦,郑春雨,等.玉米浆做Acetobacter xylinum培养基生产纤维素的发酵条件优化[J].食品工业科技,2005,26(2):107-108.
[15]罗锦洪,卢红梅,张义明,等.利用响应面法优化细菌纤维素发酵培养基[J].中国酿造,2008,27(22):39-41.
[16]王志国,钟春燕,王锡彬,等.椰子水自然发酵条件对细菌纤维素生产的影响[J].中国酿造,2009,28(4):32-34.
[17]叶 明.微生物学实验技术[M].安微:合肥工业大学出版社,2009.
[18]吴 谦,谢必祺,刘耀谦,等.木葡糖醋杆菌静置培养中的衰退现象初探[J].中国酿造,2013,32(5):19-21.
