分离自烟台白玉霓种植园的酿酒酵母发酵特性研究
2013-04-23程仕伟李林林姜文广沈志毅李记明
程仕伟,李林林,缪 静,姜文广,沈志毅,李记明*
(1.鲁东大学 生命科学学院 应用微生物研究所,山东 烟台 264001;2.烟台张裕集团有限公司 技术中心,山东 烟台 265709)
在影响葡萄酒质量的诸多因素中,发酵微生物、工艺条件、酿酒设备和生态条件与葡萄品种4个方面起了决定性的作用,这些因素的相互影响最终决定了葡萄酒的品质,而酿酒微生物是葡萄酒质量和感官风格的决定性因素[1-3]。在其他因素相对稳定的情况下,葡萄酒酵母的酿酒适应性和酿造学特性在生产中的重要作用就显得十分突出[4]。酿酒酵母性能的优劣直接影响着葡萄酒品质,其将葡萄汁中的糖类转化为乙醇和CO2并生成高级醇酯类醛类等重要风味物质[5-7]。优良葡萄酒酵母具备启动发酵速度快、发酵能力强、残糖少、挥发酸少、耐高酒精度、高SO2和酒体协调等优点[8-9]。然而目前多数葡萄酒生产企业大量使用进口活性干酵母,虽保证了发酵速率和产品质量稳定,却导致葡萄酒品质出现同质化严重的问题[10]。
优质葡萄酒的生产需要具有产区特征且能体现葡萄酒特色和风格的优良酵母菌种[11]。因此加快我国本土酿酒酵母资源的开发利用,是生产特种葡萄酒的重要保证[12]。山东烟台是我国酿酒葡萄及葡萄酒的主产区,从当地的葡萄园区及特定的环境条件中分离具有优良特性的葡萄酒酵母,对酿造具有地域特色和独特风格的产地葡萄酒有着重要的价值。本实验以分离自烟台白玉霓葡萄种植区的酿酒酵母为研究对象,通过其与商品化进口活性干酵母的发酵特性比较研究,为后续深入研究进而选育具有工业化应用潜力的菌株提供数据支撑。
1 材料与方法
1.1 供试菌株
自烟台白玉霓葡萄种植园的葡萄叶片、果实、土壤和葡萄须根部位取样,经孟加拉红选择性筛选获得本土酵母41个,经鉴定有3株菌为酿酒酵母,分别为ZYYT-1、ZYYT-2、ZYYT-3。商品化酵母Actiflore F33 购自Laffort 公司,EC1118购自法国Lallemand公司,均由烟台张裕集团技术中心提供。
1.2 培养基与试剂
采用YPD(yeast extract peptone dextrose medium)培养基:葡萄糖20g/L,蛋白胨20g/L,酵母浸粉10g/L。所有试剂均为分析纯或生物纯。
1.3 发酵性能指标测定
1.3.1 发酵力测定
CO2失重法:将2%接种量的种液转接到300mL灭菌的YPD培养基中,28℃培养。以CO2产生量为纵坐标,发酵时间为横坐标,绘制CO2产生量曲线。
1.3.2 产酒精能力测定
重铬酸钾比色法:用重铬酸钾氧化乙醇为醋酸后,根据反应中生成的Cr3+的颜色在波长610nm处进行比色,从标准曲线中得出所含的酒精含量[13-14]。
1.3.3 总酸含量测定
采用国标GB/T 15038-2006中的指示剂法,利用酸碱滴定原理,以酚酞作指示剂,用碱标准溶液滴定,根据碱的用量计算总酸含量[15]。
1.3.4 残糖量测定
采用DNS比色法测定还原糖的含量。发酵液经8000r/min离心2min得发酵上清液,取稀释后的上清液1mL于试管中,加入1mL蒸馏水和3mL DNS试剂,煮沸10min,待冷却后定容至25mL,波长540nm处测其吸光度值。根据标准曲线查出对应的葡萄糖量。
1.3.5 酿酒酵母耐受性测定
采用不同乙醇浓度(12%vol、14%vol、16%vol、18%vol)、柠檬酸浓度(1.5%、2.0%、2.5%、3.0%)、SO2浓度(60mg/L、100mg/L、150mg/L、200mg/L)的6mL YPD培养基(内装有杜氏管),接种已活化的菌液一环,28℃恒温培养48h,记录起始发酵时间并观察产生气泡的现象。
2 结果与分析
2.1 发酵力比较
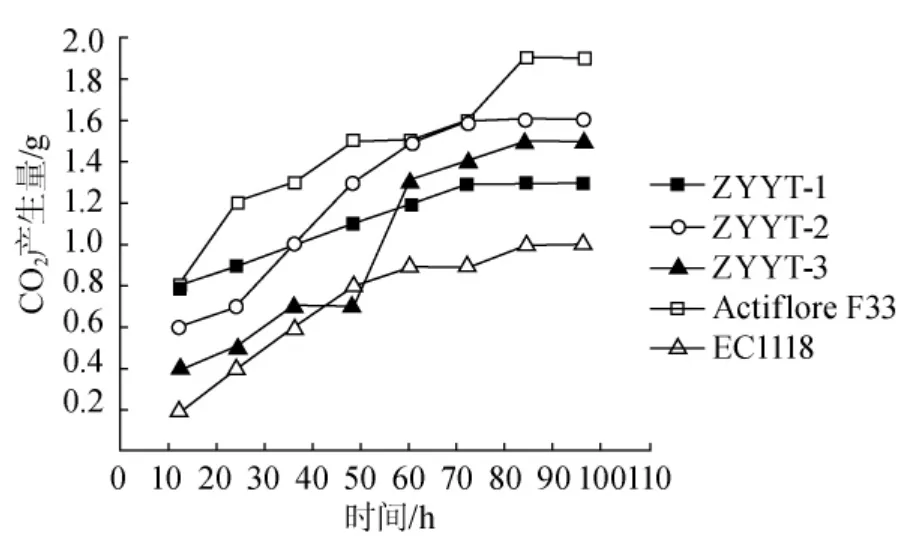
图1 酿酒酵母的发酵力Fig.1 The fermenting power ofSaccharomyces cerevisiae
酿酒酵母发酵力测定结果见图1。在接种后的24h内,所有菌株均能快速启动发酵。3株本土酵母菌中,尽管YTZY-2菌株前期启动发酵能力略低于YTZY-1,但是其总体发酵产气量均高于YTZY-1和YTZY-3。从筛选的本土酿酒酵母与商品化酵母的发酵力比较看,3株本土酵母的发酵能力低于Actiflore F33,但是高于EC1118,其中YTZY-2的发酵产气量与Actiflore F33非常接近,故YTZY-2是实际酿酒应用的潜力菌株。
2.2 产酒精能力与残糖量结果分析
从图2可以看出,产酒精能力依次为YTZY-2>YTZY-1>EC1118>Actiflore F33>YTZY-3,YTZY-2和YTZY-1具有高产酒精能力,甚至高于商品化酵母EC1118和Actiflore F33。发酵液中的残糖量可以反映酵母对糖的转化利用能力,如果初始含糖量相同,发酵结束后残糖量低,说明酵母对糖的转化利用率高,则说明发酵能力强[16]。由图3可以看出,与产酒精能力对应的,发酵结束后YTZY-2菌株的残糖含量最低,甚至低于商品化酵母的发酵残糖量,表明菌株利用糖类的能力较强,发酵较为彻底。
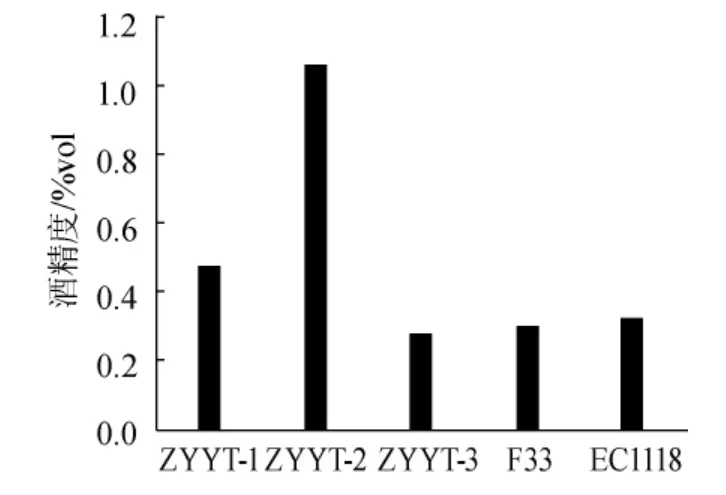
图2 酿酒酵母产酒精能力Fig.2 The producing ability of alcohol bySaccharomyces cerevisiae
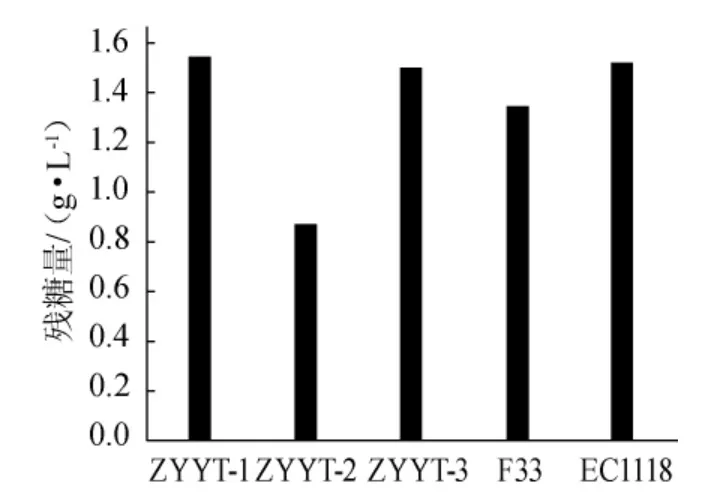
图3 酿酒酵母的发酵残糖量Fig.3 Residual sugar content after 48h fermentaion bySaccharomyces cerevisiae
2.3 发酵后总酸量
总酸含量用来判定酵母产酸能力,酸类物质虽不是酒类的香气成分,但其是主要的呈味物质。从图4可以看出,产酸能力依次为YTZY-3>YTZY-1>EC1118>YTZY-2>Actiflore F33,其中YTZY-2菌株产酸量与商品化酵母EC1118和Actiflore F33基本处于同一水平。酸类物质虽然是主要的呈味物质,但是过高或过低均影响口感,酸含量需适中,否则将影响酒类的色、香、味[3]。综上分析,初步判定筛选的酿酒酵母YTZY-2具有生产特色葡萄酒的潜力。
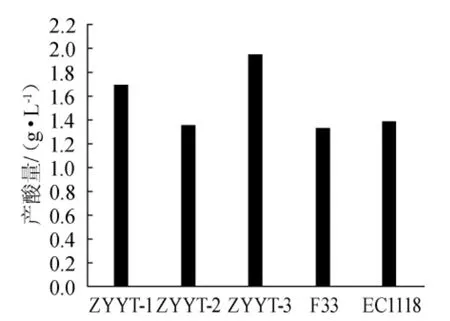
图4 酿酒酵母的发酵产酸量Fig.4 Produced acid content bySaccharomyces cerevisiae
2.4 耐受酒精能力
酿酒酵母耐受酒精能力的结果见表1。商品化酵母EC1118和F33以及本土酵母YTZY-2均具有较好的酒精耐受力,其中EC1118在酒精度为18%vol时仍能继续发酵,而YTZY-1和YTZY-3的耐受酒精能力较差。工业化葡萄酒酿造过程中酒精度一般为12%vol,YTZY-2、EC1118和F33在酒精度为12%vol时仍能够持续发酵,具有较好酒精耐受能力。YTZY-2可以耐受的酒精度为16%vol。

表1 酿酒酵母对酒精浓度的耐受力Table 1 Alcohol tolerance ofSaccharomyces cerevisiae
2.5 耐受SO2能力
由表2可以看出,供试酵母耐受SO2能力大小为Actiflore F33>EC1118>YTZY-2>YTZY-3>YTZY-1,Actiflore F33在SO2浓度为200mg/L时仍能持续发酵,而YTZY-1耐受SO2能力较差。一般SO2在葡萄汁中添加量为一般为60mg/L即可起到较好的抑制杂菌效果,YTZY-2在SO2浓度为60mg/L时可以较好的发酵,可以耐受的SO2浓度为150mg/L,可以用于葡萄酒实际生产中。

表2 酿酒酵母耐受SO2 的能力Table 2 SO2 tolerance ofSaccharomyces cerevisiae
2.6 耐酸能力

表3 酿酒酵母的耐酸能力Table 3 Acid tolerance of Saccharomyces cerevisiae
由表3可以看出,供试酵母耐受酸能力大小为Actiflore F33>EC1118>YTZY-2>YTZY-3>YTZY-1,Actiflore F33在柠檬酸质量浓度为3%时仍能持续发酵,而YTZY-1和YTZY-3耐酸能力较差。YTZY-2可以耐受柠檬酸质量浓度为2.5%。
3 结论
通过烟台白玉霓葡萄种植园筛选的本土酿酒酵母与商品化活性干酵母的发酵特性比较研究,确定菌株YTZY-2的发酵力和产酒精能力较强,产酸量适中,具有较强的工业化应用潜力,而YTZY-1和YTZY-3的发酵效果欠佳。菌株耐受性比较研究表明,本土葡萄酒酵母YTZY-2具有一定的耐受酒精度、SO2和酸度能力,能够在工业发酵条件下正常发酵。有关YTZY-2菌株的葡萄汁实际发酵效果评价正在进行中。
[1]RASPOR P,MILEK DM,POLANC J,et al.Yeasts isolated from three varieties of grapes cultivated in different locations of the Dolenjska vinegrowing region,Slovenia[J].Int J Food Microbiol,2006,109:97-102.
[2]LI X,CHAN LJ,YU B,et al.Fermentation of three varieties of mango juices with a mixture ofSaccharomyces cerevisiaeandWilliopsis saturnusvar.mrakii[J].Int J Food Microbiol,2012,158(1):28-35.
[3]王 红,刘天明,刘思喜.天然优良葡萄酒酵母发酵特性研究[J].酿酒科技,2012,219(9):75-77.
[4]LV XC,HUANG XL,ZHANG W,et al.Yeast diversity of traditional alcohol fermentation starters for Hong Qu glutinous rice wine brewing,revealed by culture-dependent and culture-independent methods[J].Food Control,2013,34(1):183-190.
[5]KRAKOVA L,CHOVANOVA K,ZENISOVA K,et al.Yeast diversity investig ation of wine-related sample s from two different Slovakian wine-producing areas through a multistep procedure[J].LWT-Food Sci Technol,2012,46(2):406-411.
[6]CAPECE A,SIESTO G,LAGRECA VM,et al.Assessme nt of competition in wine fermentat ion amon g wildSaccharomyces cerevisiaestrains isolated from Sangiovese grapes in Tuscany region[J].LWT-Food Sci Technol,2013,54(2):485-492.
[7]郭志刚,刘天明,赵长增.甘肃天然优良酵母菌株的发酵特性评价[J].中国酿造,2008,27(11):19-22.
[8]STRINGINI M,COMITINI F,TACCARI M,et al.Yeast diversity during tapping and fermentation of palm wine from Cameroon[J].Food Microbiol,2009,26(4):415-420.
[9]CLAVIJO A,CALDERON IL,PANEQUE P.Diversity ofSaccharomycesand non-Saccharomycesyeasts in three red grape varieties cultured in theSerranía de Ronda(Spain)vine-growing region[J].Int J Food Microbiol,2010,143(3):241-245.
[10]汤晓宏,胡文效.葡萄酿酒酵母研究进展[J].中外葡萄与葡萄酒,2012(5):53-57.
[11]薛 波,韩 娜,侯 敏,等.7 株葡萄野生酵母菌的特性研究[J].中国酿造,2009,28(10):19-21.
[12]苑 伟,王学锋,刘延琳.优选酿酒酵母菌株发酵性能研究[J].中国酿造,2010,29(9):48-52.
[13]魏冬梅,张艳芳,张予林.利用比色法测定葡萄酒的酒精度[J].食品工业,2001(4):45-46.
[14]邵法都,梅朝勇,沈振新.用比色法测定啤酒中的酒精度[J].酿酒,1999,131(2):89-90.
[15]GB/T 15038-2006.葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2007.
[16]RUBEN DBG,MIRIAM OH,MONTSERRAT SI,et al.Interactions of phenolic and volatile compounds with yeast lees,commercial yeast derivatives and non toasted chips in model solutions and young red wines[J].Eur Food Res Technol,2012,234(2):231-244.
