坎地沙坦酯片的处方工艺研究
2012-04-17包汝泼
包汝泼,左 锋,陈 诚
(浙江省宁波市天衡制药有限公司,浙江 宁波 315201)
坎地沙坦酯是一种新型血管紧张素Ⅱ(AngⅡ)受体拮抗剂,可以选择性地阻断AngⅡ在人体组织中的作用,具有良好的降压效果,并对心衰也有明显治疗作用,目前在抗高血压市场上应用较广[1-2]。本试验采用原研厂家产品为参比制剂,通过筛选不同处方,考察不同制备工艺参数对杂质及溶出特性的影响,以获得质量稳定的产品。
1 仪器和试药
Agilent 1200型高效液相色谱仪(美国安捷伦公司);GL-5C型全自动干法制粒机(浙江明天机械有限公司);ZPS008型旋转压片机(上海天祥健台制药机械有限公司);GKZ快速整粒机(宁波市华拳机械有限公司);YPD-200C型片剂硬度仪(上海黄海药检仪器有限公司);RCZ-8M溶出试验仪(天津天大天发科技有限公司)和激光粒度仪(英国Malvern公司)。坎地沙坦酯及有关物质A,B,E(宁波市天衡制药有限公司);参比制剂必洛斯(天津武田药品有限公司,批号为020B);乳糖(荷兰DMV国际有限公司);玉米淀粉(法国罗盖特公司);硬脂酸镁(安徽山河辅料有限公司);羧甲基纤维素钙(日本五德药业);聚乙二醇(PEG6000,三洋化成工业株式会社);柠檬酸三乙酯(蚌埠丰原医药科技发展有限公司);甘油(浙江万联药业有限公司);微晶纤维素PH-101(日本旭化成株式会社);乙腈等试剂为色谱纯。
2 方法与结果
2.1 含量及有关物质测定方法[3]
色谱条件:色谱柱为diamonsil ODS柱(250 mm×4.6 mm,5 μm);以乙腈-水-乙酸(57∶43∶1)为流动相A,以乙腈-水-乙酸(90∶10∶1)为流动相B,流动相梯度洗脱程序见表1;检测波长254 nm;流速1.0 mL/min;柱温30℃;进样量10 μL;理论板数按主峰计不低于2 000,主峰与相邻杂质峰的分离度大于1.5。上述色谱条件下,各辅料对主峰检测无干扰,主峰峰形良好,保留时间约为19.8 min。主药质量浓度在5.0~200.0 μg/mL范围内与峰面积线性关系良好,日间和日内RSD均小于0.5%,回收率为98.3%~100.2%。
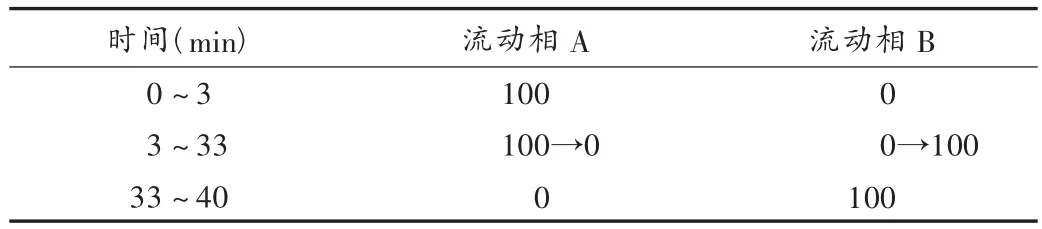
表1 梯度洗脱条件
样品溶液制备与测定:精密称取坎地沙坦酯和杂质对照品各25 mg,置于50 mL容量瓶中,加入乙腈适量试溶解并稀释至刻度,摇匀,精密量取1 mL,置100 mL容量瓶中,加入乙腈-水(3∶2)稀释至刻度作为对照品溶液。另精密称取坎地沙坦酯片细粉适量(约相当于坎地沙坦西酯10.0 mg),置于100 mL容量瓶中,加入乙腈-水(3∶2)适量,超声处理 10 min,并稀释至刻度,摇匀,12 000 r/min转速离心10 min,取上清液作为供试品溶液,精密量取对照品溶液和供试品溶液10 μL,分别注入液相色谱仪。
2.2 溶出曲线测定及相似因子f2计算[4]
参考美国食品和药物管理局溶出数据库,用桨法进行溶出曲线测定,具体试验条件,溶出介质为0.35%吐温20的0.05 mol/L磷酸盐缓冲液(pH=6.8),体积为900 mL,温度为(37±0.5)℃,转速为 50 r/min。分别在 5,10,15,20,30,45 min 时取样,样品溶液经过0.45 μm微孔滤膜过滤,移取一定体积,采用高效液相色谱法测定药物的浓度,计算出药物的溶出度。采用美国食品和药物管理局推荐的相似因子f2比较自研制剂和参比制剂溶出曲线的匹配程度。相似因子f2计算公式,f2=50×log{[1+1/n×Σ(Rt-Tt)2]-1/2×100}。其中Rt和Tt分别表示自研制剂与参比制剂在第n个取样点时的平均累积溶出度,f2大于50,可认为是溶出匹配,f2越大,匹配程度越好。
2.3 处方筛选
根据预试验发现坎地沙坦酯本身不稳定,在压片和贮藏过程中会分解,造成杂质易升高,添加一些低熔点的油性物质有助于其稳定,本试验选择3种油性物质组成不同处方,具体处方见表2。按表2称取相应的原辅料,将油性物质先与坎地沙坦酯及部分乳糖混匀,过45目筛,再与除羧甲基纤维素钙和硬脂酸镁的其他辅料混匀,用干法制粒机制粒,过30目筛整粒,外加羧甲基纤维素钙和硬脂酸镁混合,压片,将片剂分别用铝袋包装后放置在高温高湿条件[60℃,RH(90 ±5)%]下,于 0,5,10 d 取样,按 2.1 项下检测含量及有关物质,统计含量及总杂的变化,结果见表3。从表3可见,相对不加油性物质的处方4,PEG6000、柠檬酸三乙酯和甘油的加入可提高坎地沙坦酯的稳定性,其中含PEG6000的处方在高温、高湿条件下有关物质增幅最低,含量没有明显下降,与原研参比制剂稳定性相似。因此,以下处方采用含PEG6000的处方。
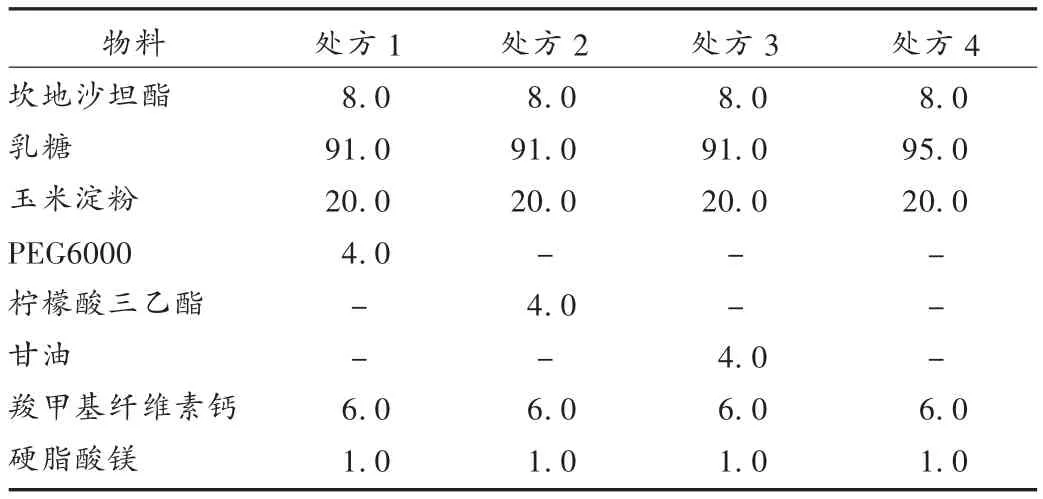
表2 处方组成
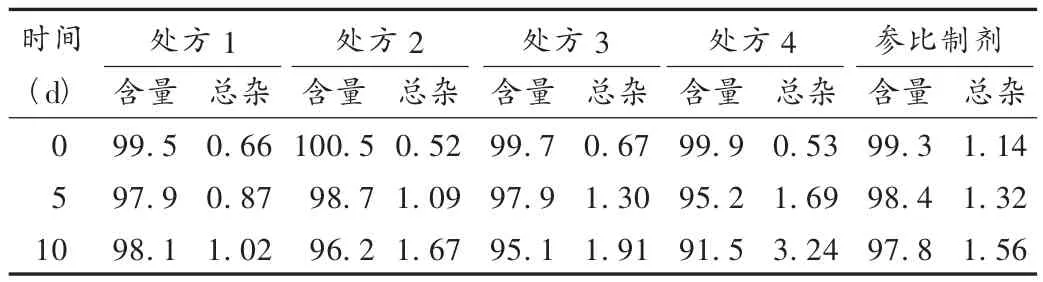
表3 影响因素条件下含量及杂质变化(%)
2.4 处方工艺优化
在预试验时,发现羧甲基纤维素钙单片用量、原料粒径和片剂硬度对溶出影响比较大,原料粒径系采用Malvern scirocco 2000型激光子粒度仪检测所得。采用L9(34)正交设计法进行试验,考察因素及水平设置见表4,片剂处方以2.3项下的处方1为基础,因羧甲基纤维素钙用量调整导致片重不足时以乳糖填充,采用2.3项下工艺,制成片剂后按2.2项下测定溶出曲线并计算f2值。结果见表5和表6。从表6可知,因素A与因素B对片剂的溶出特性有显著的影响,主要原因是坎地沙坦酯在水及缓冲液中溶解度比较低,原料粒径及崩解剂用量的变化对药物崩解溶出影响比较敏感,考虑到原料粒径是一范围,根据补充试验发现原料粒径在1 μm≤D(V,0.9)≤15 μm之间对溶出曲线相似因子f2影响不明显。综合表5、表6得出最终确定最佳处方工艺参数,即原料粒径在1 μm≤D(V,0.9)≤15 μm之间,羧甲基纤维素钙单片用量为6 mg,片剂硬度为50 N。
2.5 验证试验
按2.4项下筛选出的最佳处方工艺制备3批坎地沙坦酯片(批号分别为111201,111202,111203),测定3批样品的溶出曲线,结果见表7,根据f2计算原则取小于30 min的5个点的累积溶出度计算f2值,与参比制剂比较,3批自研片的f2值分别为64,62,78,根据相似性判定,自研片和参比制剂的溶出行为一致。

表4 因素水平表

表5 正交试验方案及结果
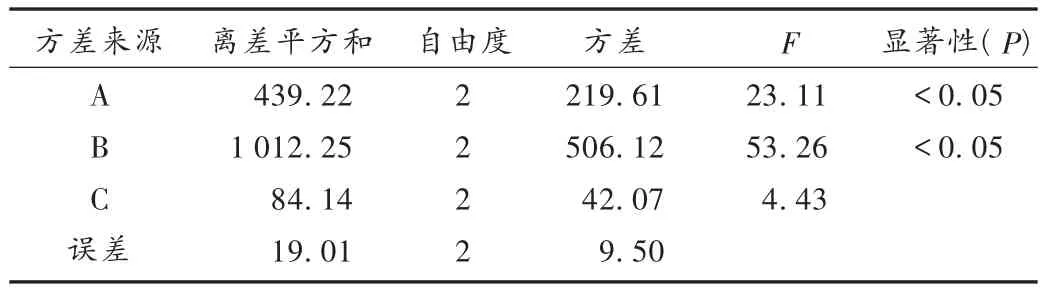
表6 方差分析结果
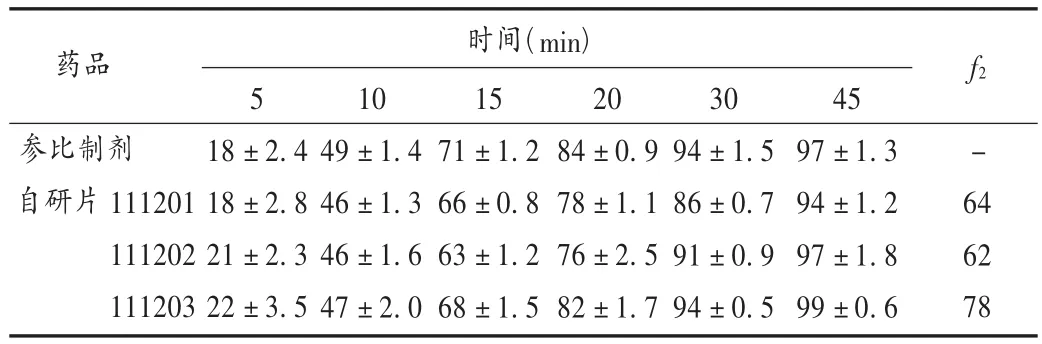
表7 自研片和参比制剂的累积溶出率(%,n=6)
3 讨论
目前,口服固体制剂研发要求仿制药与参比制剂在多种介质中溶出行为一致,本试验筛选出的处方工艺在标准介质pH=6.8磷酸盐缓冲液溶出曲线匹配好,但仍需进一步研究在pH=4.5醋酸缓冲液和pH=1.0盐酸中的匹配性。
本试验利用影响因素试验筛选合适的辅料时,没有按照《化学药物稳定性研究技术指导原则》中对温度、湿度、光线等的要求来做,而是选择比较剧烈的高温、高湿条件,主要考虑初步筛选处方时这样既能节省一定的资源,又能放大原辅料之间的相互影响,在基本确定处方工艺后,再细致地按照相关规定进行研究。
[1]杨 纲.坎地沙坦的临床研究[J].国外医药,2000,20(1):39-41.
[2]Easthope SE,Jarvis B.Candesartan cilexetil:an update of its use in essential hypertension[J].Drugs,2002,62(8):1 253-1 287.
[3]EDQM.European Pharmacopeia 7.3[M].Liguge:Aubin,2012:3 906-3 908.
[4]夏锦辉,刘昌孝.固体药物制剂的体外溶出度的统计学评价分析[J].中国药学杂志,2000,35(2):130-131.
