三七渣固态发酵生产生防菌绿色木霉的初步研究
2012-04-13王君君谭显东羊依金杨如勇
王君君,谭显东*,羊依金,杨如勇,孙 楠
(成都信息工程学院 资源环境学院,四川 成都 610225)
目前,木霉在生防上的应用主要为孢子制剂,木霉制剂可以用于叶面喷洒,种子处理,还可以使用到土壤中,对作物根系、种子以及幼苗都起到保护作用[1]。绿色木霉(Trichodermaviride)是一种重要的生防菌,主要是通过竞争、重寄生、产生抗生素、诱导抗性、溶菌、植物促生等多种机制实现对病原真菌的拮抗作用[2]。作为生防剂的木霉菌生产方法所采用的培养基大多以粮食为主[3-4],生产成本较高,限制了其大范围的应用。为了在低成本的前提下获得高的产孢量,许多研究者摸索了各种培养条件。其中包括用玉米粉[5]、植物秸秆和麦麸等进行液态和固体发酵培养[6]。中成药在生产加工过程中会产生大量的药渣,如果长期堆置不处理极易腐坏,其味臭难闻,在夏季更为严重,对环境也造成了极大的污染。中药渣中含有大量的淀粉、多糖、粗脂肪、粗蛋白、粗纤维及大量的氨基酸、维生素和微量元素[7]。将中药渣作为发酵基质使用,不仅能变废为宝,提高植物资源的利用率,而且对消除环境污染也具有重要的意义。本试验以三七渣为培养基质,通过单因素和正交试验筛选出最佳的固态发酵培养基,为三七渣大规模固态发酵生产绿色木霉提供参数。
1 材料和方法
1.1 材料
菌种:绿色木霉3.3711菌株由四川大学建筑与环境学院保藏和提供。
三七渣:取自成都某制药厂,湿物料经烘干、粉碎、过筛后置于干燥器中备用。
PDA培养基:马铃薯浸取液1.0L,葡萄糖20.0g,琼脂20.0g,pH值自然,121℃灭菌30min,用于绿色木霉的培养。
1.2 方法
1.2.1 菌种活化
将灭菌的PDA培养基冷却至45℃,倒入灭菌后的培养皿中,冷却至室温后接种绿色木霉,30℃培养3d。
1.2.2 发酵方法及产孢量测定
三七渣10g含水量60%搅拌均匀,装入250mL三角瓶中封口灭菌,活化后的绿色木霉菌株用无菌水配制成孢子悬浮液(2×107cfu/mL)。将孢悬液接入三七渣培养基中,30℃下培养5d。发酵后取1g发酵物,0.1%吐温水稀释,在磁力搅拌器上充分搅拌,血球计数板测定孢子浓度[8]。
初始含水量计算公式:

注:M1为三七渣质量,g;M2为加营养液后的总质量,g。
1.2.3 固态发酵培养基的单因素试验
分别考察氮源添加量、pH值、粒径、磷酸盐添加量、含水量、麸皮添加量对产孢量的影响。
1.2.4 发酵条件的优化试验
以产孢量为考察指标,取氮源添加量、含水量、磷酸盐添加量3个因素,每因素设3个水平。
1.2.5 统计分析
试验数据采用SPSS17.0软件进行统计分析。
2 结果与分析
2.1 单因素实验结果分析
2.1.1 氮源添加量对产孢量的影响
氮是合成蛋白质的重要元素,是微生物细胞生长和代谢的重要成分,三七渣中氮源相对缺乏,碳氮比不能满足微生物生长的需求,所以需要适当的补充氮源。由图1可见,适当添加氮源能增加产孢量。在氮源添加2%时产孢量最高,氮源添加过高或过低都对产孢不利;氮源不足时,碳氮比失调,菌体生长繁殖缓慢,不利于产孢;氮源过高时,不仅会造成氮源浪费,而且会抑制微生物的生长。
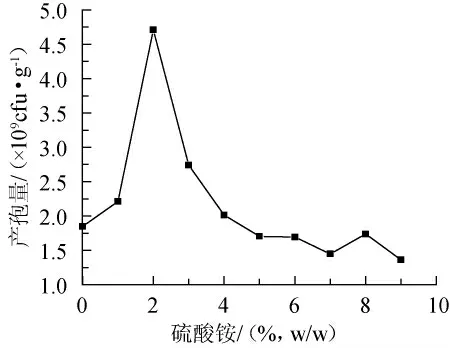
图1 氮源添加量对产孢量的影响Fig.1 Effect of addition of nitrogen source on sporulation quantity
2.1.2 初始pH值对产孢量的影响
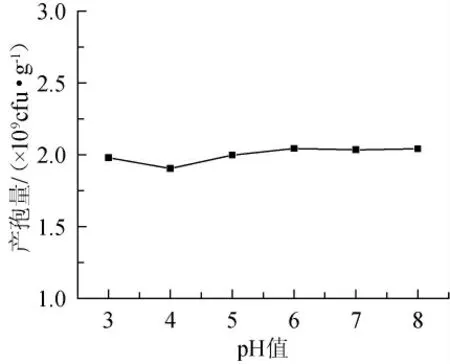
图2 初始pH值对产孢量的影响Fig.2 Effect of initial pH value on sporulation quantity
大多营养物质的吸收与H+存在协同运输作用[9],所以菌种需要在适宜的pH值范围内才能较好的生长。有研究表明多数真菌对环境pH值不是很敏感,一般在3~9都能很好的生长[10],略偏酸性环境适宜木霉的生长,当pH值过高或过低时,木霉生物量才有所降低[11]。由图2可见,发酵培养基初始pH值在3~8时,绿色木霉产孢量变化不大,尤其pH值为5~8时,产孢量基本不变。分析其原因可能是绿色木霉在发酵过程中产生一些代谢物来调节其生长环境的pH值;同时三七渣本身也具有一定的缓冲能力。三七渣培养基自然pH值为6左右,故后续试验中将采取自然pH值。
2.1.3 原料粒径对产孢量的影响

图3 原料粒径对产孢量的影响Fig.3 Effect of particle size of raw materials on sporulation quantity
由图3可见,原料粒径在100目时发酵效果较好,随着粒径的减小产孢量降低。因为粒径太小容易造成发酵底物的积团,颗粒间空隙减小,导致阻力增大,不利于系统的传热、传质,进而影响微生物的呼吸,使其不能良好的生长[12]。
2.1.4 磷酸盐添加量对产孢量的影响
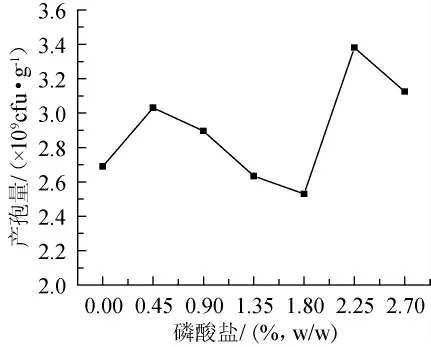
图4 磷酸盐添加量对产孢量的影响Fig.4 Effect of addition of phosphate on sporulation quantity
磷是构成菌体核酸、核蛋白等细胞物质的重要组成成分,也是很多辅酶和高能磷酸键的构成成分[13],同时又是氧化磷酸化反应的必需元素,钾在酶反应中作为激活剂或辅助因子[14],因此,磷和钾的添加对微生物的生长有很大的影响,磷酸盐对菌体的基础代谢及代谢产物的合成有促进作用,其中磷酸二氢钾、磷酸氢二钾这两种磷酸盐既是良好的磷源和钾源[15],又是重要的缓冲剂[13]。在固体培养基中添加一定量的磷酸二氢钾和磷酸氢二钾,2种磷酸盐的比例为5:4,考察其对产孢量的影响,由图4可见,磷酸盐在0.45%和2.25%时都出现峰值,王永东等[15]研究也出现这种现象。研究结果表明,磷酸盐添加2.25%时绿色木霉产孢量最大。
2.1.5 含水量对产孢量的影响
由图5可见,当含水量为70%时产孢量最高。在最适含水量下,培养基疏松度较好,培养基的颗粒之间存在合适的空隙,利于氧气的溶入和二氧化碳的排出,有利于菌体生长繁殖,从而增加产孢量;当含水量过低时,不能保持菌体的生长特性,引起细胞新陈代谢不平衡,影响产孢量;当含水量过高时,物料易结块成团,多孔性降低,减少了物料内的气体交换[13],菌丝只在基质表面生长,培养基的透气性大大降低,难以通风和散热,也不利于微生物的生长,同时观察发酵底物内部,散发出一种腐败味。
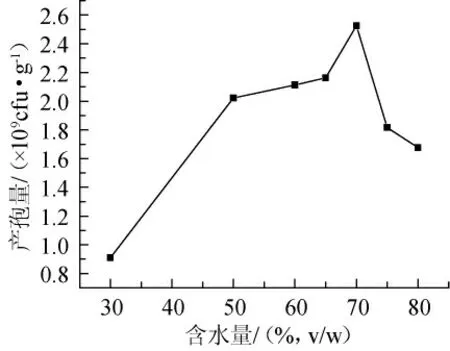
图5 含水量对产孢量的影响Fig.5 Effect of moisture content on sporulation quantity
2.1.6 麸皮添加量对产孢量的影响

图6 麸皮添加量对产孢量的影响Fig.6 Effect of addition of bran on sporulation quantity
麸皮中含有一定量的蛋白质、脂肪、碳水化合物、维生素和无机盐,可以促进微生物生长和繁殖,同时麸皮质地疏松能增大底物的间隙率,有利于传质、传热,对微生物的通气和呼吸有促进作用[16]。由图6可见,随着麸皮添加量的增大,产孢量也逐步提高,麸皮在固态发酵过程中起到明显的促进作用;但从相对增加孢子量来看,麸皮添加10%时相对增加的孢子量最大,而且过多的添加麸皮会对主原料的研究意义降低,因此选择10%的麸皮添加量。
2.2 三七渣固态发酵条件的优化
通过对单因素培养基组分的筛选,氮源添加量、含水量、磷酸盐添加量3个因素对三七渣固态发酵生产绿色木霉的产孢量影响较大,本研究采用L9(33)正交试验对培养基制备条件进行优化,正交试验因素水平见表1,正交试验结果与方差分析分别见表2和表3。
方差分析结果表明,氮源添加量、含水量以及所考察的3个因素之间的交互作用对试验结果的影响极显著(p<0.01),磷酸盐添加量对试验结果的影响显著(p<0.05),由于所考察的3个因素之间的交互作用显著,需要进行多重比较才能获得最优的试验条件搭配。正交试验结果的多重比较分析见表4。

表1 发酵条件优化正交试验因素水平Table 1 Levels and factors of orthogonal test of fermentation condition optimization
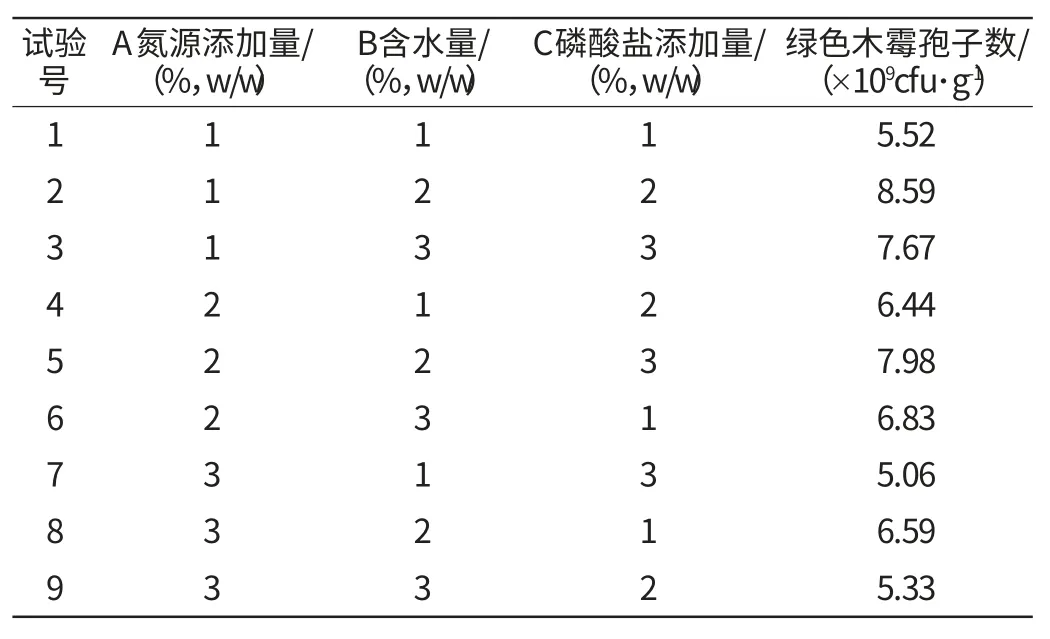
表2 发酵条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal test of fermentation conditions optimization
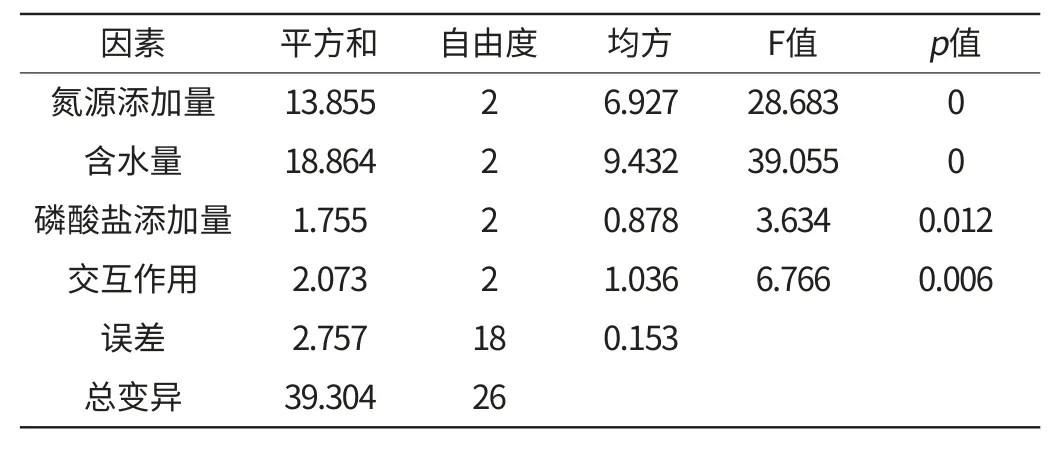
表3 正交试验方差分析Table 3 Variance analysis of orthogonal test

表4 正交试验多重比较Table 4 Multiple comparation of orthogonal test
由表4可以看出,2号试验和5号试验的结果没有显著差异,其试验结果显著优于其他试验。2号实验的结果略好于5号试验,因此,在所考察的3个试验因素中,最佳的搭配是A1B2C2,即硫酸铵添加量为1%,含水量为60%,磷酸盐添加量为1.35%。在此条件下,绿色木霉的产孢量为8.59×109cfu/g。据报道,木霉孢子制剂的孢子浓度达到105cfu/g时,对一些植物真菌病害有明显的防治效果[17],而本研究所获得的三七渣固态发酵培养物中绿色木霉孢子浓度可达到109cfu/g,因此,该产品具有较高的生产应用价值。
3 结论
以三七渣为原料固态发酵生产生防菌绿色木霉是可行的,其优化的培养基制备条件为麸皮添加量为10%,硫酸铵添加量为1%,含水量为60%,磷酸盐添加量为1.35%,原料粒径100目,pH值自然。在此条件下发酵,绿色木霉产孢量可达到8.59×109cfu/g。
[1]HARMANGE,TAYLOY A G,STASZ T E.Combining effectivestrains ofTrichoderma harzianumand solid matrix priming to improve biological seed treatments[J].Plant Dis,1989,73(8):631-637.
[2]屈海泳,刘连妹,王雪梅.木霉菌在生物防治上应用的研究进展[J].湖北农业科学,2009(3):743-746.
[3]王汉荣,茹水江,王连平.木霉属真菌生防颗粒菌剂及其制备方法[P].中国,CN1554242A,2004.
[4]王宽仓,查仙芳,等.用于植物土传性病根防治的木霉菌菌株及其发酵、粉粒剂制备工艺[P].中国,CN1422946A,2003.
[5]刘时轮,李 勇,傅俊范,等.绿色木霉菌株Tv04-2固体发酵条件研究[J].华北农学报,2008(S2):244-247.
[6]张 良,纪明山,张玉芬,等.绿色木霉TR-8发酵工艺条件筛选[J].沈阳农业大学学报,2005(4):494-496.
[7]马逊风,马宏军,唐占辉,等.中药渣剩余成分分析及利用途径研究[J].东北师大学报:自然科学版,2004(2):108-111.
[8]陈 欣,李 寅,堵国成,等.应用响应面方法优化Coniothyrium minitans固态发酵生产生物农药[J].工业微生物,2004(1):26-29.
[9]刘 梅,徐 同.木霉的营养生长及发酵条件[J].云南农业大学学报,2000,15(3):263-268,278.
[10]陈洪章.纤维素生物技术[M].北京:化学工业出版社,2005.
[11]于敏敏,王守娟,刘 鹏,等.木霉T68发酵基质的研究[J].中国酿造,2011(3):31-35.
[12]刘凤梅,谭显东,羊依金,等.三七渣固态发酵生产蛋白饲料[J].中国酿造,2011,227(2):67-70.
[13]张福元,陈风风.混菌发酵酒糟饲料的初步研究[J].饲料研究,2008(11):32-34.
[14]杨振海,蔡辉益.饲料添加剂安全使用规范[M].北京:中国农业出版社,2004.
[15]王永东,蒋立科,岳永德,等.生防菌株哈茨木霉H-13固体发酵条件的研究[J].浙江大学学报:农业与生命科学版,2006,32(6):645-650.
[16]朱 辉,娄沂春,林福呈,等.利用城市垃圾发酵生产绿色木霉孢子[J].微生物学通报,1999(6):387-389.
[17]HARMAN G E,CHET I,BAKER R.Factors affectingTrichoderma hamatumapplied to seeds as a biocontrol agent[J].Phytopathology,1981,71:569-572.
