米曲霉A-1固体发酵产胞外高活性植酸酶工艺研究
2011-08-09覃拥灵何海燕
覃拥灵 何海燕
磷是动物体必需的常量元素,摄取不足会导致动物生产性能下降、酸碱失衡,严重者易患骨质疏松症或佝偻病。饲料是动物体磷的主要来源,植物是饲料的主要来源,植物中的磷大部分(60%~70%)以植酸磷的形式存在[1]。饲料中的磷可分为无机磷和有机磷,其中有机磷是以植酸磷的形式存在。植酸[6-磷酸肌醇,myo-inositol(1,2,3,4,5,6)hexakis phosphate],常存在于种子、谷物、胚芽、米糠中。植酸不以单独的游离态存在,与一些矿物元素钙、镁或钾的复盐(如肌醇六磷酸钙镁)和蛋白质以络合物形态广泛存在于植物中。因为其强螯合能力,影响其螯合的金属及蛋白质的吸收,被认为是抗营养因子(anti-nutritive factor)[2-3]。
植酸酶 (Phytases,myo-inositol hexakisphosphate phosphohydrolase;EC 3.1.3.8和EC 3.1.3.26),即肌醇六磷酸水解酶,是催化植酸及其植酸盐水解成肌醇与磷酸(或磷酸盐)一类酶的总称[1,4-5]。植酸的利用率因动物种类的不同而不同,反刍动物瘤胃中的微生物能产生植酸酶,对植酸磷的利用率比较高,成年反刍动物可高达90%[4]。单胃动物消化道中只有很少的植酸酶,且活性很低,所以不能很好地利用饲料中的植酸磷,使得植酸磷随粪便排入环境,既浪费资源,又污染环境。在饲料中添加植酸酶不仅可以解除植酸的抗营养作用,提高动物对饲料的利用率,还可以减少无机磷在饲料中的添加量,从而减少单胃动物对无机磷和植酸磷的排除量,最终减少磷对环境的污染[4-5]。植酸酶的主要来源于动物、植物和微生物,但是动物、植物中植酸酶活性很低,稳定性也比微生物来源的植酸酶差,因此目前研究都集中于微生物植酸酶[4]。
前期试验通过紫外诱变后得到一株酶活高遗传稳定性优良的高产植酸酶菌种——米曲霉(Aspergillus oryzae)A-1菌株,在饲料工业上有潜在应用价值[6]。本课题利用本地来源充足、价格低廉的农业副产品桑杆、蔗渣、棉籽壳、板栗壳作为培养基碳源开展固体发酵产植酸酶条件优化研究,同时研究表面活性剂诱导产胞外酶及酶提取工艺,提高固体发酵产植酸酶得率。
1 材料与方法
1.1 菌种
实验室选育的米曲霉(Asper gillusoryzae)A-1菌株[6]。
1.2 PDA斜面培养基
依照诸葛健(1994)[7]的方法配制。
1.3 菌种活化及种子培养
取已经活化的米曲霉A-1新鲜斜面种,在无菌超净工作台中将斜面种用生理盐水洗下制成孢子液,利用生理盐水配制成孢子含量为1×107个/ml的孢子液,取100 ml的孢子液置于250 ml三角瓶中,160 r/min恒温摇床30℃振荡培养12h,使孢子处于预萌发状态,备用接种。
1.4 固体发酵产酶培养基
①桑杆固体发酵培养基:6 g粉碎的桑杆、4 g麸皮;②蔗渣固体发酵培养基:6 g蔗渣、4 g麸皮;③板栗壳渣固体发酵培养基:6 g粉碎的板栗壳渣、4 g麸皮;④棉籽壳固体发酵培养基:6 g天然棉籽壳、4 g麸皮。
营养盐液:5 g NH4NO3、0.5 g KCl、0.5 g MgSO4·7H2O、0.3 g MnSO4·7H2O、0.3 g FeSO4·7H2O、0.2 g NaCl、0.5 g NH4Cl,溶于 1 000 ml蒸馏水中。
所有固体培养基材料均粉碎至100目(筛孔尺寸0.150 mm),以上4种固体发酵培养基均各加入30 ml营养盐液于250 ml锥形瓶中,自然pH值,121℃灭菌20 min。
1.5 不同时间固体发酵产酶及酶液的提取
取107个孢子转入4种固体发酵生产植酸酶培养基中,30℃培养,培养3~6 d后提取酶液。按10:1(v/m)加入dd H2O,40℃、200 r/min恒温摇床2 h,8层纱布过滤,4℃、5 000 r/min离心20 min,上清液即为粗酶液[8]。粗酶液4℃冰箱中保存,待测酶活时用。
3次平行试验,取平均值。
1.6 不同温度产酶研究
取米曲霉A-1菌株107个孢子转入4种固体发酵产植酸酶培养基中,将已接种的固体产酶培养基统一放到恒温培养箱中,30~50℃,每隔5℃一个梯度,培养适宜时间后提取酶液。
1.7 培养基初始pH值对产植酸酶的影响
调节培养基初始pH值为3~6,考察培养基初始pH值对产植酸酶的影响。
1.8 不同氮源对产酶的影响
以营养盐液中的不同氮源培养米曲霉:NH4Cl、NH4NO3、(NH4)2SO4、花生饼粉、黄豆饼粉、蛋白胨,试验方法同1.5。
1.9 表面活性剂对产酶的影响
固体培养基中添加0.2%~0.7%吐温80,研究表面活性剂吐温80对产酶的影响[9-10]。
1.10 酶液的提取优化
参照1.5提取法,添加2%不同盐液[9]:CaCl2·2H2O、CaCO3、CaSO4·2H2O、KCl,优化酶液提取工艺。
1.11 植酸酶的酶活检测方法[11-13]
采用2009年制定的中华人民共和国国家标准:饲用植酸酶活性的测定——分光光度法进行测定,酶活力单位定义:样品在植酸钠浓度为 5.0 mmol/l,温度37℃,pH值5.5的条件下,每分钟从植酸钠中释放出1 μmol无机磷,即为1个酶活单位,以 U表示。
2 结果与分析
2.1 不同固体碳源及不同时间产植酸酶研究
向4种固体产酶培养基中接入米曲霉孢子悬液1 ml(107个孢子),于30℃恒温培养箱中培养。每隔1 d按照以上的酶液提取方法定期取出一定量酶液,测其酶活(见表1)。试验结果表明,第4 d所产的植酸酶酶活最高,推测米曲霉产植酸酶应该为与生长无相关型发酵,产物在菌种生长稳定期合成,时间过长营养供应不足,菌体死亡后自溶活性降低,最适发酵时间为4 d。
试验结果表明,桑杆、蔗渣、板栗壳、天然棉籽壳均可以固体发酵产植酸酶,第4 d酶活最高,其中蔗渣为碳源的培养基植酸酶活性较高,活力为71.2 U/g,以下固体发酵试验优化选用蔗渣为碳源。
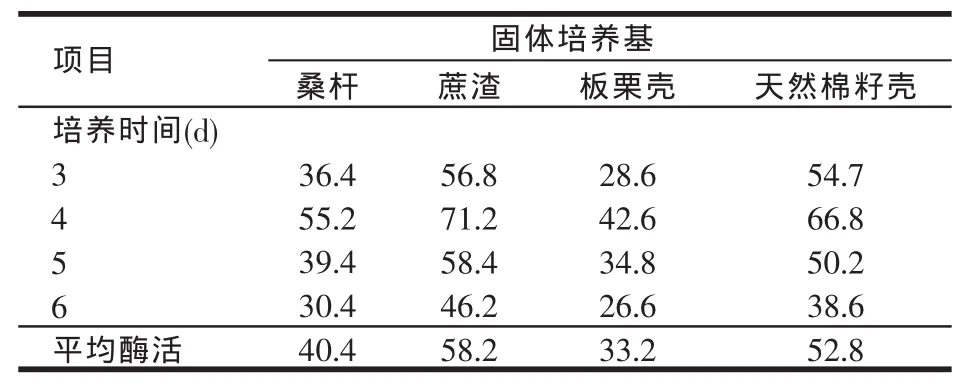
表1 固体碳源和培养时间对产植酸酶酶活的影响(U/g)
2.2 培养基初始pH值对产植酸酶的影响(见图1)
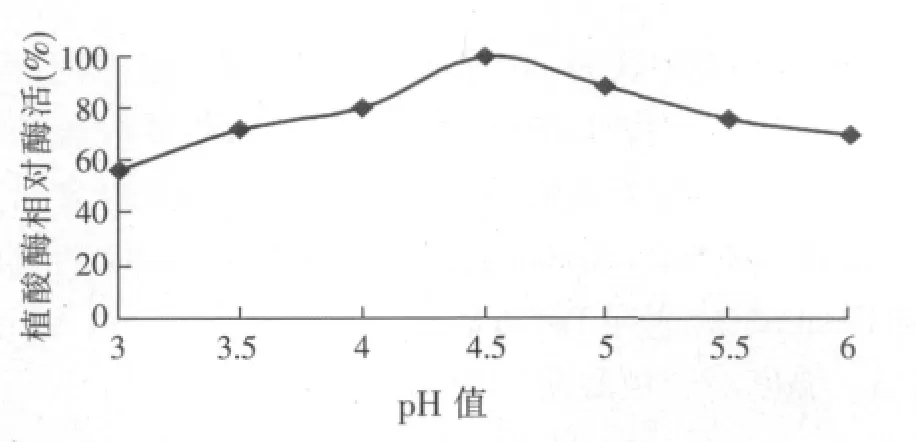
图1 pH值对产植酸酶的影响
30℃,不同pH值培养4 d。培养基最佳初始pH值产酶酶活最高,设该pH值条件下酶活为100%,测定不同初始pH值条件下产酶的相对酶活作图。测定蔗渣天然固体培养基pH值为6,试验结果显示,pH值为4.5时,米曲霉A1菌株所产的植酸酶酶活最高,比天然培养基提高20%,达到85.4 U/g。pH值是微生物代谢的综合反映,由试验结果推测,pH值4.5为酶的最适pH值;pH值4.5影响米曲霉A1细胞膜所带电荷发生改变,从而改变细胞膜的通透性,促进植酸酶排出细胞外,提高整体酶活。
2.3 氮源对产植酸酶的影响(见图2)

图2 不同氮源对产植酸酶的影响
氯化铵等6种氮源被用于固体发酵产植酸酶,30℃培养4 d。设氯化铵为氮源时酶活为100%,以不同氮源与相对酶活作图。由图2可知,花生饼粉、黄豆饼粉、蛋白胨这些有机氮源产酶相对较低,硝酸铵可以明显提高产酶能力,比氯化铵为氮源提高32%,达到112.8 U/g,以下试验选用硝酸铵为氮源。
2.4 吐温80对产胞外植酸酶的影响(见图3)
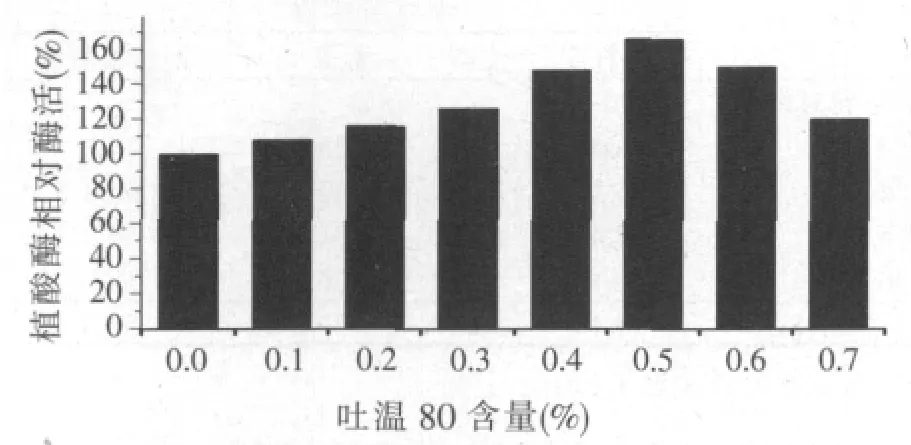
图3 吐温80对产植酸酶的影响
Ebune等[8]认为,吐温80可以刺激微生物生长,合成更多植酸酶[10],同时,吐温80可以明显改善细胞渗透性,诱导胞外植酸酶的生产[11]。当吐温80含量为培养基的0.5%(w/w)时,酶活比未添加吐温80的对照组增加66%,达到187.2 U/g。
2.5 温度对产植酸酶的影响(见图4)
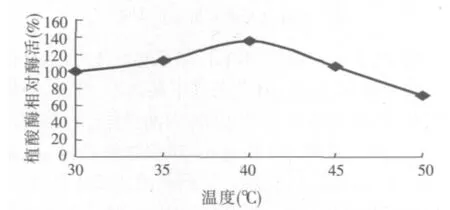
图4 温度对产植酸酶的影响
温度是发酵过程一个很重要的影响因子,较高的温度可以加速微生物体内生物化学反应过程,提高催化合成植酸酶的酶活性。由图4可知,当培养温度为40℃时,酶活比30℃培养温度提高36%,为254.6 U/g。但过高的温度影响微生物的生长,产酶能力下降。
2.6 酶液的提取优化(见表2)
与不添加盐液的空白对照组(H2O)相比,添加2%不同盐液 CaCl2·2H2O、CaCO3、CaSO4·2H2O、KCl,可以提高固体发酵产植酸酶得率,推测这些盐液可以改变细胞通透性,利于胞内植酸酶排出,其中添加CaCl2·2H2O植酸酶得率最高,相对酶活比空白对照试验增加32%,酶活达到336 U/g。
3 结论
以实验室保存的米曲霉A1菌种为出发菌株,研究4种固体培养基发酵产植酸酶,结果表明,蔗渣所产植酸酶活性最高,以NH4NO3为氮源,添加0.5%表面活性剂吐温80可以诱导产胞外植酸酶,CaCl2·2H2O更利于酶的提取,40℃培养4d,酶活达到336U/g。
蔗渣以纤维素及半纤维素为主要成分,纤维素含量达45%~50%,半纤维素22%~30%,表皮组织的木质素含量约占19%~23%。蔗渣的木质素分子质量和聚合度低,含丰富的多糖类物质。甘蔗渣是我国甘蔗糖厂数量最大的纤维残渣副产物,年产量约为2 200万吨左右。蔗渣来源丰富、价格低廉[14],简单粉碎处理就可以作为固体碳源。本试验对培养基的氮源、培养温度和pH值等进行发酵条件优化,进一步提高了米曲霉固体发酵产植酸酶的得率和酶活,将会产生可观的效益。
[1]Lei X G,Porres J M.P hytase enzymology,applications,and biotechnology[J].Biotechnol.Lett.,2003,25:1787-1794.
[2]Lei X,Pao K,Elwyn R M,et al.Supplemental microbial phytase improves bioavailability of dietary zinc to weanling pigs[J].Nutr.,1993,123:1117-1123.
[3]SharmaCB,GoelM.Myo-inositolhexaphosphateas potential inhibitor ofα-amylasesofdifferentorigins[J].Phytochemistry,1978,47:201-204.
[4]Mullaney E J,Daly C B,Ullah A H J.Advances in phytase research[J].Appl.Microbiol.,2000,47:56-61.
[5]谢英利,杨海龙,吴明江.植酸酶发酵生产的研究进展[J].饲料工业,2011,32(2):36-39.
[6]覃拥灵,何海燕.产植酸酶菌种的选育及发酵条件初步研究[J].广西轻工业,2011(8):14-16.
[7]诸葛健,玉祥业.微生物实验技术手册[M].北京:中国轻工业出版社,1994:367.
[8]Ebune A,S Al-Asheh,Z Duvnjak.Effects of phosphate,surfactants and glucose on phytase production and hydrolysis of phytic acid in canola meal by Aspergillus ficuum during solid state fermentation[J].Biores.Technol.,1995,54:241-247.
[9]Mandviwala T N,Khire J M.Production of high activity thermostable phytase from thermotolerantAspergillusnigerin solid state fermentation[J].Journal of Industrial Microbiology&Biotechnology,2000,24:237-243.
[10]Al-Asheh S,Duvnjak Z.The effect of surfactants on the phytase production and the reduction of the phytic acid content in canola meal by Aspergillus carbonarius during a solid state fermentation process[J].Biotechnology Letters,1994,16(2):183-188.
[11]张英.饲料中植酸酶活性检测方法的比较与研究[J].饲料工业,2010,31(22):54-57.
[12]刘志伟,黄玉亭,张铁鹰,等.国标法测定植酸酶活性存在问题的探讨[J].中国饲料,2006(18):29-31.
[13]中华人民共和国质量监督检验检疫总局.GB/T18634—2009饲用植酸酶活性的测定——分光光度法[S].北京:中国标准出版社,2009.
[14]王允圃,李积华,刘玉环,等.甘蔗渣综合利用技术的最新进展[J].中国农学通报,2010,26(16):370-375.
