Lgi1基因通过控制髓鞘装配和TSC1-mTORC1依赖的脂质生物合成促进外周神经系统髓鞘化
2024-01-26唐涣垚易如岚梁小玲冉啟鹏
唐涣垚,易如岚,2,梁小玲,王 旭,冉啟鹏,周 亮,3
(1.遵义医科大学 脑科学特色重点实验室,贵州 遵义 563099;2.遵义医科大学附属医院 麻醉科,贵州 遵义563099;3.遵义医科大学 贵州省麻醉与器官保护基础研究重点实验室,贵州 遵义 563099)
髓鞘为包绕于有髓神经纤维轴突外的脂质细胞膜,它由髓鞘生成细胞的膜构成。中枢神经系统(central nervous system,CNS)髓鞘形成细胞为少突胶质细胞而周围神经系统(peripheral nervous system ,PNS)则为施万细胞。髓鞘为维持神经系统正常生理功能所必需,外周脱髓鞘病变主要有炎症、遗传介导的罕见病及创伤和毒素接触引起外周髓鞘的直接损害,未得到及时救治可导致截肢和肾衰的严重恶果。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是mTOR信号通路中的核心角色,它根据多种生长因子、细胞能量状态和氨基酸水平调节细胞生长和代谢平衡。mTORC1可由结节性硬化症复合体(tuberous sclerosis complex, TSC)蛋白、Hamartin(TSC1)和Tuberin(TSC2)形成的GTPase激活异二聚体蛋白复合物所抑制。TSC严重影响CNS和PNS的神经元功能,导致认知障碍、癫痫、自闭症和白质异常。有研究表明在少突胶质前体细胞(oligodendrocyte progenitor cells, OPCs)中TSC1或TSC2的缺失会激活 mTORC1 从而导致髓鞘发育不全[1],但具体机制仍有待探索。富亮氨酸胶质瘤失活蛋白1 (leucine rich glioma inactivated 1, Lgi1)是一种神经元分泌的蛋白,对脑的发育、维持神经元兴奋性及突触传递起着至关重要的作用,并与神经系统疾病关系密切。Lgi1缺失可使大脑皮层中神经元无序分层[2]和降低胚胎期小脑外颗粒细胞层的厚度[3-4]。更重要的是,Lgi1已被证实与中枢神经系统髓鞘化以及少突胶质细胞分化有关[5]。另外,Lgi家族另一成员Lgi4作为PNS内施万细胞髓鞘化的启动器,其功能缺失可引起小鼠爪-爪表型(claw-paw phenotype, clp),这是由于PNS中髓鞘化不全所致[6]。此外,Lgi4与人解整合素金属蛋白酶22 (Monoclonal Antibody to A Disintegrin And Metalloprotease 22, ADAM22)相互作用加强了轴突与施万细胞的细胞间相互作用,是PNS的髓鞘化的关键[7-8]。既往研究显示Lgi1可在谷氨酸突触可塑性[8-12]和海马中谷氨酸的传递[13-14]过程中起调节作用。本课题组前期研究还发现,Lgi1能直接与Kv1.2结合参与大脑皮层锥体神经元动作电位的调节[15],然而目前对Lgi1和PNS髓鞘化关系的研究还很少,本文采用免疫组织化学、蛋白质印迹法和电镜等手段对它们的关系进行了研究,并对其可能信号通路进行了分析。
1 材料与方法
1.1 材料
1.1.1 实验动物 8~12周龄清洁级Lgi1+/-小鼠,体重20~25 g,Lgi1+/-小鼠由浙江大学沈颖教授提供,在遵义医科大学实验动物中心饲养。小鼠可自由活动、饮水、摄食,饲养房以12 h/12 h的明暗循环(08∶00 关灯,20∶00 开灯),环境温度维持在 20~24 ℃,相对湿度维持在60 %左右。
1.1.2 仪器与试剂 激光共聚焦荧光显微镜(日本奥林巴斯,FV1000);Ultracut UCT(德国,Leica);飞利浦CM100显微镜(美国,FEI);髓磷脂碱性蛋白(MBP)、髓磷脂少突胶质细胞糖蛋白(MOG)、髓鞘相关糖蛋白(MAG)、GAPDH抗体(美国Millipore公司);S6、pS6-S240/244、TSC1(美国Cell Signaling Technology公司);Lgi1、Lgi4、外周髓磷脂P0蛋白(MPZ)、整合素β1(β1-integrin)、脂肪酸合成酶(FASN,英国Abcam公司);整合素β4(β4-integrin)、筏蛋白(Flotillin,美国BD Biosciences公司);整合素α1(α1-integrin,美国Santa Cruz公司);层粘连蛋白抗体(Laminin,美国Sigma公司);HRP二抗(美国Thermo公司);Alexa Fluor二抗(美国Invitrogen公司);蛋白酶抑制剂(美国Roche公司)。
1.2 方法
1.2.1 免疫组织化学 (1)样本处理:分离出生后第14天(P14)Lgi1-/-小鼠的坐骨神经,使用4% PFA在4 ℃下进行固定处理,过夜后在30%蔗糖中脱水;(2)用OCT冷冻组织,进行10 μm切片;将脑片置于封闭液(10%山羊血清、1% BSA和0.3% Triton溶于PBS)中,室温静置2 h,用一抗孵育过夜(MBP为1∶1 000;MPZ为1∶200;Laminin为1∶100),洗涤3次后用二抗孵育2 h;(3)共聚焦显微镜分析:在激光共聚焦荧光显微镜上拍摄,随后利用美国国立卫生研究院开发的Image J软件进行分析。
1.2.2 蛋白质印迹法(Western blot) 取P14的Lgi1-/-小鼠坐骨神经,置于含有蛋白酶抑制剂的蛋白裂解液(PBS+2 % SDS)中超声裂解,BCA检测蛋白质浓度,通过10%~15%凝胶电泳后转移至PVDF膜上,与抗体Lgi1、MAG、Laminin、β1-integrin、β4-integrin、FASN、TSC1、S6、Lgi4(稀释度1∶1 000);α1-integrin(稀释度1∶200);MBP、MOG、MPZ、Flotillin、pS6-S240/244、GAPDH(稀释度1∶10 000)孵化,次日将膜与二抗在室温下孵育1 h,化学发光法检测各蛋白信号,并用ImageJ 1.42q(NIH)定量分析。
1.2.3 电镜 经Ultracut UCT处理后的超薄切片用2%醋酸铀和柠檬酸铅对坐骨神经样本染色,利用飞利浦CM100显微镜采集图像,Image J软件对轴突直径/纤维直径的比率(g-ratio)进行分析。
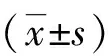
2 结果
2.1 在PNS发育过程中坐骨神经Lgi1的表达情况 蛋白质印迹法结果显示,Lgi1在产后PNS发育过程中在SN中稳定表达(图1A、B),而既往研究结果显示在产后中枢神经髓鞘化的过程中,Lgi1与MBP的表达在大脑发育期呈正相关(图1C、D)。因此,这些结果提示Lgi1在PNS和CNS髓鞘化中可能发挥不同的作用。

A:蛋白质印迹法检测产后3~60 d坐骨神经中Lgi1、MBP、MPZ的表达;B:Lgi1和MPZ的信号强度曲线;C:蛋白质印迹法检测产后3~60 d大脑中Lgi1、MBP的表达;D:Lgi1和MBP的信号强度曲线。图1 Lgi1在坐骨神经与脑中的蛋白表达
2.2 Lgi1缺失导致PNS低髓鞘化 为了进一步探究Lgi1在PNS髓鞘化中的作用,首先利用蛋白质印迹法检测基因敲除Lgi1 -/-小鼠P14时SN中的蛋白表达情况,结果显示髓鞘相关蛋白MBP、MOG和MAG与外周特异性髓鞘蛋白MPZ的表达水平较对照组减少(MBP:1.01±0.08 vs 0.63±0.08,P<0.01;MPZ:0.99±0.10 vs 0.59±0.10,P<0.01 ;MOG:1.02±0.08 vs 0.72±0.07,P<0.05;MAG:0.98±0.04 vs 0.53±0.10,P<0.05;图2A、B);免疫荧光染色结果显示Lgi1-/-小鼠的MBP和MPZ信号较弱,与蛋白质印迹法结果一致(图2C)。此外,通过电镜观察实验组与对照组小鼠SN的髓鞘,发现实验组小鼠SN中无髓鞘的轴突数量增加,且无髓鞘轴突出现堆积(图2D、E),这与免疫荧光染色所观察到扩大的无髓鞘区域一致(图2C箭头所示);其次分析g-ratio结果表明比率增加,这意味着Lgi1-/-小鼠SN中髓鞘厚度减少(图2F);以及Lgi1-/-小鼠的髓鞘呈现异常折叠(图2D),这些结果提示Lgi1调节PNS髓鞘装配过程。结合蛋白质印迹法、免疫组织化学与电镜结果,证明Lgi1-/-小鼠表现出生后PNS髓鞘发育障碍。
A:蛋白质印迹法检测P14 Lgi1-/-小鼠SN中MBP、MPZ、MOG、MAG与Lgi1的表达;B:Lgi1-/-小鼠的MBP、MPZ、MOG和MAG的蛋白水平统计结果(n = 4; MBP, P = 0.0032; MPZ, P = 0.0033; MOG, P = 0.026; MAG, P = 0.021);C:MBP和MPZ双染色,白色箭头表示无髓鞘区域扩大,标尺=50 μm;D:电镜观察Lgi1-/-小鼠与对照组髓鞘变化,红色星号表示无髓轴突,红色箭头表示异常折叠的髓鞘,标尺=2 μm(左图),1 μm(右图);E:P14 Lgi1-/-小鼠与对照组SN横截面有髓轴突数量统计结果(n = 5,P = 0.029);F:P14 Lgi1-/-小鼠与对照组轴突直径和g-ratio的关系(n = 5,P = 0.014);*、**: P <0.05、P <0.01。图2 Lgi1缺失导致周围神经系统低髓鞘化和异常的超微结构
2.3Lgi1通过Laminin-integrin信号系统调节髓鞘的组装 Laminin与integrin是髓鞘形成过程中的关键因素,蛋白质印迹法检测结果显示Laminin、integrinβ-1、integrinβ-4在Lgi1-/-小鼠SN中的表达明显减少(Laminin:1.00±0.10 vs 0.76±0.06,P<0.05;integrinβ-1:0.98±0.09 vs 0.57±0.07,P<0.01 ;integrinβ-4:1.02±0.09 vs 0.55±0.12,P<0.01),integrin α-1表达增加(integrin α-1:1.02±0.09 vs 1.39±0.12,P<0.05),见图3A、B。这一结果与Brain组中Laminin-integrin信号变化相似(Laminin:1.01±0.13 vs 0.69±0.08,P<0.05;integrinβ-1:0.98±0.06 vs 0.60±0.03,P<0.01;integrinβ-4:1.02±0.09 vs 0.51±0.15,P<0.05, integrin α-1:1.00±0.07 vs 1.68±0.26,P<0.01),见图3C、D,表明Lgi1可能参与调节PNS与CNS的髓鞘装配。与既往研究结果一致,Laminin-integrin信号系统的变化可影响髓鞘形成。MBP与Laminin双重染色显示Lgi1-/-小鼠SN中两者重合部分减少(图3E),表明MBP不能定位在髓鞘膜的正确位置,这可能是引起髓鞘装配异常的原因之一(图2D)。此外,对比了Lgi1-/-小鼠大脑中胞膜成分中髓鞘相关蛋白的变化,结果表明MBP和MAG在膜上的含量也减少(MBP:1.00±0.00 vs 0.64±0.06,P<0.01;MAG:1.00±0.00 vs 0.54±0.07,P<0.01(图3F、G),也提示Lgi1敲除导致髓鞘结构异常。

A:蛋白质印迹法检测P14 Lgi1-/-小鼠SN中Laminin、Integrin β1、Integrin β4 and Integrin α1的表达;B:Lgi1-/-小鼠SN中Laminin、Integrin β1、Integrin β4 and Integrin α1的蛋白水平统计结果(n=4; Laminin, P =0.035; Integrin β1, P =0.0065; Integrin β4, P =0.0098; Integrin α1, P =0.026);C:MBP和Laminin双染色,白色箭头表示MBP与层粘连蛋白共标的纤维,MBP未能与Laminin共标区域增加(白色星号),标尺=50 μm;D:蛋白质印迹法检测P14 Lgi1-/-小鼠脑中Laminin、Integrin β1、 Integrin β4 、 Integrin α1的表达;E:Lgi1-/-小鼠脑中Laminin、 Integrin β1、Integrin β4、Integrin α1的蛋白水平统计结果(n=4; Laminin, P =0.026; Integrin β1, P =0.0041; Integrin β4, P =0.019; Integrin α1, P =0.011);F:蛋白质印迹法检测P14 Lgi1-/-小鼠大脑的总蛋白和膜蛋白中MBP、MAG、Flotillin的表达;G:P14 Lgi1-/-小鼠大脑的总蛋白和膜蛋白中MBP、MAG蛋白水平统计结果(n = 4; MBP, P = 0.011; MAG, P = 0.0017); * 、**:P <0.05、P <0.01。图3 Lgi1的缺失破坏了依赖Laminin-integrin信号系统的髓鞘装配
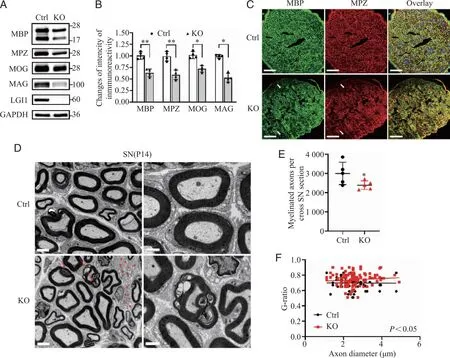
2.4Lgi1通过TSC1-mTORC1信号通路影响PNS的脂质合成 脂质合成为髓鞘的多层膜结构提供了物质基础。在Lgi1-/-小鼠SN中观察到g-ratio和异常折叠的髓鞘增加(图2),因此进一步探索Lgi1的缺失是否会影响SN脂质合成。蛋白质印迹法结果显示与对照组相比,Lgi1-/-小鼠中FASN蛋白表达量较少(0.99±0.12 vs 0.57±0.07,P<0.05,图4A、B),与之前发现的Lgi1-/-小鼠大脑中FASN表达降低一致(0.99±0.12 vs 0.57±0.07,P<0.05,图4C、D)。这些结果表明,Lgi1-/-小鼠SN中受损的髓鞘层可能是由PNS中的脂质合成障碍引起的。据报道,TSC1-mTOR信号是CNS和PNS髓鞘化的重要影响因素,mTOR影响各种细胞系的脂质合成,包括少突胶质细胞。利用蛋白质印迹法检测TSC1-mTORC1信号,在Lgi1-/-小鼠SN中,mTORC1信号被激活,表现为pS6水平增加和TSC1表达减少(1.00±0.12 vs 2.43±0.17,P<0.01;1.03±0.08 vs 0.50±0.12,P<0.01,图4A、B),证明了Lgi1基因敲除会激活mTORC1信号,抑制FASN表达与脂类合成从而阻止髓鞘的形成并导致PNS低髓鞘化。
A:蛋白质印迹法检测P14 Lgi1-/-小鼠SN中FASN、pS6、S6和TSC1的表达;B:Lgi1-/-小鼠SN中FASN、pS6、S6和TSC1的蛋白水平统计结果(n = 4;FASN,P = 0.037;pS6/S6,P = 0.0078;TSC1,P = 0.0085);C:蛋白质印迹法检测P14 Lgi1-/-小鼠脑中FASN、pS6、S6和TSC1的表达;D:Lgi1-/-小鼠脑中FASN、pS6、S6和TSC1的蛋白水平统计结果(n = 4;FASN,P = 0.0057;pS6/S6,P = 0.0063;TSC1,P = 0.017);*、** :P <0.05, P <0.01。图4 Lgi1的缺失降低脂肪酸合成酶的表达并激活mTORC1信号通路
3 讨论
本课题组之前的研究揭示了Lgi1在中枢神经系统髓鞘化中的作用[3],有研究表明,Lgi1缺失会损害PNS和CNS形成髓鞘的过程[16]。然而,Lgi1在PNS髓鞘化的作用机制仍是未知的。本研究证明Lgi1的缺失会导致产后PNS的低髓鞘化和髓鞘超微结构的改变且可能通过两种方式影响PNS髓鞘化:一种是通过Laminin-integrin信号系统调节髓鞘的装配;另一种是通过改变TSC1-mTORC1的信号传导来控制脂质的生物合成。
据报道,在CNS中Lgi1与MBP的表达呈正相关[4],然而本实验结果证明了Lgi1可能以不同的方式调控PNS和CNS的髓鞘化,Lgi1敲除小鼠的PNS和CNS的髓鞘结构存在差异。其中的原因可能是Lgi1与Lingo-1结合以介导中枢神经系统的髓鞘化,且Lingo-1只在中枢神经系统中表达,并对中枢神经系统的髓鞘化进行负向调节[4,17-19];而另一种解释则是Lgi家族的另一个成员Lgi4,其被确定为PNS中施万细胞髓鞘化的一个关键因子[5,20]。据报道,Lgi4主要在PNS胶质细胞中表达[20],结合我们的研究结果发现,PNS髓鞘化可能由Lgi1和Lgi4共同控制。
在PNS中,基底膜(basement membranes,BMs)通过促进径向轴突排序,在施万细胞成熟过程中发挥关键作用[21-23]。这一过程依赖于层粘连蛋白和整合素与BM配体的结合,从而介导施万细胞髓鞘化[24-28]。层粘连蛋白通过在施万细胞表面组装BMs,导致整合素β1和其他受体的激活,促进PNS早期髓鞘化。本实验数据显示,Lgi1-/-小鼠SN中层粘连蛋白水平下降,整合素表达改变,证明Lgi1可能通过Laminin-integrin信号系统动态地参与调节髓鞘化。此外,Lgi1-/-小鼠坐骨神经的电镜图像显示了髓鞘层的缺失和g-ratio的增加,再加上MBP信号未能与膜上的层粘连蛋白定位,认为Lgi1可能通过层粘连蛋白-整合素的方式调节髓鞘的装配。一种可能的机制是Lgi1与Adam22结合从而调节与整合素相关的功能,如癫痫和轴突排序[10,29]。在PNS中,Lgi4也与Adam22相互作用,介导其在施万细胞髓鞘化中的作用。而Adam22的缺失表现为PNS的低髓鞘化,因此假设Lgi1通过调控层粘连蛋白-整合素介导的髓鞘装配来控制PNS的髓鞘化。
PNS和CNS髓鞘化都需要mTORC1的参与[30-38]。Zou等[30]报道,TSC1-mTORC1信号以时间特异性的方式控制施万细胞的髓鞘化:在施万细胞前体细胞中特异性敲除TSC1会引起mTOR的激活,从而导致髓鞘缺陷。相反,成熟施万细胞中的TSC1缺失会导致成年小鼠的高髓鞘化。目前的研究表明,Lgi1的缺乏激活了mTORC1,并降低了TSC1的表达,Lgi1-/-小鼠表现出脂质合成减弱和异常折叠髓鞘增加,证实了TSC1-mTORC1通路在PNS髓鞘化中的重要性[35-36]。另一方面,本课题组以前的研究结果显示,Lgi1也通过TSC1-mTORC1介导脂质合成以控制中枢神经系统髓鞘化[4]。综上所述,除了上述可能的不同调控,Lgi1在PNS和CNS髓鞘化中至少有部分共同机制。同样,细胞特异性的Lgi1敲除模型对于阐明Lgi1在PNS和CNS髓鞘化中的精确机制至关重要。
总之,本研究明确了Lgi1参与调控PNS髓鞘化,特异性敲除Lgi1会引起髓鞘相关蛋白表达下降与髓鞘超微结构异常,从而引起SN低髓鞘化,并明确了Lgi1可能通过Laminin-integrin信号介导的髓鞘装配以及TSC1-mTORC1依赖的脂类合成参与调控PNS髓鞘化,为深入研究Lgi1在PNS和CNS髓鞘化中的作用提供一种全新思路。
