转谷氨酰胺酶交联对溶菌酶潜在致敏性的影响
2024-01-26张晨晨黎江东周荣钦麻小娟
张晨晨,黎江东,周荣钦,麻小娟
(遵义医科大学 公共卫生学院,贵州 遵义 563099)
鸡蛋作为一种优质食物蛋白,价格低廉且具有丰富营养,是大众的日常食物,在人们的餐桌上占有不可或缺的席位[1]。然而,鸡蛋也是引起过敏反应的最常见食物之一[2]。鸡蛋过敏常表现为鼻炎、皮炎和哮喘,严重时可诱发休克甚至危及生命。鸡蛋引起的过敏在临床上尚未发现有效的预防及根除方法,常用的药物只能暂时缓解过敏症状[3-4]。目前应对鸡蛋过敏的推荐方法是避免食用或接触过敏原[5],而随着现代食品工业的快速发展及鸡蛋在食品行业中的广泛应用,完全避免食用鸡蛋成分是难以实现的,此外,饮食中避免鸡蛋摄入又可能引起蛋白摄入不足等营养问题[6-7]。因此,在全球范围内鸡蛋过敏发生率仍呈上升趋势,严重影响了过敏人群的健康生活[2]。鸡蛋过敏已成为人们重点关注的食品安全和公共卫生问题。
鸡蛋所导致的过敏主要是由蛋清蛋白引起的,其中含有4种公认的主要过敏原,分别是卵白蛋白、卵类粘蛋白、卵转铁蛋白和溶菌酶[8]。溶菌酶(lysozyme, Lys)占蛋清蛋白总量的3.4%,分子质量为14.3 kDa,主要是由129个氨基酸残基组成,含有4个二硫键、35个谷氨酰胺残基以及多肽链氨基末端的赖氨酸残基[9-10]。溶菌酶可以通过催化胞壁酸和粘多糖的水解破坏细胞壁,具有很好的抗菌活性,被广泛应用于食品生物防腐、医药、日用化工等行业[11-13]。另一方面,由于溶菌酶在多种食品和药品中的高使用率使其成为鸡蛋过敏研究的重要目标[14]。因此,通过食品加工技术解决 (降低) 溶菌酶的致敏性是非常有必要的。食品加工对溶菌酶致敏性的影响方面,Mine等[15]研究发现在95 ℃加热15 min并不能降低溶菌酶的IgE结合能力。Ouahidi等[16]研究发现酸处理后溶菌酶的IgE结合能力未发生显著变化;在100 ℃加热30 min后,溶菌酶的IgE结合能力有所降低,但免疫印迹显示加热后的溶菌酶仍可与患者血清发生反应。Jimenez-Saiz等[17]将溶菌酶进行模拟胃肠消化,发现消化产物的IgE结合能力升高。目前暂未发现可消除溶菌酶致敏性的有效方法。
酶交联是现代食品工业中一种常见的加工技术,主要是利用酶或化学剂催化蛋白质内部氨基酸残基之间或者是蛋白质分子之间形成新的共价键,从而生成分子量更大的聚合物[18]。常用的蛋白交联酶有转谷氨酰胺酶、多酚氧化酶等[19]。其中转谷氨酰胺酶作为一种高效、安全的常用生物酶交联剂,具有催化底物广泛的优势,已报道可通过改变蛋白质微观结构改善食品蛋白功能特性,提高食品营养价值[20-21]。此外,已证实转谷氨酰胺酶催化交联可有效降低多种过敏原的致敏性。如Yuan等[22]研究表明,转谷氨酰胺酶催化反应可以使虾原肌球蛋白发生结构变化,破坏致敏表位,从而使得IgG/IgE的结合能力降低。Benedé等[23]发现转谷氨酰胺酶催化的交联可有效降低脱脂乳和酪蛋白的IgE结合能力。Yu等[24]发现乳清分离蛋白经碱性蛋白酶和胰蛋白酶水解后,产生的水解物经转谷氨酰胺酶交联后抗原性进一步下降。邓涵[25]研究发现,经过转谷氨酰胺酶交联后豆浆蛋白的潜在致敏性显著降低,当交联度越大时,潜在致敏性就越低。Brzozowski[26]发现小麦粉蛋白质在转谷氨酰胺酶辅助交联后,随着多肽平均链长的增加,小麦过敏原的免疫反应性大大降低。然而,并非所有的过敏原经转谷氨酰胺酶催化交联后致敏性都能有效降低。如Benedé等[23]发现经转谷氨酰胺酶催化交联后,乳清蛋白的IgE结合能力不降反升。目前国内外对鸡蛋过敏原致敏性的研究集中在热处理、酶水解等方面,目前尚缺少酶交联对溶菌酶致敏性影响的相关研究报道。
本课题选用转谷氨酰胺酶催化溶菌酶进行交联反应,通过SDS-PAGE分析产物的分子量变化,通过间接ELISA法评价交联后产物的IgG和IgE结合能力变化,为下一步研发低致敏或脱敏鸡蛋产品提供一定的借鉴和参考。
1 材料与方法
1.1 材料与试剂 新鲜鸡蛋购自当地养殖场;转谷氨酰胺酶(江苏一鸣生物股份有限公司);CM-sepharoseFF阳离子层析柱材(瑞典GE公司);羊抗兔IgG二抗和羊抗人IgE二抗(美国Sigma公司),其他试剂均为分析纯。
1.2 方法
1.2.1 溶菌酶的分离 按照课题组前期建立的方法分离溶菌酶[27],简要介绍如下:向CM-sepharose FF层析柱中加入20 mmol/L醋酸-醋酸钠溶液(pH 4.0)以平衡柱子。加入处理好的蛋清液,待穿过峰洗出后换用含0.1~0.15 mol/L NaCl的醋酸-醋酸钠缓冲溶液(pH 4.3)梯度进行卵类粘蛋白和卵白蛋白的洗脱;用含0.13~0.23 mol/L NaCl醋酸-醋酸钠缓冲液(pH 6.1)进行卵转铁蛋白分离;最后用含0.1~0.4 mol/L NaCl的PBS缓冲液(pH 7.0)洗脱分离卵转铁蛋白和溶菌酶。将得到的溶菌酶用PEG 20000浓缩,再用透析袋进行透析(在透析袋外加预冷的蒸馏水),透析后冻干,置于-20℃冻干保存。
1.2.2 SDS-PAGE电泳分析 收集目标分离峰,与5×蛋白上样缓冲液以4∶1(v/v)混合后,在100 ℃金属浴加热10 min进行蛋白变性。设置恒压80 V,电泳30 min后,将电压调至120 V,电泳至染料距离胶底端1 cm左右时,停止电泳。经常规染色、脱色步骤后,通过凝胶成像仪拍照。
1.2.3 转谷氨酰胺酶催化溶菌酶交联 (1) 酶与底物质量比对交联的影响研究:将溶菌酶用PBS缓冲液稀释,加入转谷氨酰胺酶使得体系中酶与底物质量比分别为5、10、20、30、40、50、100、200、300 U/g,充分混匀,在45 ℃的恒温培养箱里反应3 h,反应结束后100 ℃金属浴灭酶活。(2) 反应时间对交联的影响研究:将溶菌酶用PBS缓冲液稀释,在酶与底物质量比为50 U/g 的情况下,充分混匀,依次在45 ℃恒温培养箱里反应1、2、3、4、5、6 h,反应结束后100 ℃金属浴灭酶活。
1.2.4 溶菌酶交联产物IgG结合能力的测定 用间接ELISA检测溶菌酶与特异性兔血清的IgG结合能力,具体步骤参照参考文献[28]。其中兔抗溶菌酶多克隆抗体的稀释倍数为1∶10 000,HRP标记羊抗兔IgG稀释倍数为1∶100 000。
1.2.5 溶菌酶交联产物IgE 结合能力的测定 (1)鸡蛋过敏患者血清池的构建:研究中鸡蛋过敏患者血清由遵义医科大学第二附属医院提供,均已被确诊为鸡蛋过敏阳性。将8个血清等体积混合构成鸡蛋过敏患者血清池。8位患者过敏信息见表1。
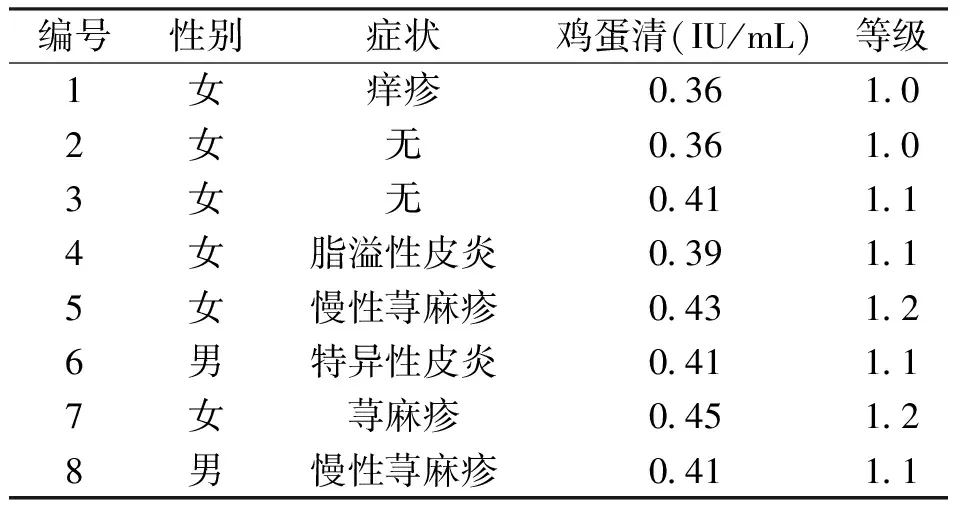
表1 鸡蛋过敏患者信息
(2)溶菌酶交联产物IgE 结合能力的测定 :用间接ELISA比较酶交联溶菌酶与过敏患者血清的IgE结合能力[28],其中一抗采用上述过敏患者血清池( 1∶10 稀释),羊抗人IgE二抗的稀释倍数为 1∶2 000 。
2 结果
2.1 分离溶菌酶纯度测定 利用课题组前期建立的方法,分离所得溶菌酶SDS-PAGE,检测结果见图1。可见溶菌酶(14.3 kDa)泳道上未显示其它蛋白条带,说明分离的溶菌酶达到电泳纯。
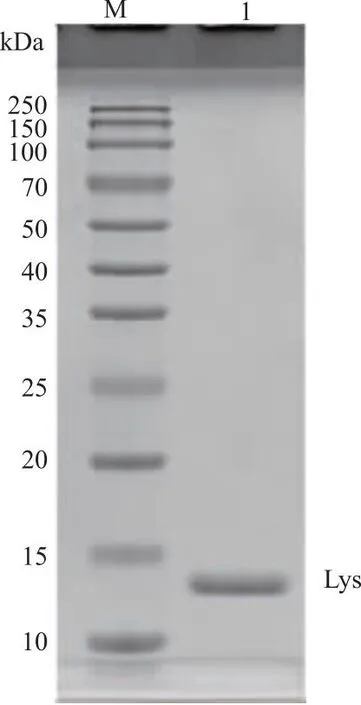
M:Marker蛋白;1:溶菌酶。图1 SDS-PAGE法检测的溶菌酶纯度
2.2 转谷氨酰胺酶添加量对溶菌酶致敏性的影响
2.2.1 SDS-PAGE确定交联产物分子量情况 溶菌酶经转谷氨酰胺酶诱导交联后,利用SDS-PAGE分析其分子量变化情况。如图2所示,当转谷氨酰胺酶添加量≥5 U/g时,溶菌酶条带变浅,在17 kDa和25 kDa附近出现了新的蛋白条带,在70 kDa以上出现弥散条带,说明交联反应发生。当转谷氨酰胺酶添加量为40 U/g时,70 kDa以上出现的弥散条带颜色较深,说明在此条件下大分子量交联产物形成的更多。而当转谷氨酰胺酶添加量为50 U/g时,70 kDa以上出现的弥散条带颜色较浅,说明该条件下主要形成小分子量交联产物。
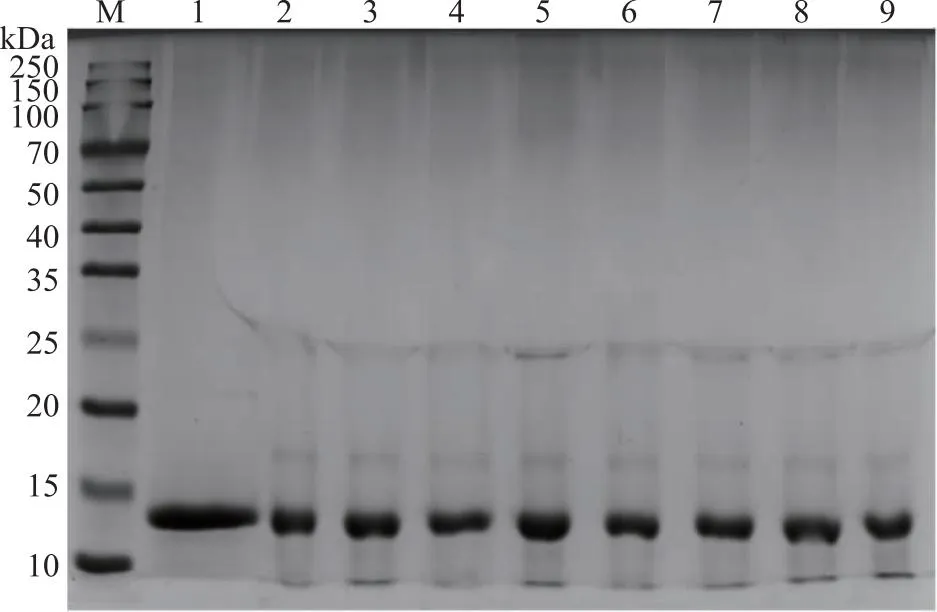
M: marker;1~9:转谷氨酰胺酶酶活性与底物质量比分别为0、5、10、20、40、50、100、200、300 U/g。图2 转谷氨酰胺酶与底物质量比对溶菌酶交联的影响
2.2.2 转谷氨酰胺酶添加量对溶菌酶IgG结合能力的影响 通过间接ELISA来测定不同转谷氨酰胺酶添加量对溶菌酶IgG结合能力的影响。间接ELISA法测定溶菌酶IgG结合能力的原理在于酶标板固相载体可捕获加工前后的抗原,反应结束后将未反应的固相载体封阻并添加一抗,可使抗原抗体发生特异性反应,捕获一定数量的一抗。将未反应的一抗清洗去除后加入酶标二抗,待一抗二抗反应完全将多余酶标二抗清洗去除,加入显色液,即可通过酶标仪490 nm处吸光值来反映IgG结合能力的强弱,见图3。图4指示了转谷氨酰胺酶与底物质量比对溶菌酶IgG结合能力的影响。可见相比于未处理的溶菌酶,转谷氨酰胺酶催化交联后的溶菌酶产物IgG结合能力显著降低(P<0.05),当转谷氨酰胺酶与底物质量比为50 U/g时,IgG结合能力降至最低值(OD值0.358,未处理溶菌酶OD值为0.94),较10、20、100 U/g显著降低(P<0.05),然而与其它组相比,差异不显著(P>0.05)。
图3 间接ELISA原理示意
2.2.3 转谷氨酰胺酶添加量对溶菌酶IgE结合能力的影响 通过间接ELISA来测定不同转谷氨酰胺酶添加量对溶菌酶IgE结合能力的影响,原理见图3,通过490 nm处吸光值来反映IgE结合能力的强弱,结果见图5。可见转谷氨酰胺酶与底物质量比为10 U/g和300 U/g时,交联后溶菌酶的IgE结合能力较未加工溶菌酶显著降低,IgE结合能力最低值出现在10 U/g(OD值1.090,未处理溶菌酶OD值为1.223)。然而,在转谷氨酰胺酶与底物质量比为10 U/g时,反应产物的OD值较其它组差异不显著(P>0.05)。
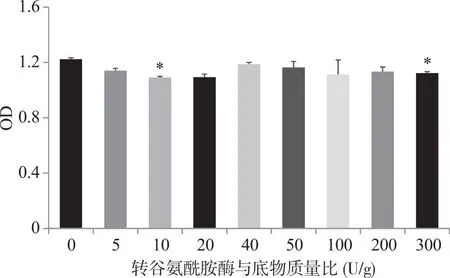
*:与未交联溶菌酶相比,P<0.05。图5 转谷氨酰胺酶与底物质量比对溶菌酶IgE结合能力的影响
2.3 交联时间对溶菌酶致敏性的影响
2.3.1 SDS-PAGE确定交联产物分子量情况 转谷氨酰胺酶反应时间对溶菌酶交联的影响结果见图6。可见当交联进行1 h时,在17 kDa和25 kDa附近出现了新的蛋白条带,在70 kDa以上出现弥散条带,说明交联反应发生。当交联进行4 h时,25 kDa附近条带和70 kDa以上弥散条带的颜色均较深,说明交联反应发生的更好。
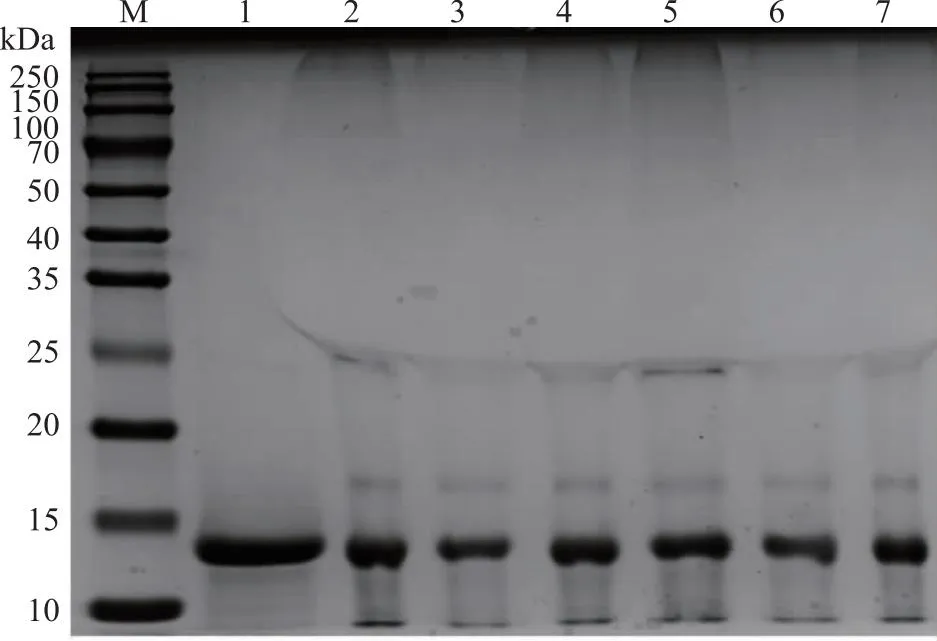
M: marker;1~7,转谷氨酰胺酶反应时间对溶菌酶交联分别为0、1、2、3、4、5、6 h。图6 转谷氨酰胺酶反应时间对溶菌酶交联的影响
2.3.2 交联时间对溶菌酶IgG结合能力的影响 转谷氨酰胺酶催化反应不同时间对溶菌酶IgG结合能力的影响结果如图7所示,交联1~6 h后,溶菌酶产物的IgG结合能力较未反应前明显降低(P<0.05),当交联进行6 h时,产物IgG结合能力达到最低值(OD值0.407,未处理溶菌酶OD值为0.94)。
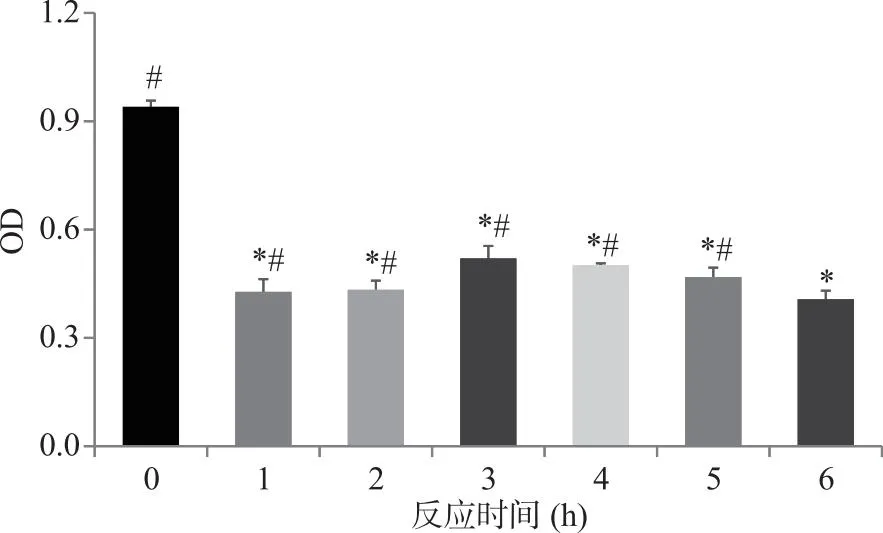
*:与未交联溶菌酶相比,P<0.05;#:与交联6h的溶菌酶产物相比,P<0.05。图7 转谷氨酰胺酶反应时间对溶菌酶IgG结合能力的影响
2.3.3 交联时间对溶菌酶IgE结合能力的影响 通过间接ELISA来测定不同转谷氨酰胺酶添加量对溶菌酶IgE结合能力的影响,通过490 nm处吸光值来反应IgE结合能力的强弱,结果见图8。可见虽然交联6 h时溶菌酶的IgE结合能力均值较其它交联时间有所降低(与未加工溶菌酶相比,差异显著,OD值从1.223降至0.839,降低约31%),然而该降低结果与其它反应时间相比未呈现统计学差异,即转谷氨酰胺酶催化不同时间并未影响溶菌酶的IgE结合能力(P>0.05)。

*:与未交联溶菌酶相比,P<0.05。图8 转谷氨酰胺酶反应时间对溶菌酶IgE结合能力的影响
3 讨论
转谷氨酰胺酶能够催化溶菌酶分子中谷氨酰胺残基和赖氨酸残基中的ε-氨基发生反应,形成分子内和(或)分子间异肽键,结果使溶菌酶分子发生交联。转谷氨酰胺酶催化溶菌酶交联反应后,SDS-PAGE电泳结果显示交联后的溶菌酶泳道中出现了17 kDa和25 kDa的新条带(非转谷氨酰胺酶条带,其分子量为3.8 kDa),且70 kDa以上出现弥散条带,说明转谷氨酰胺酶成功催化了溶菌酶发生交联反应。70 kDa以上出现连续的弥散条带可能是因为底物溶菌酶含35个谷氨酰胺残基和多肽链氨基末端的赖氨酸残基,在转谷氨酰胺酶催化下可能有多个不同位置的谷氨酰胺残基和赖氨酸残基参与反应,导致不同分子量的聚合物生成,由于聚合物种类多,分子量较大,在电泳胶上体现为连续地分布在泳道上方,形成了弥散状。但是,交联产物没有随着酶量以及交联时间的延长而增多。当转谷氨酰胺酶添加量为40 U/g时,大分子量交联产物形成的更多;而当转谷氨酰胺酶添加量为50 U/g时,主要形成小分子量交联产物,可能与高转谷氨酰胺酶浓度下,溶菌酶倾向于发生分子内交联有关。交联进行4 h,形成的交联产物更多。转谷氨酰胺酶添加量和交联时间能够影响交联产物的形成,在β-酪蛋白交联过程中也观察到[28-29],可能会对产物部分特性造成影响。
转谷氨酰胺酶催化溶菌酶交联后产物的IgG结合能力显著降低,可能是因为在转谷氨酰胺酶催化作用下多肽链上赖氨酸与谷氨酰胺残基之间发生了反应,该过程改变了底物溶菌酶构象或交联发生的处于线性表位区域的位点,即相应地破坏或掩盖了过敏原蛋白的IgG结合表位。然而,尽管转谷氨酰胺酶添加量和反应时间的不同导致了交联产物生成的差异,仅反应时间对交联产物的IgG结合能力造成了不同影响,且IgG结合能力的最低值并未出现在形成大分子量交联产物的条件下,提示提升交联度或诱导分子间交联以获得大分子量交联产物可能并不是改变溶菌酶分子特性的好方法。
本实验中选用8位鸡蛋过敏患者的血清建立血清池,用于溶菌酶以及交联产物的IgE结合能力研究。结果显示大部分交联条件的选择并未影响底物溶菌酶的IgE结合能力,仅在个别条件下IgE结合能力降低,且降低的比例未达到40%。可能是因为交联未发生在该过敏原的IgE结合位点上,或者交联过程中生成了新的表位,与交联导致的表位破坏/屏蔽相抵消,终结果显示为IgE结合能力变化不显著。本课题原计划进行单因素实验后摸索交联降低溶菌酶致敏性的最佳实验条件,然而由于催化酶添加量的不同和反应时间延长均未显著影响溶菌酶致敏性主要参考指标IgE结合能力,可判定转谷氨酰胺酶催化的交联不是降低溶菌酶致敏性的好方法,故未进行进一步的实验探索。赵瑞芳[30]发现使用转谷氨酰胺酶直接处理花生过敏原Ara h 2,基本不改变其IgG结合能力,而使用还原剂将Ara h 2变性后再诱导交联则可以改变交联位点,达到有效降低Ara h 2 IgG结合能力的目的。该研究为课题组后续研究指明了方向,将溶菌酶还原后再进行交联反应,或可达到有效降低其致敏性的目的。
本课题从鸡蛋清中提纯溶菌酶后,利用转谷氨酰胺酶催化其发生交联反应。SDS-PAGE电泳结果表明,转谷氨酰胺酶能够催化溶菌酶发生交联反应,在改变转谷氨酰胺酶添加量和交联时间后,能够获得不同的交联产物。尽管转谷氨酰胺酶催化溶菌酶交联后产物的IgG结合能力降低,然而,在所有探索的反应条件下,生成交联产物的IgE结合能力较未加工的溶菌酶样品降低均未超过40%,且不同反应条件下生成的溶菌酶产物IgE结合能力差异不显著。提示通过变换转谷氨酰胺酶催化条件诱导交联不是消减溶菌酶致敏性的好方法。本文可以为食物蛋白质致敏性的控制提供方法的参考,同时本研究显示了通过交联条件的控制,成功诱导了溶菌酶交联。交联后致敏性变化不显著,不代表其营养价值、功能性质等未发生变化,即本研究提供了溶菌酶交联的方法,为溶菌酶其他相关研究提供了借鉴。
