miRNA-338促进施万细胞成髓鞘*
2021-06-30周松林谢慧敏杜明智杨述海韩笑笑
周松林,刘 畅,谢慧敏,杜明智,杨述海,韩笑笑,于 彬
(1南通大学江苏省神经再生重点实验室,江苏226001;2南通大学附属医院口腔科;3南通大学医学院)
微小RNA(microRNA,miRNA)是一类物种之间高度保守、长度为19~25个核苷酸、不编码蛋白质的单链RNA分子。miRNA在RNA聚合酶Ⅱ作用下形成初级miRNA,经核糖核酸酶作用得到前体miRNA,最后在Dicer酶剪切下成为成熟miRNA。miRNA可以通过抑制翻译或转录水平来调控靶基因的表达,参与细胞分化、生长、增殖调控等重要生命活动过程[1]。已发现在周围神经损伤后大量miRNAs存在差异表达,在调节施万细胞表型中发挥重要作用[2]。
施万细胞是周围神经系统主要的胶质细胞,在周围神经发育、功能和再生中起着重要作用,能沿神经突起形成髓鞘。周围神经损伤后施万细胞发生一系列的表型变化,如脱髓鞘和去分化[3]。神经再生过程中施万细胞先去分化为施万细胞祖细胞,祖细胞在短时间内分裂、分化、增殖,生成大量施万细胞,参与髓鞘碎屑吞噬和Bunger带的形成,进而引导神经再生过程。
目前已发现miRNA与中枢及周围神经损伤和修复密切相关。脊髓损伤后miR-21显著上调,通过靶向促凋亡基因Fas配体(FasL)、人第10号染色体缺失的磷酸酶及张力蛋白同源基因(PTEN)和程序性死亡蛋白4(PDCD4),在限制继发细胞死亡方面发挥重要作用[4]。miR-124在脊髓损伤时显著升高,可作为诊断脊柱创伤后急性脊髓损伤的潜在标志物。另外,miRNAs促进施万细胞的再分化与髓鞘形成而修复神经。在体外施万细胞与背根神经节细胞共培养时,miR-30c可促进周围神经损伤后施万细胞髓鞘形成[5]。miR-221-3p通过下调对施万细胞髓鞘形成至关重要的NGF1-A结合蛋白1(Nab1),抑制施万细胞的髓鞘形成,miR-221-3p也可促进坐骨神经损伤后施万细胞的增殖和迁移[6]。目前发现miR-338在很多肿瘤中,如肝癌、黑色素瘤中呈低表达。本文主要研究miR-338对周围神经损伤及再生过程中施万细胞髓鞘形成的影响,寻求周围神经损伤的新治疗策略。
1 材料与方法
1.1 主要材料和试剂 成年雄性Sprague-Dawley大鼠30只,体重180 g(南通大学实验动物中心提供)。TRizol试剂(Invitrogen公司,美国),RT试剂(TaKaRa,中国),SYBR Premix Ex Taq(TaKaRa,中国),Taqman miRNA检测试剂盒(Life Technologies公司,美国),Ⅰ型胶原酶(Sigma公司,美国),Neurobasal培养基(Thermo Fisher Scientific公司,美国),神经生长因子(NGF)(RD Systems公司,美国),L-glu(Invitrogen公司,美国),anti-S100(DAKO公司,美国),Lipofectamine RNAiMAX转染试剂(Invitrogen公司,美国),B27补充剂(Thermo Fisher Scientific公司),粘连蛋白(Invitrogen公司,美国),聚L赖氨酸(Sigma公司),Dulbecco’s modified Eagle’s medium(DMEM)(Sigma公司),抗坏血酸(Sigma公司),Triton X-100(Sigma公司),胎牛血清(Sigma公司),miR-338 agomir、miR-338 antagomir及对照(锐博,中国)。
1.2 实验方法
1.2.1 大鼠坐骨神经夹伤模型:大鼠经复合麻醉剂(0.3 mL/100g)腹腔麻醉后,侧卧位固定,常规备皮、消毒。沿左侧股骨作1 cm切口,暴露坐骨神经。无齿镊钳夹坐骨神经3次,挤压宽度3 mm,每次10 s,间隔10 s。
1.2.2 RT-qPCR检测miRNA表达量:以Trizol法匀浆提取受损伤坐骨神经总RNA,随后使用Prime-Script RT试剂盒反转录,Taqman miRNA检测试剂盒进行miRNA检测。
1.2.3 施万细胞原代培养及转染:取1日龄SD大鼠,在后肢外侧切开皮肤,暴露坐骨神经,取出约8 mm长坐骨神经。经胰蛋白酶消化,分离施万细胞,再用抗Thy1.1抗体和兔补体去除成纤维细胞。以施万细胞特异性标记物anti-S100进行免疫染色,最终得到纯度接近95%的施万细胞。将施万细胞培养于含10%胎牛血清的DMEM(DMED+10%FBS+1%PS)。使用Lipofectamine RNAiMAX转染试剂分别将miR-338 agomir(20 mmol/L)、agomir-negative control(20 mmol/L)、miR-338 antagomir(100 mmol/L)和antagomir negative control(100 mmol/L)转染施万细胞。
1.2.4 施万细胞-背根神经节神经元共培养:从SD大鼠14.5天胚胎中剥离背根神经节(DRG),将单个DRG转移到无Ca2+/Mg2+的Hank’s缓冲液中。24孔板预先用多聚L赖氨酸和10 mg/mL层粘连蛋白包被。以0.1%Ⅰ型胶原酶和0.25%胰蛋白酶将DRG消化至单细胞后,重悬于Neurobasal培养基,添加B27补充剂(1∶50)、100 ng/mL神经生长因子和L-glu(1∶100)。用尿苷(10 nmol/L)和氟脱氧尿苷(10 nmol/L)处理细胞2次,每次48 h,去除非神经元细胞。在与神经元共培养前,将miR-338 agomir、miR-338 antagomir转染到施万细胞中,转染后施万细胞置于含5%胎牛血清和100 ng/mL NGF的DMEM中,培养2 d,以帮助施万细胞在DRG突起上粘附。7 d后添加50μg/mL抗坏血酸诱导髓磷脂形成,每2 d重新添加含有抗坏血酸的新鲜培养基维持培养。
1.2.5 免疫荧光染色:收集共培养的DRG和施万细胞,4%多聚甲醛室温固定25 min,0.1%Triton X-100通透10 min,5%BSA室温封闭30 min,加一抗anti-MBP在4℃过夜,二抗Cy3-conjugated sheep antirabbit IgG在室温下放置2 h。使用Leica DMi8倒置荧光显微镜拍摄照片。
1.2.6 芯片检测分析:使用mirVanaTM miRNA分离试剂盒、BioAnalyer 210生物分析仪和NanoDrop ND-1000分光光度计分别进行提取总RNA、质检和量化。Agilent mRNA芯片由上海欧易公司进行标记和杂交,采用安捷伦扫描控制软件扫描芯片的照片,安捷伦分析软件进行图像分析,GeneSpring进行微阵列数据解读和初步分析。
2 结 果
2.1 RT-qPCR定量测定受损伤坐骨神经miR-338表达量 坐骨神经横断后miR-338表达水平迅速下调,在第4天达到最低水平,在第7天、14天逐渐增加,表明miR-338在损伤后急性期下调,然后在再生期缓慢恢复到正常水平。见图1。

图1 实时荧光定量PCR检测miR-338表达
2.2 miR-338促进施万细胞再分化 miR-338 agomir处理的施万细胞再分化为髓鞘的效果明显增强,而miR-338 antiagomir处理的施万细胞再分化为髓鞘明显减少,表明过表达miR-338可促进施万细胞再分化为髓鞘,miR-338可能在髓鞘形成过程中具有积极作用。见图2。
2.3 过表达miR-338对施万细胞转录组的影响 通过热火图对过表达miR-338后施万细胞中的差异基因进行聚类,发现463个上调基因和194个下调基因。通过基因本体(gene ontology,GO)数据库对上调基因行使的分子功能和参与的生物学过程进行聚类,发现差异上调基因功能富集最显著的GO与髓鞘形成相关。见图3。
3 讨 论
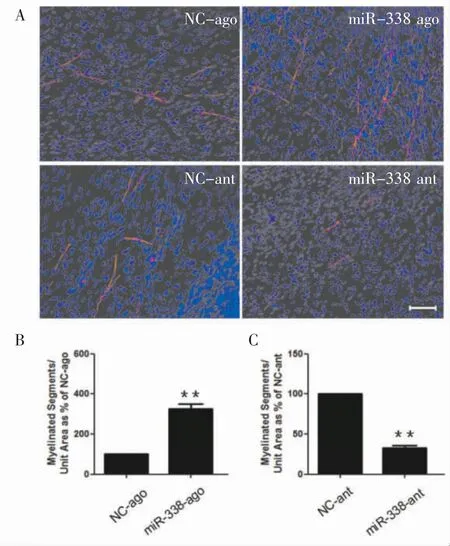
图2 miR-338促进施万细胞髓鞘形成
日常生活中神经损伤非常普遍,中枢神经再生能力有限,而周围神经具有一定的再生能力。研究表明,miRNAs能通过调控施万细胞而重塑再生微环境。miR-34a和miR-140是施万细胞增殖和髓鞘形成的重要功能调控因子[7];miR-338能够调控轴突定位的COXIV,导致线粒体活性下降。通过测量细胞耗氧量和ATP水平的降低,确定miR-338存在于轴突之中[8]。我们先前的研究发现miR-9通过直接靶向CTHRC1的3’-UTR而显著下调CTHRC1表达,从而调控施万细胞的迁移作用[9];miR-221/222通过靶向长寿保证同源物2(LASS2)促进雪旺细胞的增殖和迁移[10];miR-3075靶向接触蛋白2(CNTN2)抑制施万细胞的迁移;miR-sc3通过靶向星形肌动蛋白1(astrotactin1,ASTN1)来促进施万细胞的增殖和迁移,而miR-sc4和miR-sc8通过靶向周期蛋白依赖性激酶5激活因子1(CDK5R1)和表皮生长因子受体(EGFR)来抑制施万细胞的增殖和迁移[11]。let-7和miR-9分别通过靶向人轴突生长诱向因子1(Ntn1)和结直肠癌缺失基因(DCC),确保受损轴突朝着正确方向增殖[12]。孤儿核受体3(NR4A3)是PI3K-mTOR通路的负调控因子,miR-20a通过靶向NR4A3促进体外DRG神经元的神经突生长和体内损伤后的轴突再生[13]。另外,miRNAs可调控少突胶质细胞的分化和髓鞘形成过程[14]。目前发现miRNA的加工是促进少突胶质细胞正常分化和髓鞘形成所必需的[15]。miR-338和miR-219对少突胶质细胞分化具有叠加作用,并且是髓鞘完整形成所必需的[16]。
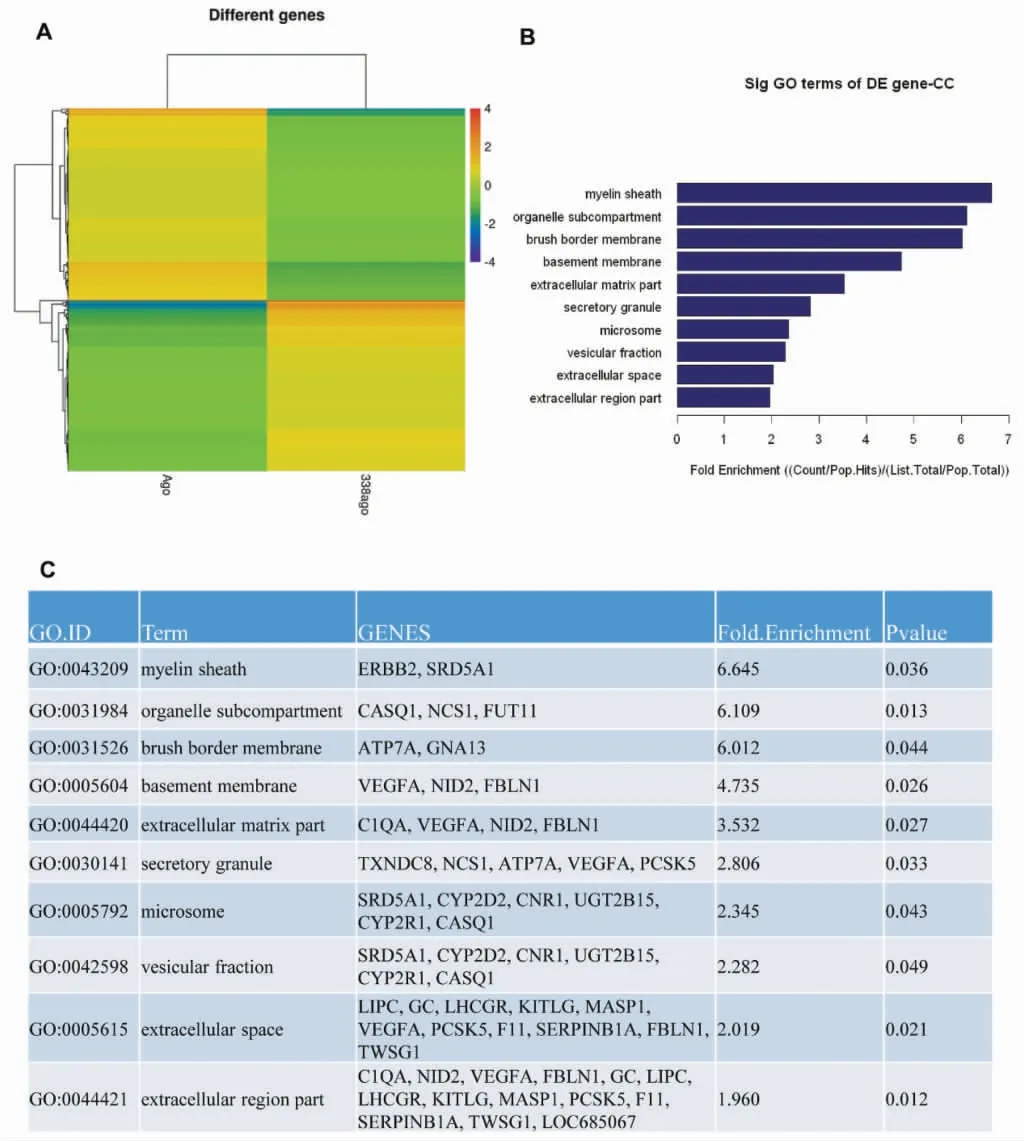
图3 过表达miR-338对施万细胞转录组的影响
以前有研究证实miR-338可促进中枢少突胶质细胞成髓鞘[17],但miR-338在周围神经系统中的作用尚不清楚。本研究发现,在SD大鼠坐骨神经损伤后miR-338促进施万细胞成髓鞘,通过分析坐骨神经横断后不同时间点的近端神经残段,发现miR-338表达量先下调,第4天后表达量逐渐上调,表明miR-338在神经损伤后的再生中可能发挥作用。原代培养的施万细胞与DRG神经元共培养试验显示,过表达miR-338促使施万细胞的髓鞘形成,过表达miR-338后差异基因功能富集最显著的GO与髓鞘形成有关。miR-338可以促进施万细胞再分化,有助于更好了解miRNAs在神经再生中的调控作用,为神经损伤的治疗提供新的途径。
